Method Article
Aislamiento y expansión de células madre mesenquimales / estromales derivadas de tejido de placenta humana
En este artículo
Resumen
En este documento se describen los métodos para la disección de tejidos fetales y maternas de placenta humana a término, seguido por el aislamiento y expansión de células madre mesenquimatosas / estroma (MSC) de estos tejidos.
Resumen
Mesenchymal stem/stromal cells (MSC) are promising candidates for use in cell-based therapies. In most cases, therapeutic response appears to be cell-dose dependent. Human term placenta is rich in MSC and is a physically large tissue that is generally discarded following birth. Placenta is an ideal starting material for the large-scale manufacture of multiple cell doses of allogeneic MSC. The placenta is a fetomaternal organ from which either fetal or maternal tissue can be isolated. This article describes the placental anatomy and procedure to dissect apart the decidua (maternal), chorionic villi (fetal), and chorionic plate (fetal) tissue. The protocol then outlines how to isolate MSC from each dissected tissue region, and provides representative analysis of expanded MSC derived from the respective tissue types. These methods are intended for pre-clinical MSC isolation, but have also been adapted for clinical manufacture of placental MSC for human therapeutic use.
Introducción
Mesenquimales del estroma células madre / (MSC) están emergiendo como un candidato prometedor para su uso en terapias basadas en células 1. La mayoría de las aplicaciones parecen apuntar a la reparación de tejidos MSC o mediada por la regulación inmune 2. En muchas de estas aplicaciones, alogénico MSC puede ser tan eficaz como MSC autólogas 3. El uso de MSC alogénicas tiene la ventaja económica de ser compatible con la fabricación a gran escala de múltiples dosis de células a partir de un solo tejido fuente 4 para el tratamiento de muchos pacientes.
Históricamente, los estudios preclínicos y clínicos han utilizado MSC-deriva de la médula ósea 4. La médula ósea se recoge generalmente de la cresta ilíaca de un donante voluntario. Este proceso es invasivo, y sólo una pequeña cantidad de médula ósea (~ 20 ml) se recoge en un solo pinchazo. La generación de números clínicamente significativas de MSC requiere una amplia expansión in vitro. potencia de la célula disminuye con el número de pases 3, creando una paradoja que se aumenta más la población celular se expande el número teórico de células requeridas para la eficacia clínica. En contraste con aspirados de médula ósea, placenta a término es un físicamente grande de tejido de partida (por lo general 500 a 750 g 4), que se puede recoger de forma aséptica durante la cesárea, sin riesgo para el donante. MSC derivados de la placenta tienen la proliferación y 5 inmunomodulador capacidad a largo plazo 6, superior a la del hueso MSC derivadas de médula. En un estudio anterior, hemos demostrado que una sola placenta a término contenía suficientes MSC para la fabricación de hasta 7.000 dosis clínicas 4. Estas características hacen de placenta un tejido fuente ideal para la fabricación de MSC alogénicas.
La placenta es un órgano maternofetal que consiste en tanto el tejido fetal y materna 7, y por lo tanto el MSC de origen fetal o materna puede ser, en teoría, aislado. Las siguientes referencias proporcionan deinformación de cola en el desarrollo y la patología, así como el examen microscópico y macroscópico de la placenta humana y sus anexos 8,9. La placenta adecuada se compone en gran parte de los vasos sanguíneos fetales y secretora y células de soporte llamadas trofoblastos, que constituyen las vellosidades coriónicas cubiertos por el corion frondoso (placa) 8. Las vellosidades placentarias ramificados se bañan en sangre materna liberado de las arterias espirales uterinas, lo que permite nutrientes, hormonas y el intercambio de gases entre el feto y la madre. La placenta se ancla al endometrio a través de las células del estroma de la decidua materna y trofoblastos fetales extravillious se intercalan en la matriz extracelular 8. Las vellosidades convergen sobre la placa coriónica fetal donde forman el cordón umbilical 8.
Uno de los resultados del primer Taller Internacional sobre Células Madre provenientes de la placenta (2008) fue una apreciación de la necesidad de estandarizar el aislamiento y characterization de las células de la placenta humana a término 10. Debido a la anatomía de la placenta, la disección de los diferentes tejidos, el aislamiento de MSC y los resultados esperados de cultivo puede ser abrumador para los recién llegados al campo. En este protocolo, la cosecha de tejidos coriónicas de la placenta, seguido por el aislamiento y la expansión de MSC es bien detallada. Caracterización MSC a través de citometría de flujo y diferenciación in vitro se considera tratamiento rutinario 5,11-13, y por lo tanto se detalla brevemente aquí.
Como se destacó en una reciente revisión sistemática de la literatura 14, MSC obtiene a partir de las vellosidades coriónicas de la placenta generalmente se supone que son fetal. A pesar de que sólo el 18% de los estudios examinó el origen del MSC obtenido, y de ellos, sólo la mitad de los estudios informó MSC fetal y la otra mitad informó poblaciones MSC maternos o mixtos. Cada uno de los tres componentes del tejido descritos en este documento (vellosidades coriónicas, coriónicas placa y decidua basal) son lososed principalmente de la membrana fetal / vellosidades, y una pequeña proporción de células maternas uterinos derivados, los cuales permanecen unidas a la placenta entregado. Proporcionamos datos que demuestran que el aislamiento de MSC desde el lado materno de la placenta, en lugar del lado fetal de la placenta, como hemos informado anteriormente de 5,11, es un material de partida más apropiado si se desean MSC materna. Este protocolo también describe el uso de XY FISH para validar contribución fetal o maternal a cultivos de células. Si bien este es un protocolo estándar del fabricante, este análisis es a menudo descuidado y su importancia subestimada 14.
Protocolo
La investigación Comités de Ética Humanos en Servicios de Salud Mater, Royal Brisbane Hospital de Mujeres, Universidad de Tecnología de Queensland y la Universidad de Queensland aprobó la investigación y la recolección de muestras de placenta humana utilizados en el estudio. Todos los protocolos de cumplimiento de las directrices nacionales de investigación. Los pacientes dieron su consentimiento informado por escrito para el uso de tejidos con fines de investigación.
placentas tercer trimestre se obtuvieron de madres sanas siguientes nacimientos de rutina cesárea (CS) al término de los hospitales antes mencionados en Brisbane, Australia. embarazos discordantes Hombre para muestras plazo se utilizaron en este estudio para distinguir fetal a partir de células maternas. el sexo del feto había sido determinado por ecografía antes del nacimiento y / o inspección visual del recién nacido al nacer por el personal clínico. X e Y de fluorescencia cromosoma hibridación in situ (FISH) se utilizó para validar aún más el género y el origen fetal o materna de tejido conservado de laplacentas originales.
1. Antes de la cosecha, de tener la siguiente
Nota: Al hacer hasta soluciones de enzimas, los requisitos y las concentraciones específicas proporcionadas por el fabricante para cada producto deben ser seguidas. Las enzimas se proporcionan a menudo como una mezcla cruda de proteínas, por lo tanto enzimas similares de diferentes empresas son propensos a tener diferentes actividades / concentraciones. Por esta razón el consejo del fabricante debe ser reconocido y preparación de la solución puede tener que ser modificado en consecuencia.
- Preparar o comprar 1,5-2 L total de estéril solución salina equilibrada de Hank (HBSS) para este protocolo.
- Preparar la solución de colagenasa I Stock pesando colagenasa tipo I y disolver 1 mg / ml en HBSS y agitar suavemente para asegurar la disolución completa. Determinar el volumen de HBSS (que contiene calcio y magnesio) para realzar solución de colagenasa a 100 unidades (U) / l (1.000 x solución de stock) y luego filtrar usando un 0,2 y# 181; m filtro de jeringa. Alícuotas volúmenes de 1 ml en tubos de 1,5 ml y almacenar a -20 ° C hasta que se necesite.
- Preparar solución madre de dispasa disolviendo dispasa no estéril a 10 mg / ml en solución salina tamponada con fosfato de Dulbecco (DPBS) sin calcio o magnesio. Además diluir con DPBS sin calcio o magnesio a una concentración final de 2,4 U / ml. Filtro de esterilizar a través de un filtro de jeringa de 0,2 micras. Alícuotas volúmenes de 1 ml en tubos de 1,5 ml y almacenar a -20 ° C hasta que se necesite.
- Preparar solución madre de desoxirribonucleasa -I (DNasa) por disolución de ADNasa-I a 10 mg / ml en 0,15 M NaCl. Filtro thorugh un filtro de jeringa de 0,2 micras. Alícuotas volúmenes de 1 ml en tubos de 1,5 ml y almacenar a -20 ° C hasta que se necesite.
- Preparar la solución de digestión de trabajo mediante la combinación de 100 U de colagenasa tipo / ml, I.5 g / ml de DNasa I y 2,4 U / ml de dispasa en DMEM libre de suero. Recién descongelar y diluir la enzima stocks inmediatamente antes del uso. Aproximadamente, una relación 1: 1 de solución de digestiónvolumen a volumen de tejido se requiere (por ejemplo, 10 ml de tejido, medida en un tubo de 50 ml, requiere 10 ml de solución de digestión).
- Preparar una solución de 4% de paraformaldehído (PFA) en PBS y se ajusta a pH 7,4 15. Tienda 25 mL alícuotas a -20 ° C para el largo plazo oa 4 ° C durante 1 semana.
- Preparar medio de cultivo DMEM-MSC de baja glucosa (DMEM-LG), complementado con una solución antibiótica y antimicótica 1x y suero bovino al 10% no-fetal inactivado por calor. FBS MSC grado se pueden adquirir en muchos proveedores de FBS.
- Autoclave esterilizar el equipo de disección con antelación según las directrices institucionales. Estos incluyen tijeras, fórceps, escalpelos, y una bandeja de disección de metal grande. Recoger el material de plástico adicional estéril de cultivo de tejidos y los consumibles (por ejemplo, hojas de bisturí, 50 ml y 15 ml tubos, 25 ml, 10 ml y 5 ml pipetas, y 75 o 175 frascos de cultivo celular cm 2).
- Usar el equipo de laboratorio de cultivos celulares primarios estándar: una clase II bgabinete iosafety adecuado para el aislamiento de células primarias, incubadora de cultivo celular fijó en 5% de CO2 y 37 ° C, un eje de balancín en una incubadora a 37ºC, y una centrífuga con una capacidad para tubos de 50 ml.
- Utilice equipo de protección personal: una bata de laboratorio, 2 pares de guantes (en todo momento), gafas de seguridad, y zapatos cerrados de acuerdo con las directrices institucionales.
- Preparar soluciones de descontaminación adecuados para muestras de sangre humana según las directrices institucionales y contenedores para residuos biológicos líquidos de antemano.
2. Aislamiento de la placenta MSC
- Preparación de la placenta
- Vestir en el equipo de protección personal requerido. Configurar la cabina de seguridad biológica con los materiales necesarios, soluciones y contenedores de residuos para llevar a cabo el procedimiento hasta la digestión enzimática (sección 2.5.6).
- Obtener una placenta con el consentimiento informado y la aprobación ética. Reunir a través de la placenta seg cesáreación bajo condiciones quirúrgicas asépticas, y el paquete en una bolsa estéril o un cubo para el transporte al laboratorio.
- Durante el transporte y antes de la disección, almacenar la placenta a temperatura ambiente o 4 ° C.
Nota: El tejido se puede almacenar durante un máximo de 6 horas sin afectar el rendimiento del cultivo celular.- Limitar el tiempo entre la recolección y el procesamiento de tejido de placenta cuando sea posible. Esta recomendación se basa en cuestiones prácticas. En algunos casos, hemos retrasado el proceso de aislamiento de células para un máximo de 6 horas después del nacimiento. En estos casos, las placentas se han mantenido a temperatura ambiente oa 4 ° C (en el laboratorio o en el centro de recogida). No se observaron diferencias detectables, por encima de la variación general de donante, en el MSC obtenido a partir de placentas cuando se almacenaron a 4 ° C o a temperatura ambiente.
- Coloque el recipiente con placenta en la cabina de seguridad biológica. Abrir el envase y transferir la placenta en una bandeja estéril.
- Se abren las membranas fetales (saco amniótico o laeve amnios-coriónica) 8. Conviértase orientado con las partes de la placenta. El lado fetal tiene la inserción del cordón umbilical, que es en general, insertado en el centro de la placenta. El lado materno (forrado con decidua basal), que es opuesto al lado fetal, tiene cotiledones obvios (o lóbulos).
- Para comenzar la disección, orientar la placenta con el cordón umbilical hacia arriba en la bandeja estéril.
Nota: Este protocolo está diseñado para producir suficientes células para semilla en un matraz T175 de cada uno de los tres tipos de tejidos. Cada digestión comienza con aproximadamente 10 g de tejido. Este es un número similar de partida frascos como los cultivos de MSC iniciadas a partir de un aspirado de médula ósea 20 ml. Si se desean más células, a continuación, más tejido puede ser cosechado y el protocolo se puede escalar linealmente. Los tamaños de tejido para ser cosechadas son sólo indicativos de lo que es práctico con el tejido placentario. Hay pocos definincaracterísticas g en las vellosidades de la placenta, que se puede utilizar como punto de referencia. Las dimensiones indicadas sirven como una estimación y el cordón umbilical se utiliza como un punto de referencia en la superficie fetal.
- La disección de los tejidos (D) Decidual
- Voltear la placenta más de lo que la superficie materna (decidua basal) quede hacia arriba. Compruebe que la cara fetal con el punto de inserción del cordón umbilical se encuentra hacia abajo.
- Cortar trozos de 0,5 cm de espesor desde el lado materno de la placenta (tejido que contiene decidua basal).
- Coloque piezas de tejido en una placa de Petri que contiene HBSS durante la disección para mantener las piezas de tejido hidratado.
- Transferencia de tejido suficiente para llenar un tubo hasta la marca de 10 ml en un tubo de 50 ml (esto es aproximadamente 10 g de tejido).
- La disección de la placa coriónica (CP) de Tejidos
- Mecánicamente eliminar de la membrana amniótica de la superficie fetal de la placenta (no el saco amniótico), dejando el chofrondosum rionic (placa coriónica) intacta.
- Cortar trozos ~ 1 cm de ancho por 0,5 cm de profundidad de la placa coriónica. Cosecha de la placa coriónica de la región más cercana al cordón umbilical, lejos del borde de la placenta.
- Coloque piezas de tejido en una placa de Petri que contiene HBSS durante la disección para mantenerlos hidratado.
- Transferir el tejido suficiente para llenar un tubo de 50 ml hasta la marca de 10 ml (~ 10 g de tejido).
- La disección de la vellosidad coriónica (CV) de Tejidos
- Diseccionar el tejido CV ~ 1 cm 2 x 0,5-1 cm de profundidad a partir de tejido de la placenta, donde el PP ya ha sido retirado. Una vez más, la cosecha CV de la región más cercana al cordón umbilical, lejos del borde de la placenta. Trate de mantenerse al menos 1 cm de distancia del lado materno de la placenta (tejido que contiene decidua basal); el objetivo es la cosecha de tejidos desde el interior del tejido vellosidades placentarias.
- Coloque las piezas de tejido en una placa de Petri que contiene HBSS durante el dissección para mantenerlos hidratados.
- Transferir el tejido suficiente para llenar un tubo de 50 ml hasta la marca de 10 ml (~ 10 g de tejido).
- Picar carne y digestión enzimática de la D, CP y CV placentarios Tejidos
- Como hay ~ 10 g de D, CP o CV tejidos en tres diferentes tubos de 50 ml, se llenan cada tubo con aproximadamente 40 ml de HBSS y se invierten repetidamente el tubo con el fin de lavar el tejido (repetición de ~ 10 seg).
- Se decanta el sobrenadante y repetir este paso de lavado 2-3 veces hasta que la solución es en gran parte libre de la sangre. Usar una pipeta de 10 ml o pinzas largas para asegurar las piezas de tejido no se pierden fuera del tubo (s) cuando decantar el sobrenadante.
- Volver piezas de tejido a un 10 cm placa de Petri con la transferencia de líquido mínimo. Chop / pelos en el tejido en trozos finos de aproximadamente 1-5 mm 3 con tijeras o cuchilla de afeitar.
- La transferencia de los tejidos picados de nuevo en debidamente etiquetado (D, CP o CV) tubos de 50 ml.
- Añadir recién prepared digerir medios de comunicación en al menos una relación 1: 1 con el tejido (por ejemplo, 10 ml de tejido, más 10 ml de digerir medios de comunicación). Vuelva a colocar la tapa en cada tubo e invierta los tubos varias veces para mezclar.
- Incubar los tejidos en los tubos con medios digerir durante 1-2 horas a 37 ° C. Una atmósfera humidificada y 5% de CO 2 no son necesarios para este paso.
Nota: Se requiere agitación rápida con el fin de disociar eficazmente células de los tejidos y maximizar el rendimiento de MSC. rendimiento Limited será evidente por muy pocas células unidas al matraz de cultivo a 48 hr y un primer tiempo de paso más de 1-2 semanas. El tiempo de incubación y método de agitación depende de la incubadora a 37 ° disponible en el laboratorio y pueden requerir la optimización.- Para una incubadora con una rápida y controlable mecanismo de agitación, el lugar del tejido y digerir en un tubo de 50 ml o matraz cónico estéril, colocar en la incubadora medio y ajustar la velocidad de agitación a 250 rpm. Esto resultará en un resumen completo deel tejido en 1 hora.
- Alternativamente, para una incubadora con un suave balanceo o ningún mecanismo basculante, agitar manualmente el tubo rápida y vigorosamente a mano durante 10 s cada 30 min para 1,5 a 2 hr. El período de incubación de la enzima es un momento adecuado para desechar los residuos, limpiar la cabina de bioseguridad de los elementos innecesarios, cambiar bata de laboratorio si es sucia y prepararse para la siguiente parte del procedimiento.
- Recolección de células mononucleares y de las planchas en matraces
Nota: A partir de la etapa anterior, hay tres tubos de 50 ml (D, CP o CV) para digerir los trozos de tejido. Cuando la solución de digestión del tejido evoluciona un aspecto turbio y los vasos de sangre blancas son evidentes en el tejido, la digestión es completa.- Añadir 30 ml de medio que contiene FBS MSC a cada tubo para inactivar las enzimas contenidas en la solución de digestión.
- Para separar las células mononucleares de la gran desechos no digeridos, pulso Centrifugar el tubo 50 ml. En pocas palabras, permitirla centrífuga para llegar a 340 x g durante 5 segundos y luego se detiene. Esto obligará al desechos grandes para sedimentar en el fondo del tubo, dejando las células mononucleares en suspensión líquida.
Nota: Las células mononucleares se mantendrán en la fase líquida si el tubo es sólo brevemente (pulsado) se centrifuga. Si se extiende la centrifugación, las células mononucleares también sedimentar en la parte inferior del tubo con las piezas de tejido, lo que resulta en la pérdida de células indeseable. - Recoger el sobrenadante, que contiene las células mononucleares, y transferir este a un nuevo tubo de 50 ml con una pipeta.
- Añadir 30 ml de medios de comunicación o HBSS para los restos de tejido placentario restante y agitar vigorosamente. Esto traerá restantes células mononucleares separadas en suspensión y permitir una segunda cosecha de MSC putativa del tejido.
- Pulso centrifugar el tubo una segunda vez, y de nuevo Transferir el sobrenadante a un nuevo tubo de 50 ml. Repita este paso tercio tiempo para maximizar la eficiencia de recolecciónde células mononucleares a partir de cada fuente de tejido.
- Agrupar los sobrenadantes de cada uno de los tipos de tejidos individuales en dos tubos de 50 ml. Esto dará lugar a 6 tubos totales (2 tubos de cada D, CP y CV). Centrifugar cada tubo durante 5 minutos a 340 x g. Este paso sedimentar las células mononucleares a la parte inferior de los tubos.
- Separar con precaución o una pipeta el sobrenadante a la basura. No es necesario tratar de eliminar hasta la última gota de sobrenadante.
Nota: El sedimento celular será frágil debido a un gran número de células rojas de la sangre. Tenga cuidado de no desprenderse accidentalmente el pellet si está decantación directamente desde el tubo de 50 ml. - Después de eliminar la mayor parte del sobrenadante, chasquear suavemente el tubo varias veces con un dedo para desalojar el sedimento celular. Combinar los pellets, por lo que hay un único tubo para cada D, CP o CV tejido y resuspender cada uno en 35 ml de medio de MSC.
- Opcional: Se filtra la fracción mononuclear a través de un filtro de células de malla de 100 micras conjunto Up en un tubo de 50 ml para eliminar grupos de células o material fibroso.
Nota: Es necesario tener cuidado ya que los filtros se obstruyen fácilmente hacia arriba y sobre-llenado. Además, las burbujas de aire pueden obstruir los filtros de drenaje. Si esto ocurre, levante lentamente el filtro fuera del tubo para permitir que el aire fluya bajo el filtro, lavar con filtro a través de medios de cultivo celular o de cambio a un nuevo filtro. Excluyendo la etapa de filtrado no parece alterar el rendimiento o la calidad de los cultivos de MSC posteriores.- Opcionalmente, un glóbulo rojo (RBC) la lisis o la densidad de centrifugación en gradiente de puede llevar a cabo en esta etapa 15. Sin embargo, nuestra experiencia es que RBC no interfieren con el accesorio de MSC o la proliferación y por lo tanto la lisis RBC no es necesario. Las células mononucleares se podía contar en este paso si la eliminación de RBC se llevó a cabo 15. Aunque, la gran mayoría de las células en esta etapa no será MSC, pero sea trofoblastos fetales de origen, células endoteliales y las células hematopoyéticas, así como macélulas de origen hematopoyético internas y las células del estroma decidua.
- Transferir la suspensión celular para cada D, CP o tejido CV en un único matraz de cultivo y T175 en un incubador humidificado a 37 ° C y 5% de CO 2.
- Expansión Post-célula Aislamiento
- A las 48 horas tras el aislamiento inicial, se elimina el medio de cada uno de los matraces (D, CP y CV) y reemplazarla con 35 ml de medio fresco MSC. La células desprendidas y medio gastado se pueden descartar, como MSC putativo se presume que se adjunta al matraz de cultivo de tejidos 16. Volver frascos a la incubadora durante 24 horas.
- Después de un 24 horas adicionales de cultivo, lavar los frascos dos veces con DPBS (25 ml) para eliminar los residuos y los glóbulos rojos. Agitar el líquido alrededor de la parte inferior del matraz para desalojar los glóbulos rojos. Utilizar una pipeta para eliminar el líquido y los residuos. Añadir 35 ml de medio de MSC a los matraces y devolver los matraces a la incubadora.
- Sustitución de los medios dos veces por semana, y enculturas Cubate hasta las monocapas celulares son 80- 90% de confluencia. Esta expansión inicial toma 4-14 días, dependiendo de la calidad del tejido, la cantidad de material de partida y la eficiencia y el tiempo de incubación con la solución de digestión.
3. El subcultivo de las EMSP
- Cuando los cultivos son el 80-90% de confluencia, se lava dos veces con 20 ml de 1x HBSS o DPBS y descartar los lavados. Añadir tripsina sustituto a cada matraz (es decir, utilizar 5 ml para un matraz T175).
- Incubar los matraces de 5 min a 37 ° C para liberar MSC de la superficie de cultivo de tejidos. Toque en las paredes del matraz cada ~ 2 minutos para facilitar la separación.
- Cuando las células se separan de la superficie y en una suspensión de células, se lavan las células del matraz con medio MSC y recoger las células en tubos. Los medios de comunicación MSC diluirán y desactivar la tripsina sustituto (uso ~ 15 ml de medio MSC por matraz T175).
- Transferir el contenido de cada frasco de cultivo de tejido a un 50ml tubo.
- tubos de centrifugación a 340 xg durante 5 min para sedimentar las células.
- Eliminar el sobrenadante y volver a suspender los sedimentos celulares en 1 ml de medio MSC.
- Diluir 10 l de suspensión celular en 10 l de azul de tripano. Recuento de células utilizando un hemocitómetro y calcular el número total de células 15.
- Transferir las células a nuevos matraces a 1.150 células / cm 2 en los medios de comunicación MSC fresco y se incuban en una incubadora de cultivo de tejidos. A esta densidad de la siembra, las semillas 200.000 MSC en cada nuevo matraz T175 en 35 ml de medio de MSC. Alimentar las células dos veces por semana hasta el 80-90% de confluencia. Semillas pasajes posteriores a 1.150 células / cm2 o 200 000 MSC en cada matraz T175.
- Cuando el Paso 1 (P1) o células son confluentes P2, criopreservar la mayoría de las células para su uso futuro, y sembrar de nuevo sólo un matraz T175 para la propagación y caracterización. Las células propagadas se pueden utilizar en P3 o P4 para ensayos de diferenciación mesodérmica y caracterización de células a través de flflujo citometría.
Nota: En los primeros pasajes, puede haber muy pocas colonias poco separadas, pero la densidad celular local dentro de cada colonia puede ser muy alto. Esto no es ideal, ya que el empaquetamiento denso local de las células dará lugar a la inhibición por contacto, lo que retrasa el crecimiento y reducir el rendimiento de cultivo. Recomendamos cuando se observan densas colonias, las células deben ser cosechados y se sembraron de nuevo en un nuevo matraz. Este proceso de redistribución proporciona células con capacidad de proliferar, y el rendimiento general la cultura será mejorado. - Para criopreservar MSC, recoger ~ 1 x 10 6 células en 1 ml de 90% de FCS y 10% dimetilsulfóxido (DMSO) y congelar utilizando protocolos estándar.
Nota: En la sección de resultados representativos, hay descripciones de caracterización MSC usando citometría de flujo, la diferenciación mesodérmica y análisis FISH XY para determinar el sexo de los tres diferentes (D, CP y CV) poblaciones de células expandidas. En nuestro estudio, las placentas fueron de bebés de sexo masculino; así todoscélulas fetales podrían diferenciarse como masculinos (cromosoma Y) y todas las células maternas podrían ser distinguidos como femenina (cromosoma X).
Resultados
El procedimiento de aislamiento MSC placentaria se resume en la Figura 1. Las tres áreas de la anatomía de la placenta a partir del cual se aislaron MSC están resaltados en la figura 2. Estos son los decidua materna, así como los tejidos fetales en gran parte de la placa coriónica y vellosidades coriónicas. Muchos libros de texto, artículos y recursos en línea detalle el desarrollo y el papel funcional de los distintos tejidos de la placenta (véase la referencia 8).
Morfología de las culturas 48 hr después de aislamiento y la eliminación de los restos de tejido.
Tras 48 horas de cultivo, las MSC se han unido al plástico de cultivo de tejidos, mientras que los glóbulos rojos y la mayoría de otros restos celulares no se han unido. En este momento, el medio debe ser reemplazado con 35 ml de medio de cultivo fresco. Antes de este cambio de medio, es difícil hacer observaciones precisas a causa de laun gran número de glóbulos rojos, que obstruir la evaluación visual. La aparición del sobrenadante del cultivo puede variar sustancialmente entre los donantes placenta. Esta variación se puede ver visualmente en el Ejemplo 1 y 2 (Figura 3A). Estos dos aislamientos de MSC, que parecían ser muy diferentes, se llevaron a cabo de forma simultánea a partir de dos placentas diferentes. Sin embargo, una vez lavada, ambas culturas parecían similares (véase el ejemplo lavó 3, Figura 3A).
Bajo un microscopio, después de que el intercambio de medios 48 hr, sólo unas pocas células se adjuntará al matraz (Figura 3B), y las células aparecerán significativamente diferente de MSCs más ampliamente expandido. Algunos escombros y eritrocitos serán visibles como grumos flotantes o adjuntos y éstos no interfieran con el crecimiento de la MSC. Las células fibroblásticas ya adheridos al fondo del matraz es probable que sean una mezcla de células incluyendo MSC, hematopoyético,trofoblástica o células endoteliales. Una vez más, las células no MSC no pongan en peligro los cultivos de MSC, ya que estas células no serán generalmente sobrevivir más de 1-2 pasajes en las condiciones de cultivo de MSC. A pesar de algunas variaciones en el aspecto inicial de las culturas, los resultados posteriores de expansión son generalmente consistentes.
Morfología de las culturas MSC a través del tiempo.
En este ejemplo representativo, siete días después del aislamiento, pequeñas colonias de MSC fibroblásticas eran visibles, aunque las células no-MSC también podrían ser vistos como redonda o células poco adheridas (Figura 4A). Las células unidas se lo que se denominó originalmente una "unidad formadora de colonias -fibroblast "(CFU-F) 17 y más tarde denominado MSC 18. Trece días después del aislamiento, las colonias de MSC fibroblásticas eran grandes (Figura 4B). Generalmente, la monocapa será 80-90% confluentes en este punto y las células debe ser Passa GED. Desde el paso 2 en adelante, la monocapa MSC placentaria desarrollará la morfología característica de remolino en la confluencia (Figura 4C). A menos que las células se pasan a baja densidad, ya no se observa la formación de CFU-F. A baja densidad, MSC placenta derivados tienen una apariencia más pequeña, más cuadrado que el hueso adulto MSC derivadas de médula 1. Mientras que el MSC placentaria derivada y MSC derivadas de médula ósea exhiben tasas de proliferación similares, las células provenientes de la placenta son menos propensos a la rápida senescencia 5.
Caracterización de la placenta MSC in vitro.
Cada población celular expandida debe caracterizarse para asegurar que se ajusta a los criterios de MSC estándar 16, incluyendo (1) la adherencia de plástico (2) la presencia de marcadores de superficie mesenquimales y la ausencia de marcadores de superficie hematopoyéticas, y (3) la capacidad de someterse a mesodérmico diferenciación.
Como se muestra en la Figura 4, las MSC en cultivo son de plástico adherente y tienen una morfología fibroblástica-similares; Esto valida que las células se reúnen los primeros criterios que definen el MSC 16.
MSC marcadores de superficie de visualización mesenquimal placentaria.
La segunda característica definitoria MSC es la presencia de marcadores de superficie mesenquimales y la ausencia de marcadores de superficie hematopoyéticas 16. Como no hay ningún marcador único capaz de identificar definitivamente un MSC, los paneles de marcadores se utilizan generalmente en combinación con citometría de flujo análisis para identificar células que son mesenquimales, pero no hematopoyético. En el conjunto de datos representativo proporcionada aquí (Figura 5A), se evaluó la expresión de células mesenquimales de los marcadores CD73, CD105, CD90, CD146 y CD44, los marcadores hematopoyéticos CD45 y CD34 y HLA-DR, como well como el CD31 marcador endotelial. Todos los anticuerpos utilizados en este proceso de caracterización MSC placenta se enumeran en la Tabla de Materiales / Equipos. La tinción se realizó según las instrucciones del fabricante, con los métodos de análisis descritos aquí 19.
Las células fueron positivas para los marcadores mesenquimales CD73, CD105, CD44, y negativos para los marcadores de superficie celular CD45, CD34, HLA-DR y CD31, como se esperaba 5,20. Aproximadamente, el 37% y el 57% de las células de nuestro conjunto de datos representativos fueron positivas para CD90 y CD146 21, respectivamente. Tanto CD90 y CD146 se utilizan comúnmente MSC marcadores 21. Perfiles de marcador de superficie celular de MSC pueden ser diferentes dependiendo de la fuente MSC tejido, composición del medio, o el número de paso 22. En nuestros muchos años de experiencia, no hemos observado la contaminación a largo plazo de la placenta MSC derivadas de células no mesenquimales siguiente 1-2 passages 5,11.
MSC pantalla placentaria potencial de diferenciación mesenquimal
Por definición, el MSC debe poseer in vitro capacidad de diferenciación mesodérmica 5,13. potencial de diferenciación mesodérmica se evalúa comúnmente a través de cualquiera de las pruebas de diferenciación tri- o bi-linaje. ensayos de Bi-linaje osteogénico generalmente evaluar y capacidad de diferenciación adipogénica, mientras que los ensayos tri-linaje evaluar adicionalmente la capacidad de diferenciación condrogénica. En los resultados representativos presentados aquí, se muestra que las poblaciones de MSC expandidas forman los dos depósitos de calcio, indicativo de la diferenciación osteogénica, y vacuolas lipídicas, indicativo de la adipogénesis (Figura 5B).
Para caracterizar las poblaciones de MSC reportados aquí, sembramos células en 24 pocillos de cultivo a los 6 x 10 4 células en 1 ml de medio de inducción. El medio componentes se enumeran en la Tabla de Materiales / Equipos. Aunque las formulaciones medio de inducción son comunes en la literatura, existe una considerable variabilidad en formulaciones publicadas. Por esta razón se indican brevemente nuestras formulaciones de inducción medio de tinción y enfoques aquí. medio de inducción osteogénica contenía DMEM-HG, 10% de FBS, solución antimicótica antibiótica 1x, 10 mM β-glicerol fosfato, 100 nM de dexametasona, y 50 mM de ácido L-ascórbico 2-fosfato. medio de inducción adipogénica contenía DMEM-HG, 10% de FBS, solución antimicótica antibiótica 1x, 10 mg / ml de insulina, 100 nM de dexametasona, 200 M indometacina y 500 xantina mu M 3-isobutil-1-metilo. Aquí, los cultivos se mantuvieron en un 37 ° C, 5% de CO 2 incubadora y se cultivaron durante 14 días. medio de inducción se intercambió dos veces por semana durante el período de cultivo. Después de 14 días de la inducción, los cultivos se caracterizan por cualquiera de matriz similar al hueso (osteogénesis) o vacuolas lipídicas (adipogénesis) como por nuestra prevpublicación ious 5. análisis de la deposición de matriz osteogénico de calcio se logró por primera aspirar fuera el medio, la fijación de los cultivos con paraformaldehído al 4% durante 20 minutos, lavando la monocapa con DPBS, y después de la tinción con rojo de alizarina S de acuerdo con las instrucciones del fabricante. inducción adipogénica se evaluó mediante la aspiración de la media, la fijación de los cultivos con paraformaldehído al 4% durante 20 min, lavado de la monocapa, y la tinción con solución de Oil Red O de acuerdo con las instrucciones del fabricante. depósitos de calcio manchadas de aceite y vacuolas fueron entonces visualizadas con un microscopio de luz, y las imágenes guardadas para futuras referencias.
En publicaciones anteriores, se ha caracterizado el potencial de diferenciación de MSC placentaria derivada de forma más extensa 4,5. Placentaria derivada de la osteogénesis MSC es similar al hueso MSC derivadas de médula, mientras que la adipogénesis es generalmente menos eficiente en MSC placentaria derivada 5 </ Sup>. No llevamos a cabo de forma rutinaria la diferenciación condrogénica por varias razones, aunque esto ha sido previamente informado por nosotros para placentaria-MSC 5. En primer lugar, mientras que la capacidad de diferenciación mesodérmica es una característica definitoria de MSC, lo más probable es de importancia secundaria 23-25, especialmente cuando es probable que se derivan de las secreciones paracrinos MSC 26 el beneficio terapéutico. En segundo lugar, aunque Dominici et al. Propuesto criterios mínimos para la producción clínica de hueso adulto MSC humana derivada de la médula 16, estudios más recientes indican MSC de diferentes nichos tienen diferentes propiedades inherentes y capacidades de diferenciación 5,13,27-32. De hecho, Parolini et al. Propone que el MSC derivada de placenta debe diferenciarse en linajes "uno o más mesodermales" en lugar de los tres linajes 10. Por último, muchos estudios MSC no incluyen la diferenciación condrogénica, ya que se produce a través de un similaresvía de señalización intracelular como la osteogénesis (vía la familia TGF) 33-35.
Placentaria MSC son de origen materno utilizando este método de cultivo, a pesar de la localización anatómica del material de partida.
Muchas publicaciones suponen que las células aisladas de la MSC fetal rendimiento corion fetal en la cultura 14. Sin embargo, como hemos informado anteriormente de 5, todos los cultivos derivados de corion fetal, utilizando este protocolo, se vuelven rápidamente enriquecido para MSC materna como sería de esperar de forma intuitiva para los cultivos de MSC decidua materna. En estos resultados representativos se utilizó tejido de la placenta de los bebés varones de modo que era posible delinear fácilmente la contribución de células fetal y materna en las poblaciones de células expandidas. Para estos estudios se utilizó el kit de FISH XY enumerados en la Tabla de Materiales / Equipos y seguimos las instrucciones del fabricante.
En los datos representativos proporcionados aquí, los cultivos derivados de la decidua materna fueron ~ 90% de células maternas (XX) y ~ 10% de células fetales (XY) en el pase 0 (Figura 6) . Por el paso 2, las poblaciones de células derivadas de los tejidos maternos eran ~ células maternas 100% (XX), y las células fetales (XY) fueron indetectables. Esto sugiere que la disección del tejido materno física llevó al enriquecimiento de las células maternas en las culturas posteriores. Sin embargo, es fundamental tener en cuenta los resultados del cultivo de las vellosidades coriónicas fetal y culturas coriónicas derivados de chapa. En el paso 0, cultivos en placa derivado tanto fetal vellosidades coriónicas y coriónicas fueron ~ 85% XY, o de origen fetal, lo que indica que la disección específica enriquecida en células fetales (Figura 6). En el paso 0, ambos cultivos contenían células madre ~ 15% la contaminación (XX). Sorprendentemente, en el paso 2, ambos cultivos fetales se poblaron con ~ 100% de células maternas (XX), y las células fetales (XY)ya no eran detectables. análisis FISH XY revela que las células maternas (cromosomas XX) rápida y consistente de adquisición los cultivos derivados de los tejidos fetales coriónicas. Esta es una observación cultura crítica que a menudo se pasa por alto 5. El detalle de este análisis se incluye en este protocolo, ya que demuestra la observación muy importante que las células maternas pueblan rápidamente todas las culturas cuando DMEM suplementado con 10% de SFB se usa sin factores adicionales diseñados para soportar las poblaciones-fetales derivadas.
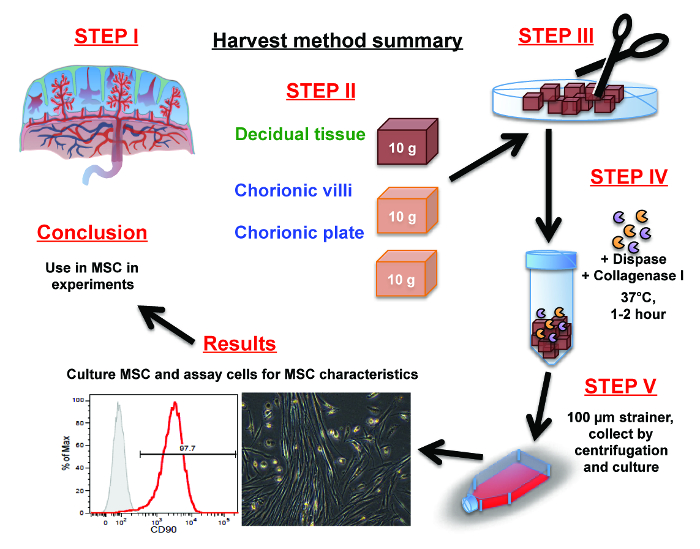
Figura 1:. Resumen del procedimiento de aislamiento MSC placentaria (Paso 1) orientarse con la anatomía placenta. (Paso 2) diseccionar manual de 10 g de tejido, ya sea del decidua, vellosidades coriónicas o la placa coriónica con unas tijeras. (Paso 3) Pique tdiseccionó porciones de decidua, vellosidades coriónicas o los tejidos placa coriónica en trozos finos con unas tijeras o un escalpelo.
(Paso 4) liberar las células de los trozos finos a través de una digestión 1-2 hr en dispasa y colagenasa I.
(Paso 5) separar las células del tejido fibroso por centrifugación de pulso y / o lavado a través de un filtro de células. Recoger y volver a suspender las células en medio de cultivo y se colocaron en frascos de cultivo. Haga clic aquí para ver una versión más grande de esta figura.
células estromales mesenquimales (MSC) se seleccionan en base a su propensión a la adherencia de plástico y la capacidad de sobrevivir y proliferar en el medio de cultivo. Por último, en la sección de resultados, la MSC expandida puede ser caracterizado y se almacena para su uso en experimentos futuros.
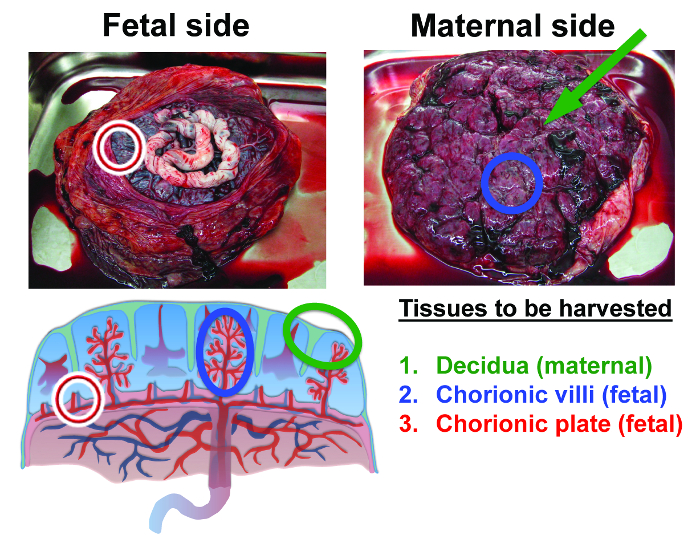
Figura 2:. Anatomía de la placenta humana a término y tejidos aislados en este procedimiento el primer tejido para ser cosechado es decidua materna. Decidua es el tejido que permanece como una capa delgada sobre la superficie de la placenta después de que se desprende de la pared uterina (decidua se identifica por los marcadores verdes). El segundo tejido que va a ser cosechado desde el interior de la placenta es el vellosidades coriónicas fetal (marcadores azules). El tercer tejido para ser cosechado es la placa coriónica fetal (marcadores rojos) (adaptada de la referencia 36). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Morfología de cultivos de 48 horas después del aislamiento y volvermover los restos de tejido. (A) La aparición del sobrenadante del cultivo puede variar sustancialmente entre los donantes de la placenta antes de lavar los escombros. culturas Ejemplo 1 y 2 demuestran esta variación. Estos dos aislamientos se llevaron a cabo simultáneamente, pero a partir de dos placentas diferentes. Una vez lavadas las culturas serán claras de los glóbulos rojos y los restos de tejido, como se muestra en el ejemplo 3. Los resultados posteriores de expansión son generalmente consistentes. (B) Tras el intercambio de medios de 48 horas, sólo unas pocas células se adjuntará al matraz. Barra de escala = 200 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. La morfología de los cultivos de MSC a través del tiempo (A) Siete días después del aislamiento, pequeña fcolonias de MSC ibroblastic son visibles aunque las células no-MSC también estar presente como redonda o células poco adheridas. (B) 13 días después del aislamiento, las colonias de MSC fibroblásticas son grandes y, a menudo la monocapa de MSC es confluente y listo para el paso. (C) del paso 2 en adelante, la monocapa MSC desarrollará una morfología característica de hidromasaje-como en la confluencia. Barra de escala = 200 micras. Haga clic aquí para ver una versión más grande de esta figura.
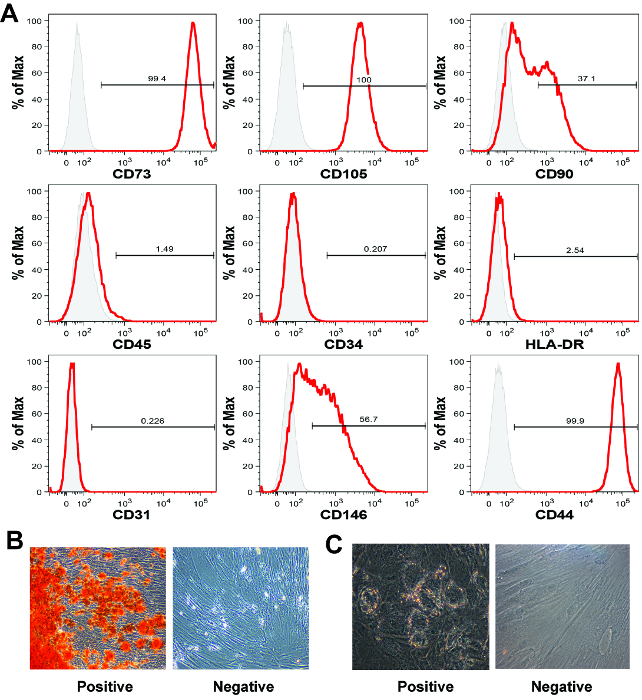
Figura 5:. MSC caracterización por citometría de flujo y la diferenciación mesodérmica (A) El MSC coriónica de la placenta vellosidades derivados de mostrar un perfil clásico marcador MSC por citometría de flujo análisis, aunque para estos marcadores de superficie celular, expressión es similar para todos los tipos de MSC humanos. Cada histograma muestra la intensidad de señal (eje x) versus el recuento de células normalizado en el eje Y (% del máximo). En estos datos representativos figuran las células fueron positivas para CD73, CD105 y CD44, y negativos para los marcadores hematopoyéticos CD45 y CD34 y HLA-DR. (B) de la placenta MSC generalmente se someten robusto diferenciación osteogénica, sin embargo (C) la diferenciación adipogénica puede ser menos eficiente que con el hueso MSC derivadas de médula. Se tomaron imágenes en Categoría B y C a 40 aumentos. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6: MSC placentario son de origen materno utilizando este método de cultivo, a pesar de la localización anatómica del material de partida.Los gráficos muestran la cuantificación de la fetal (varón, XY) y materna composición de células (hembra, XX) de los cultivos de MSC aisladas de la placenta decidual, vellosidades coriónicas y tejidos placa coriónica en cada segundo paso. células maternas (XX) con rapidez y de forma reproducible hacerse cargo de los cultivos derivados de los tejidos fetales coriónicas. Fetal = hombre = cromosomas XY detectados en una celda individual, maternos = mujer = XX cromosomas detectados en una celda individual. Los datos presentados aquí fue a partir de N = 3 placentas donantes independientes de los bebés varones, con un mínimo de 100 células teñidas para XY FISH y contados para cada punto de datos. Las barras representan las medias y las barras de error reflejan una desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
La placenta es un órgano grande físicamente maternofetal, a partir del cual el MSC fetal o materna puede aislarse 22. En este documento, hemos proporcionado una descripción detallada de la anatomía de la placenta y la instrucción sobre la forma de diseccionar específicamente decidua (materna), vellosidades coriónicas (fetal), y la placa coriónica (fetal) tejido (Paso 2,2-2,4). Posteriormente, hemos descrito un protocolo robusto que permite el aislamiento de MSC de cada uno de estos tres tejidos (paso 2,5-2,6). Expansión de la placenta MSC es eficiente y culturas parece similar al hueso cultivos de MSC derivadas de médula (Figuras 3 y 4). La diferenciación osteogénica es fiable (Figura 5B), mientras que la diferenciación adipogénica es generalmente menos eficiente (Figura 5C) 5.
Muchos recién llegados al campo van a suponer que los cultivos derivados de vellosidades coriónicas o tejidos fetales placa coriónica se enriquecen de MSC fetal. Sin embargo, en nuestras manos FeTal enriquecimiento celular sólo es transitorio cuando el medio de expansión MSC estándar tal como DMEM-LG + 10% de FBS se utiliza 5. A continuación se muestran resultados representativos utilizando tejidos de la placenta derivados de un bebé de sexo masculino. Mediante el uso de tejido de la placenta de un bebé de sexo masculino, las células fetales son fácilmente identificables por tener cromosomas XY, mientras que las células maternas son identificables por tener cromosomas XX. La figura 6 muestra XY resultados de FISH para una cultura representativa. Mientras que el MSC fetal (XY) se enriquecen (hasta 80%) en los cultivos iniciales derivados de vellosidades coriónicas fetal o tejidos placa coriónica, estos mismos cultivos son superadas rápidamente (~ 100%) por la madre (XX) MSC durante los dos primeros pasajes . En medio estándar, compuesto de DMEM-LG + 10% de FBS, los pocos MSC-materna derivada que contaminan los tejidos fetales outcompete las células fetales obtenidas por cultivo.
Un paso crítico descrito en este protocolo es una apreciación de la anatomía de la placenta y de donde fetaly tejido materno se puede cosechar más eficaz. Como se indica en la sección de resultados representativa, la disección de tejido fetal no permiten el enriquecimiento transitorio de MSC fetal derivado. Las mejoras en la formulación del medio de expansión, a través de la suplementación medio del factor de crecimiento exógena específica deben permitir la expansión selectiva de las poblaciones de MSC-fetales derivados, y la producción de un producto de células que se enriquece por fetal en lugar de células maternas (nuestro grupo está desarrollando actualmente dichas formulaciones de medio). La fabricación de las poblaciones de MSC fetales puede tener una serie de ventajas, como MSC fetal se supone que tienen una mayor angiogénesis y propiedades inmunosupresoras que las poblaciones de MSC maternas equivalentes 37.
En cada uno de los protocolos de aislamiento descritas, se utilizó aproximadamente 10 g de tejido. Toda una placenta es típicamente 500-750 g, y en trabajos anteriores hemos demostrado que a través del tejido automatizado compendio y un proc biorreactor expansión celulareses que debería ser posible fabricar más de 7.000 dosis de células clínicos desde una única placenta 4. Estas cifras ponen de manifiesto la posible idoneidad de MSC placentaria derivada en terapias de MSC alogénicas, y la importancia de este método, independientemente del origen del MSC (fetal o materna). Desde una perspectiva terapéutica, es más crítico que los usuarios tienen una comprensión completa del producto celular y la capacidad de fabricar de forma fiable este producto celular. Esperamos que nuestro video ayudará a los investigadores a entender la anatomía placenta, aislar MSC de la placenta, y anticipar la composición celular fetal o materna probable de sus culturas.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
RP fue apoyado por el Consejo Nacional de la Salud y la Investigación Médica (NHMRC) Postdoctoral becas de formación. VS fue apoyado por una beca de la Universidad de Queensland Estudiante Internacional de Postgrado. MRD fue apoyada por el NHMRC e Inner Wheel Australia.
Damos las gracias al personal clínico y de enfermería para ayudar en el consentimiento del paciente y la toma de muestras. Agradecemos al Prof. Nickolas Fisk, el Prof. Dr. Kerry Atkinson y Rohan Lourie para discusiones interesantes en obstetricia, el desarrollo de la placenta y feto-placenta anatomía.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| HBSS | Gibco/Invitrogen | 14185-052 | Long name: Hanks Balanced Salt Solution |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| trypsin-substitute | Gibco/Invitrogen | 12563-029 | Long name: TrypLE Select |
| DMEM-LG | Gibco/Invitrogen | 11885-092 | Long name: Dulbecco’s Modified Eagles Medium-Low Glucose |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| PBS (Mg+Ca+ free) | Gibco/Invitrogen | 14190-250 | Long name: Dulbecco's Phosphate buffered saline, magnesium and calcium free |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| paraformaldehyde powder or 4% solution | any | ||
| Collagenase I | Invitrogen | 17100-017 | 2,500 U/ml |
| Dnase I | Sigma | D5025 | 10 mg/ml in 0.15 M NaCl |
| Dispase | Invitrogen | 17105-041 | 10 mg/ml in water (20,000 U/ml). |
| Material | Company | Catalog Number | Comments |
| Disposables: | |||
| 50 ml centrifuge tubes | Falcon or any brand | ||
| petri dishes, sterile plactic (25 cm and 10 cm diameter) | Nunc | ||
| Cell strainers (100 μm) | Becton Dickinson | 352340 | |
| 175 and 75 cm2 (T175 and T75) tissue culture flasks | Nunc | ||
| 5 ml, 10 ml, 25 ml sterile serolgical pipettes | any brand | ||
| Material | Company | Catalog Number | Comments |
| Equipment: | |||
| Centrifuge | |||
| tissue culture incubator 37 °C, 5% CO2 | |||
| Biological safety cabinet | |||
| Sterile scissors and tweezers | |||
| Tube racks | |||
| Pipette-boy or equivalent | |||
| Gilson type pipetters and sterile tips 1,000 µl, 200 µl, 20 µl. | |||
| rocking or shaking incubator (37 °C) | |||
| personal protective equipment | |||
| cleaning solutions (suitable for blood) | |||
| waste containers, correct disposal bins for tissue/blood | |||
| Reagents for MSC characterization | |||
| Antibody (Clone ID) | Manufacturer | Catalogue No. | Isotype |
| CD73 (AD2) | Miltenyi Biotec | 130-095-183 | Mouse IgG1 |
| CD105 (43A4E1) | Miltenyi Biotec | 130-094-941 | Mouse IgG1 |
| CD90/Thy-1 (AC122) | Miltenyi Biotec | 130-095-403 | Mouse IgG1 |
| CD45 (5B1) | Miltenyi Biotec | 130-080-202 | Mouse IgG2a |
| CD34 (AC136) | Miltenyi Biotec | 130-090-954 | Mouse IgG2a |
| HLA-DR (AC122) | Miltenyi Biotec | 130-095-298 | Mouse IgG2a |
| CD31 (PECAM-1) | BD Pharmingen | 555446 | Mouse IgG1 |
| CD146 (541-10B2) | Miltenyi Biotec | 130-092-849 | Mouse IgG1 |
| CD44 (DB105) | Miltenyi Biotec | 130-095-180 | Mouse IgG1 |
| Isotype Controls (Clone ID) | Manufacturer | Catalogue No. | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-214 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-212 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-213 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-091-837 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-098-849 | |
| MACS Buffer | Miltenyi Biotec | 130-091-221 | |
| Osteogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| Dexamethasone | Sigma | D4902 | |
| β-Glycerol Phophate | Sigma | 50020 | |
| L-ascorbic acid 2-phosphate | Sigma | A8960-5G | |
| Alizarin Red S | Sigma | A5533-25G | For calcium matrix staining |
| Adipogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| insulin | Sigma | I2643 | |
| Dexamethasone | Sigma | D4902 | |
| Indomethacin | Sigma | I7378 | |
| 3-isobutyl-1-methyl xanthine | Sigma | I5879 | |
| Oil Red O solution | Sigma | O1391-250ML | For lipid vacuole staining |
| XY FISH kit to determine fetal or maternal origin of cells | |||
| XY chomosome FISH kit | Vysis (Abbott Molecular) | 07J20-050 | Long name: CEP X SpectrumOrange/Y SpectrumGreen Direct Labeled Fluorescent DNA Probe Kit |
Referencias
- Brooke, G., et al. Therapeutic applications of mesenchymal stromal cells. Semin Cell dev Biol. 18, 846-858 (2007).
- Wei, X., et al. Mesenchymal stem cells: a new trend for cell therapy. Acta Phamacol Sin. 34, 747-754 (2013).
- Ma, S., et al. Immunobiology of mesenchymal stem cells. Cell Death Differ. 21, 216-225 (2014).
- Timmins, N. E., et al. Closed system isolation and scalable expansion of human placental mesenchymal stem cells. Biotechnol Bioeng. 109, 1817-1826 (2012).
- Barlow, S., et al. Comparison of human placenta- and bone marrow-derived multipotent mesenchymal stem cells. Stem Cell Dev. 17, 1095-1107 (2008).
- Jones, B. J., Brooke, G., Atkinson, K., McTaggart, S. J. Immunosuppression by placental indoleamine 2,3-dioxygenase: a role for mesenchymal stem cells. Placenta. 28, 1174-1181 (2007).
- Parolini, O., et al. Toward cell therapy using placenta-derived cells: disease mechanisms, cell biology, preclinical studies, and regulatory aspects at the round table. Stem Cell Dev. 19, 143-154 (2010).
- Benirschke, K., Burton, G. J., Baergen, R. N. Pathology of the Human Placenta. , 6 edn (2012).
- Moore, K., Persaud, T., Torchia, M. The developing human: clinically oriented embryology. , Elsevier/ Saunders. (2013).
- Parolini, O., et al. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem cells. 26, 300-311 (2008).
- Brooke, G., et al. Manufacturing of human placenta-derived mesenchymal stem cells for clinical trials. Brit J Haematol. 144, 571-579 (2009).
- Pelekanos, R. A., et al. Intracellular trafficking and endocytosis of CXCR4 in fetal mesenchymal stem/stromal cells. BMC cell biology. 15, 15(2014).
- Chen, Y. S., et al. Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells. Stem Cells Transl Med. 1, 83-95 (2012).
- Heazlewood, C. F., et al. High incidence of contaminating maternal cell overgrowth in human placental mesenchymal stem/stromal cell cultures: a systematic review. Stem Cells Transl Med. 3, 1305-1311 (2014).
- Horn, P., Bork, S., Wagner, W. Standardized isolation of human mesenchymal stromal cells with red blood cell lysis. Methods Mol Biol. 698, 23-35 (2011).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Friedenstein, A. J., et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol. 2, 83-92 (1974).
- Caplan, A. I. Mesenchymal stem cells. J Orthop Res. 9, 641-650 (1991).
- Futrega, K., et al. The microwell-mesh: A novel device and protocol for the high throughput manufacturing of cartilage microtissues. Biomaterials. 62, 1-12 (2015).
- Liu, Y., Goldberg, A. J., Dennis, J. E., Gronowicz, G. A., Kuhn, L. T. One-step derivation of mesenchymal stem cell (MSC)-like cells from human pluripotent stem cells on a fibrillar collagen coating. PloS one. 7, 33225(2012).
- Maleki, M., Ghanbarvand, F., Reza Behvarz, M., Ejtemaei, M., Ghadirkhomi, E. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int J Stem Cell. 7, 118-126 (2014).
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Commun Signal. 9, 12(2011).
- Bianco, P., Robey, P. G., Simmons, P. J. Mesenchymal stem cells: revisiting history, concepts, and assays. Cell stem cell. 2, 313-319 (2008).
- Bianco, P., et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nature med. 19, 35-42 (2013).
- Da Silva Meirelles, L., Caplan, A. I., Nardi, N. B. In search of the in vivo identity of mesenchymal stem cells. Stem cells. 26, 2287-2299 (2008).
- Caplan, A. I., Correa, D. The MSC: an injury drugstore. Cell Stem Cell. 9, 11-15 (2011).
- Wegmeyer, H., et al. Mesenchymal Stromal Cell Characteristics Vary Depending on Their Origin. Stem Cell Dev. , (2013).
- Guillot, P. V., Gotherstrom, C., Chan, J., Kurata, H., Fisk, N. M. Human first-trimester fetal MSC express pluripotency markers and grow faster and have longer telomeres than adult MSC. Stem cells. 25, 646-654 (2007).
- Covas, D. T., et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Exp Hemol. 36, 642-654 (2008).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell stem cell. 3, 301-313 (2008).
- Pelekanos, R. A., et al. Comprehensive transcriptome and immunophenotype analysis of renal and cardiac MSC-like populations supports strong congruence with bone marrow MSC despite maintenance of distinct identities. Stem cell res. 8, 58-73 (2012).
- da Silva Meirelles, L., Chagastelles, P. C., Nardi, N. B. Mesenchymal stem cells reside in virtually all post-natal organs and tissues. J Cell Sci. 119, 2204-2213 (2006).
- James, A. W. Review of Signaling Pathways Governing MSC Osteogenic and Adipogenic Differentiation. Scientifica (Cairo). 2013, 684736(2013).
- Xu, C., et al. Cross-Talking between PPAR and WNT Signaling and Its Regulation in Mesenchymal Stem Cell Differentiation. Curr Stem Cell Res Ther. , (2015).
- Zhuang, H., et al. Molecular Mechanisms of PPAR-gamma Governing MSC Osteogenic and Adipogenic Differentiation. Curr Stem Cell Res Ther. , (2015).
- Moore, K., Persaud, T., Torchia, M. Before We Are Born: Essentials of Embryology and Birth Defects. , Elsevier Health Sciences. 8 edn (2011).
- Zhu, Y., et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther. 5, 48(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados