Method Article
単離およびヒト胎盤組織由来の間葉系幹/間質細胞の増殖
要約
ここで我々が分離し、これらの組織から間葉系幹/間質細胞(MSC)の拡大が続く人間の満期胎盤から胎児と母体組織の切開のための方法を記載しています。
要約
Mesenchymal stem/stromal cells (MSC) are promising candidates for use in cell-based therapies. In most cases, therapeutic response appears to be cell-dose dependent. Human term placenta is rich in MSC and is a physically large tissue that is generally discarded following birth. Placenta is an ideal starting material for the large-scale manufacture of multiple cell doses of allogeneic MSC. The placenta is a fetomaternal organ from which either fetal or maternal tissue can be isolated. This article describes the placental anatomy and procedure to dissect apart the decidua (maternal), chorionic villi (fetal), and chorionic plate (fetal) tissue. The protocol then outlines how to isolate MSC from each dissected tissue region, and provides representative analysis of expanded MSC derived from the respective tissue types. These methods are intended for pre-clinical MSC isolation, but have also been adapted for clinical manufacture of placental MSC for human therapeutic use.
概要
間葉系幹/間質細胞(MSC)は、細胞ベースの治療法1で使用するための有望な候補として浮上しています。ほとんどのアプリケーションは、MSC媒介組織修復または免疫調節2を標的とするように思われます。これらの用途の多くでは、同種異系MSCは自家MSC 3と同程度に有効であってもよいです。同種MSCの使用は、多くの患者を治療するための単一のソース組織4からの複数の細胞用量の大規模製造と適合性であるという経済的利点を有します。
歴史的には、前臨床および臨床研究は、MSC由来の骨髄4からを利用しています。骨髄は、一般的にボランティアドナーの腸骨稜から収集されます。このプロセスは、侵襲的であり、骨髄(〜20mL)中のわずかな量は、単一の穿刺を介して収集されます。 MSCの臨床的に意味のある数字を生成することは、 インビトロ拡大に広範囲が必要です。セルの効力は、通路の数とともに減少します 3、臨床的有効性のために必要な細胞の理論数は、より多くの細胞集団が展開されて増加するパラドックスを作成します。骨髄吸引とは対照的に、用語の胎盤は、ドナーに危険で帝王切開中に無菌的に採取することができる物理的に大きな始動組織(一般的に500〜750グラム4)、です。胎盤由来MSCは、骨髄由来MSCに優れた長期的な増殖5および免疫調節容量6を 、持っています。以前の研究では、単一の用語の胎盤は、最大7000の臨床用量4の製造のための十分なMSCが含まれていることを実証しました。これらの特性は、同種異系MSCの製造のための理想的な供給源組織プラセンタ作ります。
胎盤は、胎児と母親の両方の組織7からなる胎児母体臓器であり、したがって、胎児や母体の起源のMSCは、理論的には、分離することができます。以下の参考文献は、デを提供します開発と病理学上の尾情報、並びにヒト胎盤および付属器8,9の顕微鏡および肉眼検査。胎盤は、適切繁生絨毛膜(板)8で覆われた絨毛膜絨毛を構成する、主として胎児の血管および分泌と栄養膜と呼ばれる支持細胞から構成されています。分枝状の胎盤絨毛は栄養素、ホルモンと胎児と母親との間のガス交換を可能にする、子宮らせん動脈から配信母体血を浴びています。胎盤は、母体の脱落膜間質細胞を経由して子宮内膜に固定され、胎児extravillious栄養膜は、細胞外マトリックス8に散在しています。絨毛は、彼らが臍帯8を形成し 、胎児の絨毛膜板上に収束します。
胎盤由来幹細胞の最初の国際ワークショップ(2008年)の結果は、単離およびcharacterizatioを標準化する必要性の感謝でした人間の満期胎盤10からの細胞のn個。そのため、胎盤の解剖学の、異なる組織の切開は、MSCの単離および予想される培養の結果は、フィールドへの新規参入者のための圧倒的なことができます。このプロトコルでは、MSCの単離および拡大が続く胎盤絨毛組織の収穫は、徹底的に詳述されています。フローサイトメトリーを経由し、in vitro分化における MSCの特徴付けは、ルーチン5,11-13を考え、そのためだけに簡単にここで詳しく説明されています。
最近の系統的な文献レビュー14で強調したように、胎盤の絨毛から得られたMSCは、一般的に胎児であると仮定されています。 、研究のわずか18%が得られたMSCの起源を検討し、それらのが、研究の唯一の半分は、胎児MSCを報告し、他の半分は、母体または混合MSC集団を報告しました。本明細書中に説明した3つの組織成分のそれぞれ(絨毛、絨毛膜板及び基底脱落膜)がコンプです主に胎児膜/絨毛、および配信胎盤に付着したまま、子宮由来の母体細胞の小さな割合のosed。我々は以前に5,11を報告しているとして、母体MSCが望ましい場合ではなく、胎盤の胎児側より、胎盤の母側からMSCを単離し、より適切な出発物質であることを実証するデータを提供します。このプロトコルはまた、細胞培養への胎児や母体の貢献度を検証するXY FISHの使用を記載しています。これは、メーカーからの標準プロトコルであるが、この分析は、しばしば無視し、その重要性は、14を過小評価されています。
プロトコル
マーテルヘルスサービス、ロイヤルブリスベンウイメンズ病院の人間研究倫理委員会、クイーンズランド工科大学とクイーンズランド大学は、研究で用いたヒト胎盤サンプルの研究とコレクションを承認しました。すべてのプロトコルは、国の研究ガイドラインを遵守します。患者は、研究目的のために組織を使用するための書面によるインフォームドコンセントを提供しました。
妊娠後期の胎盤は、ブリスベン、オーストラリアで上記の病院からの用語で、ルーチン帝王切開(CS)出生以下の健康な母親から得ました。用語サンプルの男性不一致妊娠は母体細胞から胎児を区別するために、本研究で利用しました。胎児の性別は、出産前および/または臨床スタッフによる出生時の新生児の目視検査に超音波によって決定されていました。 in situハイブリダイゼーション(FISH) における X及びY染色体の蛍光は、さらに性別から保存された組織の胎児又は母体起源を検証するために利用されましたオリジナルの胎盤。
1.前に収穫するには、次のように準備します
注:酵素液を構成する場合には、各製品のメーカーが提供する特定の要件および濃度に従うべきです。酵素は、多くの場合、したがって、異なる企業からの同様の酵素が異なる活性/濃度を有する可能性があり、タンパク質の粗混合物として提供されます。この理由のために、製造者のアドバイスは認められるべきであり、溶液の調製は、それに応じて変更する必要ができます。
- このプロトコルのために1.5 L 2の総滅菌ハンクス平衡塩溶液(HBSS)を準備したり、購入してください。
- コラゲナーゼI型を計量することによりコラゲナーゼIストック溶液を準備し、静かに完全な溶解を確実にするために1mg / HBSS中ミリリットルと渦を溶解します。 100単位(U)/μlの(1,000倍ストック溶液)にコラゲナーゼ溶液を持参した後、0.2&使用してフィルタリングするために必要なHBSS(カルシウムとマグネシウムを含む)の量を決定します#181;メートルシリンジフィルター。 -20℃で1.5 mlチューブとストアにアリコート1ミリリットルボリュームを必要になるまで。
- カルシウムまたはマグネシウムを含まないダルベッコのリン酸緩衝食塩水(DPBS)中10mg / mlの非滅菌ディスパーゼを溶解することによりディスパーゼストック溶液を調製します。さらに、2.4 U / mlの最終濃度になるように、カルシウムまたはマグネシウムを含まないDPBSで希釈します。 0.2μmのシリンジフィルターを通して滅菌フィルター。 -20℃でアリコート1ミリリットルの1.5ミリリットルチューブ内のボリュームとストアが必要になるまで。
- 0.15 M NaCl中に10mg / mlのDNアーゼIを溶解することにより、デオキシリボヌクレアーゼ(DNアーゼ)-Iストック溶液を準備します。 0.2μmのシリンジフィルターthorughフィルター。 -20℃でアリコート1ミリリットルの1.5ミリリットルチューブ内のボリュームとストアが必要になるまで。
- 100 U / mlのコラゲナーゼタイプを組み合わせることにより、作業消化溶液を調製I、I.5 / mlのDNアーゼIおよび2.4 U / mlのディスパーゼ、無血清DMEMです。たて使用直前に酵素ストックを解凍し、希釈します。およそ、1:消化溶液の1比組織容積の容積が必要とされる( 例えば 、50mlチューブ中で測定した組織を10ml、消化溶液10mlが必要)。
- PBS中の4%パラホルムアルデヒド(PFA)の溶液を調製し、pHを7.4〜15に調整します。ストア長期または1週間4℃で-20℃で25mLのアリコート。
- 1×抗生物質や抗真菌剤溶液と、10%の非熱不活性化ウシ胎児血清を添加したDMEM低グルコース(DMEM-LG)からのMSC培養培地を準備します。 MSCグレードFBSは、多くのFBS供給業者から購入することができます。
- オートクレーブは、施設の指針に従って、事前に解剖器具を滅菌します。これらは、はさみ、ピンセット、メス、および大きな金属解剖トレイを含みます。追加の滅菌組織培養プラスチック容器と消耗品を収集する( 例えば外科用メス刃50mlの15 mlチューブ25mlの10mlの、5mlのピペット、及び75又は175cm 2の細胞培養フラスコ)。
- クラスII B:標準の初代培養細胞の実験装置を使用して、初代細胞分離、細胞培養、5%CO 2及び37℃に設定したインキュベーター中、37℃のインキュベーター中でロッカー、50 mlチューブ用の容量を有する遠心分離機適しiosafetyキャビネット。
- 機関のガイドラインに従って実験室コート、(常時)手袋2組、安全メガネ、閉じるつま先の靴:適切な個人保護具を使用してください。
- 事前に施設の指針と液体生物学的廃棄物容器当たりヒト血液検体のための適切な除染溶液を調製します。
胎盤MSCの2の単離
- プラセンタの調製
- 必要な個人用保護具を着ます。酵素消化(セクション2.5.6)に手順を実行するために必要な材料、ソリューション、廃棄物容器に生物学的安全キャビネットを設定します。
- インフォームドコンセントおよび倫理的な承認を得て胎盤を入手します。帝王切開秒経由で胎盤を収集研究室への輸送のための滅菌バッグやバケツで無菌外科的条件の下化、およびパッケージ。
- 輸送と解剖の前に中に、室温または4℃で胎盤を格納します。
注:組織は、細胞培養の性能に影響を与えることなく、最大6時間保存することができます。- 胎盤の収集と組織処理可能な間の時間を制限します。この勧告は、実用的な問題に基づいています。いくつかの例では、我々は、出生後最大6時間、細胞単離のプロセスを遅らせています。これらの例では胎盤は、室温または4°C(ラボ内またはコレクションの中心で)で維持されてきました。それらは4℃または室温で保存したときに検出可能な差が胎盤から得られたMSCに、一般的なドナーの変化の上に、観察されませんでした。
- 生物学的安全キャビネットの中で胎盤を有する容器を置きます。コンテナを開き、滅菌トレイに胎盤を移します。
- 胎児膜(羊膜嚢または羊膜絨毛laeve)8を開きます。胎盤の一部に配向さになります。胎児側が中央に胎盤に挿入し、一般的にある臍帯挿入を、持っています。胎児側とは反対である(基底脱落膜で裏打ち)母性側は、明らかな子葉(またはローブ)を有しています。
- 解剖を開始するには、滅菌トレイに上向きに臍帯と胎盤を向けます。
注意:このプロトコルは、3つの組織型のそれぞれから1 T175フラスコに播種するために十分な細胞を得るために設計されています。各ダイジェストは組織の約10グラムから始まります。これは、20ミリリットルの骨髄穿刺液から開始MSCの培養物フラスコの同様の開始番号です。より多くの細胞が所望される場合には、より多くの組織を採取することができ、プロトコルは、直線的にスケーリングすることができます。収穫される組織の大きさは、胎盤組織と実用的であるもののみを示しています。いくつかのdefininがあります。基準点として使用することができる胎盤絨毛中のG機能。示された寸法は概算として機能し、臍帯が胎児の表面上のランドマークとして使用されています。
- 脱落膜(D)組織の解剖
- そう母体の表面上に胎盤をフリップ(基底脱落膜)上を向いています。臍帯挿入ポイントと胎児側が下を向いていることを確認します。
- (基底脱落膜組織を含む)、胎盤の母側から厚さ0.5cmの部分をカット。
- 水和組織片を維持するために解剖中にHBSSを含むペトリ皿に組織片を置きます。
- (これは組織の約10グラムである)50mlのチューブで10ミリリットルマークまで管を埋めるために十分な組織を転送します。
- 絨毛プレートの解剖(CP)組織
- 機械的に町を残して、胎盤(ない羊膜嚢)の胎児の表面から羊膜の除去rionic繁生(絨毛膜板)は無傷。
- 絨毛膜板から深い0.5センチメートルによって幅1cm〜の部分をカットします。離れて胎盤の端から、へその緒に最も近い領域から絨毛膜板を収穫。
- 水和それらを保つために解剖中にHBSSを含むペトリ皿に組織片を置きます。
- 10ミリリットルマーク(〜組織の10グラム)までの50ミリリットルチューブを埋めるために十分な組織を転送します。
- 絨毛(CV)組織の解剖
- 〜1センチメートルCV組織CPがすでに削除されている胎盤組織からの深い2×0.5〜1センチメートルを解剖。ここでも、離れて胎盤の端から臍帯に最も近い地域から収穫CV。 (基底脱落膜組織を含む)、胎盤の母側から離れ、少なくとも1cmに滞在してみてください。目標は、胎盤絨毛組織の内部から組織を採取することです。
- disse中にHBSSを含むペトリ皿に組織片を配置水和それらを保つためにction。
- 10ミリリットルマーク(〜組織の10グラム)までの50ミリリットルチューブを埋めるために十分な組織を転送します。
- ミンチとDの酵素消化、CP、およびCV胎盤組織
- D、CPまたはCV組織の〜10グラムは、3つの異なる50ミリリットルのチューブであるように、約40ミリリットルのHBSSと繰り返し(〜10秒間繰り返す)組織を洗浄するためにチューブを反転させて各チューブを埋めます。
- 上清を除去し、溶液を血液から大幅に外れるまで、この洗浄ステップを2-3回繰り返します。上清をデカントしたときに組織片をチューブ(複数可)の外に失われていないことを確認するために10ミリリットルピペットまたは長いピンセットを使用してください。
- 最小限の液体移送と10cmのペトリ皿に組織片を返します。チョップ/ハサミやカミソリの刃で約1〜5ミリメートル3の細かい破片に組織をミンチ。
- バック適切に標識された(D、CPまたはCV)50ミリリットルチューブにみじん切りの組織を転送します。
- たてprepar追加組織( 例えば、10組織のミリリットルを加えたダイジェスト培地10 ml)で1:1の比は、少なくとも1のメディアをダイジェスト編。各チューブのキャップを交換し、混合するためにチューブを数回転倒。
- 37℃で1〜2時間のメディアをダイジェストでチューブに組織をインキュベートします。加湿雰囲気および5%CO 2は、このステップのために必要ではありません。
注:高速振盪を効率的に組織から細胞を解離し、MSCの収率を最大にするために必要とされます。限定収率が48時間と長い1-2週間よりも第1の通過時間で培養フラスコに付着し、非常に少数の細胞によって明らかであろう。インキュベーション時間振とう方法は、実験室で利用可能な37℃のインキュベーターに依存し、最適化が必要な場合があります。- 迅速かつ制御可能な振動機構、場所組織とインキュベーターのためのインキュベーターで50ミリリットルチューブまたは滅菌三角フラスコ、代わりに培地を消化し、250rpmまで速度を振っ設定。これは、完全なダイジェストになります1時間で組織。
- 別の方法として、緩やかに揺り動かしながら、あるいは全く揺動機構とのインキュベータのために、手動で10秒、1.5〜2時間毎に30分間手で迅速かつ積極的にチューブを振ります。酵素インキュベーション期間は、廃棄物を捨てて、不要な項目の安全キャビネットをクリアし、汚れた場合は白衣を変更し、手順の次の部分を準備するのに適した時間です。
- 単核細胞の収集とフラスコにめっき
注:前のステップから、組織片を消化すると3 50mlチューブ(D、CPまたはCV)があります。組織消化液が曇った外観を進化と白の血管が組織に明らかである場合には、消化が完了です。- 消化液に含まれる酵素を不活性化するために各チューブにFBSを含有するMSC培地を30mlを加えます。
- 大規模な未消化の残骸から単核細胞を分離するために、パルスは、50ミリリットルチューブを遠心。簡単に言えば、許可340 Xに到達するために遠心分離 gで5秒間、その後停止します。これは、液体懸濁液中の単核細胞を残しつつ、チューブの底にペレットに大きな破片を強制します。
注:チューブが短時間だけ(パルス)を遠心分離であれば単核細胞は、液相のままになります。遠心分離は、延長された場合、単核細胞は、望ましくない細胞の損失をもたらす、組織片を有するチューブの底にペレット化します。 - 単核細胞を含む、上清を収集し、ピペットで新しい50mlチューブにこれを転送します。
- 残りの胎盤組織の破片にメディアまたはHBSSの30ミリリットルを加え、激しく振ります。これは、懸濁液中に残りの一戸建て単核細胞を持参し、組織から推定されるMSCの第二の収穫を可能にします。
- パルス遠心管秒の時間を、再度新しい50ミリリットルチューブに上清を移します。このステップを収集効率を最大にするために三回繰り返し各組織源からの単核細胞の。
- (50ml×2回)チューブに個々の組織タイプの各々からの上清をプールします。これは、合計6チューブ(各D、CPおよびCVの2管)を得ます。遠心分離機340×gで5分間、各チューブ。このステップは、チューブの底に単核細胞をペレット化します。
- 廃棄物に上清を注意深くデカントまたはオフにピペット。上清の一滴を排除しようとする必要はありません。
注:細胞ペレットによる赤血球の数が多いために脆弱です。あなたは50ミリリットルチューブから直接デカントしている場合、誤ってペレットを廃棄しないように注意してください。 - 上清のほとんどを除去した後、穏やかに細胞ペレットを除去するために、指でチューブを数回フリック。各D、CPまたはCV組織のための単一のチューブが存在するように、ペレットを組み合わせて、MSCのメディアの35ミリリットルでそれぞれ再懸濁します。
- オプション:Uを設定し100μmのメッシュセルストレーナーを介して単核球画分をフィルター細胞塊または繊維材料を除去するために50mlのチューブ中のp。
注:フィルタは簡単に詰まらせるとオーバーフィルすることができますように注意が必要です。また、気泡が排水からフィルタを妨害することができます。この問題が発生した場合は、ゆっくりと細胞培養培地または新しいフィルターに交換がされたフィルターを洗浄し、空気がフィルターの下に流れるようにチューブからフィルターを持ち上げます。フィルタリングステップを除外すると、後続のMSC培養物の収量や品質を変更するためには表示されません。- 任意に、赤血球(RBC)溶解または密度勾配遠心分離は、この段階15で行うことができます。しかしながら、我々の経験では、RBCは、MSCの付着または増殖に干渉しないため、RBCの溶解を必要としないことです。 RBCの除去が15を行った場合、単核細胞は、この段階でカウントすることができます。なお、この段階での細胞の大部分はMSCであるが、胎児起源の栄養膜細胞、内皮細胞および造血細胞、ならびにミリアンペアではありませんternal起源造血細胞と脱落膜間質細胞。
- 37℃の加湿インキュベーター中、単一のT175フラスコや文化にそれぞれD、CPやCVの組織のための細胞懸濁液を移し、5%CO 2。
- ポストの単離細胞の拡張
- 最初の単離後48時間で、フラスコ(D、CPおよびCV)のそれぞれから培地を除去し、新鮮なMSCメディアの35ミリリットルと交換してください。推定上のMSCは組織培養フラスコ16に装着されると推定される使用済み培地と分離した細胞を、廃棄することができます。さらに24時間インキュベーターにフラスコを返します。
- 文化の追加の24時間後、破片や赤血球を除去するために、DPBS(25ミリリットル)で2回フラスコを洗います。赤血球を取り除くために、フラスコの底の周りに液体を旋回。液体や破片を除去するためにピペットを使用してください。フラスコにMSCのメディアの35ミリリットルを加え、インキュベーターにフラスコを返します。
- 週2回、及びメディアを交換してください細胞単層までcubate培養は、80〜90%コンフルエントです。この最初の拡張は、消化液と組織の質、出発物質の量と効率とのインキュベーション時間に依存して、4-14日かかります。
pMSCsの3サブカルチャー
- 培養物が80〜90%のコンフルエントである場合、20ミリリットル1×HBSSまたはDPBSで二回洗浄し、洗浄液を廃棄します。 ( すなわち T175フラスコのために5ミリリットルを使用)を各フラスコにトリプシンの代替を追加します。
- 組織培養表面からMSCを遊離させるために37℃で5分間フラスコをインキュベートします。着脱を容易にするために、フラスコの側面ごとに1〜2分をタップします。
- 細胞は、表面から、単一細胞懸濁液中に取り外されている場合、MSC培地でフラスコから細胞を洗浄し、チューブに細胞を回収。 MSCのメディアは、トリプシンの代替(T175フラスコあたりMSCメディアの〜15ミリリットル使用)を希釈し、無効になります。
- 50、各組織培養フラスコの内容物を移しますmlチューブ。
- 5分間、340×gで遠心分離管は、細胞をペレット化します。
- 上清を捨て、MSC培地の1ミリリットル中に細胞ペレットを再懸濁します。
- 10μlのトリパンブルーに10μlの細胞懸濁液を希釈します。血球計数器を用いて細胞を計数し、細胞15の合計数を計算します。
- 新鮮MSC培地中1,150細胞/ cm 2で新しいフラスコに細胞を移し、組織培養インキュベーター中でインキュベートします。この播種密度で、MSCのメディアの35ミリリットルの各新しいT175フラスコに20万MSCをシード。 80〜90%のコンフルエントになるまで週2回の細胞を養います。 1150細胞/ cm 2または各T175フラスコに20万MSCでその後の継代をシード。
- 継代1(P1)またはP2細胞がコンフルエントである場合には、将来の使用のための細胞の大部分を凍結保存し、さらに増殖および特徴付けのための唯一のT175フラスコを再シード。伝播細胞は、FLを介して中胚葉分化アッセイおよび細胞の特徴付けのためのP3又はP4に使用することができますOWサイトメトリー。
注:初期の継代では、そこに非常に少数のまばらに分離したコロニーであってもよいが、各コロニー内の局所細胞密度が非常に高くすることができます。細胞の局所密充填成長を遅らせ、培養性能を低下させる、接触阻害をもたらすであろう、これは、理想的ではありません。私たちは、密なコロニーが観察されたときに、細胞を回収し、新しいフラスコに再播種する必要がありますお勧めします。この再配分プロセスが増殖する余地を細胞に提供し、全体的な培養性能が向上します。 - MSCを凍結保存するために、90%のFCSおよび10%ジメチルスルホキシド(DMSO)1ml中に約1×10 6個の細胞を収集し、標準的なプロトコールを用いて凍結します。
注意:代表的な結果のセクションでは、三つの異なる(D、CPおよびCV)拡大した細胞集団の性別を決定するために、フローサイトメトリーを用いてMSCの特徴付け、中胚葉分化とXY FISH分析の記述があります。我々の研究では、胎盤は、男性の赤ちゃんからのものでした。このように、すべての男性(Y染色体)とすべての母体細胞が女性(だけX染色体)として区別することができたとして胎児細胞を識別することができました。
結果
胎盤MSCの単離手順は、MSCが単離された胎盤解剖学の3分野がこれらには、母体の脱落膜、ならびに絨毛膜板および絨毛膜絨毛の大部分は、胎児の組織である。図2で強調表示され、図1に要約されます。多くのテキストブック、記事やオンラインリソースの詳細開発及び各種の胎盤組織の機能的役割(参照8を参照してください)。
48時間分離し、組織破片を除去した後の培養液の形態。
赤血球および他のほとんどの細胞破片が付着していませんしながら、培養48時間後、MSCは、組織培養プラスチックに付着しています。この時点で、培地を新鮮な培地35 mlを交換しなければなりません。この培地交換の前に、原因の正確な観察を行うことが困難です視覚的評価を妨げますRBCの多数、。培養上清の出現は、胎盤ドナーの間で実質的に変化してもよいです。この変形例は、実施例1及び2( 図3A)に視覚的に見ることができます。非常に異なるように見えたこれらの二つのMSCの単離は、2つの異なる胎盤から同時に行きました。しかし、一回洗浄し、両方の培養物は、(洗浄例3、 図3Aを参照)類似しているように見えました。
顕微鏡下で、48時間のメディア交換後、数個の細胞のみをフラスコ( 図3B)に添付され、細胞がより広範囲に拡大したMSCは有意に異なる表示されます。いくつかの破片とRBCがフローティングまたは付属の塊のように見えるようになり、これらはMSCの成長を妨げることはありません。フラスコの底に付着したより長い線維芽細胞は、MSC、造血系を含む細胞の混合物である可能性があります栄養膜または内皮細胞。これらの細胞は、一般的にMSCの培養条件以上1-2の通路に耐えられないだろうとして再度、非MSC細胞は、MSC培養が損なわれることはありません。文化の初期の外観に多少の変動にもかかわらず、その後の展開結果は、一般的に一致しています。
時間をかけて、MSC培養物の形態。
非MSC細胞はまた、円形またはゆるく付着した細胞( 図4A)として見ることができるが、この代表的な例では単離後、7日、小線維芽細胞MSCコロニーは、目に見えた。付着した細胞は、もともと形成」コロニーユニットと命名したものです後で-fibroblast」(CFU-F)17とは、MSC 18と呼ばれます。サーティーン日は単離後、線維芽細胞MSCコロニーは大( 図4B)でした。一般的に、単分子層は、この時点で80〜90%のコンフルエントになり、細胞がPASSAでなければなりません GED。通路2以降からは、胎盤MSCの単層がコンフルエンス( 図4C)における特性渦巻き様の形態を開発します。細胞を低密度で継代している場合を除き、CFU-Fの形成はもはや観察されません。低密度では、胎盤由来のMSCは、成体骨髄由来MSC 1よりも小さく、正方形に近い外観を有します。胎盤由来のMSCと骨髄由来MSCは同様の増殖速度を示すが、胎盤由来細胞は、急速な老化5の可能性も低くなります。
in vitroでの胎盤MSCのキャラクタリゼーション。
各拡大細胞集団は、それが(1)プラスチック付着(2)間葉表面マーカーの存在および造血表面マーカーの欠如、および中胚葉を受ける(3)容量を含む標準的なMSCの基準16に適合することを確実にするために特徴付けられなければなりません分化。
図4に示すように、培養中のMSCは接着性プラスチックであり、線維芽細胞様の形態を有しています。これは、細胞がMSC 16を定義する最初の条件を満たしていることを検証します。
胎盤MSC表示間葉表面マーカー。
第定義MSC特性は間葉表面マーカーの存在および造血表面マーカー16が存在しないことです。決定的にMSCを識別することが可能な単一のマーカーが存在しないように、マーカーのパネルは、一般的ではないが、造血、間葉ある細胞を同定するためのフローサイトメトリー分析と併せて利用されます。ここで提供されている代表的なデータセットでは( 図5A)、我々は、間葉系マーカーCD73、CD105、CD90、CD146、およびCD44、造血マーカーCD45とCD34、およびHLA-DR、WELとしての細胞発現を評価しました内皮マーカーCD31としてリットル。この胎盤MSCの特徴付けプロセスに使用する抗体はすべて、 マテリアル/機器の表に記載されています。ここ19記載の分析方法を用いて、説明書を製造に従って染色を行いました。
5,20を期待どおりに細胞は、間葉系マーカーCD73、CD105、CD44、および細胞表面マーカーCD45、CD34、HLA-DRおよびCD31について陰性陽性でした。およそ、37%および当社の代表的なデータセット内の細胞の57%が、それぞれ、CD90およびCD146 21陽性でした。 CD90とCD146の両方は、一般的にMSC 21マーカーに利用されます。 MSC細胞表面マーカープロファイルは、MSCの組織源、培地組成、または継代数22に応じて異なっていてもよいです。経験の私達の多くの年で、我々は1-2 pは、以下の非間葉系細胞と胎盤由来MSCの長期的な汚染を確認されていませんassages 5,11。
胎盤MSC表示間葉分化能
定義では、MSCは、in vitroで中胚葉分化能5,13を有していなければなりません。中胚葉分化能は、一般的に三または二系統分化アッセイのいずれかによって評価されます。三系列のアッセイは、さらに、軟骨形成分化能を評価しながら、バイ系統のアッセイは、一般的に、骨形成および脂肪生成分化能を評価します。ここで紹介する代表的な結果では、我々は、拡張MSC集団は、両方の骨形成分化を示すカルシウム沈着、および脂質空胞、脂肪生成を示す( 図5B)を形成することを示しています。
ここで報告されたMSCの集団を特徴づけるために、我々は、誘導培地1mlに6×10 4細胞で24ウェル培養に細胞を播種しました。メディアコンポネントは、マテリアル/機器の表に記載されています。誘導培地処方物は文献でよく知られているが、公開された製剤にはかなりのばらつきがあります。このような理由から、私たちはここで簡単に私たちの誘導培地製剤および染色アプローチを一覧表示します。骨形成誘導培地は、DMEM-HG、10%FBS、1×抗生物質抗真菌溶液、10mMのβ-グリセロールphophate、100nMのデキサメタゾン、および50μMのL-アスコルビン酸-2-リン酸を含有しました。脂肪生成誘導培地は、DMEM-HG、10%FBS、1×抗生物質抗真菌溶液、10 / mlのインスリン、100nMのデキサメタゾン、200μMのインドメタシン、および500μMの3-イソブチル-1-メチルキサンチンを含有していました。ここで、培養物を37℃、5%CO 2インキュベーター中で維持し、14日間培養しました。誘導培地は、培養期間にわたって1週間に2回交換しました。誘導の14日後、培養物は、私たちの前あたりのような骨様マトリックス(骨形成)または脂質空胞(脂質生成)のいずれかについて特徴付けましたIOUの出版物5。骨形成カルシウムマトリックス沈着分析はまず、培地を吸引除去20分間、4%パラホルムアルデヒドで培養物を固定し、DPBSで単層を洗浄し、次に指示を製造に従ってアリザリンレッドSで染色することにより達成されました。脂肪生成誘導指示を製造に従ってオイルレッドO溶液で、培地を吸引除去20分間、4%パラホルムアルデヒドで培養物を固定し、単層を洗浄し、染色することによって評価しました。染色されたカルシウム沈着と油液胞は、その後、光学顕微鏡で可視化し、画像は、今後の参考のために保存されました。
以前の出版物では、我々はより広範囲に4,5-胎盤由来MSCの分化能を特徴としています。脂肪生成は、<胎盤由来MSC 5に一般的にはあまり効率的である一方で、胎盤由来MSCの骨形成は、骨髄由来MSCと類似しています/ SUP>。これは以前に胎盤-MSC 5のための私達によって報告されているが、我々は日常的に、いくつかの理由から軟骨細胞分化を行っていません。中胚葉分化能は、MSCの決定的な特徴であるが、まず、それは治療上の利益は、MSCパラクリン分泌物26から誘導される可能性があり、特にここで、二次的な重要性23-25 の可能性があります。ドミニシらは、ヒト成人骨髄由来MSC 16の臨床的生産のための最小限の基準を提案したが、第二に、より多くの最近の研究では、異なる固有の特性および分化能力5,13,27-32を持っている別のニッチからMSCを示しています。実際には、パロリーニらは、胎盤由来MSCは、「一つ以上の中胚葉」の系統ではなく、すべての3系統10に分化するべきであると提案しました。それは同様のを介して行われますように最後に、多くのMSCの研究では、軟骨形成分化を除外する骨形成などの細胞内シグナル伝達経路(TGFβファミリー経路)33-35。
胎盤MSCは、出発物質の解剖学的位置にもかかわらず、文化のこの方法を使用して、原点に母性あります。
多くの出版物は、細胞が培養14時に胎児の絨毛膜収率胎児MSCから単離されていることを前提としています。直感的に母体の脱落膜MSC培養のために予想されるようにしかし、我々は以前に5を報告しているように、すべての文化は、このプロトコルを使用して、胎児の絨毛膜由来、急速に母性MSCのために濃縮されたとなります。簡単に拡張細胞集団中の胎児と母体細胞の寄与を描写することが可能であったように、これらの代表的な結果では、雄の赤ちゃんの胎盤組織を使用しました。これらの研究のために我々は材料/機器の表に記載されているのXY FISHキットを使用し、製造者の指示に従いました。
ここに提供されている代表的なデータでは、文化が母体の脱落膜由来した〜90%母体細胞(XX)と〜継代0で10%胎児細胞(XY)( 図6) 。通路2によって、母体組織由来の細胞集団は、(XX)〜100%母体細胞であった、と胎児細胞(XY)が検出されませんでした。これは、母体組織の物理的解剖は、その後の培養中の母体細胞の濃縮につながったことを示唆しています。しかし、胎児の絨毛と絨毛膜板由来の培養物からの培養の結果を考慮することが重要です。継代0では、胎児の絨毛と絨毛膜の両方のプレートに由来する培養物は、ターゲットを絞った解剖は、胎児細胞( 図6)について濃縮されたことを示す、〜85%XY、または胎児起源のものでした。継代0では、両方の培養物は〜15%母親細胞(XX)の汚染を含んでいました。驚くべきことに、胎児の両方、継代2で培養物を〜100%母体細胞(XX)が移入し、胎児細胞(XY)もはや検出されませんでした。 XY FISH分析は、母体細胞(XX染色体)が迅速かつ一貫して買収の文化胎児の絨毛組織に由来することが明らかになりました。これは、多くの場合、5見過ごされている重要な文化の観察です。それはDMEMは胎児由来の集団をサポートするように設計された追加の要因なしで使用される10%FBSを補充したときに母体細胞が急速にすべての文化を移入非常に重要な観察を実証するため、この分析の詳細は、このプロトコルに含まれています。
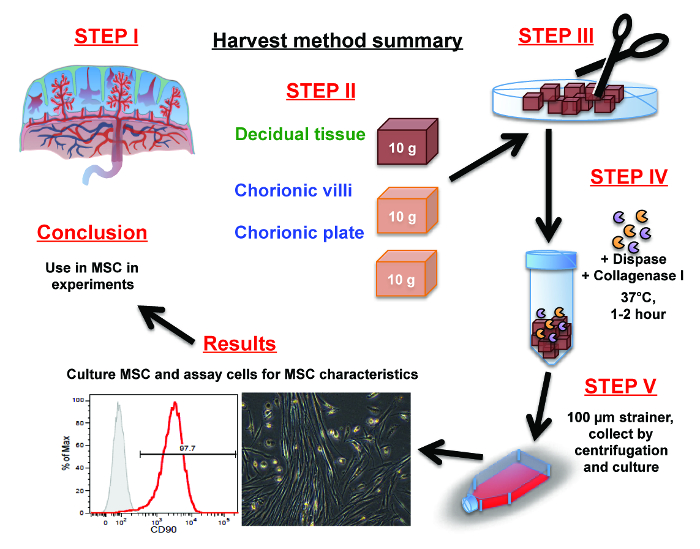
図1:胎盤MSCの単離手順の概要 ( ステップ1)は、胎盤の解剖学を自分で向きで取り付け。 ( ステップ2)は手動で脱落膜、絨毛やハサミを使用して絨毛膜板のいずれかから組織の10グラムを分析します。 ( ステップ3)ミンチトン彼はハサミやメスで細かい破片に脱落膜、絨毛膜絨毛または絨毛膜板組織の部分を解剖しました。
( ステップ4)ディスパーゼおよびコラゲナーゼIの1〜2時間消化を介して細かくから細胞を解放します
( ステップ5)、パルス遠心分離により線維組織から細胞を分離および/ または細胞ストレーナーを介してそれらを洗浄します。収集し、培養液中の細胞を再懸濁し、培養フラスコに入れた。 この図の拡大版をご覧になるにはこちらをクリックしてください。
間葉系間質細胞(MSC)は、プラスチック接着し、生き残るためには、培養培地中で増殖する能力のためにそれらの傾向に基づいて選択されます。最後に、結果のセクションでは、拡張MSCを特徴づけすることができ、将来の実験で使用するために保存しました。
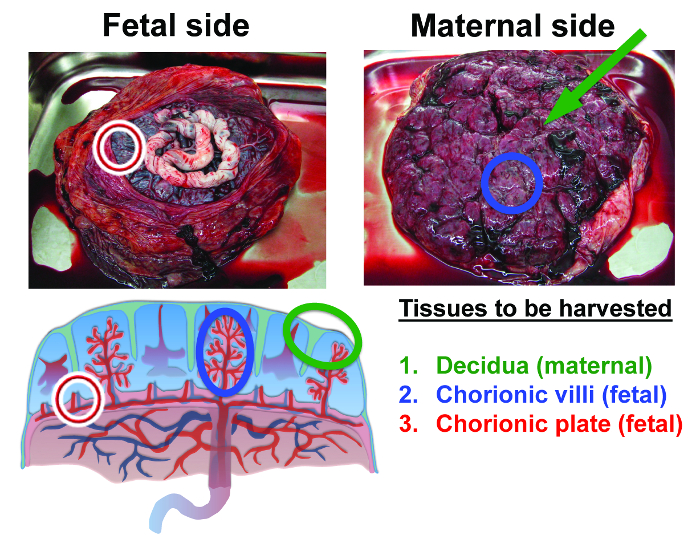
図2:この手順で単離したヒト満期胎盤および組織の解剖学に収穫された最初の組織が 母体の脱落膜です。脱落膜は、それが子宮壁(脱落膜は緑のマーカーによって識別される)から放出された後、胎盤の表面に薄い層として残る組織です。胎盤の内部から収穫される第二の組織は、胎児絨毛(青マーカー)です。収穫するための第三の組織は、胎児絨毛膜板(参照36から適応)(赤マーカー)である。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:48時間分離と再後の文化の形態組織破片を移動する。(A)培養上清の外観は破片を洗浄する前に、胎盤ドナーの間で実質的に変化させることができます。例えば培養物1及び2は、本変形例を示します。これら二つの単離を同時に行う、2つの異なる胎盤から得ました。後続の膨張の結果は、一般的に一致している実施例3のように一回洗浄した培養物は、赤血球および組織破片のは明らかであろう。 (B)48時間のメディア交換後、数個の細胞のみをフラスコに添付されます。スケールバー=200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:時間をかけて、MSC培養物の形態 (A)単離後の7日、小さなF非MSC細胞はまた、円形またはゆるく付着した細胞として存在するが、ibroblastic MSCのコロニーが表示されます。 (B)13日単離後、線維芽細胞MSCコロニーは大きく、多くの場合、MSCの単層がコンフルエントと通過する準備ができています。通路2以降から、(C)は 、MSCの単層がコンフルエンスに特徴的な渦巻き状の形態を開発します。スケールバー=200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
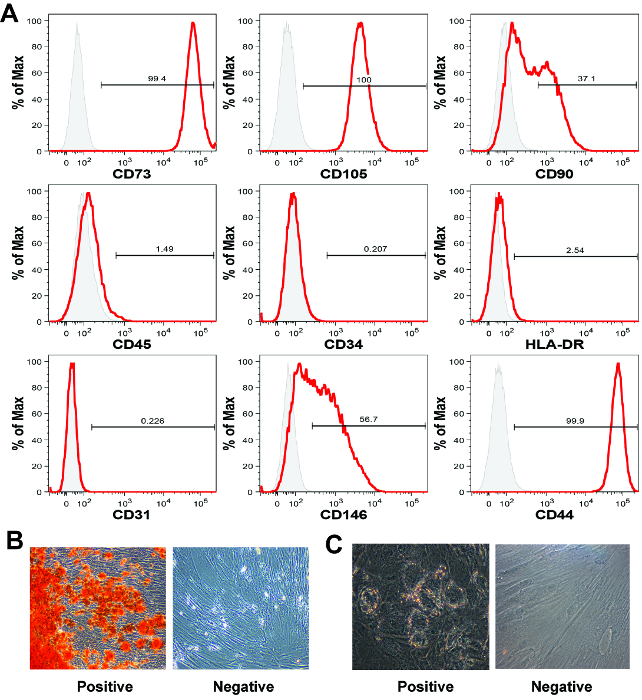
図5:フローサイトメトリーおよび中胚葉分化によってMSCの特性評価 (A)胎盤絨毛由来のMSCは、これらの細胞表面マーカーのためにも、フローサイトメトリー分析によって、古典的MSCマーカープロフィールを表示、EXPRES。シオンは、人間のMSCのすべてのタイプの似ています。各ヒストグラムは、y軸(最大の%)に正規化された細胞数に対する信号強度(x軸)を示します。設定されたこの代表的なデータでは、細胞は、造血マーカーCD45およびCD34およびHLA-DRのためのCD73、CD105及びCD44に対する陽性、および陰性でした。 (B)胎盤MSCは、一般的に強固な骨形成分化を受ける、しかし(C)脂肪生成分化は、骨髄由来MSCと比べて効率が低いことができます。キャプションのBとCの画像は40倍の倍率で撮影された。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6:胎盤MSCは、出発物質の解剖学的位置にもかかわらず、文化のこの方法を使用して、原点に母性あります。プロットは、胎児(雄、XY)と母親ごとに第2の通路で脱落膜、絨毛と絨毛膜板組織から単離された胎盤MSC培養の(メス、XX)細胞組成物の定量化を示します。母体細胞(XX)は、迅速かつ再現性胎児の絨毛組織由来の培養物を引き継ぎます。個々の細胞で検出された胎児=男性= XY染色体、個々の細胞で検出された母性=女性= XX染色体。ここに示されたデータは、100個の細胞XY FISHのために染色し、各データ点についてカウントを最小限に抑えて、オスの赤ちゃんからN = 3の独立したドナーの胎盤からのものでした。バーは平均値を表し、エラーバーは1標準偏差を反映している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
胎盤は、胎児または母体MSC 22を単離することができる物理的に大きく胎児母体器官です。ここで、我々は、胎盤の解剖学と命令具体的に脱落膜(母性)を解剖する方法については、絨毛膜絨毛(胎児)、および絨毛膜板(胎児)組織(ステップ2.2から2.4)の詳細な概要を提供します。その後、我々は、これら3つの組織(ステップ2.5から2.6)のそれぞれからMSCの分離を可能にする堅牢なプロトコルを概説しました。胎盤MSCの拡大は、効率的で、培養物は、骨髄由来MSCの培養( 図3と図 4)と同様に表示されます。脂肪細胞への分化が( 図5C)5一般的にはあまり効率的である一方で骨形成分化は、( 図5B)信頼性があります。
フィールドに多くの新規参入者は、胎児の絨毛膜絨毛または絨毛膜板組織由来の培養物は、胎児のMSCについて濃縮されるであろうと推定されます。しかし、我々の手中のFeタル細胞濃縮は、DMEM-LG + FBSを5利用されている10%のみと過渡時の標準的なMSC増殖培地です。ここでは、オスの赤ちゃん由来胎盤組織を使用して代表的な結果を提供します。母体細胞はXX染色体を有するものとして識別可能であるが、男性の赤ちゃんから胎盤組織を使用することにより、胎児細胞は、容易に識別可能XY染色体を持つようです。6は、代表的な文化のためのXY FISH結果を示しています。胎児のMSC(XY)は、胎児の絨毛膜絨毛または絨毛膜板組織由来の初期培養物で(80%まで)濃縮されているが、これらの同じ培養物を急速に最初の2つの通路の上に母性(XX)MSCによって(〜100%)に抜かれています。標準培地では、DMEM-LG + 10%FBS、胎児組織は、培養中の胎児由来の細胞を負かす汚染少数の母性由来MSCから構成される。
このプロトコルで概説重要なステップは、胎盤の解剖学的構造のどこ胎児から感謝ですそして、母体組織は、最も効果的に収穫することができます。代表的な結果のセクションで概説したように、胎児組織の切開は、胎児由来のMSCのための過渡的な濃縮を可能にします。拡大培地製剤の改善は、特定の外因性の成長因子培地の補充を介して胎児由来MSC集団の選択的拡大を可能にし、(私たちのグループは現在、このような培地製剤を開発している)胎児ではなく、母体細胞について濃縮された細胞生成物を製造する必要があります。胎児のMSCが等価母体MSC集団37より大きい血管形成および免疫抑制特性を有すると主張されているように、胎児のMSC集団の製造は、多くの利点を有することができます。
記載の分離プロトコルの各々において、我々は、組織の約10gを使用しました。全体の胎盤は、一般的に500〜750グラムで、前作で我々は、自動化された組織ダイジェストと細胞増殖バイオリアクターのprocを介してそれを実証しました単一の胎盤4から7,000以上の臨床細胞用量を製造することが可能でなければならないことesses。これらの数字は、同種異系MSC治療における胎盤由来MSCの潜在的な適合性、およびかかわらず(胎児や母体の)MSC由来のこの方法の重要性を強調表示します。治療の観点から、ユーザーが細胞産物と確実にこの細胞製品を製造する能力を完全に理解していることが最も重要です。私たちは、ビデオは、胎盤解剖学を理解胎盤からMSCを分離し、その文化の可能性が高い胎児や母体の細胞組成物を予測する研究者を支援することを願っています。
開示事項
The authors have nothing to disclose.
謝辞
RPは、国立保健医療研究評議会(NHMRC)ポストドクトラル研修フェローシップによってサポートされていました。 VSは、クイーンズランド大学国際大学院の学生の奨学金によってサポートされていました。 MRDはNHMRCとインナー・ホイールオーストラリアによってサポートされていました。
私たちは、患者の同意およびサンプル収集を支援するための臨床および看護スタッフに感謝します。私たちは産科、胎児胎盤の開発と胎盤の解剖学で洞察に満ちた議論のための教授ニコラス・フィスク、教授ケリー・アトキンソン博士ローハンラウリーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| HBSS | Gibco/Invitrogen | 14185-052 | Long name: Hanks Balanced Salt Solution |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| trypsin-substitute | Gibco/Invitrogen | 12563-029 | Long name: TrypLE Select |
| DMEM-LG | Gibco/Invitrogen | 11885-092 | Long name: Dulbecco’s Modified Eagles Medium-Low Glucose |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| PBS (Mg+Ca+ free) | Gibco/Invitrogen | 14190-250 | Long name: Dulbecco's Phosphate buffered saline, magnesium and calcium free |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| paraformaldehyde powder or 4% solution | any | ||
| Collagenase I | Invitrogen | 17100-017 | 2,500 U/ml |
| Dnase I | Sigma | D5025 | 10 mg/ml in 0.15 M NaCl |
| Dispase | Invitrogen | 17105-041 | 10 mg/ml in water (20,000 U/ml). |
| Material | Company | Catalog Number | Comments |
| Disposables: | |||
| 50 ml centrifuge tubes | Falcon or any brand | ||
| petri dishes, sterile plactic (25 cm and 10 cm diameter) | Nunc | ||
| Cell strainers (100 μm) | Becton Dickinson | 352340 | |
| 175 and 75 cm2 (T175 and T75) tissue culture flasks | Nunc | ||
| 5 ml, 10 ml, 25 ml sterile serolgical pipettes | any brand | ||
| Material | Company | Catalog Number | Comments |
| Equipment: | |||
| Centrifuge | |||
| tissue culture incubator 37 °C, 5% CO2 | |||
| Biological safety cabinet | |||
| Sterile scissors and tweezers | |||
| Tube racks | |||
| Pipette-boy or equivalent | |||
| Gilson type pipetters and sterile tips 1,000 µl, 200 µl, 20 µl. | |||
| rocking or shaking incubator (37 °C) | |||
| personal protective equipment | |||
| cleaning solutions (suitable for blood) | |||
| waste containers, correct disposal bins for tissue/blood | |||
| Reagents for MSC characterization | |||
| Antibody (Clone ID) | Manufacturer | Catalogue No. | Isotype |
| CD73 (AD2) | Miltenyi Biotec | 130-095-183 | Mouse IgG1 |
| CD105 (43A4E1) | Miltenyi Biotec | 130-094-941 | Mouse IgG1 |
| CD90/Thy-1 (AC122) | Miltenyi Biotec | 130-095-403 | Mouse IgG1 |
| CD45 (5B1) | Miltenyi Biotec | 130-080-202 | Mouse IgG2a |
| CD34 (AC136) | Miltenyi Biotec | 130-090-954 | Mouse IgG2a |
| HLA-DR (AC122) | Miltenyi Biotec | 130-095-298 | Mouse IgG2a |
| CD31 (PECAM-1) | BD Pharmingen | 555446 | Mouse IgG1 |
| CD146 (541-10B2) | Miltenyi Biotec | 130-092-849 | Mouse IgG1 |
| CD44 (DB105) | Miltenyi Biotec | 130-095-180 | Mouse IgG1 |
| Isotype Controls (Clone ID) | Manufacturer | Catalogue No. | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-214 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-212 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-213 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-091-837 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-098-849 | |
| MACS Buffer | Miltenyi Biotec | 130-091-221 | |
| Osteogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| Dexamethasone | Sigma | D4902 | |
| β-Glycerol Phophate | Sigma | 50020 | |
| L-ascorbic acid 2-phosphate | Sigma | A8960-5G | |
| Alizarin Red S | Sigma | A5533-25G | For calcium matrix staining |
| Adipogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| insulin | Sigma | I2643 | |
| Dexamethasone | Sigma | D4902 | |
| Indomethacin | Sigma | I7378 | |
| 3-isobutyl-1-methyl xanthine | Sigma | I5879 | |
| Oil Red O solution | Sigma | O1391-250ML | For lipid vacuole staining |
| XY FISH kit to determine fetal or maternal origin of cells | |||
| XY chomosome FISH kit | Vysis (Abbott Molecular) | 07J20-050 | Long name: CEP X SpectrumOrange/Y SpectrumGreen Direct Labeled Fluorescent DNA Probe Kit |
参考文献
- Brooke, G., et al. Therapeutic applications of mesenchymal stromal cells. Semin Cell dev Biol. 18, 846-858 (2007).
- Wei, X., et al. Mesenchymal stem cells: a new trend for cell therapy. Acta Phamacol Sin. 34, 747-754 (2013).
- Ma, S., et al. Immunobiology of mesenchymal stem cells. Cell Death Differ. 21, 216-225 (2014).
- Timmins, N. E., et al. Closed system isolation and scalable expansion of human placental mesenchymal stem cells. Biotechnol Bioeng. 109, 1817-1826 (2012).
- Barlow, S., et al. Comparison of human placenta- and bone marrow-derived multipotent mesenchymal stem cells. Stem Cell Dev. 17, 1095-1107 (2008).
- Jones, B. J., Brooke, G., Atkinson, K., McTaggart, S. J. Immunosuppression by placental indoleamine 2,3-dioxygenase: a role for mesenchymal stem cells. Placenta. 28, 1174-1181 (2007).
- Parolini, O., et al. Toward cell therapy using placenta-derived cells: disease mechanisms, cell biology, preclinical studies, and regulatory aspects at the round table. Stem Cell Dev. 19, 143-154 (2010).
- Benirschke, K., Burton, G. J., Baergen, R. N. Pathology of the Human Placenta. , 6 edn (2012).
- Moore, K., Persaud, T., Torchia, M. The developing human: clinically oriented embryology. , Elsevier/ Saunders. (2013).
- Parolini, O., et al. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem cells. 26, 300-311 (2008).
- Brooke, G., et al. Manufacturing of human placenta-derived mesenchymal stem cells for clinical trials. Brit J Haematol. 144, 571-579 (2009).
- Pelekanos, R. A., et al. Intracellular trafficking and endocytosis of CXCR4 in fetal mesenchymal stem/stromal cells. BMC cell biology. 15, 15(2014).
- Chen, Y. S., et al. Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells. Stem Cells Transl Med. 1, 83-95 (2012).
- Heazlewood, C. F., et al. High incidence of contaminating maternal cell overgrowth in human placental mesenchymal stem/stromal cell cultures: a systematic review. Stem Cells Transl Med. 3, 1305-1311 (2014).
- Horn, P., Bork, S., Wagner, W. Standardized isolation of human mesenchymal stromal cells with red blood cell lysis. Methods Mol Biol. 698, 23-35 (2011).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Friedenstein, A. J., et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol. 2, 83-92 (1974).
- Caplan, A. I. Mesenchymal stem cells. J Orthop Res. 9, 641-650 (1991).
- Futrega, K., et al. The microwell-mesh: A novel device and protocol for the high throughput manufacturing of cartilage microtissues. Biomaterials. 62, 1-12 (2015).
- Liu, Y., Goldberg, A. J., Dennis, J. E., Gronowicz, G. A., Kuhn, L. T. One-step derivation of mesenchymal stem cell (MSC)-like cells from human pluripotent stem cells on a fibrillar collagen coating. PloS one. 7, 33225(2012).
- Maleki, M., Ghanbarvand, F., Reza Behvarz, M., Ejtemaei, M., Ghadirkhomi, E. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int J Stem Cell. 7, 118-126 (2014).
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Commun Signal. 9, 12(2011).
- Bianco, P., Robey, P. G., Simmons, P. J. Mesenchymal stem cells: revisiting history, concepts, and assays. Cell stem cell. 2, 313-319 (2008).
- Bianco, P., et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nature med. 19, 35-42 (2013).
- Da Silva Meirelles, L., Caplan, A. I., Nardi, N. B. In search of the in vivo identity of mesenchymal stem cells. Stem cells. 26, 2287-2299 (2008).
- Caplan, A. I., Correa, D. The MSC: an injury drugstore. Cell Stem Cell. 9, 11-15 (2011).
- Wegmeyer, H., et al. Mesenchymal Stromal Cell Characteristics Vary Depending on Their Origin. Stem Cell Dev. , (2013).
- Guillot, P. V., Gotherstrom, C., Chan, J., Kurata, H., Fisk, N. M. Human first-trimester fetal MSC express pluripotency markers and grow faster and have longer telomeres than adult MSC. Stem cells. 25, 646-654 (2007).
- Covas, D. T., et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Exp Hemol. 36, 642-654 (2008).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell stem cell. 3, 301-313 (2008).
- Pelekanos, R. A., et al. Comprehensive transcriptome and immunophenotype analysis of renal and cardiac MSC-like populations supports strong congruence with bone marrow MSC despite maintenance of distinct identities. Stem cell res. 8, 58-73 (2012).
- da Silva Meirelles, L., Chagastelles, P. C., Nardi, N. B. Mesenchymal stem cells reside in virtually all post-natal organs and tissues. J Cell Sci. 119, 2204-2213 (2006).
- James, A. W. Review of Signaling Pathways Governing MSC Osteogenic and Adipogenic Differentiation. Scientifica (Cairo). 2013, 684736(2013).
- Xu, C., et al. Cross-Talking between PPAR and WNT Signaling and Its Regulation in Mesenchymal Stem Cell Differentiation. Curr Stem Cell Res Ther. , (2015).
- Zhuang, H., et al. Molecular Mechanisms of PPAR-gamma Governing MSC Osteogenic and Adipogenic Differentiation. Curr Stem Cell Res Ther. , (2015).
- Moore, K., Persaud, T., Torchia, M. Before We Are Born: Essentials of Embryology and Birth Defects. , Elsevier Health Sciences. 8 edn (2011).
- Zhu, Y., et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther. 5, 48(2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved