Method Article
Preparação Facile da Internamente auto-montados Lipid partículas estabilizada por nanotubos de carbono
Neste Artigo
Resumo
We report on a smart application of carbon nanotubes for kinetic stabilization of lipid particles that contain self-assembled nanostructures in their cores. The preparation of lipid particles requires rather low concentrations of carbon nanotubes permitting their use in biomedical applications such as drug delivery.
Resumo
Nós apresentamos um método fácil de preparar partículas lipídicas nanoestruturados estabilizados por meio de nanotubos de carbono (CNT). De parede única (primitivo) e com paredes múltiplas (funcionalizados) nanotubos de carbono são usados como estabilizadores para produzir emulsões de tipo óleo Pickering-em-água (O / W). Os lípidos ou seja, Dimodan L e Phytantriol são utilizados como emulsionantes, que em excesso de água auto-montar em fase cúbica bi continua Pn3m. Esta fase altamente viscoso é fragmentada em partículas menores, utilizando uma sonda ultrasonicator na presença de estabilizadores surfactantes convencionais ou nanotubos de carbono como feito aqui. Inicialmente, os nanotubos de carbono (pó) são dispersos em água seguido de mais ultra-sons, com o lípido fundido para formar a emulsão final. Durante este processo, os nanotubos de carbono se revestido com moléculas de lípidos, as quais, por sua vez, se suponha que rodeiam as gotículas de gordura para formar uma emulsão de partículas que é estável durante meses. O tamanho médio das partículas lipídicas nanoestruturados CNT-estabilizado é no submicrónica range, o que compara bem com as partículas estabilizadas utilizando surfactantes convencionais. Dados de Raios X de ângulo pequeno espalhamento confirma a retenção da fase cúbica inicial Pn3m nas dispersões de lípidos CNT-estabilizados em relação à fase lipídica pura (estado a granel). deslocamento para o azul e abaixamento das intensidades de bandas característico e L de nanotubos de carbono observados em espectroscopia Raman G 'caracterizar a interacção entre moléculas de superfície e de lípidos CNT. Estes resultados sugerem que as interacções entre os nanotubos de carbono e lípidos são responsáveis pela sua estabilização mútua em soluções aquosas. À medida que as concentrações de nanotubos de carbono empregues para a estabilização são muito baixos e as moléculas de lípidos são capazes de funcionalizar os nanotubos de carbono, é esperado que a toxicidade de nanotubos de carbono a ser insignificante, enquanto a sua biocompatibilidade é grandemente aumentada. Por conseguinte, a presente abordagem encontra um grande potencial em várias aplicações biomédicas, por exemplo, para o desenvolvimento de sistemas de nanocarrier híbridos para a entrega de multiple moléculas funcionais como em terapia de combinação ou politerapia.
Introdução
Ao longo das últimas décadas, a nanotecnologia emergiu como uma ferramenta poderosa especialmente na área de desenvolvimento pré-clínico de medicamentos para combater doenças tais como cancro notórios 1. Neste contexto, as estruturas em nano-escala com um tamanho <1000 nm são amplamente explorados como veículo de entrega de várias biomoléculas activas tais como drogas, proteínas, ácidos nucleicos, genes e agentes de diagnóstico por imagem 1-4. Estas biomoléculas ou são encapsulados dentro das nanopartículas ou conjugado sobre a superfície das nanopartículas e são libertados no sítio da acção por disparadores tais como pH 5,6 ou temperatura. Embora extremamente pequeno em tamanho, a grande área de superfície destas nanopartículas prova ser muito vantajosa para a entrega direccionada de biomoléculas activas. O controlo sobre o tamanho de partícula e biocompatibilidade é de extrema importância, a fim de optimizar a eficácia terapêutica e, por conseguinte, a aplicabilidade de nanopartículas 7,8.Lipídios 9-13, polímeros, metais 14,15 16,17 e nanotubos de carbono 18,19 têm sido comumente empregada como nanocarriers para várias aplicações biomédicas e farmacêuticas.
Além disso, as aplicações nanocarrier baseados em nanoestruturas auto-organizadas de lipídios têm uma grande importância em muitas outras disciplinas, incluindo alimentos e indústrias de cosméticos 20,21. Por exemplo, eles são utilizados na cristalização de proteínas 22, 23 de separação de biomoléculas, como por exemplo estabilizadores alimentares, em sobremesas 24, e na entrega de moléculas activas, tais como nutrientes, aromatizantes e perfumes 25-31. Nanoestruturas de lípidos auto-montadas não só têm a capacidade de libertar moléculas bioactivas, de forma controlada e direccionada 32-38, mas que também são capazes de proteger as moléculas funcionais de degradação química e enzimática 39,40. Embora bicamada fluido planar é a mais Commna nanoestrutura formada por moléculas de lípidos anfifílicos em presença de água, outras estruturas tais como a hexagonal e cúbica são também frequentemente observadas 20,41,42. O tipo de nanoestrutura formado dependerá estrutura forma molecular dos lípidos, a composição lipídica em água, bem como sobre as condições físico-químicas empregues, tais como a temperatura e pressão 43. A aplicabilidade de nanoestruturas de lípidos não planares que especialmente de fases cúbicas, é restrito devido à sua elevada viscosidade e consistência domínio não-homogênea. Estes problemas são ultrapassados por dispersão dos nanoestruturas lipídicas em grande quantidade de água para formar emulsões que contêm micron ou submicron partículas lipídicas dimensionada de óleo-em-água (O / W). Desta maneira, um produto adequado de baixa viscosidade podem ser preparados mantendo a estrutura auto-montada lipídica original para dentro das partículas dispersas. A formação destas partículas auto-montadas internamente (abreviado como 44 ISAsomes Por exemplo, cubosomes de fases cúbicas e hexagonais hexosomes de fases) normalmente requer uma combinação de um passo de entrada de alta energia e a adição de estabilizadores, tais como agentes tensioactivos ou polímeros. Uma pesquisa recente neste sentido demonstra a aplicação de várias partículas sólidas 45, incluindo nanopartículas de sílica 46, argila 47-49 e nanotubos de carbono 50 para a estabilização de emulsões acima mencionados, adequadamente denominado como Pickering 51 ou emulsões Ramsden-Pickering 52.
Nos últimos anos, o carbono nanoestruturas como nanotubos de parede única de carbono (SWCNTs) com base, os nanotubos de carbono de paredes múltiplas (MWCNTs) e fulerenos ter recebido uma grande atenção como novos biomateriais 53,54. As principais preocupações são a sua toxicidade 55-58, insolubilidade em água 59 e, portanto, sua biocompatibilidade 56. Uma maneira eficiente de resolver estas questões é a função de superfíciezação por meio de moléculas não-tóxicos e biocompatíveis tais como lípidos. Na presença de água, os lípidos interagir com os nanotubos de carbono de forma que a superfície hidrofóbica dos nanotubos de carbono é protegido a partir de meio aquoso polar enquanto que os grupos de cabeça hidrófilos de lípidos auxiliar a sua solubilidade em água ou dispersão 60,61. Os lípidos são componentes integrais de organelos celulares, bem como alguns materiais alimentares, por conseguinte, a sua decoração devem, idealmente, diminuir a toxicidade in vivo de nanotubos de carbono. Aplicações biomédicas com base independentemente em nanotubos de carbono 18,19 e nanoestruturas lipídicas 9-13 estão em desenvolvimento extenso, mas as aplicações que combinam as propriedades dos dois ainda não são bem-explorado.
Neste trabalho, empregamos dois tipos diferentes de lipídios e três tipos de nanotubos de carbono dos quais SWCNTs estão na forma pura enquanto MWCNTs são funcionalizado com hidroxilo e grupos carboxílicos. Usámos concentrações muito baixas de nanotubos de carbono para preparar as dispersões cujosestabilidade depende de vários factores, por exemplo, o tipo de lípido, tipo de CNT, razão de lípido para CNT utilizado, bem como sobre os parâmetros de sonicação empregues, tais como o poder e a duração. Este protocolo de vídeo fornece detalhes técnicos de um método de cineticamente estabilização nanopartículas lipídicas utilizando várias CNT-estabilizadores.
Protocolo
Cuidado: os nanotubos de carbono usados neste trabalho estão na forma de nanopartículas, que podem ter riscos adicionais em comparação com as suas contrapartes granel. A inalação de grafite, tanto naturais como sintéticas, podem causar pneumoconiose 62 semelhante a pneumoconiose dos mineiros de carvão. Além disso, tem havido preocupações relativamente à toxicidade de nanoestruturas à base de carbono e alguns dos estudos anteriores sugerem que a toxicidade aguda e crónica associada com a inalação de nanotubos de carbono 63-68. Assim, evitar a inalação do pó CNT multa e segurá-lo com muito cuidado. Se inalado, mover-se para o ar fresco. Se a respiração é difícil, usar oxigênio puro em vez disso e procurar consulta médica. formulações de solução / dispersão de nanotubos de carbono são bastante seguro de manusear.
Cuidado: Os lipídios e surfactantes usados neste estudo são materiais de qualidade alimentar e, portanto, não perigosos em geral, mas eles são irritantes para os olhos e pele, e também altamente inflamável. Por isso, utilize todas as práticas de segurança adequadas, tais como o uso de encontroles engenha- (exaustor) e equipamentos de proteção individual (óculos de segurança, luvas, jaleco, calça de corpo inteiro, sapatos fechados) amostras de nanopartículas durante o manuseamento ou a preparar. Em caso de contacto com a pele ou olhos, imediatamente lave a pele ou os olhos com água em abundância por pelo menos 15 min. Consultar um médico, se necessário.
1. Preparação de lípidos massa Fases / Água
Cuidado: Armazenar os lipídios na geladeira a 4 ° C. lípidos puro grau deve ser armazenado no congelador (-20 ° C). Alíquota-os em pequenos frascos de vidro para evitar a contaminação de todo o caldo e comodidade de manuseamento. Outros produtos químicos, incluindo os nanotubos de carbono e surfactantes pode ser armazenado à temperatura ambiente, mas mantê-los longe da luz solar direta.
- Manter lípidos, isto é, Dimodan L (DU) e Phytantriol (PT) a TA durante 15-20 min antes de abrir o / tampa de frasco de garrafa, a fim de evitar a condensação de humidade.
(Nota: DU é um glicérido destilada que compreende 96% de monoglicéridos e aresto são diglicéridos e ácidos graxos livres. Dois componentes principais monoglicérido DU são linoleato (62%) e oleato (25%). Por conseguinte, a parte hidrofóbica do DU contém principalmente cadeias C18 (91%), a composição exacta dos quais é como se segue; C18: 2 (61,9%), C18: 1 (24,9%), e C18: 0 (4.2%), indica onde a C18 de cadeia 18C e depois o número de cólon indica o número de ligações C = C. A PT é uma mistura de isómeros ópticos 3,7,11,15-tetrametil-1,2,3-hexadecanetriol. Ele não contém um grupo funcional éster mas consiste em cauda phytanyl altamente ramificada com uma headgroup tri-hidroxi. Ambos DU e PT formar fases cúbicas em presença de excesso de água, que também é o caso para os núcleos de partículas lipídicas estabilizadas 13, 45). - Derreter os lípidos, colocando os frascos num banho de água quente ou de um copo contendo água mantida acima de 60 ° C (aquecimento agitador magnético: 230 V, 50 Hz, 630 W ou semelhante para ser usado para aquecer a água numa proveta).
- Alternativamente frascos de calor que utilizam aquecedores de bloco. Não aquecer o lípido contendo frascos directamente sobre a placa quente, a fim de evitar um gradiente de temperatura e a subsequente decomposição de lípidos.
- Pesar 500 mg do lípido fundido, em tubo de microcentrífuga pesado previamente (com tampa de encaixe cónico, 1,5 ml), utilizando uma pipeta de Pasteur de vidro com uma lâmpada de látex.
- Adicionar 500 ml de água ultrapura (resistividade de água = 18,2 mohms · cm) para o tubo de microcentrífuga acima.
- Misturar os componentes manualmente durante 15 min usando minúsculos (custom-built) espátula. Fazer tal espátula pelo achatamento da ponta de uma agulha de seringa (0,9 mm Comprimento cânula x 40 mm) usando um alicate.
- Centrifugar a mistura de lípido / água durante 10 min a uma velocidade de 2000 x g. Novamente agitar a mistura manualmente durante 10 min, em seguida equilibrar-lo durante 24 h. Antes de caracterizar as amostras, agitá-los, durante 5 min e depois deixá-los à temperatura ambiente.
- Para assegurar a formação de uma fase lipídica equilíbrio ao longo de todo o tubo, executar cerca de 10 ciclos de congelamento e descongelamento e inte rmittently realizar um passo de centrifugação, tal como definido acima. Tanto a forma altamente viscosos fases lipídicas granel DU e PT tornando difícil lidar com eles manualmente (Figura 1).
Nota: O protocolo acima (seção 1) só é necessário, se um gostaria de comparar o comportamento nanoestrutural (tipo treliça e dimensões de auto-montagem) de partículas dispersas com a fase lipídica granel e / ou usá-lo como um controle para confirmar a retenção de nanoestrutura originais.
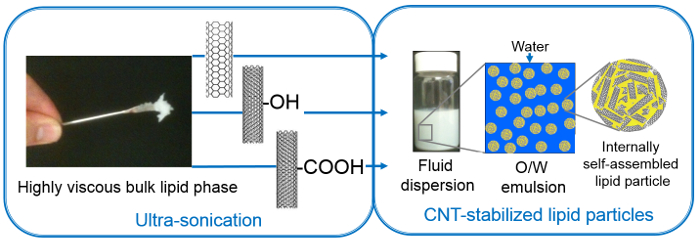
Figura 1. Preparação de S / W com emulsão de partículas de consistência fluida fase lipídica altamente viscosa utilizando a entrada de energia elevada (ultra-sons) e utilizando diferentes estabilizadores CNT-SWCNT, nomeadamente, MWCNT-OH, MWCNT-COOH (Figura reproduzida a partir da referência [50] com permissão da The Royal Society of Chemistry)._upload / 53489 / 53489fig1large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
2. Preparação do surfactante estabilizada Partículas lipídicas
- Preparar uma solução a 0,2% (w / w) de surfactante (Pluronic F127) em solução de água.
- Dissolve-se 200 mg do agente tensioactivo (pó fofo branco) em 100 ml de água ultrapura por agitação durante 20-30 min (numa placa magnética com uma barra de agitação magnética). Pluronic F127 é um tensioactivo não iónico e é comumente utilizado como estabilizador de emulsão. É um copolímero tribloco PEO de 99 -PPO 67 -PEO 99, e, consequentemente, demora muito tempo a dissolver-se em água.
- Adicionar 500 mg de fundido DU ou PT (usando uma pipeta de Pasteur de vidro) para um frasco de vidro (de cintilação de soda-cal equipado com uma folha de tampa forrada ureia, 20 ml).
- Adicionar 9,5 g de solução de F127 a 0,2%.
- Na máquina de ultra-som sonda, prender firmemente o frasco para a retorta ficar mandíbula (Retort Montagem Stands comsuporte, braçadeira, base, haste, borracha 3 mandíbula e bosshead), de modo que possa resistir às vibrações geradas por sonicação.
- Inserir a sonda liga de titânio sólido (13 mm de diâmetro x comprimento 139 milímetros) ligado ao Sonicator celular. Ajuste a altura ea posição do frasco para garantir que os seus lados e no fundo não se estão a tocar a sonda. Uma distância de 0,5 cm entre a ponta da sonda e o fundo do frasco de vidro dá bons resultados.
- Sonicar a mistura durante 10 min num modo pulsado com impulsos de 1 segundo mediada pelo tempo de atraso de 1 segundo a 35% (do máximo) de energia. O frasco fica muito quente devido ao calor gerado durante a sonicação. Portanto, deixe-o arrefecer até à temperatura ambiente antes de tirá-lo do grampo.
- Armazenar a dispersão formada-leitoso à temperatura ambiente durante pelo menos 24 horas, antes de posterior utilização. Isto é para assegurar a sua estabilidade contra a separação de fase.
Nota: Antes e depois de usar a sonda, limpe-o com acetona e seco com uma toalha de papel, em seguida, lave-o com água ultrapura umd secá-lo mais uma vez.
3. Preparação de dispersões de nanotubos de carbono puros de Água
- Em dois copos separados, pesam em 4 mg de pó MWCNT-OH e MWCNT-COOH, ambos os quais são de cor preta.
- Adicionar 500 ml de água ultrapura a cada copo. Usando uma sonda de ultrasonicator sonicar as misturas durante 2 minutos num modo de impulsos contínua a 40% (do máximo) de energia. A concentração resultante da dispersão MWCNT é de 8 ug / ml (solução-mãe).
- Diluir a solução estoque MWCNT com quantidades apropriadas de água ultrapura para atingir 6,25, 5, 4, 2 ug / ml de dispersões MWCNT.
- Sonicate estas dispersões como descrito anteriormente (ver 3.2).
- Da mesma forma, dispersar 3 mg de SWCNT em pó (também na cor preta) em 500 ml de água ultrapura para fazer uma / dispersão SWCNT ml 6 mg (solução-mãe).
- Dilui-se a solução estoque SWCNT e sonicar-los como acima descrito (ver 3.2) para se obter 0,5, 0,4, 0,3125, 0,2 ug / ml dispe SWCNTrsions.
Nota: Todas as dispersões são claros para cerca de 30 min, após o que os nanotubos de carbono começam a se depositam no fundo.
4. Preparação de CNT-estabilizado nanoestruturado Lipid partículas (Figura 1)
- Pesa-se 500 mg do DU fundido num frasco de vidro.
- Adicionar 9,5 ml de o / mL de dispersão de SWCNT 6 ug para o frasco.
- Sonicar a mistura CNT-DU utilizando os mesmos parâmetros utilizados para fazer dispersões CNT puro (ver 3.2). Após arrefecimento até à temperatura ambiente, as partículas lipídicas CNT-estabilizado com nanoestrutura auto-montados internamente conservada estará pronto.
- De uma maneira similar, preparar as partículas lipídicas utilizando os 0,4 ug / ml e 0,2 ug / ml dispersões SWCNT.
- Seguir os protocolos de 4,1 a 4,4 para fazer partículas lipídicas utilizando MWCNT-OH e MWCNT-COOH, mas usando concentrações diferentes, a saber, 8, 4 e 2 ug / ml de CNT.
- Do mesmo modo, preparar três dispersões CNT-PT diferentes usando 4 ug / ml MWCNT-OH e MWCNT-COOH, Bem como 0,4 ug / mL SWCNT. Note-se que as dispersões CNT-PT requerem menos energia (35% do máximo) mas mais tempo (15 min) num modo contínuo de impulsos. Arrefecer as dispersões para RT e deixá-los por 24 horas antes de caracterizá-los.
Nota: Os parâmetros de sonicação pode ser diferente para diferentes lipídios (como para DU e PT aqui) e para composições diferentes; que necessitam de ser optimizados para conseguir dispersões bem estabilizadas.
5. Controlo da estabilidade das dispersões de lípidos CNT-estabilizados
- Monitorizar a estabilidade das dispersões por observação visual: verificar se as dispersões são desestabilizadas ou protuberâncias se formaram nas dispersões.
- Tirar fotos (com câmera digital) em intervalos regulares. Por exemplo, tirar fotos de dispersões todos os dias na primeira semana, em seguida, todos os dias durante uma semana seguida de uma vez por semana, durante as próximas duas semanas, e, finalmente, uma vez por mês como por obrigação.
Resultados
Os resultados seguintes representam a) a estabilidade de dispersões, b), a distribuição do tamanho de partículas de lípidos, c) do tipo de auto-montagem e d) a evidência para o revestimento lipídico de nanotubos de carbono. A estabilidade das dispersões (Figura 2) foi monitorado usando uma câmera de 5 MP com foco automático e flash LED.

Figura 2. Esquemas de tipos CNT (A) MWCNT-OH, (B) MWCNT-COOH, e SWCNT (C) e imagens das emulsões correspondentes. Emulsões estáveis foram obtidos apenas em uma determinada região (sombreado), onde o CNT para lipídico proporção era óptima; abaixo e acima emulsão estável não se formou por causa de uma quantidade muito pequena ou muito grande de nanotubos de carbono, respectivamente. Uma seta indica uma protuberância típica CNT numa emulsão instável. Estas medidas foram realizadas por uma série de dispersões de DU-CNT; represaqueles tante são mostrados aqui (figura reproduzida de referência [50] com a permissão da The Royal Society of Chemistry). Por favor clique aqui para ver uma versão maior desta figura.
Pequeno ângulo de raios X de dispersão (SAXS) padrões foram registados, a fim de determinar o tipo de estrutura da nanoestrutura interior dos isasomes estabilizadas (Figura 3A). A câmara SAXSpace está ligado a um equipamento gerador de raios-X analítica (ISO-DEBYEFLEX3003) com um tubo selado-Cu-ânodo operando a 40 kV e 50 mA. O tubo de raios-X é arrefecida com um circuito fechado de água. A unidade SAXSpace bloco colimação transforma o feixe de raios X divergente policromática em uma linha de feixe em forma verticalmente focado de radiação α Cu-K com um comprimento de onda, λ, de 0,154 nm. Para as experiências de SAXS o modo de alta resolução foi escolhido, o qual pErmits para detectar um vector mínimo de dispersão, q min, de 0,04 nm -1 (Q = (4π / λ) sinθ, onde 2θ é o ângulo de dispersão). Uma paragem de feixe semi-transparente permite gravar o perfil do feixe primário atenuada para a determinação exata do vetor de zero dispersão e correção de transmissão. Cada uma das amostras estudadas é fechado no mesmo estanque ao vácuo, capilar de quartzo reutilizável de 1 mm a garantir exactamente o mesmo volume de espalhamento. O capilar foi colocada na fase de amostra de temperatura controlada equipado com elementos Peltier, que está ligado a um termostato de arrefecimento de água para livrar-se do excesso de calor. Todas as experiências foram realizadas a 25 ° C, com uma estabilidade de temperatura de 0,1 ° C. Uma bomba de vácuo foi usado para evacuar a câmara de amostra atingir uma pressão mínima de ~ 1 mbar. Os padrões de espalhamento 1D foram gravadas com um detector de raios-X micro-strip. Este detector é única contagem de fótons e tem uma SensITárea ive de 64 × 8 milímetros 2, que compreende 1.280 canais, cada um com um tamanho de canal de 0,05 × 8 mm (v × h). A distância amostra-detector foi 317.09 mm. Cada amostra foi exposta três vezes para 300 seg, e os seus perfis de espalhamento integrados-se a média.
O software foi empregue para SAXStreat corrigir os padrões de dispersão com respeito à posição do feixe primário. Os dados de SAXS foi mais transmissão corrigida ajustando a intensidade de dispersão atenuada pelo q = 0 a unidade eo fundo foi subtraído utilizando o software SAXSQuant. A dispersão vector q foi calibrado com prata-beenato, que tem um espaçamento de rede conhecida de 5,84 nm 69. Todos os padrões de difracção gravados pode ser indexado com o grupo espacial Pn3m (diamante da fase cúbica bi continua), no qual os 110, 111, 200, 211, 220 e 221 reflexões foram identificados (Figura 3A). a lattice parâmetro, uma, para a fase Pn3m foi determinado por regressão linear da aplicação da seguinte equação treliça
A = 2 π / Q HKL × √ (2 h + k + 2 L 2) (1)
em que H, K e L são os índices de Miller.
A distribuição de tamanhos e tamanho das partículas lipídicas dispersas (Figura 3B) foram determinados utilizando um laser de tamanho de partícula analyer.
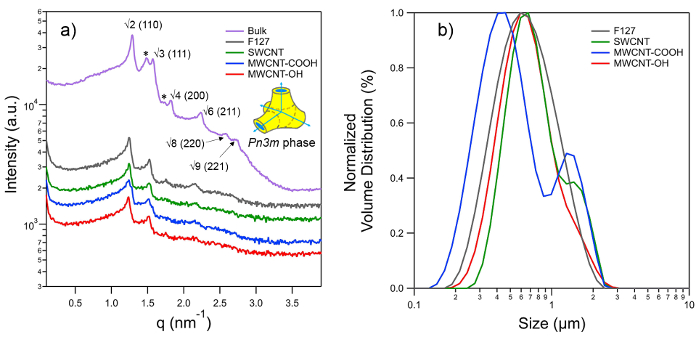
Figura 3. (A) SAXS padrões da fase Pn3m observado para phytantriol grandes quantidades (PT) e dispersões preparadas com 5% em peso de PT em excesso de água e utilizando diferentes estabilizadores F127 CNT correspondente. O diagrama esquemático 3-D mostrada na direita mostra parte da célula unitária de fase Pn3m, que é uma fase cúbica bi contínua, cuja estrutura é baseada na dupla diamante (D) o tipo de superfície mínima. setas azuis indicam aquosa reunião canais no ângulo tetraédrico enquanto regiões hidrofóbicas e aquosas são de cor amarela e azul codificado, respectivamente. Picos característicos para a fase Pn3m estão indexados como √2, √3, √4, √6, √8, √9 e correspondentes índices de Miller são mostrados entre parênteses. Todos os picos acima são visíveis na PT grandes quantidades, enquanto os quatro primeiros reflexões são visíveis para as dispersões; no entanto, isso é suficiente para identificar as nanoestruturas Pn3m e avaliar os seus parâmetros de rede. Peaks destaque by asteriscos indicam a co-existência de fase cúbica tipo Ia3d, que normalmente se formam com conteúdo de água mais baixas, e, portanto, não se observa para as dispersões. partículas lipídicas com 'nanoestrutura cúbico "em seu interior são comumente chamados como" cubosomes'. (B) a distribuição de tamanho de cubosomes preparado usando vários estabilizadores como medido por dispersão de luz estática. Por favor clique aqui para ver uma versão maior desta figura.
As interações entre os nanotubos de carbono e partículas lipídicas foram estudadas usando espectroscopia Raman (Figura 4). As amostras: nanotubos de carbono, lípidos e partículas lipídicas CNT-estabilizadas foram desidratados, em primeiro lugar utilizando azoto gasoso e, em seguida, mantendo-se num exsicador de vácuo durante cerca de 20 min. Os espectros foram registados utilizando um espectrómetro de Horiba Jobin Yvon-LabRAM HR800 equipado com um Andor eletroímã cobrado coupled device (CCD) para a detecção de luz e uma câmera de vídeo para guiar a coleta espectral. Uma linha de excitação de 532 nm do laser Nd: YAG laser foi utilizado para recolher os espectros no intervalo de 100-4,000 cm - 1 utilizando um crivo de 600 g mm - 1 ardia a 750 nm.. 50X objectivo longa distância de trabalho com uma abertura numérica de 0,50 foi usado para a aquisição dos espectros e o orifício confocal foi fixada em 100 um. Antes das medições, o instrumento foi calibrado para os 520,8 cm - 1 linha espectral de silício. Todos os espectros foram recolhidos à TA (25 ° C) colocando a amostra em lâminas de fluoreto de cálcio. Os espectros foram adquiridos utilizando o laser de 532 nm e acumulou 5 vezes com a exposição a 1% por 10 seg. LabSpec conjunto de software 6 espectroscopia utilizado para pré-processamento dos dados brutos e interrogatório de dados imediata.
ftp_upload / 53489 / 53489fig4.jpg "/>
Figura 4. Os espectros de Raman para desidratado (A) puro lipídico, as nanopartículas de lípidos contendo 5,0 ug / ml MWCNT-COOH, (B) lípido puro, MWCNT-OH e de nanopartículas de lípidos contendo 5,0 ug / ml MWCNT- MWCNT-COOH e CNT-estabilizado OH, e (C) puro lipídicas, nanopartículas de lípidos e SWCNT contendo 0,3125 ug / ml SWCNT. Todas as curvas representam uma média de dez espectros onde intensidades, em unidades arbitrárias são representados graficamente em função do comprimento de onda. As linhas verticais são usados para guiar o olho, e para facilitar a detecção dos deslocamentos azuis na bandas G e G '. Estas experiências foram realizadas para DU. (D) Diagrama esquemático de possíveis decoração lipídico (auto-montagem) na superfície CNT (Figura reproduzida de referência [50] com a permissão da The Royal Society of Chemistry). Por favor clique aqui para view uma versão maior desta figura.
Discussão
A estabilização de partículas lipídicas
Três nanotubos de carbono diferentes são usados para estabilizar as dispersões de lípidos; dois dos quais são de paredes múltiplas e funcionalizado utilizando -OH e grupos -COOH, e um único é murado e não-funcionalizado (primitivo). O CNT variaram em tamanho, como se segue (diâmetro x comprimento): MWCNT-COOH: 9,5 nm x 1,5 m; MWCNT-OH: 8-15 nm x 50 mm; SWCNT: 1-2 nm x 1-3 | im. Os nanotubos de carbono em pó foram dispersas em água por sonda de ultra-sonicação. tamanhos acima mencionados de nanotubos de carbono são susceptíveis de diminuir ainda mais devido ao ultra-ultra-sons, embora de forma desigual. Dispersões CNT em água pura começaram a separar após cerca de 20 min, portanto, a continuação dos trabalhos foi executado dentro deste prazo, ou seja, a adição de lipídios e segunda sonicação. Este último (ultra-som realizado nas misturas de lípidos-CNT) auxilia na fusão e quebrar domínios grandes e inconsistentes lipídicas formados durante a hidratação em porções sub-mícron. Dispersando o i lipídico granelN desta forma facilita a formação de equilíbrio de nanoestruturas auto-montadas, que de outro modo requer ciclos de congelamento-descongelamento rigorosas e / ou tempo (dias ou semanas). A maior quebra da fase dos lípidos em nanopartículas, enquanto os nanotubos de carbono revestidos de lípidos supostamente formam conchas em torno deles. Ultra-sonicação aumenta as interações hidrofóbicas entre os nanotubos de carbono e as cadeias de alquilo de moléculas lipídicas que decoram, assim, os nanotubos de carbono por cadeias alquílicas lipídico. Assim, os nanotubos de carbono revestidos estabilizar a fase lipídica fragmentada levando a uma emulsão de partículas. Esta estabilização mútua evita a agregação de nanotubos de carbono, bem como dispersa as partículas lipídicas. Tais dispersões são também chamados de Pickering (devido à utilização de partículas sólidas) emulsões do tipo óleo-em-água (o / w), em que os lípidos formam uma "fase oleosa", enquanto "excesso de água» constitui a forma de emulsão contínua (Figura 1 ). parâmetros de ultra-som (comprimento de pulso, tempo de atraso e de energia), os parâmetros físico-químicas de um estabilizador(Por exemplo, as dimensões, de funcionalização), concentração da fase dispersa e da composição da dispersão (por exemplo, a proporção de lípido CNT) são cruciais para garantir a estabilidade final das dispersões e, por conseguinte, precisa de ser optimizada para diferentes sistemas (lípido).
Optimização da CNT a proporção de lípidos para emulsões estáveis
Uma ampla gama de concentrações, para cada tipo CNT (Figura 2) foi utilizada para estabilizar os nanoestruturas auto-montadas obtidos a partir de dois diferentes lípidos. No entanto, emulsões homogéneas e estáveis são formadas apenas num determinado intervalo de CNT a proporção de lípidos; rácios muito elevados provocar a agregação de nanotubos de carbono, enquanto que os rácios muito baixos levam a emulsões instáveis, porque não são os nanotubos de carbono suficientes para realizar uma cobertura de partículas à superfície suficientes. As melhores condições de estabilização foram encontrados com concentrações entre 3-5 ug / ml para MWCNT-COOH e MWCNT-OH, enquanto que para SWCNT na gama de 0,3-0,45ug / ml.
Caracterização morfológica das partículas lipídicas
As medidas de SAXS verificar que as partículas lipídicas da PT reter a nanoestrutura da fase cúbica inicial (mostrado pela fase em massa) (Figura 3A). Nós presumimos que a fase cúbica também é retida em caso de partículas de urânio empobrecido, no entanto, isso precisa ser confirmado posteriormente, uma vez que não foi estudado no presente trabalho. O parâmetro de rede observado para fase em massa Pn3m da PT é 6,84 nm, que após dispersão aumenta para 7,1 nm. O parâmetro da rede inferior para a fase em massa é atribuído à falta de excesso de água, que pode também ser confirmada pela coexistência da fase Ia3d (picos marcados com * na Figura 3A). A fase Ia3d é normalmente encontrado em condições de água limitados. Os parâmetros de rede para a fase Pn3m observado para todas as partículas lipídicas dispersas (ou seja, estabilizados por tensioactivo, bem como de todos os tipos CNT) são practically os mesmos que indicam as condições da água em excesso. Isto também exclui a possibilidade de perturbações CNT-accionado a nível molecular que, de outro modo, poderia ter provocado uma alteração da fase de lípidos.
As distribuições de tamanho das cubosomes são dadas pelas distribuições ponderado em volume, como mostrado na Figura 3B. Embora as partículas CNT-estabilizados exibir uma distribuição de tamanho grande, a maioria das partículas apresentam tamanhos entre 532-760 nm, que é comparável com o tamanho do surfactante estabilizado partículas lipídicas (674 nm).
Revestimento lipídico de nanotubos de carbono
Para os nanotubos de carbono puro, bandas de grafite típico Raman são vistos nos espectros de Raman. A banda L, que corresponde à vibração no plano de 'ligação CC', a banda D (não mostrado), que é devido à presença de desordem em sistemas de carbono e banda do G ', que é atribuída ao Bifónico da banda D 70 são claramente observada. Após a interactina de CNT com lípidos e na formação de partículas lipidicas CNT-estabilizados (comparar as curvas de verde e azul na Figura 4), uma mudança de números de onda mais elevados (blue shift) é observada. O deslocamento para o azul observado, pode ser devido a: i) a alta pressão exercida sobre os nanotubos de carbono ultra-sons durante resultantes da sua dispersão em oposição a um estado puro quando empacotado 70,71, e / ou ii) as interacções entre os nanotubos de carbono e moléculas de lípidos por meio de revestimento dos nanotubos por lipídios (tal mudança azul foi publicado anteriormente pela Douroumis et al. 72 para lipídicas SWCNTs revestidos).
A diminuição em intensidades relativas dos picos CNT e aparecimento de sinais de lípidos (a partir de curvas vermelhas de lípido puro (Figura 4) confirma ainda mais o revestimento de nanotubos de carbono por moléculas lipídicas. Isto sugere que as interacções hidrofóbicas entre os nanotubos de carbono e as cadeias de alquilo de moléculas lipídicas decorar o CNT superfície de tal forma que os grupos de cabeça hidrófilos enfrentar regiões aquosa assim STABILIzing O / W emulsão, como mostrado pelo esquema na Figura 4D.
Nós demonstramos um método simples e elegante de cineticamente estabilizar a emulsão do tipo O / W de partículas lipídicas nanoestruturados utilizando vários nanotubos de carbono. Muito baixas concentrações (<10 ng / ml) de nanotubos de carbono são adequados para estabilizar a dispersão de nanopartículas de lípidos, que é promissora especificamente para aplicações in vivo. Decoração de nanotubos de carbono por moléculas lipídicas é antecipado para minimizar a sua toxicidade, melhorando a biocompatibilidade. A perspectiva de carregar moléculas funcionais dentro da auto-montagem de lípidos, bem como sobre a superfície da CNT fornecer potencial ilimitado para as partículas lipídicas CNT-estabilizados na área das ciências biomédicas, especialmente no contexto de terapias combinadas contra as principais doenças 73.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Nós gostaríamos de agradecer ao Dr. Matthew J. Baker, agora na Universidade de Strathclyde, em Glasgow para o apoio com experimentos Raman e Mr. Nick Gaunt por seu trabalho antes deste projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| Dimodan U | Danisco | 15312 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Phytantriol (> 95%, GC) | TCI Europe N.V. | P1674 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Single walled Carbon Nanotubes (90%) | Nanostructured & Amorphous Materials, Inc. | 1246YJS | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Multi-walled carboxylic acid functionalized Carbon Nanotubes (> 80% Caron basis, > 8% carboxylic acid functionalized) | Sigma-Aldrich Co. LLC | 755125 | Store at room temperature. Away from direct light. Causes serious eye irritation. May cause respiratory irritation. |
| Graphitized Multi-walled hydroxy functionalized Carbon Nanotubes (99.9%) | Nanostructured & Amorphous Materials, Inc. (NanoAmor) | 1224YJF | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Pluronic F127 | Sigma-Aldrich Co. LLC | P2443 | BioReagent, suitable for cell culture. Not a hazardous substance or mixture. Store at room temperature. |
| Acetone (99.5%) | Fisher Scientific | 10134100 | Highly flammable liquid. Causes serious eye irritation. May cause drowsiness or dizziness. |
| Jars with loose, enfolding lids (375 ml) | VWR International Ltd | 216-3308 | |
| Beaker, 1,000 ml | Fisher Scientific | 12942161 | heavy duty, low form, with spout and graduations |
| Pasteur glass pipette (150 mm length) with latex bulb | Fisher Scientific | 10006021 | |
| Microcentrifuge tube conical snap cap 1.5 ml | Fisher Scientific | 11558232 | |
| Spatula | Fisher Scientific | 11352204 | |
| Heating magnetic stirrer | Fisher Scientific | 11715704 | |
| Magnetic stirrer bars (cylindrical, opaque PTFE, 30 mm x 7 mm (l x diameter)) | Fisher Scientific | 10011792 | |
| Needle (0.9 mm x 40 mm cannula length) | Terumo UK Ltd | MN-2038MQ | |
| Retort Stand Set - With stand, clamp, base, rod, rubber 3 jaw and bosshead | Camlab Ltd, UK | 1177157 | |
| Millipore water equipment | Barnstead Nanopure, Thermoscientific, USA | ||
| Progen Genfuge 24D Digital Microcentrifuge | Progen Scientific | C-2400 | |
| Probe ultra-sonicator, with 13 mm | SONICS, Vibracell, USA | ||
| 5 MP camera with auto-focus and LED flash | Samsung Galaxy Fame Mobile camera | ||
| Raman Spectrometer | Horiba Jobin-Yvon LabRAM HR800 spectrometer | ||
| Mastersizer 3000 | Malvern Instruments Ltd, Malvern, United Kingdom | ||
| Small angle X-ray scattering (SAXS) | SAXSpace camera (Anton Paar, Graz, Austria), X-ray generating equipment (ISO-DEBYEFLEX3003, GE Inspection Technologies GmbH), closed water circuit (Chilly 35, HYFRA, Germany). |
Referências
- Peer, D., et al. Nanocarriers as an emerging platform for cancer therapy. Nature Nanotech. 2, 751-760 (2007).
- White, R. R., Sullenger, B. A., Rusconi, C. P. Developing aptamers into therapeutics. J. Clin. Invest. 106, 929-934 (2000).
- Itaka, K., Chung, U. I., Kataoka, K. Supramolecular nanocarrier for gene and siRNA delivery. Nippon Rinsho Jpn. J. Clin. Med. 64, 253-257 (2006).
- Xu, S., et al. Development of pH-responsive core-shell nanocarriers for delivery of therapeutic and diagnostic agents. Bioorg. Med. Chem. Lett. 19, 1030-1034 (2009).
- Soppimath, K. S., Tan, D. C. W., Yang, Y. Y. pH-triggered thermally responsive polymer core-shell nanoparticles for drug delivery. Adv. Mater. 17, 318-323 (2005).
- Hans, M., Lowman, A. Biodegradable nanoparticles for drug delivery and targeting. Curr. Opin. Solid State Mater. Sci. 6, 319-327 (2002).
- Petros, R. A., DeSimone, J. M. Strategies in the design of nanoparticles for therapeutic applications. Nat Rev Drug Discov. 9, 615-627 (2010).
- Torchilin, V. P. Multifunctional nanocarriers. Adv Drug Deliver Rev. 64, 302-315 (2012).
- Shmeeda, H., et al. Delivery of zoledronic acid encapsulated in folate-targeted liposome results in potent in vitro cytotoxic activity on tumor cells. J. Controlled Release. 146, 76-83 (2010).
- Xu, Z., et al. The performance of docetaxel-loaded solid lipid nanoparticles targeted to hepatocellular carcinoma. Biomaterials. 30, 226-232 (2009).
- Rosenthal, E., et al. Phase IV study of liposomal daunorubicin (DaunoXome) in AIDS-related Kaposi sarcoma. Am. J. Clin. Oncol.-Canc. 25, 57-59 (2002).
- Dong, Y. D., Larson, I., Bames, T. J., Prestidge, C. A., Boyd, B. J. Adsorption of Nonlamellar Nanostructured Liquid-Crystalline Particles to Biorelevant Surfaces for Improved Delivery of Bioactive Compounds. Acs Appl Mater Inter. 3, 1771-1780 (2011).
- Rizwan, S. B., Boyd, B. J., Rades, T., Hook, S. Bicontinuous cubic liquid crystals as sustained delivery systems for peptides and proteins. Expert Opin. Drug. Deliv. 7, 1133-1144 (2010).
- Yoo, H. S., Park, T. G. Folate receptor targeted biodegradable polymeric doxorubicin micelles. J. Controlled Release. 96, 273-283 (2004).
- Khandare, J. J., et al. Dendrimer versus linear conjugate: Influence of polymeric architecture on the delivery and anticancer effect of paclitaxel. Bioconjug. Chem. 17, 1464-1472 (2006).
- Prabaharan, M., Grailer, J. J., Pilla, S., Steeber, D. A., Gong, S. Gold nanoparticles with a monolayer of doxorubicin-conjugated amphiphilic block copolymer for tumor-targeted drug delivery. Biomaterials. 30, 6065-6075 (2009).
- Fan, J., et al. Targeted anticancer prodrug with mesoporous silica nanoparticles as vehicles. Nanotechnology. 22, (2011).
- Bianco, A., Prato, M. Can carbon nanotubes be considered useful tools for biological applications? Adv. Mater. 15, 1765-1768 (2003).
- Kam, N. W. S., Dai, H. J. Carbon nanotubes as intracellular protein transporters: Generality and biological functionality. J. Am. Chem. Soc. 127, 6021-6026 (2005).
- Kulkarni, C. V. Lipid crystallization: from self-assembly to hierarchical and biological ordering. Nanoscale. 4, 5779-5791 (2012).
- Yaghmur, A., et al. Drug Formulations Based on Self-Assembled Liquid Crystalline Nanostructures. , CRC Press. 341-360 (2014).
- Kulkarni, C. V. Advances in Planar Lipid Bilayers and Liposomes. 12, Academic Press. 237-272 (2010).
- Landau, E. M., Navarro, J. V. US Pat. , US2001/025791A1 (2001).
- Kulkarni, C., Belsare, N., Lele, A. Studies on shrikhand rheology. J. Food Eng. 74, 169-177 (2006).
- Mezzenga, R., Schurtenberger, P., Burbidge, A., Michel, M. Understanding foods as soft materials. Nature Mater. 4, 729-740 (2005).
- Ubbink, J., Burbidge, A., Mezzenga, R. Food structure and functionality: a soft matter perspective. Soft Matter. 4, 1569-1581 (2008).
- Dong, Y. D., Larson, I., Hanley, T., Boyd, B. J. Bulk and dispersed aqueous phase behavior of phytantriol: effect of vitamin E acetate and F127 polymer on liquid crystal nanostructure. Langmuir. 22, 9512-9518 (2006).
- Yaghmur, A., Glatter, O. Characterization and potential applications of nanostructured aqueous dispersions. Adv. Colloid Interface Sci. 147, 333-342 (2009).
- Pardeike, J., Hommoss, A., Müller, R. H. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products. Int. J. Pharm. 366, 170-184 (2009).
- Yaghmur, A., Rappolt, M., Østergaard, J., Larsen, C., Larsen, S. W. Characterization of bupivacaine-loaded formulations based on liquid crystalline phases and microemulsions: the effect of lipid composition. Langmuir. 28, 2881-2889 (2012).
- Singh, H., Ye, A., Horne, D. Structuring food emulsions in the gastrointestinal tract to modify lipid digestion. Prog. Lipid Res. 48, 92-100 (2009).
- Angelova, A., Angelov, B., Mutafchieva, R., Lesieur, S., Couvreur, P. Self-Assembled Multicompartment Liquid Crystalline Lipid Carriers for Protein, Peptide, and Nucleic Acid Drug Delivery. Accounts Chem. Res. 44, 147-156 (2011).
- Clogston, J., Caffrey, M. Controlling release from the lipidic cubic phase. Amino acids, peptides, proteins and nucleic acids. J. Controlled Release. 107, 97-111 (2005).
- Shah, J. C., Sadhale, Y., Chilukuri, D. M. Cubic phase gels as drug delivery systems. Adv. Drug Deliver. Rev. 47, 229-250 (2001).
- Boyd, B. J., Whittaker, D. V., Khoo, S. M., Davey, G. Lyotropic liquid crystalline phases formed from glycerate surfactants as sustained release drug delivery systems. Int. J. Pharm. 309, 218-226 (2006).
- Drummond, C. J., Fong, C. Surfactant self-assembly objects as novel drug delivery vehicles. Curr. Opin. Colloid Interface Sci. 4, 449-456 (1999).
- Zhao, X. Y., Zhang, J., Zheng, L. Q., Li, D. H. Studies of cubosomes as a sustained drug delivery system. J. Dispersion Sci. Technol. 25, 795-799 (2004).
- Malmsten, M. Phase transformations in self-assembly systems for drug delivery applications. J. Dispersion Sci. Technol. 28, 63-72 (2007).
- Sadhale, Y., Shah, J. C. Stabilization of insulin against agitation-induced aggregation by the GMO cubic phase gel. Int. J. Pharm. 191, 51-64 (1999).
- Amar-Yuli, I., Azulay, D., Mishraki, T., Aserin, A., Garti, N. The role of glycerol and phosphatidylcholine in solubilizing and enhancing insulin stability in reverse hexagonal mesophases. J. Colloid Interface Sci. 364, 379-387 (2011).
- Rappolt, M. Advances in planar lipid bilayers and liposomes. Leitmannova Liu, A. 5, Elsevier Inc. Amsterdam. 253-283 (2006).
- Rappolt, M., Cacho-Nerin, F., Morello, C., Yaghmur, A. How the chain configuration governs the packing of inverted micelles in the cubic Fd 3 m-phase. Soft Matter. 9, 6291-6300 (2013).
- Kulkarni, C. V., Wachter, W., Iglesias-Salto, G., Engelskirchen, S., Ahualli, S. Monoolein: a magic lipid? Phys. Chem. Chem. Phys. 13, 3004-3021 (2011).
- Yaghmur, A., de Campo, L., Sagalowicz, L., Leser, M. E., Glatter, O. Emulsified Microemulsions and Oil-Containing Liquid Crystalline Phases. Langmuir. 21, 569-577 (2005).
- Kulkarni, C. V., Glatter, O. Ch. 6. Self-Assembled Supramolecular Architectures: Lyotropic Liquid Crystals.Surface and Interfacial Chemistry. Nissim, G. , John Wiley & Sons, Inc. (2012).
- Salonen, A., Muller, F. O., Glatter, O. Internally Self-Assembled Submicrometer Emulsions Stabilized by Spherical Nanocolloids: Finding the Free Nanoparticles in the Aqueous Continuous Phase. Langmuir. 26, 7981-7987 (2010).
- Guillot, S., Bergaya, F., de Azevedo, C., Warmont, F., Tranchant, J. F. Internally structured pickering emulsions stabilized by clay mineral particles. J. Colloid Interface Sci. 333, 563-569 (2009).
- Muller, F., Salonen, A., Glatter, O. Monoglyceride-based cubosomes stabilized by Laponite: Separating the effects of stabilizer, pH and temperature. Colloids Surf., A. 358, 50-56 (2010).
- Salonen, A., Muller, F. O., Glatter, O. Dispersions of Internally Liquid Crystalline Systems Stabilized by Charged Disklike Particles as Pickering Emulsions: Basic Properties and Time-Resolved. Langmuir. 24, 5306-5314 (2008).
- Gaunt, N. P., Patil-Sen, Y., Baker, M. J., Kulkarni, C. V. Carbon nanotubes for stabilization of nanostructured lipid particles. Nanoscale. 7, 1090-1095 (2015).
- Pickerings, S. U. Emulsions. J. Chem. Soc. 91, (2001).
- Ramsden, W. Separation of Solids in the Surface-Layers of Solutions and 'Suspensions' (Observations on Surface-Membranes, Bubbles, Emulsions, and Mechanical Coagulation). -- Preliminary Account. Proceedings of the Royal Society of London. 72, 156-164 (1903).
- Lin, Y., et al. Advances toward bioapplications of carbon nanotubes. J. Mater. Chem. 14, 527-541 (2004).
- Saito, N., et al. Safe Clinical Use of Carbon Nanotubes as Innovative Biomaterials. Chem. Rev. 114, 6040-6079 (2014).
- Pulskamp, K., Diabate, S., Krug, H. F. Carbon nanotubes show no sign of acute toxicity but induce intracellular reactive oxygen species in dependence on contaminants. Toxicol. Lett. 168, 58-74 (2007).
- Smart, S. K., Cassady, A. I., Lu, G. Q., Martin, D. J. The biocompatibility of carbon nanotubes. Carbon. 44, 1034-1047 (2006).
- Colvin, V. L. The potential environmental impact of engineered nanomaterials. Nat. Biotechnol. 21, 1166-1170 (2003).
- Firme, C. P., Bandaru, P. R. Toxicity issues in the application of carbon nanotubes to biological systems. Nanomed-Nanotechnol. 6, 245-256 (2010).
- Haddon, R. C. Carbon nanotubes. Accounts Chem. Res. 35, 997-997 (2002).
- Kapralov, A. A., et al. Adsorption of Surfactant Lipids by Single-Walled Carbon Nanotubes in Mouse Lung upon Pharyngeal Aspiration. Acs Nano. 6, 4147-4156 (2012).
- Wallace, E. J., Mark, S. P. S. Carbon nanotube self-assembly with lipids and detergent: a molecular dynamics study. Nanotechnology. 20, 045101(2009).
- George, R. B. Chest medicine: essentials of pulmonary and critical care medicine. Lippincott Williams & Wilkins. , (2005).
- Monteiro-Riviere, N. A., Nemanich, R. J., Inman, A. O., Wang, Y. Y., Riviere, J. E. Multi-walled carbon nanotube interactions with human epidermal keratinocytes. Toxicol. Lett. 155, 377-384 (2005).
- Shvedova, A., et al. Exposure to carbon nanotube material: assessment of nanotube cytotoxicity using human keratinocyte cells. J. Toxicol. Env. Heal. A. 66, 1909-1926 (2003).
- Jia, G., et al. Cytotoxicity of carbon nanomaterials: single-wall nanotube, multi-wall nanotube, and fullerene. Environ. Sci. Technol. 39, 1378-1383 (2005).
- Sato, Y., et al. Influence of length on cytotoxicity of multi-walled carbon nanotubes against human acute monocytic leukemia cell line THP-1 in vitro and subcutaneous tissue of rats in vivo. Mol. BioSyst. 1, 176-182 (2005).
- Bottini, M., et al. Multi-walled carbon nanotubes induce T lymphocyte apoptosis. Toxicol. Lett. 160, 121-126 (2006).
- Cui, D., Tian, F., Ozkan, C. S., Wang, M., Gao, H. Effect of single wall carbon nanotubes on human HEK293 cells. Toxicol. Lett. 155, 73-85 (2005).
- Huang, T., Toraya, H., Blanton, T., Wu, Y. X-ray powder diffraction analysis of silver behenate, a possible low-angle diffraction standard. J. Appl. Crystallogr. 26, 180-184 (1993).
- Bokobza, L., Zhang, J. Raman spectroscopic characterization of multiwall carbon nanotubes and of composites. Express Polym. Lett. 6, 601-608 (2012).
- Zhao, Q., Wagner, H. D. Raman spectroscopy of carbon-nanotube-based composites. Philos. Trans. R. Soc. London, Ser. A -Math. Phys. Eng. Sci. 362, 2407-2424 (2004).
- Douroumis, D., Fatouros, D. G., Bouropoulos, N., Papagelis, K., Tasis, D. Colloidal stability of carbon nanotubes in an aqueous dispersion of phospholipid. Int. J. Nanomed. 2, 761-766 (2007).
- Worthington, R. J., Melander, C. Combination approaches to combat multidrug-resistant bacteria. Trends Biotechnol. 31, 177-184 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados