Method Article
Facile Herstellung von Intern Selbstorganisierte Lipidpartikel stabilisiert durch Kohlenstoff-Nanoröhren
In diesem Artikel
Zusammenfassung
We report on a smart application of carbon nanotubes for kinetic stabilization of lipid particles that contain self-assembled nanostructures in their cores. The preparation of lipid particles requires rather low concentrations of carbon nanotubes permitting their use in biomedical applications such as drug delivery.
Zusammenfassung
Wir präsentieren eine einfache Methode nanostrukturierte Lipidpartikel von Kohlenstoffnanoröhren (CNTs) stabilisiert vorzubereiten. Einwandig (unberührte) und mehrwandig (funktionalisierte) CNTs als Stabilisatoren verwendet Pickering Typ Öl-in-Wasser (O / W) Emulsionen zu erzeugen. Lipide nämlich Dimodan U und Phytantriol als Emulgatoren, die in überschüssiges Wasser durch Selbstorganisation in die bikontinuierliche kubische Pn3m Phase verwendet. Diese hochviskose Phase wird in kleinere Partikel zerlegt eine Sonde Ultraschallgerät in Gegenwart von üblichen Tensid Stabilisatoren oder CNTs verwendet wie hier geschehen. Zunächst werden die CNTs (Pulverform) in Wasser, gefolgt von weiteren Ultraschallbehandlung mit dem geschmolzenen Lipid dispergiert, um die endgültige Emulsion zu bilden. Während dieses Prozesses erhalten die CNTs mit Lipid-Molekülen beschichtet, die wiederum davon ausgegangen werden, um die Lipidtröpfchen umgibt einen partikulären Emulsion zu bilden, die über Monate stabil ist. Die durchschnittliche Größe der nanostrukturierten Lipidpartikel-CNT stabilisiert ist im Submikron-range, die gut mit den Partikeln vergleicht stabilisiert herkömmliche Tenside verwenden. Kleinwinkel-Röntgenstreuungsdaten bestätigt die Beibehaltung der ursprünglichen Pn3m kubischen Phase in den CNT-stabilisiertes Lipid-Dispersionen im Vergleich zu den reinen Lipidphase (bulk state). Blauverschiebung und Senken der Intensitäten in Charakteristik G und G Bänder von CNTs in der Raman-Spektroskopie beobachtet die Interaktion zwischen CNT Oberfläche und Lipidmoleküle zu charakterisieren. Diese Ergebnisse legen nahe, dass die Wechselwirkungen zwischen den CNTs und Lipiden zur gegenseitigen Stabilisierung in wässrigen Lösungen verantwortlich sind. Da die Konzentrationen der zur Stabilisierung eingesetzten CNTs sind sehr niedrig und Lipidmoleküle sind in der Lage, die CNTs, die Toxizität von CNTs zu funktionalisieren, ist unbedeutend zu erwarten, während ihre Biokompatibilität stark verbessert wird. Daher ist die vorliegende Ansatz findet ein großes Potenzial in verschiedenen biomedizinischen Anwendungen, zum Beispiel für die Lieferung von m Hybrid-Nanotransporter Systeme zu entwickelnehrere funktionelle Moleküle wie in der Kombinationstherapie oder Fachtherapie.
Einleitung
Im Laufe der letzten Jahrzehnte, ein Nanotechnologie hat sich als leistungsfähiges Werkzeug, vor allem im Bereich der präklinischen Entwicklung der Medizin zur Bekämpfung der notorischen Krankheiten wie Krebs entwickelt. In diesem Zusammenhang nanoskalige Strukturen mit einer Größe von <1000 nm in großem Umfang als Träger zur Freisetzung von verschiedenen aktiven Biomoleküle, wie Medikamente, Proteine, Nukleinsäuren, Gene und diagnostischen Bildgebungsmitteln 1-4 untersucht werden. Diese Biomoleküle sind entweder in den Nanopartikeln verkapselt oder konjugiert auf die Oberfläche der Nanopartikel und am Wirkort durch Auslöser wie pH oder Temperatur 5,6 freigesetzt. Obwohl extrem klein erweist sich die große Oberfläche dieser Nanopartikel zur gezielten Abgabe von aktiven Biomoleküle von großem Vorteil sein. Die Kontrolle über die Teilchengröße und Biokompatibilität ist von äußerster Wichtigkeit, um die therapeutische Wirksamkeit und somit die Anwendbarkeit von Nanopartikeln 7,8 zu optimieren.Lipide 9-13, Polymere 14,15, Metalle 16,17 und Kohlenstoff-Nanoröhren 18,19 wurden als Nanotransporter für verschiedene biomedizinische und pharmazeutische Anwendungen angewendet.
Darüber hinaus Nanotransporter Anwendungen auf Basis von Lipidselbstorganisierte Nanostrukturen haben eine große Bedeutung in vielen anderen Disziplinen, darunter Lebensmittel- und Kosmetikindustrie 20,21. Zum Beispiel sind sie in der Proteinkristallisation 22, 23 Trennung von Biomolekülen, wie Lebensmittelstabilisatoren beispielsweise in Desserts 24 und in der Lieferung von aktiven Molekülen, wie Nährstoffe, Geschmacksstoffe und Duftstoffe 25-31 verwendet. Selbstorganisierte Lipidnanostrukturen haben nicht nur die Möglichkeit, bioaktive Moleküle zu lösen, in einer kontrollierten und zielgerichtet 32-38, aber sie sind auch in der Lage die funktionellen Moleküle aus chemischen und enzymatischen Abbau 39,40 zu schützen. Obwohl planare Fluiddoppelschicht ist die commauf Nanostruktur durch amphiphilen Lipidmolekülen in Gegenwart von Wasser, andere Strukturen wie hexagonal und kubisch sind auch häufig 20,41,42 gebildet beobachtet. Die Art der Nanostruktur gebildet hängen von der Molekülform Struktur "Lipide der Lipidzusammensetzung in Wasser als auch auf die physikalisch-chemischen Bedingungen eingesetzt, wie Temperatur und Druck 43. Die Anwendbarkeit der nicht-planaren Lipidnanostrukturen insbesondere von kubischen Phasen ist beschränkt aufgrund ihrer hohen Viskosität und inhomogene Domänen Konsistenz. Diese Probleme werden überwunden, indem die Lipid-Nanostrukturen in großen Wassermenge dispergiert Öl-in-Wasser (O / W) Emulsionen Mikron oder Submikrongröße Lipidteilchen zu bilden. Auf diese Weise kann ein geeignetes Produkt mit niedriger Viskosität hergestellt werden, während die ursprüngliche Lipidselbstorganisierte Struktur im Inneren der dispergierten Teilchen zu halten. Die Bildung dieser intern selbstorganisierten Teilchen (abgekürzt als ISAsomes 44 ZB erfordert üblicherweise eine Kombination aus einem hohen Energieeingabeschritt und den Zusatz von Stabilisatoren wie Tenside oder Polymere cubosomes aus kubischen Phasen und hexosomes von hexagonalen Phasen). Jüngste Forschungen in diese Richtung zeigt die Anwendung der verschiedenen Feststoffpartikeln 45 mit Silica-Nanopartikel 46, Ton 47-49 und Kohlenstoff-Nanoröhren 50 für die Stabilisierung der zuvor genannten Emulsionen, in geeigneter Weise bezeichnet als Pickering 51 oder Ramsden-Pickering-Emulsionen 52.
In den letzten Jahren auf Kohlenstoff basierenden Nanostrukturen wie einwandige Kohlenstoffnanoröhren (SWCNTs) wurden mehrwandige Kohlenstoffnanoröhren (MWCNTs) und Fullerene ein hohes Maß an Aufmerksamkeit wie neuartigen Biomaterialien 53,54 erhalten. Die wichtigsten Anliegen sind ihre Toxizität 55-58, Wasserunlöslichkeit 59 und damit ihre Biokompatibilität 56. Ein effizienter Weg, um diese Probleme anzugehen ist die Oberflächenfunktionsierung unter Verwendung nicht-toxisch und biokompatibel Moleküle wie Lipide. In Gegenwart von Wasser, Lipide mit CNTs in einer Weise zusammenwirken, dass hydrophobe Oberfläche von CNTs aus polaren wässrigen Medium abgeschirmt wird, während die Lipidhydrophile Kopfgruppen ihre Löslichkeit oder Dispersion in Wasser helfen 60,61. Lipide sind integrale Bestandteile von Zellorganellen wie auch einige Nahrungsmittelmaterialien, damit deren Dekoration idealerweise die in vivo Toxizität von CNTs abnehmen sollte. Biomedizinische Anwendungen basierend unabhängig auf CNTs 18,19 und Lipidnanostrukturen 13.9 sind unter intensiver Entwicklungs aber die Anwendungen, die Eigenschaften der beiden zu kombinieren sind noch nicht gut erforscht.
In dieser Arbeit beschäftigen wir zwei verschiedene Arten von Lipiden und drei Arten von CNTs von denen SWCNTs in der ursprünglichen Form sind während MWCNTs mit Hydroxyl und Carbonsäuregruppen funktionalisiert sind. Wir haben sehr niedrige Konzentrationen von CNTs verwendet, um die Dispersionen herzustellen, derenStabilität hängt von verschiedenen Faktoren wie zB der Art des Lipids, der Art der CNT, Verhältnis von Lipid zu CNT verwendet werden, sowie auf die Beschallung Parameter verwendet, wie Leistung und Dauer. Diese Video-Protokoll bietet technische Details eines Verfahrens zur Lipidnanopartikel mit verschiedenen CNT-Stabilisatoren kinetisch zu stabilisieren.
Protokoll
Achtung: CNTs in dieser Arbeit sind in der nanopartikulären Form, die zusätzliche Gefahren haben im Vergleich zu ihren Massen Pendants. Das Einatmen von Graphit, sowohl natürliche als auch synthetische, können Staublunge 62 ähnlich wie Kohle Arbeiterlunge verursachen. Darüber hinaus gab es Bedenken, auf die Toxizität von auf Kohlenstoff basierenden Nanostrukturen und einige der früheren Studien schlagen vor, im Zusammenhang akute und chronische Toxizität mit dem Einatmen von CNTs 63-68 verbunden. Daher vermeiden Einatmen des feinen CNT-Pulver und behandeln sie mit größter Sorgfalt. Falls eingeatmet, an die frische Luft bringen. Bei Atembeschwerden, mit reinem Sauerstoff statt und medizinische Beratung suchen. Lösung / Dispersion Formulierungen von CNTs sind ziemlich sicher zu handhaben.
Achtung: Lipide und Tenside in dieser Studie verwendet werden, sind lebensmittelechten Materialien und somit nicht gefährlich im Allgemeinen, aber sie sind reizend für die Augen und die Haut, und auch leicht entflammbar. Daher alle geeigneten Sicherheitspraktiken wie die Verwendung von en, nutzen Sie bittegineering Kontrollen (Abzug) und persönliche Schutzausrüstung (Schutzbrille, Handschuhe, Kittel, in voller Länge Hosen, geschlossene Schuhe) bei der Handhabung und Herstellung von Nanopartikel-Proben. Bei Berührung mit der Haut oder Augen sofort gründlich Haut oder Augen mit viel Wasser für mindestens 15 Minuten. Arzt aufsuchen, falls erforderlich.
1. Herstellung von Lipid / Wasser Bulkphasen
Achtung: Bewahren Sie die Lipide im Kühlschrank bei 4 ° C. Reiner Qualität Lipide sollten in den Gefrierschrank (-20 ° C) gelagert werden. Aliquotieren sie in kleine Glasfläschchen Kontamination des gesamten Bestand und die Bequemlichkeit der Handhabung zu vermeiden. Andere Chemikalien einschließlich CNTs und Tenside können bei RT gelagert werden, sondern halten sie vor direkter Sonneneinstrahlung schützen.
- Halten Lipide, also Dimodan U (DU) und Phytantriol (PT) bei RT für 15 bis 20 Minuten vor dem Öffnen der Flasche / Fläschchen Deckel, um Kondensation von Feuchtigkeit zu vermeiden.
(Anmerkung: DU ist ein destilliertes Glycerid, umfassend 96% Monoglyceride undRest sind Di- und freie Fettsäuren. Zwei Hauptkomponenten Monoglycerid in DU sind Linoleat (62%) und Oleat (25%). Daraus ergibt sich die hydrophobe Teil von DU enthält hauptsächlich C18-Ketten (91%), die genaue Zusammensetzung sich wie folgt ist; C18: 2 (61,9%), C18: 1 (24,9%) und C18: 0 (4,2%), wobei C18 18C-Kette und die Zahl nach dem Doppelpunkt anzeigt, zeigt die Anzahl von C = C-Bindungen. PT ist ein Gemisch von 3,7,11,15-Tetramethyl-1,2,3-hexadecantriol optische Isomere. Sie stellen keine Esterfunktion enthalten, aber aus stark verzweigten phytanyl Schwanz mit einem tri-hydroxy Kopfgruppe. Beide DU und PT bilden kubische Phasen in Gegenwart von überschüssigem Wasser, das ist auch der Fall für die Kerne von stabilisierten Lipidpartikel 13, 45). - Schmelzen Sie die Lipide von Fläschchen in ein heißes Wasserbad oder einen Becher mit Wasser gehalten über 60 ° C stellen (Heizung Magnetrührer: 230 V, 50 Hz, 630 W oder ähnliches verwendet werden, um das Wasser in einem Becher zu heizen).
- Alternativ Wärme Fläschchen Blockheizungen mit. erwärmen, um die Lipid nicht Fläschchen direkt auf der heißen Platte enthält, um Temperaturgradienten und anschließende Lipid Zersetzung zu vermeiden.
- Man wiegt 500 mg des geschmolzenen Lipids in zuvor gewogenen Mikrozentrifugenröhrchen (mit konischen Schnappkappe, 1,5 ml), einer Pasteurglaspipette mit einem Latex-Lampe verwendet wird.
- In 500 ml hochreinem Wasser (Wasserwiderstand = 18,2 M & Omega; · cm) zu der obigen Reaktionsgefäß.
- Mischen Sie die Komponenten manuell für 15 Minuten mit winzigen (custom-built) Spachtel. Machen Sie so einen Spatel durch das scharfe Ende einer Spritzennadel Abflachung (0,9 mm x 40 mm Kanülenlänge) mit einem Zangen.
- Zentrifuge der Lipid / Wasser-Gemisch für 10 min bei einer Geschwindigkeit von 2000 x g. rühren Mischung erneut manuell für 10 Minuten, dann Gleichgewicht kommen sie für 24 Stunden. Bevor die Proben Charakterisierung, rühren sie für 5 Minuten und dann bei Raumtemperatur lassen.
- Um die Bildung eines Gleichgewichts Lipidphase im gesamten Rohr gewährleisten, führen etwa 10 Frost-Tau-Zyklen und inte Durchführung rmittently einen Zentrifugationsschritt wie oben definiert. Sowohl die DU und PT Form hochviskose Masse Lipidphasen was es schwierig macht, sie zu handhaben manuell (Abbildung 1).
Hinweis: Die oben genannten Protokoll (Teil 1) ist nur notwendig, wenn ein Nanostrukturverhalten zu vergleichen möchten (Gittertyp und Dimensionen der Selbstorganisation) von verteilten Teilchen mit der Masse Lipidphase und / oder verwenden Sie es als eine Kontrolle der zu bestätigen Beibehaltung der ursprünglichen Nanostruktur.
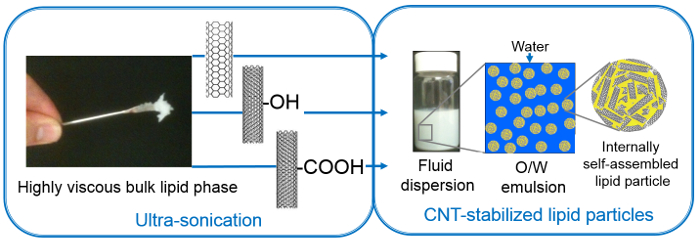
Abbildung 1. Herstellung von O / W-Emulsion mit Partikel flüssige Konsistenz von hochviskosen Lipidphase mit hohem Energieeintrag (Ultraschall) und verschiedenen CNT-Stabilisatoren verwendet, nämlich SWCNT, MWCNT-OH, MWCNT-COOH (Bild aus Referenzwiedergegeben [50] mit Genehmigung der Royal Society of Chemistry)._upload / 53489 / 53489fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
2. Herstellung von Surfactant Stabilisierte Lipidteilchen
- Bereiten einer 0,2% (w / w) oberflächenaktives Mittel (Pluronic F127) Lösung in Wasser.
- Man löst 200 mg des oberflächenaktiven Mittels (weißes flockiges Pulver) in 100 ml ultrareinem Wasser, indem sie es für 20-30 min (auf einer Magnetplatte mit einem magnetischen Rührstab verwendet wird) unter Rühren. Pluronic F127 ist ein nicht-ionisches oberflächenaktives Mittel und wird allgemein als Emulsionsstabilisator eingesetzt. Es ist ein Triblock-Copolymer aus PEO 99 -PPO 67 -PEO 99, und somit nimmt lange Zeit in Wasser auflösen.
- In 500 mg geschmolzenem DU oder PT in eine Glasampulle (einer Pasteurglaspipette) (Scintillation Kalk-Natron-ausgestattet mit einer Folie ausgekleidet Harnstoff Kappe, 20 ml).
- Hinzufügen 9,5 g der 0,2% F127 Lösung.
- Auf der Sonde Ultraschall-Maschine, fest klemmen stehen die Fläschchen zu der Retorte stehen Kiefer (Retorten Set mitstehen, Klemme, Base, Stange, Gummi 3-Backen und Muffe), so dass es die Schwingungen durch Ultraschall erzeugt standhalten kann.
- Legen Sie die feste Titan-Legierung Sonde (13 mm Durchmesser x 139 mm Länge), die an der Zell Sonicator. Höhe und Position des Fläschchens, um sicherzustellen, dass seine Seiten und dem Boden nicht mit der Sonde berühren. Ein Abstand von 0,5 cm zwischen der Sondenspitze und dem Boden der Glasampulle gute Ergebnisse.
- Beschallen das Gemisch 10 min in einem gepulsten Modus mit 1 sec Impuls um 1 sec-Verzögerungszeit bei 35% (der maximalen) Leistungs vermittelt. Das Fläschchen wird sehr heiß aufgrund der Hitze während der Beschallung erzeugten. Daher erlauben es auf RT abkühlen, bevor sie aus der Klemme nehmen.
- Bewahren Sie die milchig-gebildete Dispersion bei Raumtemperatur für mindestens 24 Stunden vor der weiteren Verwendung. Dies ist seine Stabilität gegenüber Phasentrennung zu gewährleisten.
Hinweis: Vor und nach der Verwendung der Sonde, kann es mit Aceton, trocken mit einem Papiertuch, dann spülen Sie es mit hochreinem Wasser eind trocknen es noch einmal.
3. Herstellung von Dispersionen der reinen CNTs in Wasser
- In zwei getrennten Becher, wiegen 4 mg in Pulverform MWCNT-OH und MWCNT-COOH, welche beide in der Farbe schwarz sind.
- In 500 ml hochreinem Wasser in jedes Becherglas. Ultraschallgerät mit einer Sonde, die Mischungen für 2 min in einer kontinuierlichen Impulsmodus bei 40% beschallen (der maximalen) Leistungs. Die resultierende Konzentration des MWCNT Dispersion 8 pg / ml (Stammlösung).
- Verdünnen Sie die MWCNT Stammlösung mit geeigneten Mengen an hochreinem Wasser zu erreichen, 6.25, 5, 4, 2 ug / ml MWCNT Dispersionen.
- Beschallen dieser Dispersionen, wie zuvor beschrieben (siehe 3.2).
- In ähnlicher Weise zerstreuen 3 mg Pulver SWCNT (auch in der Farbe schwarz) in 500 ml hochreinem Wasser, um eine 6 ug / ml SWCNT-Dispersion (Stammlösung) zu machen.
- Verdünnen Sie die SWCNT-Stammlösung und beschallen sie, wie oben beschrieben (siehe 3.2) 0.5 zu erhalten, 0,4, 0,3125, 0,2 ug / ml SWCNT dispersions.
Hinweis: Alle Dispersionen sind klar für etwa 30 Minuten, wonach die CNTs beginnen am Boden absetzen.
4. Herstellung von CNT-stabilisierte Nanostrukturierte Lipidteilchen (Abbildung 1)
- Wiegen in 500 mg des geschmolzenen DU in einem Glasfläschchen.
- Hinzufügen 9,5 ml der 6 & mgr; g / ml SWCNT Dispersion in das Fläschchen.
- Beschallen die CNT-DU Gemisch den gleichen Parametern wie für die Herstellung von reinen CNT-Dispersionen (siehe 3.2). Nach Abkühlen auf RT werden die CNT-stabilisierte Lipidpartikel mit konservierten intern selbstorganisierte Nanostruktur wird bereit sein.
- In ähnlicher Weise stellt die Lipidpartikel, die 0,4 & mgr; g / ml und 0,2 ug / ml SWCNT Dispersionen.
- Befolgen Sie die Protokolle 4.1 bis 4.4 auf Lipidpartikel mit MWCNT-OH und MWCNT-COOH aber mit unterschiedlichen Konzentrationen, nämlich 8, 4 und 2 ug / ml von CNT machen.
- Entsprechend wird drei verschiedenen CNT-PT-Dispersionen unter Verwendung von 4 ug / ml MWCNT-OH und MWCNT-COOH Sowie 0,4 ug / ml SWCNT. Beachten Sie, dass die CNT-PT Dispersionen benötigen weniger Leistung (35% des Maximums), aber längere Zeit (15 min) in einer kontinuierlichen Impulsmodus. Kühlen Sie die Dispersionen auf RT und lassen sie für 24 Stunden, bevor sie zu charakterisieren.
Hinweis: Die Beschallung Parameter für verschiedene Lipide unterscheiden kann (wie DU und PT hier) und für verschiedene Zusammensetzungen; sie müssen gut stabilisierte Dispersionen zu erreichen, optimiert werden.
5. Überwachung der Stabilität des CNT-stabilisierte Lipiddispersionen
- Überwachen Sie die Stabilität der Dispersionen durch visuelle Beobachtung: prüfen, ob die Dispersionen destabilisiert werden oder wenn Klumpen wurden in den Dispersionen gebildet.
- Machen Sie Fotos (mit Digitalkamera) in regelmäßigen Abständen. Nehmen Sie zum Beispiel Bilder von Dispersionen jeden Tag in der ersten Woche, dann jeden zweiten Tag für eine Woche einmal pro Woche für die nächsten zwei Wochen, gefolgt von, und schließlich einmal im Monat je nach Anforderung.
Ergebnisse
Die folgenden Ergebnisse für a) die Stabilität der Dispersionen, b) die Größenverteilung der Lipidpartikel, c) die Art der Selbstorganisation und d) den Nachweis für die Lipid-Beschichtung der CNTs. Die Stabilität von Dispersionen (Abbildung 2) wurde mit einem 5-Megapixel-Kamera mit Autofokus und LED-Blitz überwacht.

Figur 2 Schematische Darstellung CNT-Typen (A) MWCNT-OH, (B) MWCNT-COOH und (C) SWCNT und Bilder der entsprechenden Emulsionen. Stabile Emulsionen nur in einem bestimmten Bereich erhalten wurden (schraffiert), wo die CNT zu Lipid Verhältnis war optimal; unterhalb und oberhalb stabile Emulsion bilden nicht aufgrund einer zu geringen oder zu großen Menge an CNTs, respectively. Ein Pfeil zeigt eine typische CNT Klumpen in einer instabilen Emulsion. Diese Messungen wurden für eine Reihe von DU-CNT-Dispersionen durchgeführt; Representative diejenigen sind hier dargestellt (Abbildung von Referenzwiedergegeben [50] mit Genehmigung der Royal Society of Chemistry). Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Kleinwinkel-Röntgenstreuung (SAXS) Muster wurden aufgezeichnet, um die Gittertyp des inneren Nanostruktur der stabilisierten isasomes (3A) zu bestimmen. Die SAXSpace Kamera ist an einem analytischen X-ray-Erzeugungseinrichtungen (ISO-DEBYEFLEX3003) verbunden mit einer versiegelten Rohr Cu-Anode bei 40 kV und 50 mA arbeitet. Die Röntgenröhre wird mit einem geschlossenen Wasserkreislauf gekühlt. Die SAXSpace Kollimation Blockeinheit wandelt den divergierenden polychromatischen Röntgenstrahl in einen vertikal ausgerichtet linienförmige Strahl von Cu-K α-Strahlung mit einer Wellenlänge, λ, von 0,154 nm. Für die SAXS-Experimente wurde die hochauflösenden Modus gewählt, der permits eine minimale Streuvektor, q min, von 0,04 nm zu erkennen -1 (q = (4π / λ) sin &, wo 2θ der Streuwinkel ist). Ein halbtransparenter Strahlblende ermöglicht die abgeschwächte Primärstrahlprofil zur exakten Bestimmung des Nullstreuvektor und Übertragung Korrektur aufzuzeichnen. Jede der untersuchten Proben eingeschlossen ist in der gleichen vakuumdichten, wiederverwendbare 1 mm Quarzkapillare zu gewährleisten genau die gleiche Streuvolumen. Die Kapillare wurde in die temperaturgesteuerte Probentisch mit Peltierelementen ausgestattet war, der mit einem Wasserkühlthermostat verbunden ist die Beseitigung der überschüssigen Wärme zu erhalten. Alle Experimente wurden bei 25 ° C mit einer Temperaturstabilität von 0,1 ° C durchgeführt. Eine Vakuumpumpe wurde verwendet, um die Probenkammer einen Mindestdruck von ~ 1 mbar zu evakuieren erreichen. Die 1D Streumuster wurden mit einem Mikrostreifenröntgendetektor erfasst. Dieser Detektor ist Einzelphotonenzählung und hat eine sensitive Fläche von 64 × 8 mm 2, die 1280 Kanäle mit jeweils einer Kanalgröße von 0,05 x 8 mm (v × H). Die Probe-Detektor-Abstand war 317,09 mm. Jede Probe wurde für 300 sec dreimal ausgesetzt und ihre integrierte Streuprofile wurden gemittelt.
Die SAXStreat Software wurde verwendet, um die Streumuster in Bezug auf die Position des Primärstrahls zu korrigieren. Die SAXS-Daten war die weitere Übertragung korrigierten durch das gedämpfte Streuintensität bei q = 0 eingestellt, um die Einheit und der Hintergrund wurde mit der SAXSQuant Software abgezogen. Der Streuvektor q wurde mit Silber-Behenat kalibriert, die eine bekannte Gitterabstand von 5,84 nm 69 hat. Alle aufgezeichneten Beugungsmuster könnte mit der Raumgruppe Pn3m (diamond bikontinuierliche kubische Phase) indiziert werden, in denen die 110, 111, 200, 211, 220 und 221 Reflexionen wurden (3A) identifiziert. der lattice Parameter wurde ein für Pn3m Phase durch lineare Regression bestimmt die folgende Gleichung Gitter Anwendung
a = 2 π / q hkl × √ (h 2 + k 2 + l 2) (1)
worin h, k und l sind die Miller-Indizes.
Die Größe und die Größenverteilung der dispergierten Lipidteilchen (3B) wurden unter Verwendung eines Laser-Partikelgröße analyer bestimmt.
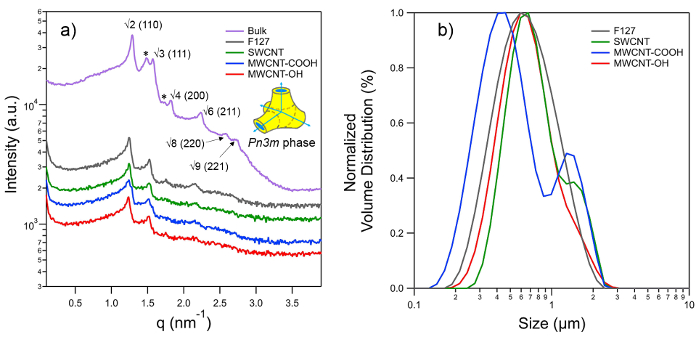
Abbildung 3. (A) SAXS Muster der Pn3m Phase für Schütt Phytantriol beobachtet (PT) und Dispersionen hergestellt mit 5 Gew% PT in überschüssiges Wasser F127 und verschiedene Stabilisatoren CNT entspricht. Die 3-D-Schaltung auf der rechten Seite zeigt einen Teil der Elementarzelle von Pn3m Phase gezeigt Diagramm, das eine bikontinuierliche kubische Phase, deren Struktur basiert auf Double Diamond (D) geben Minimalfläche. Blaue Pfeile zeigen wässrige Kanäle Treffen in Tetraederwinkel während hydrophobe und wässrige Regionen sind in Farbe Gelb und Blau. Charakteristische Peaks für Pn3m Phase als √2 indiziert, √3, √4, √6, √8, √9 und entsprechenden Miller-Indizes sind in den Klammern angegeben. Alle der oben genannten Spitzen sind in Schütt PT sichtbar, während die ersten vier Reflexionen für den Dispersionen sichtbar sind; dennoch ist dies ausreichend, um die Pn3m Nanostrukturen zu identifizieren und ihre Gitterparameter auszuwerten. Peaks hervorgehoben by Sternchen zeigen die Koexistenz von Ia3d Typ kubischen Phase, die in der Regel mit einer geringeren Wassergehalt bildet, und somit nicht für Dispersionen gesehen. Lipidpartikel mit 'cubic Nanostruktur "in ihrem Inneren sind gemeinhin als" cubosomes "genannt. (B) Größenverteilung von cubosomes vorbereitet verschiedene Stabilisatoren verwendet als durch statische Lichtstreuung gemessen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Die Wechselwirkungen zwischen den CNTs und Lipidpartikel wurden unter Verwendung von Raman-Spektroskopie (Figur 4) untersucht. Die Proben: CNTs, Lipid und CNT-stabilisierte Lipidpartikel wurden dehydratisiert, erste Stickstoffgas und dann, indem sie in einem Vakuum-Exsikkator für etwa 20 min gehalten wird. Die Spektren wurden unter Verwendung eines Horiba Jobin-Yvon LabRAM HR800 Spektrometer mit einem Andor ausgestattet aufgezeichnet Elektro Charged Coupled Device (CCD) zur Lichtdetektion und eine Videokamera Spektralsammlung zu führen. Ein 532 nm Erregungsleitung des Nd: YAG-Laser wurde Spektren im Bereich von 100-4,000 cm zu sammeln genutzt - ein mit einem Gitter von 600 g mit mm - 1 bei 750 nm Blaze.. 50X großen Arbeitsabstand Objektiv mit einer numerischen Apertur von 0,50 wurde verwendet, um die Spektren und die konfokale Loch bei 100 & mgr; m gesetzt zu erwerben. Vor den Messungen wurde das Gerät an die 520,8 cm kalibriert - 1 Spektrallinie von Silizium. Alle Spektren wurden bei RT (25 ° C) aufgefangen, indem die Probe auf Calciumfluorid Folien setzt. Spektren wurden mit dem 532 nm Laser erworben und akkumuliert 5-mal mit 1% Exposition für 10 sec. LabSpec 6 Spektroskopie-Software-Suite für die Vorverarbeitung der Rohdaten und sofortige Datenabfrage verwendet.
ftp_upload / 53489 / 53489fig4.jpg "/>
Abbildung 4. Raman-Spektren für dehydriert (A) reine Lipid, MWCNT-COOH und CNT-stabilisierte Lipidnanopartikel, die 5,0 ug / ml MWCNT-COOH, (B) reine Lipid, MWCNT-OH und Lipidnanopartikel, die 5,0 ug / ml MWCNT- OH, und (C) reine Lipid, SWCNT und Lipidnanopartikel 0,3125 ug / ml SWCNT enthält. Alle Kurven stellen einen Durchschnitt von zehn Spektren wo Intensitäten in willkürlichen Einheiten gegen die Wellenlänge aufgetragen. Vertikale Linien werden verwendet, um das Auge zu führen, und die Detektion des blauen Verschiebungen in der G und G 'Bands zu erleichtern. Diese Experimente wurden für DU durchgeführt. (D) Schematische Darstellung der möglichen Lipid Dekoration (Selbstorganisation) auf CNT Oberfläche (Abbildung von Referenzwiedergegeben [50] mit Genehmigung der Royal Society of Chemistry). Bitte klicken Sie hier, um view eine größere Version dieser Figur.
Diskussion
Stabilisierung von Lipidteilchen
Drei verschiedene CNTs werden verwendet, um die Lipiddispersionen zu stabilisieren; zwei davon sind mehrwandige und mit -OH und -COOH-Gruppen funktionalisiert sind, und eine einwandige und nicht funktionalisierten (unberührte) ist. Die CNTs in der Größe variiert wie folgt (Durchmesser x Länge): MWCNT-COOH: 9,5 nm x 1,5 um; MWCNT-OH: 8-15 nm x 50 & mgr; m; SWCNT: 1-2 nm x 1-3 um. Die pulverisierten CNTs wurden in Wasser durch die Sonde Ultraschallbehandlung dispergiert. Vorgenannte Größen von CNTs sind wahrscheinlich weiter durch Ultraschallbehandlung zu verringern, wenn auch ungleichmäßig. CNT-Dispersionen in reinem Wasser begann nach etwa 20 Minuten trennen, damit die weitere Arbeit in dieser Zeit also, die Zugabe von Lipiden und zweite Ultraschallbehandlung durchgeführt wurde. Letztere (Ultraschall auf den Lipid-CNT Mischungen durchgeführt) hilft beim Schmelzen und groß und inkonsistent Lipiddomänen während der Flüssigkeitszufuhr in Sub-Mikron-Abschnitten gebildet brechen. Dispergieren des Schüttlipid in diese Weise erleichtert das Gleichgewicht Bildung von selbstorganisierten Nanostrukturen, die sonst strengen Frost-Tau-Zyklen und / oder lange Zeit (Tage bis Wochen) erfordert. Die Masse Lipidphase bricht in Nanopartikel während die lipidbeschichteten CNTs angeblich bilden Schalen um sie herum. Ultraschallbehandlung verbessert die hydrophoben Wechselwirkungen zwischen den CNTs und den Alkylketten von Lipidmolekülen dadurch CNTs durch Lipid Alkylketten dekorieren. So beschichteten CNTs stabilisieren die fragmentierte Lipidphase, die zu einer Partikelemulsion. Diese gegenseitige Stabilisierung verhindert die Aggregation von CNT sowie die Lipidpartikel verteilt. Solche Dispersionen sind auch Pickering (aufgrund der Verwendung von Feststoffpartikeln) Typ Öl-in-Wasser (O / W) Emulsionen genannt, in denen die Lipide eine "Ölphase" bilden, während 'überschüssige Wasser' bildet die kontinuierliche Emulsionsmittel (Abbildung 1 ). Ultraschall-Parameter (Impulslänge, Laufzeit und Leistung), physikalisch-chemischen Parameter eines Stabilisators(Beispielsweise Abmessungen, Funktionalisierung), der Konzentration der dispergierten Phase und der Zusammensetzung der Dispersion (beispielsweise CNT zu Lipid-Verhältnis) sind entscheidend für die endgültige Stabilität der Dispersionen zu gewährleisten und müssen daher für unterschiedliche (Lipid) Systeme optimiert werden.
Optimierung von CNT zu Lipid-Verhältnis für stabile Emulsionen
Eine breite Palette von Konzentrationen für die einzelnen CNT-Typ (Abbildung 2) wurde eingesetzt, um die selbstorganisierte Nanostrukturen aus zwei verschiedenen Lipiden erhalten zu stabilisieren. Jedoch homogene und stabile Emulsionen sind nur in einem bestimmten Bereich von CNT zu Lipid-Verhältnis gebildet wird; zu hohe Verhältnisse verursachen Aggregation von CNTs, während eine zu niedrige Verhältnisse zu instabilen Emulsionen führen, weil es nicht genug CNTs sind eine ausreichende Partikel-Flächendeckung zu erreichen. Beste Stabilisierungsbedingungen wurden mit Konzentrationen zwischen 3-5 ug / ml für MWCNT-COOH und MWCNT-OH gefunden, während für SWCNT im Bereich von 0,3-0,45& mgr; g / ml.
Morphologische Charakterisierung von Lipidpartikeln
Die SAXS-Messungen überprüfen, ob die Lipidpartikel von PT der ursprünglichen kubischen Phase Nanostruktur beibehalten (durch Massenphase gezeigt) (3A). Wir gehen davon aus, dass die kubische Phase auch im Falle von DU-Partikel zurückgehalten wird, aber dies eine weitere Bestätigung braucht, da es nicht in der aktuellen Arbeit wurde untersucht. Der Gitterparameter für Massen Pn3m Phase der PT beobachtet wird, ist 6,84 nm, die bei der Dispergierung steigt auf 7,1 nm. Die untere Gitterparameter für Schütt Phase wird auf das Fehlen von überschüssigem Wasser zugeschrieben, die auch durch die Koexistenz von Ia3d Phase (Peaks mit * gekennzeichneten in 3A) bestätigt werden kann. Die Ia3d Phase wird in der Regel unter Bedingungen begrenzten Wassers gefunden. Die Gitterparameter für Pn3m Phase für alle dispergierten Lipidpartikel beobachtet (dh durch Tensid stabilisiert sowie von allen Arten CNT) sind practicallY gleich anzeigt überschüssiges Wasser Bedingungen. Dies schließt auch die Möglichkeit einer CNT-driven Störungen auf molekularer Ebene, die sonst haben eine Veränderung der Lipidphase ausgelöst könnte.
Die Größenverteilungen der cubosomes werden von den volumengewichteten Verteilung gegeben, wie in 3B gezeigt. Obwohl die CNT-stabilisierte Teilchen mit einer breiten Größenverteilung anzuzeigen, Mehrheit der Teilchen weisen Größen zwischen 532-760 nm, die der Größe vergleichbar sind an Tensid Lipidteilchen (674 nm) stabilisiert.
Lipid-Beschichtung von CNTs
Für reine CNTs, typischen Raman-Graphit-Bands sind in der Raman-Spektren zu sehen. Die G-Bande, die von "CC-Bindung", der D-Bande (nicht dargestellt) mit dem in-plane Schwingung entspricht, die aufgrund des Vorhandenseins von Störungen in Kohlenstoff Systeme ist und das Band 'G, die der Oberton der D-Bande zugeordnet wird 70 sind deutlich zu beobachten. Nach interactiauf der CNT mit Lipid und auf die Bildung von CNT-stabilisierte Lipidpartikel (vgl grüne und blaue Kurven in Abbildung 4), eine Verschiebung zu höheren Wellenzahlen (Blauverschiebung) beobachtet. Die beobachtete Blauverschiebung, könnte darauf zurückzuführen sein: i) Hochdruck an CNTs während Ultraschall ausgeübt in ihre Dispersion führt, wie zu einem gebündelten Zustand entgegengesetzt, wenn reines 70,71, und / oder ii) Wechselwirkungen zwischen CNTs und Lipidmolekülen durch Beschichtung von CNTs von Lipiden (wie Blauverschiebung hat nach Douroumis et al zuvor berichtet worden. 72 für die Lipid-beschichteten SWCNT).
Die Abnahme der relativen Intensitäten von CNT Peaks und das Aussehen der Lipidsignale (von rot Kurven von reinem Lipid (4) ferner die Beschichtung von CNTs durch Lipidmoleküle bestätigt. Dies legt nahe, daß die hydrophoben Wechselwirkungen zwischen CNTs und Alkylketten von Lipidmolekülen der dekorieren CNT Oberfläche in einer Weise, die hydrophile Kopfgruppen so wässrigen Regionen stehen StabiliZing O / W-Emulsion, wie in Abbildung 4D das Schema.
Wir haben eine intelligente und einfache Methode der kinetisch Stabilisierung der O / W-Emulsion von nanostrukturierten Lipidpartikel mit verschiedenen CNT demonstriert. Sehr geringe Konzentrationen (<10 pg / ml) von CNTs sind ausreichend, um die Lipid-Nanopartikel-Dispersion zu stabilisieren, die für in vivo-Anwendungen speziell vielversprechend. Dekoration von CNTs durch Lipidmoleküle wird erwartet, ihre Toxizität zu minimieren, während die Biokompatibilität zu verbessern. Die Aussicht auf das Laden funktionelle Moleküle innerhalb der Lipidselbstorganisation als auch auf der Oberfläche bereitzustellen CNT unbegrenzte Potential an die CNT-stabilisierte Lipidpartikel im Bereich der biomedizinischen Wissenschaften insbesondere im Rahmen von Kombinationstherapien gegen schwere Krankheiten 73.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir möchten Dr. Matthew J. Baker, jetzt an der University of Strathclyde, Glasgow für die Unterstützung bei Raman-Experimente und Herr Nick Gaunt für seine früheren Arbeiten dieses Projektes zu danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Dimodan U | Danisco | 15312 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Phytantriol (> 95%, GC) | TCI Europe N.V. | P1674 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Single walled Carbon Nanotubes (90%) | Nanostructured & Amorphous Materials, Inc. | 1246YJS | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Multi-walled carboxylic acid functionalized Carbon Nanotubes (> 80% Caron basis, > 8% carboxylic acid functionalized) | Sigma-Aldrich Co. LLC | 755125 | Store at room temperature. Away from direct light. Causes serious eye irritation. May cause respiratory irritation. |
| Graphitized Multi-walled hydroxy functionalized Carbon Nanotubes (99.9%) | Nanostructured & Amorphous Materials, Inc. (NanoAmor) | 1224YJF | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Pluronic F127 | Sigma-Aldrich Co. LLC | P2443 | BioReagent, suitable for cell culture. Not a hazardous substance or mixture. Store at room temperature. |
| Acetone (99.5%) | Fisher Scientific | 10134100 | Highly flammable liquid. Causes serious eye irritation. May cause drowsiness or dizziness. |
| Jars with loose, enfolding lids (375 ml) | VWR International Ltd | 216-3308 | |
| Beaker, 1,000 ml | Fisher Scientific | 12942161 | heavy duty, low form, with spout and graduations |
| Pasteur glass pipette (150 mm length) with latex bulb | Fisher Scientific | 10006021 | |
| Microcentrifuge tube conical snap cap 1.5 ml | Fisher Scientific | 11558232 | |
| Spatula | Fisher Scientific | 11352204 | |
| Heating magnetic stirrer | Fisher Scientific | 11715704 | |
| Magnetic stirrer bars (cylindrical, opaque PTFE, 30 mm x 7 mm (l x diameter)) | Fisher Scientific | 10011792 | |
| Needle (0.9 mm x 40 mm cannula length) | Terumo UK Ltd | MN-2038MQ | |
| Retort Stand Set - With stand, clamp, base, rod, rubber 3 jaw and bosshead | Camlab Ltd, UK | 1177157 | |
| Millipore water equipment | Barnstead Nanopure, Thermoscientific, USA | ||
| Progen Genfuge 24D Digital Microcentrifuge | Progen Scientific | C-2400 | |
| Probe ultra-sonicator, with 13 mm | SONICS, Vibracell, USA | ||
| 5 MP camera with auto-focus and LED flash | Samsung Galaxy Fame Mobile camera | ||
| Raman Spectrometer | Horiba Jobin-Yvon LabRAM HR800 spectrometer | ||
| Mastersizer 3000 | Malvern Instruments Ltd, Malvern, United Kingdom | ||
| Small angle X-ray scattering (SAXS) | SAXSpace camera (Anton Paar, Graz, Austria), X-ray generating equipment (ISO-DEBYEFLEX3003, GE Inspection Technologies GmbH), closed water circuit (Chilly 35, HYFRA, Germany). |
Referenzen
- Peer, D., et al. Nanocarriers as an emerging platform for cancer therapy. Nature Nanotech. 2, 751-760 (2007).
- White, R. R., Sullenger, B. A., Rusconi, C. P. Developing aptamers into therapeutics. J. Clin. Invest. 106, 929-934 (2000).
- Itaka, K., Chung, U. I., Kataoka, K. Supramolecular nanocarrier for gene and siRNA delivery. Nippon Rinsho Jpn. J. Clin. Med. 64, 253-257 (2006).
- Xu, S., et al. Development of pH-responsive core-shell nanocarriers for delivery of therapeutic and diagnostic agents. Bioorg. Med. Chem. Lett. 19, 1030-1034 (2009).
- Soppimath, K. S., Tan, D. C. W., Yang, Y. Y. pH-triggered thermally responsive polymer core-shell nanoparticles for drug delivery. Adv. Mater. 17, 318-323 (2005).
- Hans, M., Lowman, A. Biodegradable nanoparticles for drug delivery and targeting. Curr. Opin. Solid State Mater. Sci. 6, 319-327 (2002).
- Petros, R. A., DeSimone, J. M. Strategies in the design of nanoparticles for therapeutic applications. Nat Rev Drug Discov. 9, 615-627 (2010).
- Torchilin, V. P. Multifunctional nanocarriers. Adv Drug Deliver Rev. 64, 302-315 (2012).
- Shmeeda, H., et al. Delivery of zoledronic acid encapsulated in folate-targeted liposome results in potent in vitro cytotoxic activity on tumor cells. J. Controlled Release. 146, 76-83 (2010).
- Xu, Z., et al. The performance of docetaxel-loaded solid lipid nanoparticles targeted to hepatocellular carcinoma. Biomaterials. 30, 226-232 (2009).
- Rosenthal, E., et al. Phase IV study of liposomal daunorubicin (DaunoXome) in AIDS-related Kaposi sarcoma. Am. J. Clin. Oncol.-Canc. 25, 57-59 (2002).
- Dong, Y. D., Larson, I., Bames, T. J., Prestidge, C. A., Boyd, B. J. Adsorption of Nonlamellar Nanostructured Liquid-Crystalline Particles to Biorelevant Surfaces for Improved Delivery of Bioactive Compounds. Acs Appl Mater Inter. 3, 1771-1780 (2011).
- Rizwan, S. B., Boyd, B. J., Rades, T., Hook, S. Bicontinuous cubic liquid crystals as sustained delivery systems for peptides and proteins. Expert Opin. Drug. Deliv. 7, 1133-1144 (2010).
- Yoo, H. S., Park, T. G. Folate receptor targeted biodegradable polymeric doxorubicin micelles. J. Controlled Release. 96, 273-283 (2004).
- Khandare, J. J., et al. Dendrimer versus linear conjugate: Influence of polymeric architecture on the delivery and anticancer effect of paclitaxel. Bioconjug. Chem. 17, 1464-1472 (2006).
- Prabaharan, M., Grailer, J. J., Pilla, S., Steeber, D. A., Gong, S. Gold nanoparticles with a monolayer of doxorubicin-conjugated amphiphilic block copolymer for tumor-targeted drug delivery. Biomaterials. 30, 6065-6075 (2009).
- Fan, J., et al. Targeted anticancer prodrug with mesoporous silica nanoparticles as vehicles. Nanotechnology. 22, (2011).
- Bianco, A., Prato, M. Can carbon nanotubes be considered useful tools for biological applications? Adv. Mater. 15, 1765-1768 (2003).
- Kam, N. W. S., Dai, H. J. Carbon nanotubes as intracellular protein transporters: Generality and biological functionality. J. Am. Chem. Soc. 127, 6021-6026 (2005).
- Kulkarni, C. V. Lipid crystallization: from self-assembly to hierarchical and biological ordering. Nanoscale. 4, 5779-5791 (2012).
- Yaghmur, A., et al. Drug Formulations Based on Self-Assembled Liquid Crystalline Nanostructures. , CRC Press. 341-360 (2014).
- Kulkarni, C. V. Advances in Planar Lipid Bilayers and Liposomes. 12, Academic Press. 237-272 (2010).
- Landau, E. M., Navarro, J. V. US Pat. , US2001/025791A1 (2001).
- Kulkarni, C., Belsare, N., Lele, A. Studies on shrikhand rheology. J. Food Eng. 74, 169-177 (2006).
- Mezzenga, R., Schurtenberger, P., Burbidge, A., Michel, M. Understanding foods as soft materials. Nature Mater. 4, 729-740 (2005).
- Ubbink, J., Burbidge, A., Mezzenga, R. Food structure and functionality: a soft matter perspective. Soft Matter. 4, 1569-1581 (2008).
- Dong, Y. D., Larson, I., Hanley, T., Boyd, B. J. Bulk and dispersed aqueous phase behavior of phytantriol: effect of vitamin E acetate and F127 polymer on liquid crystal nanostructure. Langmuir. 22, 9512-9518 (2006).
- Yaghmur, A., Glatter, O. Characterization and potential applications of nanostructured aqueous dispersions. Adv. Colloid Interface Sci. 147, 333-342 (2009).
- Pardeike, J., Hommoss, A., Müller, R. H. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products. Int. J. Pharm. 366, 170-184 (2009).
- Yaghmur, A., Rappolt, M., Østergaard, J., Larsen, C., Larsen, S. W. Characterization of bupivacaine-loaded formulations based on liquid crystalline phases and microemulsions: the effect of lipid composition. Langmuir. 28, 2881-2889 (2012).
- Singh, H., Ye, A., Horne, D. Structuring food emulsions in the gastrointestinal tract to modify lipid digestion. Prog. Lipid Res. 48, 92-100 (2009).
- Angelova, A., Angelov, B., Mutafchieva, R., Lesieur, S., Couvreur, P. Self-Assembled Multicompartment Liquid Crystalline Lipid Carriers for Protein, Peptide, and Nucleic Acid Drug Delivery. Accounts Chem. Res. 44, 147-156 (2011).
- Clogston, J., Caffrey, M. Controlling release from the lipidic cubic phase. Amino acids, peptides, proteins and nucleic acids. J. Controlled Release. 107, 97-111 (2005).
- Shah, J. C., Sadhale, Y., Chilukuri, D. M. Cubic phase gels as drug delivery systems. Adv. Drug Deliver. Rev. 47, 229-250 (2001).
- Boyd, B. J., Whittaker, D. V., Khoo, S. M., Davey, G. Lyotropic liquid crystalline phases formed from glycerate surfactants as sustained release drug delivery systems. Int. J. Pharm. 309, 218-226 (2006).
- Drummond, C. J., Fong, C. Surfactant self-assembly objects as novel drug delivery vehicles. Curr. Opin. Colloid Interface Sci. 4, 449-456 (1999).
- Zhao, X. Y., Zhang, J., Zheng, L. Q., Li, D. H. Studies of cubosomes as a sustained drug delivery system. J. Dispersion Sci. Technol. 25, 795-799 (2004).
- Malmsten, M. Phase transformations in self-assembly systems for drug delivery applications. J. Dispersion Sci. Technol. 28, 63-72 (2007).
- Sadhale, Y., Shah, J. C. Stabilization of insulin against agitation-induced aggregation by the GMO cubic phase gel. Int. J. Pharm. 191, 51-64 (1999).
- Amar-Yuli, I., Azulay, D., Mishraki, T., Aserin, A., Garti, N. The role of glycerol and phosphatidylcholine in solubilizing and enhancing insulin stability in reverse hexagonal mesophases. J. Colloid Interface Sci. 364, 379-387 (2011).
- Rappolt, M. Advances in planar lipid bilayers and liposomes. Leitmannova Liu, A. 5, Elsevier Inc. Amsterdam. 253-283 (2006).
- Rappolt, M., Cacho-Nerin, F., Morello, C., Yaghmur, A. How the chain configuration governs the packing of inverted micelles in the cubic Fd 3 m-phase. Soft Matter. 9, 6291-6300 (2013).
- Kulkarni, C. V., Wachter, W., Iglesias-Salto, G., Engelskirchen, S., Ahualli, S. Monoolein: a magic lipid? Phys. Chem. Chem. Phys. 13, 3004-3021 (2011).
- Yaghmur, A., de Campo, L., Sagalowicz, L., Leser, M. E., Glatter, O. Emulsified Microemulsions and Oil-Containing Liquid Crystalline Phases. Langmuir. 21, 569-577 (2005).
- Kulkarni, C. V., Glatter, O. Ch. 6. Self-Assembled Supramolecular Architectures: Lyotropic Liquid Crystals.Surface and Interfacial Chemistry. Nissim, G. , John Wiley & Sons, Inc. (2012).
- Salonen, A., Muller, F. O., Glatter, O. Internally Self-Assembled Submicrometer Emulsions Stabilized by Spherical Nanocolloids: Finding the Free Nanoparticles in the Aqueous Continuous Phase. Langmuir. 26, 7981-7987 (2010).
- Guillot, S., Bergaya, F., de Azevedo, C., Warmont, F., Tranchant, J. F. Internally structured pickering emulsions stabilized by clay mineral particles. J. Colloid Interface Sci. 333, 563-569 (2009).
- Muller, F., Salonen, A., Glatter, O. Monoglyceride-based cubosomes stabilized by Laponite: Separating the effects of stabilizer, pH and temperature. Colloids Surf., A. 358, 50-56 (2010).
- Salonen, A., Muller, F. O., Glatter, O. Dispersions of Internally Liquid Crystalline Systems Stabilized by Charged Disklike Particles as Pickering Emulsions: Basic Properties and Time-Resolved. Langmuir. 24, 5306-5314 (2008).
- Gaunt, N. P., Patil-Sen, Y., Baker, M. J., Kulkarni, C. V. Carbon nanotubes for stabilization of nanostructured lipid particles. Nanoscale. 7, 1090-1095 (2015).
- Pickerings, S. U. Emulsions. J. Chem. Soc. 91, (2001).
- Ramsden, W. Separation of Solids in the Surface-Layers of Solutions and 'Suspensions' (Observations on Surface-Membranes, Bubbles, Emulsions, and Mechanical Coagulation). -- Preliminary Account. Proceedings of the Royal Society of London. 72, 156-164 (1903).
- Lin, Y., et al. Advances toward bioapplications of carbon nanotubes. J. Mater. Chem. 14, 527-541 (2004).
- Saito, N., et al. Safe Clinical Use of Carbon Nanotubes as Innovative Biomaterials. Chem. Rev. 114, 6040-6079 (2014).
- Pulskamp, K., Diabate, S., Krug, H. F. Carbon nanotubes show no sign of acute toxicity but induce intracellular reactive oxygen species in dependence on contaminants. Toxicol. Lett. 168, 58-74 (2007).
- Smart, S. K., Cassady, A. I., Lu, G. Q., Martin, D. J. The biocompatibility of carbon nanotubes. Carbon. 44, 1034-1047 (2006).
- Colvin, V. L. The potential environmental impact of engineered nanomaterials. Nat. Biotechnol. 21, 1166-1170 (2003).
- Firme, C. P., Bandaru, P. R. Toxicity issues in the application of carbon nanotubes to biological systems. Nanomed-Nanotechnol. 6, 245-256 (2010).
- Haddon, R. C. Carbon nanotubes. Accounts Chem. Res. 35, 997-997 (2002).
- Kapralov, A. A., et al. Adsorption of Surfactant Lipids by Single-Walled Carbon Nanotubes in Mouse Lung upon Pharyngeal Aspiration. Acs Nano. 6, 4147-4156 (2012).
- Wallace, E. J., Mark, S. P. S. Carbon nanotube self-assembly with lipids and detergent: a molecular dynamics study. Nanotechnology. 20, 045101(2009).
- George, R. B. Chest medicine: essentials of pulmonary and critical care medicine. Lippincott Williams & Wilkins. , (2005).
- Monteiro-Riviere, N. A., Nemanich, R. J., Inman, A. O., Wang, Y. Y., Riviere, J. E. Multi-walled carbon nanotube interactions with human epidermal keratinocytes. Toxicol. Lett. 155, 377-384 (2005).
- Shvedova, A., et al. Exposure to carbon nanotube material: assessment of nanotube cytotoxicity using human keratinocyte cells. J. Toxicol. Env. Heal. A. 66, 1909-1926 (2003).
- Jia, G., et al. Cytotoxicity of carbon nanomaterials: single-wall nanotube, multi-wall nanotube, and fullerene. Environ. Sci. Technol. 39, 1378-1383 (2005).
- Sato, Y., et al. Influence of length on cytotoxicity of multi-walled carbon nanotubes against human acute monocytic leukemia cell line THP-1 in vitro and subcutaneous tissue of rats in vivo. Mol. BioSyst. 1, 176-182 (2005).
- Bottini, M., et al. Multi-walled carbon nanotubes induce T lymphocyte apoptosis. Toxicol. Lett. 160, 121-126 (2006).
- Cui, D., Tian, F., Ozkan, C. S., Wang, M., Gao, H. Effect of single wall carbon nanotubes on human HEK293 cells. Toxicol. Lett. 155, 73-85 (2005).
- Huang, T., Toraya, H., Blanton, T., Wu, Y. X-ray powder diffraction analysis of silver behenate, a possible low-angle diffraction standard. J. Appl. Crystallogr. 26, 180-184 (1993).
- Bokobza, L., Zhang, J. Raman spectroscopic characterization of multiwall carbon nanotubes and of composites. Express Polym. Lett. 6, 601-608 (2012).
- Zhao, Q., Wagner, H. D. Raman spectroscopy of carbon-nanotube-based composites. Philos. Trans. R. Soc. London, Ser. A -Math. Phys. Eng. Sci. 362, 2407-2424 (2004).
- Douroumis, D., Fatouros, D. G., Bouropoulos, N., Papagelis, K., Tasis, D. Colloidal stability of carbon nanotubes in an aqueous dispersion of phospholipid. Int. J. Nanomed. 2, 761-766 (2007).
- Worthington, R. J., Melander, C. Combination approaches to combat multidrug-resistant bacteria. Trends Biotechnol. 31, 177-184 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten