Method Article
Preparación fácil del ensamblado autónomos Internamente Lípidos Las partículas estabilizadas por nanotubos de carbono
En este artículo
Resumen
We report on a smart application of carbon nanotubes for kinetic stabilization of lipid particles that contain self-assembled nanostructures in their cores. The preparation of lipid particles requires rather low concentrations of carbon nanotubes permitting their use in biomedical applications such as drug delivery.
Resumen
Se presenta un método fácil para preparar partículas lipídicas nanoestructurados estabilizados por nanotubos de carbono (CNT). De una sola pared (prístina) y de paredes múltiples (funcionalizados) CNTs se utilizan como estabilizadores para producir emulsiones (O / W) de tipo Pickering aceite-en-agua. Los lípidos a saber, Dimodan U y fitantriol se utilizan como emulsionantes, que en el exceso de agua se autoensamblan en la fase Pn3m cúbica bicontinua. Esta fase altamente viscoso se fragmenta en partículas más pequeñas utilizando una sonda de ultrasonidos en presencia de estabilizadores de agentes tensioactivos convencionales o nanotubos de carbono como se hizo aquí. Inicialmente, los nanotubos de carbono (forma de polvo) se dispersan en agua seguido de nuevo de ultrasonidos con el lípido fundido para formar la emulsión final. Durante este proceso los NTC quedan recubiertas con moléculas de lípidos, que a su vez se presume para rodear las gotitas de lípidos para formar una emulsión de partículas que es estable durante meses. El tamaño medio de las partículas lipídicas estabilizadas nanoestructurados-CNT está en el submicrónico range, lo que se compara bien con las partículas estabilizadas usando agentes tensioactivos convencionales. Pequeño datos de ángulo de dispersión de rayos X confirma la retención de la fase cúbica Pn3m original en las dispersiones de lípidos estabilizadas-CNT en comparación con la fase lipídica pura (estado a granel). desplazamiento al azul y el descenso de las intensidades en G característica y bandas de CNTs observados en la espectroscopia Raman G 'caracterizar la interacción entre la superficie y de lípidos moléculas CNT. Estos resultados sugieren que las interacciones entre los nanotubos de carbono y los lípidos son responsables de su estabilización mutua en soluciones acuosas. Como las concentraciones de nanotubos de carbono empleados para la estabilización son muy bajos y las moléculas de lípidos son capaces de funcionalizar los NTC, se espera que la toxicidad de los CNT a ser insignificante, mientras que su biocompatibilidad es mucho mayor. Por lo tanto el presente enfoque encuentra un gran potencial en diversas aplicaciones biomédicas, por ejemplo, para el desarrollo de sistemas de nanotransportador híbridos para la entrega de multiple moléculas funcionales como en la terapia de combinación o politerapia.
Introducción
Durante las últimas décadas, la nanotecnología se ha convertido en una herramienta poderosa en especial en el campo de desarrollo preclínico de medicamentos para combatir enfermedades como el cáncer notorios 1. En este contexto, las estructuras a nanoescala con un tamaño de <1000 nm son ampliamente explorada como vehículo de administración de diversas biomoléculas activas tales como fármacos, proteínas, ácidos nucleicos, genes y agentes de diagnóstico por imagen 1-4. Estas biomoléculas se encapsulan ya sea dentro de las nanopartículas o conjugarse en la superficie de las nanopartículas y se liberan en el sitio de acción de los factores desencadenantes tales como el pH o la temperatura 5,6. Aunque es extremadamente pequeño en tamaño, la gran superficie de estas nanopartículas resulta ser muy ventajoso para la administración dirigida de biomoléculas activas. El control sobre el tamaño de partícula y la biocompatibilidad es de suma importancia con el fin de optimizar la eficacia terapéutica y por lo tanto, la aplicabilidad de las nanopartículas 7,8.Los lípidos 9-13, polímeros, metales 14,15 16,17 18,19 y nanotubos de carbono se han empleado comúnmente como nanoportadores para diversas aplicaciones biomédicas y farmacéuticas.
Por otra parte, las aplicaciones nanotransportador basados en nanoestructuras autoensambladas lípidos tienen una gran importancia en muchas otras disciplinas, incluyendo las industrias de cosméticos y alimentos 20,21. Por ejemplo, se utilizan en la cristalización de proteínas 22, la separación de biomoléculas 23, como estabilizadores de alimentos, por ejemplo, en los postres 24, y en la entrega de moléculas activas, tales como nutrientes, sabores y perfumes 25-31. Nanoestructuras de lípidos autoensambladas no sólo tienen la capacidad de liberar moléculas bioactivas de una manera controlada y selectiva 32-38 sino que también son capaces de proteger las moléculas funcionales de química y enzimática degradación 39,40. Aunque bicapa planar fluido es el más commen nanoestructura formada por moléculas de lípidos anfifílicos en presencia de agua, otras estructuras tales como hexagonal y cúbica también se observan comúnmente 20,41,42. El tipo de nanoestructura formada depende de la estructura de la forma molecular de los lípidos ', la composición de lípidos en agua, así como de las condiciones físico-químicas empleadas tales como la temperatura y la presión 43. La aplicabilidad de nanoestructuras de lípidos no planas especialmente la de las fases cúbicas, está restringido debido a su alta viscosidad y la consistencia de dominio no homogénea. Estos problemas se superan mediante la dispersión de las nanoestructuras de lípidos en gran cantidad de agua para formar emulsiones que contienen micrómetro o partículas lipídicas de tamaño submicrónico de aceite-en-agua (O / W). De esta manera, un producto adecuado de baja viscosidad se puede preparar al tiempo que conserva la estructura auto-ensamblado de lípidos original dentro las partículas dispersas. La formación de estas partículas internamente autoensambladas (abreviado como ISAsomes 44 Por ejemplo, cubosomas de fases cúbicas y hexosomes de fases hexagonales) requiere habitualmente una combinación de un paso de entrada de alta energía y la adición de estabilizadores tales como tensioactivos o polímeros. La investigación reciente en esta dirección demuestra la aplicación de diversas partículas sólidas 45, incluyendo nanopartículas de sílice 46, arcilla 47-49 y nanotubos de carbono 50 para la estabilización de emulsiones anteriormente mencionadas, adecuadamente denominado como Pickering 51 o emulsiones de Pickering Ramsden-52.
En los últimos años, el carbono nanoestructuras tales como nanotubos de carbono de pared simple (SWCNTs) con base, los nanotubos de carbono de pared múltiple (MWCNTs) y fullerenos han recibido una gran atención como nuevos biomateriales 53,54. Las principales preocupaciones son su toxicidad 55-58, 59 insolubilidad en agua y por lo tanto su biocompatibilidad 56. Una forma eficaz de hacer frente a estos problemas es la función de la superficielización utilizando moléculas no tóxicos y biocompatibles tales como lípidos. En presencia de agua, lípidos interactúan con CNTs de una manera que la superficie hidrofóbica de los CNT está protegido de medio acuoso polar mientras que los grupos de cabeza hidrófilos lípidos ayudar a su solubilidad o dispersión en agua 60,61. Los lípidos son componentes integrales de orgánulos celulares, así como algunos materiales alimenticios, por lo tanto su decoración idealmente debería disminuir la toxicidad in vivo de los CNT. Aplicaciones biomédicas basadas independientemente en CNT 18,19 y nanoestructuras lipídicas 9-13 están en fase de desarrollo muy amplia, pero las aplicaciones que combinan las propiedades de los dos no están todavía bien explorado.
En este trabajo, empleamos dos tipos diferentes de lípidos y tres tipos de nanotubos de carbono de los cuales SWCNTs se presentan en forma prístina mientras que MWCNTs están funcionalizados con hidroxilo y grupos carboxílicos. Hemos utilizado concentraciones muy bajas de los CNT para preparar las dispersiones cuyosestabilidad depende de varios factores, por ejemplo, el tipo de lípido, el tipo de CNT, relación de lípido a CNT utilizado, así como de los parámetros de sonicación empleadas como la energía y la duración. Este protocolo de vídeo ofrece detalles técnicos de un método de estabilización de nanopartículas lipídicas cinéticamente utilizando diversos CNT-estabilizadores.
Protocolo
Precaución: los nanotubos de carbono utilizados en este trabajo se presentan en forma de nanopartículas que puede tener riesgos adicionales en comparación con sus homólogos a granel. La inhalación de grafito, tanto naturales como sintéticos, puede causar neumoconiosis 62 similar a la neumoconiosis de los mineros del carbón. Por otra parte, ha habido preocupaciones relacionadas con la toxicidad de nanoestructuras de carbono basadas y algunos de los estudios anteriores sugieren toxicidad aguda y crónica asociada con la inhalación de CNTs 63-68. Por lo tanto, evitar la inhalación del polvo fino CNT y manejarlo con mucho cuidado. Si es inhalado, trasladar al aire libre. Si la respiración es difícil, usar oxígeno puro en vez y buscar la consulta médica. Las formulaciones de solución / dispersión de los nanotubos de carbono son bastante seguro de manejar.
Precaución: Los lípidos y tensioactivos usados en este estudio son materiales de calidad alimentaria y por lo tanto no peligrosos en general, pero son irritantes para los ojos y la piel, y también altamente inflamable. Por lo tanto, por favor utilice todas las prácticas de seguridad adecuadas, tales como el uso de la lineacontroles gineering (campana de humos) y equipo de protección personal (gafas de seguridad, guantes, bata de laboratorio, pantalones largos, zapatos cerrados) durante la manipulación o preparación de muestras de nanopartículas. En caso de contacto con la piel o los ojos, enjuagar inmediatamente la piel o los ojos con abundante agua durante al menos 15 minutos. Consultar a un médico si es necesario.
1. Preparación de lípidos Fases granel / agua
Precaución: Almacenar los lípidos en el refrigerador a 4 ° C. lípidos puros de grado no se deben almacenar en el congelador (-20 ° C). Alícuota en pequeños frascos de vidrio para evitar la contaminación de toda la población y la comodidad de manejo. Otros productos químicos, incluyendo los CNT y tensioactivos se pueden almacenar a temperatura ambiente, pero mantenerlos alejados de la luz solar directa.
- Mantener los lípidos, es decir, Dimodan U (DU) y fitantriol (PT) a TA durante 15 a 20 min antes de abrir la botella / tapa vial con el fin de evitar la condensación de humedad.
(Nota: el uranio empobrecido es un glicérido destilado que comprende 96% de monoglicéridos y laresto son diglicéridos y ácidos grasos libres. Dos componentes principales de monoglicéridos en DU son linoleato (62%) y oleato (25%). De ahí que la parte hidrofóbica de DU contiene principalmente cadenas C18 (91%), la composición exacta de los cuales es de la siguiente manera; C18: 2 (61,9%), C18: 1 (24,9%), y C18: 0 (4,2%), donde C18 de cadena indica 18C y el número después de colon indica el número de enlaces C = C. PT es una mezcla de isómeros ópticos 3,7,11,15-tetrametil-1,2,3-hexadecanotriol. No contiene un grupo funcional éster, pero se compone de cola phytanyl altamente ramificado con un grupo de cabeza tri-hidroxi. Ambos DU y PT formar fases cúbicas en presencia de exceso de agua, que es también el caso de los núcleos de las partículas lipídicas estabilizadas 13, 45). - Fundir los lípidos poniendo los viales en un baño de agua caliente o un agua vaso que contiene mantenido por encima de 60 ° C (calentar agitador magnético: 230 V, 50 Hz, 630 W o similar para ser utilizado para calentar el agua en un vaso de precipitados).
- Alternativamente viales de calor utilizando calentadores del bloque. No caliente el lípido que contiene los viales directamente en el plato caliente con el fin de evitar el gradiente de temperatura y la posterior descomposición de los lípidos.
- Pesar 500 mg de lípido fundido, en tubo de microcentrífuga previamente pesado (con tapón de resorte cónico, 1,5 ml), usando una pipeta Pasteur de vidrio con un bulbo de látex.
- Añadir 500 ml de agua ultrapura (agua resistividad = 18,2 mO · cm) al tubo de microcentrífuga anteriormente.
- Mezclar los componentes de forma manual durante 15 minutos usando una espátula pequeña (a la medida). Hacer una espátula tales aplanando la punta de una aguja de jeringa (0,9 mm x 40 mm de longitud de la cánula) utilizando una pinza.
- Centrifugar la mezcla de lípidos / agua durante 10 min a una velocidad de 2.000 x g. Una vez más la mezcla se agita manualmente durante 10 minutos, a continuación se equilibre durante 24 hr. Antes de la caracterización de las muestras, se revuelve durante 5 minutos y luego dejarlos a temperatura ambiente.
- Para asegurar la formación de una fase de equilibrio de lípidos a lo largo de todo el tubo, realizar cerca de 10 ciclos de congelación-descongelación y inte rmittently llevar a cabo una etapa de centrifugación como se define anteriormente. Tanto la forma altamente viscosos fases lipídicas mayor de uranio empobrecido y PT por lo que es difícil de manejar manualmente (Figura 1).
Nota: El protocolo anterior (sección 1) sólo es necesaria, si a uno le gustaría comparar el comportamiento nanoestructural (celosía tipo y las dimensiones del auto-ensamblaje) de partículas dispersas en la fase lipídica a granel y / o utilizarlo como un control para confirmar la retención de nanoestructura originales.
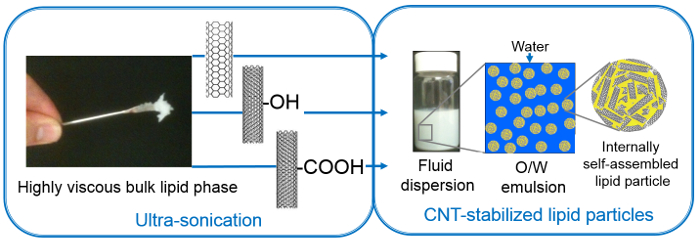
Figura 1. Preparación de la emulsión O / W de partículas con consistencia fluida de la fase lipídica altamente viscoso con el ingreso de energía alta (ultrasonidos) y el uso de diferentes CNT-estabilizadores, a saber SWCNT, MWCNT-OH, MWCNT-COOH (figura reproducido de la referencia [50] con el permiso de la Royal Society of Chemistry)._upload / 53489 / 53489fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación de tensioactivo estabilizado de lípidos partículas
- Preparar un 0,2% (w / w) tensioactivo (Pluronic F127) en agua.
- Disolver 200 mg de agente tensioactivo (polvo blanco esponjoso) en 100 ml de agua ultrapura por agitación durante 20 a 30 min (en una placa magnética usando una barra de agitador magnético). F127 Pluronic es un tensioactivo no iónico y se utiliza comúnmente como estabilizador de la emulsión. Es un copolímero de tribloques de PEO 99 -ppo 67 PEO 99, y por lo tanto lleva mucho tiempo para disolverse en agua.
- Añadir 500 mg de DU fundido o PT (usando una pipeta Pasteur de vidrio) a un vial de vidrio (de centelleo de sosa-cal equipado con papel de tapa urea alineado, 20 ml).
- Añadir 9,5 g de la solución F127 0,2%.
- En la máquina de ultrasonidos de sonda, sujete firmemente el vial de la retorta se destacan la mandíbula (Réplica Montaje Stands conde pie, abrazadera, base, barra, caucho 3 de la mandíbula y nuez), de modo que pueda resistir las vibraciones generadas por sonicación.
- Insertar la sonda de aleación de titanio sólido (13 mm de diámetro x 139 mm de longitud) unido a la célula Sonicator. Ajustar la altura y la posición del vial para asegurar que sus lados y el fondo no están en contacto con la sonda. A distancia de 0,5 cm entre la punta de la sonda y la parte inferior del vial de vidrio da buenos resultados.
- Sonicar la mezcla durante 10 min en un modo pulsado con pulso 1 sec mediada por tiempo de retardo de 1 seg a 35% (del máximo) de potencia. El vial se calienta debido al calor generado durante la sonicación. Por lo tanto, deje que se enfríe a temperatura ambiente antes de tomarlo de la abrazadera.
- Almacenar la dispersión lechosa formada a temperatura ambiente durante al menos 24 horas, antes de su uso posterior. Esto es para asegurar su estabilidad frente a la separación de fases.
Nota: Antes y después de usar la sonda, limpiarla con acetona, se seca con una toalla de papel, y luego enjuagarlo con agua ultrapura unad secar una vez más.
3. Preparación de dispersiones de CNT en Pure Water
- En dos vasos de precipitados separados, pesar en 4 mg en polvo MWCNT-OH y MWCNT-COOH, ambos de los cuales son de color negro.
- Añadir 500 ml de agua ultrapura a cada vaso de precipitados. El uso de una sonda de ultrasonidos sonicar las mezclas de 2 min en un modo de pulso continuo a 40% (del máximo) de potencia. La concentración resultante de la dispersión MWCNT es de 8 mg / ml (solución madre).
- Diluir la solución madre MWCNT con cantidades apropiadas de agua ultrapura para alcanzar 6,25, 5, 4, 2 g / dispersiones MWCNT ml.
- Sonicar estas dispersiones como se ha descrito antes (véase 3.2).
- Del mismo modo, dispersar a 3 mg de SWCNT en polvo (también de color negro) en 500 ml de agua ultrapura para hacer una dispersión de 6 mg / ml SWCNT (solución madre).
- Diluir la solución SWCNT de valores y sonicar como se describe anteriormente (véase 3.2) para obtener 0,5, 0,4, 0,3125, 0,2 mg / ml dispe SWCNTrsions.
Nota: Todas las dispersiones son transparentes durante aproximadamente 30 minutos, después de lo cual los nanotubos de carbono comienzan a asentarse en el fondo.
4. Preparación de estabilizado-CNT nanoestructurados Lipid partículas (Figura 1)
- Pesar en 500 mg del DU fundido en un vial de vidrio.
- Añadir 9,5 ml de la / ml dispersión SWCNT 6 g al vial.
- Sonicar la mezcla de CNT-DU utilizando los mismos parámetros tal como se utiliza para la fabricación de dispersiones CNT puros (ver 3.2). Después de enfriar a RT, las partículas lipídicas estabilizadas-CNT con nanoestructura internamente auto-ensamblado conservado estarán listos.
- De una manera similar, preparar las partículas lipídicas usando las dispersiones SWCNT 0,4 g / ml y 0,2 g / ml.
- Siga los protocolos de 4.1 a 4.4 para que las partículas de lípidos utilizando MWCNT-OH y MWCNT-COOH pero utilizando diferentes concentraciones, a saber, 8, 4 y 2 mg / ml de CNT.
- Del mismo modo, preparar tres dispersiones CNT-PT diferentes utilizando 4 mg / ml MWCNT-OH y MWCNT-COOH, Así como 0,4 g / ml SWCNT. Tenga en cuenta que las dispersiones CNT-PT requieren menos energía (35% del máximo), pero más tiempo (15 min) en un modo de impulso continuo. Enfriar las dispersiones a temperatura ambiente y dejarlos durante 24 horas antes de que los caracteriza.
Nota: Los parámetros de sonicación pueden ser diferentes para diferentes lípidos (como por DU y PT aquí) y para diferentes composiciones; que necesitan ser optimizados para lograr dispersiones bien estabilizada.
5. Control de la estabilidad de las dispersiones estabilizadas de lípidos-CNT
- Vigilar la estabilidad de las dispersiones mediante la observación visual: comprobar si se desestabilizan las dispersiones o si las protuberancias se han formado en las dispersiones.
- Tomar fotos (con cámara digital) a intervalos regulares. Por ejemplo, tomar fotografías de dispersiones de todos los días en la primera semana, a continuación, cada dos días durante una semana seguida de una vez a la semana durante las próximas dos semanas, y finalmente una vez al mes según el requisito.
Resultados
Los siguientes resultados representan a) la estabilidad de las dispersiones, b) la distribución de tamaños de partículas lipídicas, c) el tipo de auto-ensamblaje y d) Las pruebas para el revestimiento de lípidos de la CNT. La estabilidad de las dispersiones (Figura 2) se controló utilizando una cámara de 5 MP con enfoque automático y flash LED.

Figura 2. Esquema de tipos de CNT (A) MWCNT-OH, (B) MWCNT-COOH, y (C) SWCNT y fotos de las emulsiones correspondientes. Se obtuvieron emulsiones estables sólo en una determinada región (sombreada), donde la CNT a lípido proporción era óptimo; debajo y por encima emulsión estable no formaron a causa de un demasiado poco o demasiado grande cantidad de nanotubos de carbono, respectivamente. Una flecha indica un típico nudo CNT en una emulsión inestable. Estas mediciones se realizaron para una gama de dispersiones DU-CNT; represlos represen- se muestran aquí (figura reproducido de la referencia [50] con el permiso de la Royal Society of Chemistry). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Patrones de ángulo pequeño de dispersión de rayos X (SAXS) se registraron con el fin de determinar el tipo de celosía de la nanoestructura interior de los isasomes estabilizadas (Figura 3A). La cámara SAXSpace está conectado a un equipo de generación de análisis de rayos X (ISO-DEBYEFLEX3003) con un tubo sellado Cu-ánodo que funciona a 40 kV y 50 mA. El tubo de rayos X se enfrió con un circuito cerrado de agua. La unidad de bloque de colimación SAXSpace transforma el haz de rayos X policromático divergente en un haz en forma de línea de centrado verticalmente de la radiación α Cu-K con una longitud de onda, λ, de 0.154 nm. Para los experimentos de SAXS se eligió el modo de alta resolución, que permits para detectar un vector de dispersión mínimo, q min, de 0,04 nm -1 (q = (4π / λ) sinθ, donde 2θ es el ángulo de dispersión). Una parada de haz de semi-transparente permite grabar el perfil de la viga principal atenuada para la determinación exacta del vector de dispersión cero y la corrección de la transmisión. Cada una de las muestras estudiadas se encierra en el mismo, reutilizable capilar de cuarzo resistente al vacío de 1 mm para garantizar exactamente el mismo volumen de dispersión. El capilar se colocó en la etapa de muestra de temperatura controlada equipado con elementos Peltier, que está conectado a un termostato de refrigeración por agua para deshacerse del exceso de calor. Todos los experimentos se realizaron a 25 ° C con una estabilidad de temperatura de 0,1 ° C. Una bomba de vacío se utiliza para evacuar la cámara de muestra el logro de una presión mínima de ~ 1 mbar. Los patrones de dispersión 1D se registraron con un detector de rayos X micro-tira. Este detector es un solo conteo de fotones y tiene una sensitive área de 64 x 8 mm 2, que comprende 1.280 canales cada uno con un tamaño de canal de 0,05 x 8 mm (v × h). La distancia muestra-detector era 317.09 mm. Cada muestra se expuso tres veces durante 300 segundos, y se promediaron sus perfiles de dispersión integrados.
El software SAXStreat fue empleado para corregir los patrones de dispersión con respecto a la posición del haz primario. Los datos de SAXS era aún más la transmisión de solucionar configurando la intensidad de dispersión atenuada en q = 0 a la unidad y el fondo se sustrajo el uso del software SAXSQuant. El vector de dispersión q se calibró con plata-behenato, que tiene una conocida espaciado reticular de 5,84 nm 69. Todos los patrones de difracción grabadas podrían ser indexados con el grupo de espacio Pn3m (diamante en fase cúbica bicontinua), en la que se identificaron los 110, 111, 200, 211, 220 y 221 reflexiones (Figura 3A). el lAparámetro ttice, a, para la fase Pn3m se determinó por regresión lineal aplicando la siguiente ecuación de celosía
a = 2 π / q hkl × √ (2 h + k + l 2 2) (1)
donde h, k y l son los índices de Miller.
La distribución de tamaño y tamaño de partículas lipídicas dispersas (Figura 3B) se determinaron usando un analyer tamaño de partícula láser.
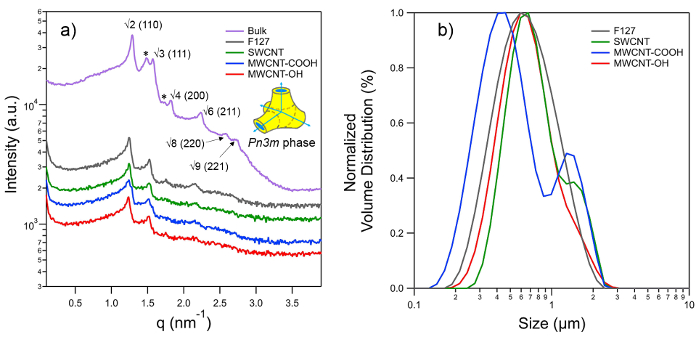
Figura 3. (A) SAXS patrones de la fase Pn3m observado para fitantriol mayor (PT) y dispersiones preparadas con 5% en peso de PT en el exceso de agua usando F127 y diferentes estabilizadores CNT correspondiente. El esquema 3-D se muestra en la parte derecha muestra de la celda unitaria de la fase Pn3m, que es una fase cúbica bicontinua cuya estructura se basa en doble diamante (D) Tipo de superficie mínima. Las flechas azules indican reunión canales acuosa al ángulo tetraédrico mientras que las regiones hidrofóbicas y acuosa se codifican en color amarillo y azul, respectivamente. Picos característicos para la fase Pn3m se indexan como √2, √3, √4, √6, √8, √9 y los correspondientes índices de Miller se muestran en los soportes. Todos los picos por encima son visibles en la PT a granel, mientras que los primeros cuatro reflexiones son visibles para las dispersiones; sin embargo, esto es suficiente para identificar las nanoestructuras Pn3m y evaluar sus parámetros de red. B picos resaltadosY asteriscos indican la co-existencia de fase cúbica tipo Ia3d, que generalmente se forma con contenidos de agua más bajos, y por lo tanto no se ve para dispersiones. partículas lipídicas con 'nanoestructura cúbico' en su interior se denominan comúnmente como '' cubosomas. (B) La distribución de tamaños de cubosomas prepara utilizando diversos estabilizadores, medida por dispersión de luz estática. Haga clic aquí para ver una versión más grande de esta figura.
Las interacciones entre los nanotubos de carbono y partículas lipídicas se estudiaron mediante espectroscopía Raman (Figura 4). Las muestras: CNTs, de lípidos y partículas lipídicas estabilizadas-CNT se deshidrataron, primero usando gas nitrógeno y después manteniéndolos en un desecador de vacío durante aproximadamente 20 min. Los espectros se registraron utilizando un espectrómetro de Horiba Jobin-Yvon LabRAM HR800 equipado con un Andor electroimán carga (CCD) para la detección de la luz y una cámara de video para guiar la recolección espectral. Una línea de excitación 532 nm de láser Nd: YAG se utilizó para recoger los espectros en el intervalo 100-4,000 cm - 1 utilizando una rejilla de 600 g mm - 1 se encendió a 750 nm.. 50X objetivo de larga distancia de trabajo con una apertura numérica de 0.50 se utilizó para adquirir los espectros y el agujero confocal se fijó en 100 m. Antes de las mediciones, el instrumento se calibró con los 520,8 cm - 1 línea espectral de silicio. Todos los espectros se recogieron a temperatura ambiente (25 ° C) mediante la colocación de la muestra en las diapositivas de fluoruro de calcio. Los espectros se adquirieron usando el láser de 532 nm y se acumula 5 veces con la exposición 1% durante 10 s. LabSpec suite de software utilizado para la espectroscopia 6 de pre-procesamiento de los datos en bruto y el interrogatorio de datos inmediata.
ftp_upload / 53489 / 53489fig4.jpg "/>
Figura 4. espectros Raman para deshidratado (A) lípido puro, MWCNT-COOH y CNT-estabilizado nanopartículas lipídicas que contienen 5,0 mg / ml MWCNT-COOH, (B) lipídica pura, MWCNT-OH y nanopartículas lipídicas que contienen 5,0 mg / ml MWCNT- OH, y (C) de lípidos puro, SWCNT y lípidos que contienen nanopartículas de 0,3125 g / ml SWCNT. Todas las curvas representan un promedio de diez espectros donde intensidades, en unidades arbitrarias se representan frente al longitud de onda. Las líneas verticales se utilizan para guiar el ojo, y para facilitar la detección de los cambios de color azul en el G y bandas G '. Estos experimentos se realizaron para DU. (D) Representación esquemática de la posible decoración de lípidos (auto-montaje) en la superficie de la CNT (figura reproducido de la referencia [50] con el permiso de la Royal Society of Chemistry). Por favor, haga clic aquí para VIew una versión más grande de esta figura.
Discusión
La estabilización de las partículas lipídicas
Tres CNTs diferentes se utilizan para estabilizar las dispersiones de lípidos; dos de los cuales son de múltiples paredes y funcionalizado usando -OH y grupos -COOH, y uno es único con funcionalidad no amurallado y (virgen). La CNT variar en tamaño como sigue (diámetro x longitud): MWCNT-COOH: 9,5 nm x 1,5 m; MWCNT-OH: 8-15 nm x 50 micras; SWCNT: 1-2 nm x 1-3 micras. Los nanotubos de carbono en polvo se dispersaron en agua por la sonda ultra-sonicación. tamaños mencionados anteriormente de los nanotubos de carbono es probable que disminuya aún más debido a la ultra-sonicación, aunque de manera desigual. Dispersiones CNT en agua pura comenzaron a separarse después de unos 20 minutos, por lo tanto, más trabajo fue ejecutado dentro de este tiempo, es decir, la adición de los lípidos y el segundo tratamiento con ultrasonidos. Este último (ultrasonidos realizado en las mezclas de lípidos-CNT) asiste en la fusión y descomposición de dominios de lípidos grandes e inconsistentes formados durante la hidratación en porciones inferior a una micra. Dispersando el lípido i graneln esta manera facilita la formación de equilibrio de nanoestructuras autoensambladas, que de otro modo requiere ciclos de congelación-descongelación rigurosas y / o mucho tiempo (días o semanas). Los saltos de fase lipídica a granel en nanopartículas, mientras que los nanotubos de carbono recubiertos de lípidos supuestamente forman conchas alrededor de ellos. Ultrasonicación mejora las interacciones hidrofóbicas entre los nanotubos de carbono y las cadenas de alquilo de moléculas de lípidos que decoran este modo CNT por cadenas de alquilo de lípidos. De este modo CNT recubiertos estabilizan la fase lipídica fragmentada que conduce a una emulsión de partículas. Esta estabilización mutua evita la agregación de los CNT, así como dispersa las partículas lipídicas. Tales dispersiones también se llaman Pickering (debido a la utilización de partículas sólidas) de tipo emulsiones de aceite-en-agua (O / W), en los que los lípidos forman una "fase de aceite", mientras que "el exceso de agua 'constituye el medio emulsión continua (Figura 1 ). ultrasonication parámetros (longitud de pulso, tiempo de retardo y de alimentación), los parámetros físico-químicas de un estabilizador(Por ejemplo, dimensiones, funcionalización), la concentración de la fase dispersa y la composición de la dispersión (por ejemplo, la CNT a la proporción de lípidos) son cruciales para garantizar la estabilidad final de las dispersiones y por lo tanto necesitan ser optimizados para diferentes sistemas (lípidos).
Optimización de CNT a la proporción de lípidos para emulsiones estables
Se empleó una amplia gama de concentraciones para cada CNT-tipo (Figura 2) para estabilizar las nanoestructuras autoensambladas obtenidas a partir de dos diferentes lípidos. Sin embargo, las emulsiones homogéneas y estables solamente se forman en un rango particular de CNT a la proporción de lípidos; demasiado altas relaciones causan agregación de los nanotubos de carbono, mientras que relaciones demasiado bajas conducen a emulsiones inestables, debido a que no hay suficientes nanotubos de carbono para lograr una cobertura suficiente de las partículas de la superficie. Las mejores condiciones de estabilización se encontraron con concentraciones entre 3-5 g / ml para MWCNT-COOH y MWCNT-OH, mientras que para SWCNT en el intervalo de 0,3 a 0,45g / ml.
Caracterización morfológica de las partículas lipídicas
Las mediciones de SAXS verificar que las partículas lipídicas de PT conservan la nanoestructura original de volumen de fase (que se muestra por fase en masa) (Figura 3A). Partimos de que la fase cúbica se mantiene también en el caso de partículas de uranio empobrecido, sin embargo, esto necesita una confirmación adicional, ya que no se ha estudiado en el presente trabajo. El parámetro de red observada para mayor fase Pn3m del PT es de 6.84 nm, que tras la dispersión aumenta a 7,1 nm. El parámetro de red más baja para la fase mayor se atribuye a la falta de agua en exceso, que puede ser también confirmado por la coexistencia de fase Ia3d (picos marcados por * en la figura 3A). La fase Ia3d se encuentra generalmente en condiciones limitadas de agua. Los parámetros de celosía para la fase Pn3m observado para todas las partículas lipídicas dispersadas (es decir, estabilizada por surfactante, así como por todos los tipos de CNT) son practically los mismos que indican condiciones de exceso de agua. Esto también elimina la posibilidad de perturbaciones conducidas-CNT a nivel molecular que, de lo contrario, podría haber provocado un cambio de la fase lipídica.
Las distribuciones de tamaño de las cubosomas están dadas por las distribuciones de volumen ponderado como se muestra en la Figura 3B. Aunque las partículas estabilizadas-CNT muestran una distribución de tamaño amplia, la mayoría de la exposición de las partículas de tamaños entre 532 a 760 nm que son comparables al tamaño de tensioactivo estabilizado partículas lipídicas (674 nm).
Recubrimiento lipídico de CNT
Para CNTs puros, bandas de grafito típico Raman se ven en los espectros Raman. La banda G que corresponde a la vibración en el plano de 'enlace CC', la banda D (no mostrado) que es debido a la presencia del trastorno en los sistemas de carbono y la banda el G ', que se atribuye a la sobretono de la banda D 70 se observan con claridad. Al interactiel de la CNT con los lípidos y en la formación de partículas lipídicas estabilizadas-CNT (comparar las curvas verdes y azules en la figura 4), se observa un cambio de números de onda más altas (desplazamiento hacia el azul). El desplazamiento hacia el azul observado, podría ser debido a: i) de alta presión ejercida sobre los nanotubos de carbono durante la aplicación de ultrasonidos que resulta en su dispersión en oposición a un estado liado en estado puro 70,71, y / o ii) las interacciones entre los nanotubos de carbono y moléculas de lípidos a través de recubrimiento de CNT por lípidos (tal cambio azul se ha informado anteriormente por Douroumis et al. 72 para SWCNTs recubiertas de lípidos).
La disminución en las intensidades relativas de los picos y la apariencia de las señales de lípidos (a partir de curvas rojas de lípido puro (Figura 4) de la CNT confirma una vez más la capa de nanotubos de carbono de las moléculas de lípidos. Esto sugiere que las interacciones hidrófobas entre los CNT y las cadenas de alquilo de moléculas de lípidos decoran el superficie CNT de tal manera que los grupos de cabeza hidrófila se enfrentan regiones acuosa así STABILIzing O / emulsión W, como se muestra por el diagrama esquemático en la Figura 4D.
Hemos demostrado un método sencillo y elegante, de estabilizar cinéticamente la emulsión de tipo O / W de partículas lipídicas nanoestructurados utilizando diversos CNT. Muy bajas concentraciones (<10 mg / ml) de los nanotubos de carbono son adecuados para estabilizar la dispersión de nanopartículas de lípidos, que es prometedor específicamente para aplicaciones en vivo. Se prevé la decoración de la CNT por moléculas de lípidos para minimizar su toxicidad al tiempo que mejora la biocompatibilidad. La perspectiva de la carga de moléculas funcionales dentro del lípido auto-ensamblaje, así como en la superficie CNT proporciona un potencial ilimitado para las partículas lipídicas estabilizadas-CNT en el ámbito de las ciencias biomédicas, especialmente en el contexto de las terapias combinadas contra las principales enfermedades 73.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Nos gustaría agradecer al Dr. Matthew J. Baker, ahora en la Universidad de Strathclyde, Glasgow por el apoyo con los experimentos Raman y el Sr. Nick Gaunt por su trabajo previo de este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| Dimodan U | Danisco | 15312 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Phytantriol (> 95%, GC) | TCI Europe N.V. | P1674 | Store at 4 °C. Non-hazardous. Irritant to eyes and skin. |
| Single walled Carbon Nanotubes (90%) | Nanostructured & Amorphous Materials, Inc. | 1246YJS | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Multi-walled carboxylic acid functionalized Carbon Nanotubes (> 80% Caron basis, > 8% carboxylic acid functionalized) | Sigma-Aldrich Co. LLC | 755125 | Store at room temperature. Away from direct light. Causes serious eye irritation. May cause respiratory irritation. |
| Graphitized Multi-walled hydroxy functionalized Carbon Nanotubes (99.9%) | Nanostructured & Amorphous Materials, Inc. (NanoAmor) | 1224YJF | Store at room temperature. Away from direct light. Irritating to eyes, skin and respiratory system. |
| Pluronic F127 | Sigma-Aldrich Co. LLC | P2443 | BioReagent, suitable for cell culture. Not a hazardous substance or mixture. Store at room temperature. |
| Acetone (99.5%) | Fisher Scientific | 10134100 | Highly flammable liquid. Causes serious eye irritation. May cause drowsiness or dizziness. |
| Jars with loose, enfolding lids (375 ml) | VWR International Ltd | 216-3308 | |
| Beaker, 1,000 ml | Fisher Scientific | 12942161 | heavy duty, low form, with spout and graduations |
| Pasteur glass pipette (150 mm length) with latex bulb | Fisher Scientific | 10006021 | |
| Microcentrifuge tube conical snap cap 1.5 ml | Fisher Scientific | 11558232 | |
| Spatula | Fisher Scientific | 11352204 | |
| Heating magnetic stirrer | Fisher Scientific | 11715704 | |
| Magnetic stirrer bars (cylindrical, opaque PTFE, 30 mm x 7 mm (l x diameter)) | Fisher Scientific | 10011792 | |
| Needle (0.9 mm x 40 mm cannula length) | Terumo UK Ltd | MN-2038MQ | |
| Retort Stand Set - With stand, clamp, base, rod, rubber 3 jaw and bosshead | Camlab Ltd, UK | 1177157 | |
| Millipore water equipment | Barnstead Nanopure, Thermoscientific, USA | ||
| Progen Genfuge 24D Digital Microcentrifuge | Progen Scientific | C-2400 | |
| Probe ultra-sonicator, with 13 mm | SONICS, Vibracell, USA | ||
| 5 MP camera with auto-focus and LED flash | Samsung Galaxy Fame Mobile camera | ||
| Raman Spectrometer | Horiba Jobin-Yvon LabRAM HR800 spectrometer | ||
| Mastersizer 3000 | Malvern Instruments Ltd, Malvern, United Kingdom | ||
| Small angle X-ray scattering (SAXS) | SAXSpace camera (Anton Paar, Graz, Austria), X-ray generating equipment (ISO-DEBYEFLEX3003, GE Inspection Technologies GmbH), closed water circuit (Chilly 35, HYFRA, Germany). |
Referencias
- Peer, D., et al. Nanocarriers as an emerging platform for cancer therapy. Nature Nanotech. 2, 751-760 (2007).
- White, R. R., Sullenger, B. A., Rusconi, C. P. Developing aptamers into therapeutics. J. Clin. Invest. 106, 929-934 (2000).
- Itaka, K., Chung, U. I., Kataoka, K. Supramolecular nanocarrier for gene and siRNA delivery. Nippon Rinsho Jpn. J. Clin. Med. 64, 253-257 (2006).
- Xu, S., et al. Development of pH-responsive core-shell nanocarriers for delivery of therapeutic and diagnostic agents. Bioorg. Med. Chem. Lett. 19, 1030-1034 (2009).
- Soppimath, K. S., Tan, D. C. W., Yang, Y. Y. pH-triggered thermally responsive polymer core-shell nanoparticles for drug delivery. Adv. Mater. 17, 318-323 (2005).
- Hans, M., Lowman, A. Biodegradable nanoparticles for drug delivery and targeting. Curr. Opin. Solid State Mater. Sci. 6, 319-327 (2002).
- Petros, R. A., DeSimone, J. M. Strategies in the design of nanoparticles for therapeutic applications. Nat Rev Drug Discov. 9, 615-627 (2010).
- Torchilin, V. P. Multifunctional nanocarriers. Adv Drug Deliver Rev. 64, 302-315 (2012).
- Shmeeda, H., et al. Delivery of zoledronic acid encapsulated in folate-targeted liposome results in potent in vitro cytotoxic activity on tumor cells. J. Controlled Release. 146, 76-83 (2010).
- Xu, Z., et al. The performance of docetaxel-loaded solid lipid nanoparticles targeted to hepatocellular carcinoma. Biomaterials. 30, 226-232 (2009).
- Rosenthal, E., et al. Phase IV study of liposomal daunorubicin (DaunoXome) in AIDS-related Kaposi sarcoma. Am. J. Clin. Oncol.-Canc. 25, 57-59 (2002).
- Dong, Y. D., Larson, I., Bames, T. J., Prestidge, C. A., Boyd, B. J. Adsorption of Nonlamellar Nanostructured Liquid-Crystalline Particles to Biorelevant Surfaces for Improved Delivery of Bioactive Compounds. Acs Appl Mater Inter. 3, 1771-1780 (2011).
- Rizwan, S. B., Boyd, B. J., Rades, T., Hook, S. Bicontinuous cubic liquid crystals as sustained delivery systems for peptides and proteins. Expert Opin. Drug. Deliv. 7, 1133-1144 (2010).
- Yoo, H. S., Park, T. G. Folate receptor targeted biodegradable polymeric doxorubicin micelles. J. Controlled Release. 96, 273-283 (2004).
- Khandare, J. J., et al. Dendrimer versus linear conjugate: Influence of polymeric architecture on the delivery and anticancer effect of paclitaxel. Bioconjug. Chem. 17, 1464-1472 (2006).
- Prabaharan, M., Grailer, J. J., Pilla, S., Steeber, D. A., Gong, S. Gold nanoparticles with a monolayer of doxorubicin-conjugated amphiphilic block copolymer for tumor-targeted drug delivery. Biomaterials. 30, 6065-6075 (2009).
- Fan, J., et al. Targeted anticancer prodrug with mesoporous silica nanoparticles as vehicles. Nanotechnology. 22, (2011).
- Bianco, A., Prato, M. Can carbon nanotubes be considered useful tools for biological applications? Adv. Mater. 15, 1765-1768 (2003).
- Kam, N. W. S., Dai, H. J. Carbon nanotubes as intracellular protein transporters: Generality and biological functionality. J. Am. Chem. Soc. 127, 6021-6026 (2005).
- Kulkarni, C. V. Lipid crystallization: from self-assembly to hierarchical and biological ordering. Nanoscale. 4, 5779-5791 (2012).
- Yaghmur, A., et al. Drug Formulations Based on Self-Assembled Liquid Crystalline Nanostructures. , CRC Press. 341-360 (2014).
- Kulkarni, C. V. Advances in Planar Lipid Bilayers and Liposomes. 12, Academic Press. 237-272 (2010).
- Landau, E. M., Navarro, J. V. US Pat. , US2001/025791A1 (2001).
- Kulkarni, C., Belsare, N., Lele, A. Studies on shrikhand rheology. J. Food Eng. 74, 169-177 (2006).
- Mezzenga, R., Schurtenberger, P., Burbidge, A., Michel, M. Understanding foods as soft materials. Nature Mater. 4, 729-740 (2005).
- Ubbink, J., Burbidge, A., Mezzenga, R. Food structure and functionality: a soft matter perspective. Soft Matter. 4, 1569-1581 (2008).
- Dong, Y. D., Larson, I., Hanley, T., Boyd, B. J. Bulk and dispersed aqueous phase behavior of phytantriol: effect of vitamin E acetate and F127 polymer on liquid crystal nanostructure. Langmuir. 22, 9512-9518 (2006).
- Yaghmur, A., Glatter, O. Characterization and potential applications of nanostructured aqueous dispersions. Adv. Colloid Interface Sci. 147, 333-342 (2009).
- Pardeike, J., Hommoss, A., Müller, R. H. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products. Int. J. Pharm. 366, 170-184 (2009).
- Yaghmur, A., Rappolt, M., Østergaard, J., Larsen, C., Larsen, S. W. Characterization of bupivacaine-loaded formulations based on liquid crystalline phases and microemulsions: the effect of lipid composition. Langmuir. 28, 2881-2889 (2012).
- Singh, H., Ye, A., Horne, D. Structuring food emulsions in the gastrointestinal tract to modify lipid digestion. Prog. Lipid Res. 48, 92-100 (2009).
- Angelova, A., Angelov, B., Mutafchieva, R., Lesieur, S., Couvreur, P. Self-Assembled Multicompartment Liquid Crystalline Lipid Carriers for Protein, Peptide, and Nucleic Acid Drug Delivery. Accounts Chem. Res. 44, 147-156 (2011).
- Clogston, J., Caffrey, M. Controlling release from the lipidic cubic phase. Amino acids, peptides, proteins and nucleic acids. J. Controlled Release. 107, 97-111 (2005).
- Shah, J. C., Sadhale, Y., Chilukuri, D. M. Cubic phase gels as drug delivery systems. Adv. Drug Deliver. Rev. 47, 229-250 (2001).
- Boyd, B. J., Whittaker, D. V., Khoo, S. M., Davey, G. Lyotropic liquid crystalline phases formed from glycerate surfactants as sustained release drug delivery systems. Int. J. Pharm. 309, 218-226 (2006).
- Drummond, C. J., Fong, C. Surfactant self-assembly objects as novel drug delivery vehicles. Curr. Opin. Colloid Interface Sci. 4, 449-456 (1999).
- Zhao, X. Y., Zhang, J., Zheng, L. Q., Li, D. H. Studies of cubosomes as a sustained drug delivery system. J. Dispersion Sci. Technol. 25, 795-799 (2004).
- Malmsten, M. Phase transformations in self-assembly systems for drug delivery applications. J. Dispersion Sci. Technol. 28, 63-72 (2007).
- Sadhale, Y., Shah, J. C. Stabilization of insulin against agitation-induced aggregation by the GMO cubic phase gel. Int. J. Pharm. 191, 51-64 (1999).
- Amar-Yuli, I., Azulay, D., Mishraki, T., Aserin, A., Garti, N. The role of glycerol and phosphatidylcholine in solubilizing and enhancing insulin stability in reverse hexagonal mesophases. J. Colloid Interface Sci. 364, 379-387 (2011).
- Rappolt, M. Advances in planar lipid bilayers and liposomes. Leitmannova Liu, A. 5, Elsevier Inc. Amsterdam. 253-283 (2006).
- Rappolt, M., Cacho-Nerin, F., Morello, C., Yaghmur, A. How the chain configuration governs the packing of inverted micelles in the cubic Fd 3 m-phase. Soft Matter. 9, 6291-6300 (2013).
- Kulkarni, C. V., Wachter, W., Iglesias-Salto, G., Engelskirchen, S., Ahualli, S. Monoolein: a magic lipid? Phys. Chem. Chem. Phys. 13, 3004-3021 (2011).
- Yaghmur, A., de Campo, L., Sagalowicz, L., Leser, M. E., Glatter, O. Emulsified Microemulsions and Oil-Containing Liquid Crystalline Phases. Langmuir. 21, 569-577 (2005).
- Kulkarni, C. V., Glatter, O. Ch. 6. Self-Assembled Supramolecular Architectures: Lyotropic Liquid Crystals.Surface and Interfacial Chemistry. Nissim, G. , John Wiley & Sons, Inc. (2012).
- Salonen, A., Muller, F. O., Glatter, O. Internally Self-Assembled Submicrometer Emulsions Stabilized by Spherical Nanocolloids: Finding the Free Nanoparticles in the Aqueous Continuous Phase. Langmuir. 26, 7981-7987 (2010).
- Guillot, S., Bergaya, F., de Azevedo, C., Warmont, F., Tranchant, J. F. Internally structured pickering emulsions stabilized by clay mineral particles. J. Colloid Interface Sci. 333, 563-569 (2009).
- Muller, F., Salonen, A., Glatter, O. Monoglyceride-based cubosomes stabilized by Laponite: Separating the effects of stabilizer, pH and temperature. Colloids Surf., A. 358, 50-56 (2010).
- Salonen, A., Muller, F. O., Glatter, O. Dispersions of Internally Liquid Crystalline Systems Stabilized by Charged Disklike Particles as Pickering Emulsions: Basic Properties and Time-Resolved. Langmuir. 24, 5306-5314 (2008).
- Gaunt, N. P., Patil-Sen, Y., Baker, M. J., Kulkarni, C. V. Carbon nanotubes for stabilization of nanostructured lipid particles. Nanoscale. 7, 1090-1095 (2015).
- Pickerings, S. U. Emulsions. J. Chem. Soc. 91, (2001).
- Ramsden, W. Separation of Solids in the Surface-Layers of Solutions and 'Suspensions' (Observations on Surface-Membranes, Bubbles, Emulsions, and Mechanical Coagulation). -- Preliminary Account. Proceedings of the Royal Society of London. 72, 156-164 (1903).
- Lin, Y., et al. Advances toward bioapplications of carbon nanotubes. J. Mater. Chem. 14, 527-541 (2004).
- Saito, N., et al. Safe Clinical Use of Carbon Nanotubes as Innovative Biomaterials. Chem. Rev. 114, 6040-6079 (2014).
- Pulskamp, K., Diabate, S., Krug, H. F. Carbon nanotubes show no sign of acute toxicity but induce intracellular reactive oxygen species in dependence on contaminants. Toxicol. Lett. 168, 58-74 (2007).
- Smart, S. K., Cassady, A. I., Lu, G. Q., Martin, D. J. The biocompatibility of carbon nanotubes. Carbon. 44, 1034-1047 (2006).
- Colvin, V. L. The potential environmental impact of engineered nanomaterials. Nat. Biotechnol. 21, 1166-1170 (2003).
- Firme, C. P., Bandaru, P. R. Toxicity issues in the application of carbon nanotubes to biological systems. Nanomed-Nanotechnol. 6, 245-256 (2010).
- Haddon, R. C. Carbon nanotubes. Accounts Chem. Res. 35, 997-997 (2002).
- Kapralov, A. A., et al. Adsorption of Surfactant Lipids by Single-Walled Carbon Nanotubes in Mouse Lung upon Pharyngeal Aspiration. Acs Nano. 6, 4147-4156 (2012).
- Wallace, E. J., Mark, S. P. S. Carbon nanotube self-assembly with lipids and detergent: a molecular dynamics study. Nanotechnology. 20, 045101(2009).
- George, R. B. Chest medicine: essentials of pulmonary and critical care medicine. Lippincott Williams & Wilkins. , (2005).
- Monteiro-Riviere, N. A., Nemanich, R. J., Inman, A. O., Wang, Y. Y., Riviere, J. E. Multi-walled carbon nanotube interactions with human epidermal keratinocytes. Toxicol. Lett. 155, 377-384 (2005).
- Shvedova, A., et al. Exposure to carbon nanotube material: assessment of nanotube cytotoxicity using human keratinocyte cells. J. Toxicol. Env. Heal. A. 66, 1909-1926 (2003).
- Jia, G., et al. Cytotoxicity of carbon nanomaterials: single-wall nanotube, multi-wall nanotube, and fullerene. Environ. Sci. Technol. 39, 1378-1383 (2005).
- Sato, Y., et al. Influence of length on cytotoxicity of multi-walled carbon nanotubes against human acute monocytic leukemia cell line THP-1 in vitro and subcutaneous tissue of rats in vivo. Mol. BioSyst. 1, 176-182 (2005).
- Bottini, M., et al. Multi-walled carbon nanotubes induce T lymphocyte apoptosis. Toxicol. Lett. 160, 121-126 (2006).
- Cui, D., Tian, F., Ozkan, C. S., Wang, M., Gao, H. Effect of single wall carbon nanotubes on human HEK293 cells. Toxicol. Lett. 155, 73-85 (2005).
- Huang, T., Toraya, H., Blanton, T., Wu, Y. X-ray powder diffraction analysis of silver behenate, a possible low-angle diffraction standard. J. Appl. Crystallogr. 26, 180-184 (1993).
- Bokobza, L., Zhang, J. Raman spectroscopic characterization of multiwall carbon nanotubes and of composites. Express Polym. Lett. 6, 601-608 (2012).
- Zhao, Q., Wagner, H. D. Raman spectroscopy of carbon-nanotube-based composites. Philos. Trans. R. Soc. London, Ser. A -Math. Phys. Eng. Sci. 362, 2407-2424 (2004).
- Douroumis, D., Fatouros, D. G., Bouropoulos, N., Papagelis, K., Tasis, D. Colloidal stability of carbon nanotubes in an aqueous dispersion of phospholipid. Int. J. Nanomed. 2, 761-766 (2007).
- Worthington, R. J., Melander, C. Combination approaches to combat multidrug-resistant bacteria. Trends Biotechnol. 31, 177-184 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados