Method Article
Estabelecimento de epiteliais humanas Enteroids e Colonoids de tecido inteiro e biópsia
Neste Artigo
Resumo
We describe a method to establish human enteroids from small intestinal crypts and colonoids from colon crypts collected from both surgical tissue and biopsies. In this methodological article, we present the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Resumo
The epithelium of the gastrointestinal tract is constantly renewed as it turns over. This process is triggered by the proliferation of intestinal stem cells (ISCs) and progeny that progressively migrate and differentiate toward the tip of the villi. These processes, essential for gastrointestinal homeostasis, have been extensively studied using multiple approaches. Ex vivo technologies, especially primary cell cultures have proven to be promising for understanding intestinal epithelial functions. A long-term primary culture system for mouse intestinal crypts has been established to generate 3-dimensional epithelial organoids. These epithelial structures contain crypt- and villus-like domains reminiscent of normal gut epithelium. Commonly, termed “enteroids” when derived from small intestine and “colonoids” when derived from colon, they are different from organoids that also contain mesenchyme tissue. Additionally, these enteroids/colonoids continuously produce all cell types found normally within the intestinal epithelium. This in vitro organ-like culture system is rapidly becoming the new gold standard for investigation of intestinal stem cell biology and epithelial cell physiology. This technology has been recently transferred to the study of human gut. The establishment of human derived epithelial enteroids and colonoids from small intestine and colon has been possible through the utilization of specific culture media that allow their growth and maintenance over time. Here, we describe a method to establish a small intestinal and colon crypt-derived system from human whole tissue or biopsies. We emphasize the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Introdução
O epitélio de revestimento do trato gastrointestinal está em constante renovação. Este processo é desencadeado por proliferação de células estaminais intestinais (ISC), que produzem continuamente descendência para substituir rapidamente o epitélio intestinal, uma vez que se vira. O compartimento proliferativa compreendendo os ISC está confinada à parte inferior das criptas. As ISC dar origem a descendência que eventualmente se diferenciar em linhagens de absorção ou secreção. Saindo da cripta e para o vilo ou superfície do epitélio, as células diferenciam-se progressivamente à medida que migram para cima antes de esfoliação para o lúmen 1. ISC dar origem a todos os tipos de células epiteliais do intestino incluindo enterócitos, células microfold, células enteroendócrinas, células caliciformes, células topete e células de Paneth. O cólon é caracterizada por criptas alongadas composta principalmente de colonócitos e células caliciformes, com enteroend�rina dispersa e células topete 2.
Ex vivo culsistemas tura constituem ferramenta promissora para o estudo de manutenção ISC e homeostase do tecido intestinal. No entanto, é difícil contar com técnicas de cultura de tecidos como condições fisiológicas não são inteiramente reproduzida e o microambiente epitelial, muitas vezes alterados 3,4. Um grande avanço no campo ISC foi o estabelecimento de técnicas de cultura de tecidos para manter e expandir ISC murino individuais utilizando fatores de crescimento definidas para substituir os sinais de nicho intestinal normal. Condições de cultura a longo prazo foram descritos por Sato et al., Em que criptas individuais ou isolados a partir de células estaminais do epitélio intestinal crescer para formar estruturas epiteliais 3-dimensional, incluindo vários domínios das criptas do tipo 5-7. Estas estruturas tridimensionais sofrer eventos de fissão para expandir continuamente. Curiosamente, todos os tipos de células intestinais específicas para o tecido de origem são produzidos e assim são extrudidas em um lúmen 8. Utilizando modificações deste sistema, epitelialOrganóides pode ser gerado a partir do estômago, intestino delgado e cólon. Mais especificamente, Organóides epiteliais do intestino delgado são enteroids 9, e os do cólon são colonoids 9,10. Esses sistemas de cultura organ�de epiteliais foram usadas para testar a capacidade das células individuais isoladas funcionar como células estaminais in vitro, testando assim a "stemness" de células isoladas 5,6,10-15. Outros pesquisadores utilizaram ambos enteroids e colonoids para estudar a função das células epiteliais individuais 16-21. Assim, culturas enteroid colonoid e pode ser utilizado para avaliar ambas as funções estaminais e células não estaminais e dar uma nova visão em interacções celulares fundamentais dentro dos intestinos.
Em 2011, Sato e colegas gerado cultura de longo prazo de Organóides epiteliais derivadas do intestino delgado e cólon 22,23 humano. Além das diferenças na composição da mídia, os enteroids epiteliais humanase colonoids apresentam as mesmas características que o seu homólogo murino. Além disso, eles podem ser gerados a partir de tecidos doentes, tais como esófago, adenoma ou adenocarcinoma de Barrett, e fibrose cística 22,24. Enteroids humanos constituem um sistema valioso para estudar de células-tronco da mucosa intestinal e da biologia epitelial e servir como um novo sistema experimental para estudar a fisiologia gastrointestinal tanto normal como anormal 3.
Aqui, descrevemos métodos para estabelecer enteroids e colonoids de intestino delgado humano e criptas do cólon (Figura 1). Nesta revisão metodológica, enfatizamos a coleção cripta do tecido inteiro e biópsias. Nós recapitular as modalidades de cultura que são essenciais para o crescimento bem sucedido e manutenção de enteroids e colonoids humanos e as possíveis estratégias experimentais realizados por este modelo.
Protocolo
Declaração de Ética: NOTA: Todos experimentação utilizando tecidos humanos aqui descritos foi aprovado por um IRB em CCHMC (IRB # 2012-2858; # 2.014-0.427). O consentimento informado para a recolha de tecido, armazenamento e utilização das amostras foi obtida a partir dos dadores a CCHMC.
1. Preparação para a Cultura
NOTA: Todos os reagentes estão listados na Tabela 1.
- Preparar a solução de estoque de EDTA como se segue: preparar 0,5 M de ácido etilenodiaminotetraacético, pH 8 (EDTA) em ultrapura H2O, esterilizada por filtração com filtros de 0,22 um. Opcionalmente, armazenar a solução de EDTA a RT indefinidamente.
- Preparar tampão quelante, como segue: misturar 2% de sorbitol, 1% de sacarose, 1% de fracção V de albumina de soro bovino (BSA) e gentamicina 1x / solução de anfotericina em fosfato de Dulbecco tamponado com solução salina, sem Ca 2+ e Mg 2+ (DPBS), esterilizado por filtração com filtro de 0,22 um. Prepare o buf quelantefer fresco.
- Prepare meio de Wnt-3A-condicionado como se segue: O meio de Wnt-3A-condicionado é feito em casa utilizando a linha celular de Wnt-L 3A de acordo com as instruções do fabricante (ATCC, CRL-2647). Suplementar o meio com 2 mM de glutamina, 10 mM de HEPES, 100 U / ml de penicilina, 100 g / ml de estreptomicina, 1 suplemento N2, 1 B27 suplemento, 1% de BSA e esterilizado por filtração com um filtro de 0,22? M.
NOTA: Teste todos os lotes para a atividade Wnt usando um ensaio TOPflash. Utilize uma linha celular HEK293 TOPflash estável (Hans Clevers laboratório) com um kit de ensaio de luciferase de Renilla de acordo com as instruções do fabricante. Normalizar o ensaio TOPflash com 100 ng / ml de recombinante humano Wnt-3A. Confirme pelo menos uma atividade de 10 fold-change dos meios condicionados relação ao controle. Divide meio de Wnt-3A-condicionado fresco em alíquotas de 10 ml em tubos cónicos de 15 ml e congeladas a -20 ° C durante até 6 meses. Loja descongeladas aliquotas até 5 dias a 4 ° C sem perda de actividade. - Prepare meio minigut humano como se segue: Suplemento avançada meio DMEM / F12 com 2 mM de glutamina, 10 mM de HEPES, 100 U / mL de penicilina, 100 g / mL de estreptomicina, 1 suplemento N2, 1 B27 suplemento, 1% de BSA e esterilizado por filtração com 0,22 filtro de? m.
NOTA: Dividir meio minigut humano fresco em 10 ml de partes alíquotas em tubos cónicos de 15 ml e congeladas a -20 ° C durante até 3 meses. Loja descongeladas aliquotas até 5 dias a 4 ° C sem perda de actividade. - Prepare meio completo minigut humana da seguinte forma: Prepare fresco antes de cultura cripta ou mudança médio médio minigut humana (ver 1.4) suplementado com 50% de Wnt-condicionado-3A meio (ver 1.3), 1 mg / ml R-espondina 1 (1: 1.000 diluição de 1 mg / ml de stock), Noggin 100 ng / ml (1: 1000 de diluição de 100 g / mL de estoque), 50 ng / mL de EGF (diluição 1: 10.000 de 500 ug / mL de estoque), 500 nM de A-83 -01 (1: 1000 de diluição de 500 M estoque), 10 uM SB202190 (1: 3000 de diluição de estoque 30 mM), 10 nM de [Leu] 15-Gastrina 1 (diluição 1: 10.000 de 100 uMestoque), 10 mM de nicotinamida (diluição 1: 100 de 1 M) e 1 mM de N-Acetilcisteína (1: 1000 de diluição de 1 M).
NOTA: Loja completos media minigut humanos até 2 dias a 4 ° C, sem perda de atividade.
2. Crypt Isolamento da Whole Tissue
NOTA: A partir da coleta de tecido, é essencial para manter a amostra em solução salina. Recomenda-se a manter o tecido em gelo durante o transporte. Preparação da amostra para o isolamento de cripta deve ser realizada o mais rapidamente possível.
NOTA: Todos os reagentes estão listados na Tabela 1, ferramentas, equipamento, e materiais de consumo estão listados na Tabela 2.
- Preparar todos os reagentes antes de se iniciar a experiência. Descongelar a matriz da membrana basal em gelo e pré-incubar uma placa de 24 cavidades em uma incubadora de CO 2 a 37 ° C.
NOTA: Como alternativa fazer uma fina camada de membrana basal da matriz, utilizando 15 uL / cavidade no centro de um 24-bem placa e colocá-lo em uma incubadora de CO 2 a 37 ° C. Esta etapa facultativa mantém a matriz da membrana basal, como uma queda durante a polimerização. - Lavar o tecido com gelado de Dulbecco tamponada com fosfato salino sem Ca 2+ e Mg 2+ (DPBS). Continuar até que o teor de DPBS é clara.
- Usando 0,2 mm de diâmetro minutien pinos, proteger o tecido sobre uma placa de Petri de vidro revestidas com silicone preenchida com DPBS gelado. Esticar e fixar o tecido plano com o lado da mucosa voltada para cima.
- Sob um microscópio de dissecação, remover a mucosa sobrejacente a partir da submucosa e tecido conjuntivo usando micro-dissecação tesouras e pinças curvas do ponto fino (Figura 2A, B).
- Esticar e fixar o dissecados mucosa plana no vidro placa de Petri com revestimento de silicone com o lado da mucosa voltada para cima. O restante da submucosa e tecido conjuntivo pode ser descartado ou usado para experimentos posteriores (Figura 2C).
- Suavementeraspar a superfície da mucosa com pinças curvas. Este passo é necessário para melhorar a qualidade da preparação.
- Para intestino delgado, raspe a mucosa para remover as vilosidades.
- Para cólon, raspe a mucosa para remover muco e detritos.
- Lava-se a mucosa 3-4 vezes com tampão arrefecido com gelo de quelação para remover detritos e vilosidades.
- Cubra a mucosa com tampão de quelação EDTA 2 preparada na hora (200 mL de 0,5 M EDTA em 49,6 ml de tampão de quelação).
- Coloque a placa de Petri no gelo e agitar suavemente durante 30 min num agitador orbital horizontal.
- Lavar o tecido 3-4 vezes com tampão de quelação gelada sem EDTA. Após a lavagem, deixar a mucosa em tampão de quelação gelada.
- Processar a mucosa sob um microscópio de dissecação usando uma pinça curva e multa. Raspe o mucosa para libertar criptas intestinais utilizando a pinça curvos.
- Remova cuidadosamente a suspensão cripta da placa de Petri usando um pipette e transferi-lo para um tubo de 50 ml.
NOTA: verificar o tecido para se certificar de que quase todas as criptas foram removidas a partir da mucosa. - Filtra-se a suspensão através de criptas a 150 mm de malha 2 vezes.
Nota: Verifique o flow-through para o enriquecimento cripta sob um microscópio (Figura 2D). - Centrifugar a suspensão cripta 5 min a 50 xg, 4 ° C. Descartar o sobrenadante.
- Ressuspender o sedimento em 5 ml de tampão arrefecido com gelo de quelação.
- Contar o número de criptas por queda de 10 ul da suspensão do passo 2.15. Transferir o número de criptas necessários para chapeamento de um tubo de 5 mL de fundo redondo. Use 200 a 500 criptas por poço de um prato de 24 cavidades para estabelecer enteroids ou colonoids.
- Centrifugar a fracção cripta durante 10 min a 150 g, 4 ° C. Remover o sobrenadante.
- Use criptas para a cultura subseqüente.
3. Crypt Isolamento de Biópsia
- Prepare todos os reagentes antes dainício da experiência. Descongelar a matriz da membrana basal em gelo e pré-incubar uma placa de 24 cavidades em uma incubadora de CO 2 a 37 ° C.
- Lava-se a biópsia com gelado de Dulbecco tamponada com fosfato salino sem Ca 2+ e Mg 2+ (DPBS).
- Utilizando 0,1 mm de diâmetro minutien pinos, garantir a biópsia sobre uma placa de Petri de vidro revestidas com silicone preenchida com DPBS gelado. Esticar e fixar a mucosa plana com o lado da mucosa voltada para cima (Figura 2E).
- Raspe a superfície da mucosa com pinças curvas para remover detritos e vilosidades. Este passo é necessário para melhorar a qualidade da preparação.
- Lava-se a biópsia 3-4 vezes com tampão arrefecido com gelo de quelação para remover detritos e vilosidades.
- Cubra a biópsia com tampão de quelação EDTA 2 preparada na hora (200 mL de 0,5 M EDTA em 49,8 ml de tampão de quelação).
- Coloque a placa de Petri no gelo e agitar suavemente durante 30 min num agitador orbital horizontal.
- Lavar a biópsia 3-4 vezes com tampão de quelação gelada sem EDTA. Após a lavagem, deixar a biópsia em tampão de quelação gelada.
- Processar a biópsia sob um microscópio de dissecação usando uma pinça curva e multa. Raspe a mucosa para liberar as criptas intestinais usando uma pinça curva.
- Remova cuidadosamente a suspensão cripta da placa de Petri com uma pipeta e transferi-lo para um tubo de 50 ml.
NOTA: verificar o tecido para se certificar de que quase todas as criptas foram removidas a partir da mucosa. - Filtra-se a suspensão através de uma cripta de nylon de 150 um de malha 2 vezes.
Nota: Verifique o flow-through para o enriquecimento cripta sob um microscópio. - Centrifugar a suspensão cripta 5 min a 50 xg, 4 ° C. Descartar o sobrenadante.
- Ressuspender o sedimento em 1 ml de tampão arrefecido com gelo de quelação. Transferir a suspensão cripta de um tubo de 1,5 mL de microcentrífuga.
- Centrifugar a fracção cripta durante 10 minutos a 150 xg, a 4 ° C. Remover o sobrenadante.
- Use criptas para a cultura subseqüente.
4. Crypt Cultura em Basement Membrane Matrix
- Usando pontas de pipetas pré-refrigerados, colocar o agregado de crypt (a partir do passo 2.18 ou 3.15) na matriz da membrana basal (200 a 500 criptas / matriz da membrana basal 50 ul).
- Aplicar 50 ul de suspensão cripta na matriz da membrana basal por poço na placa pré-aquecida. Lentamente ejectar a matriz da membrana basal no centro do poço.
- Colocar a placa de 24 cavidades em uma de 37 ° C, 5% de CO2 durante 30 min para permitir uma polimerização completa da matriz da membrana basal.
- Overlay a matriz da membrana basal com 500 mL de meio minigut humano completo suplementado com 2,5 mM CHIR99021 (1: 4000 diluição de 10 estoque mM) e 2,5 mM Thiazovivin (1: 4000 diluição de estoque 10 mM).
- Incubar a placa em uma temperatura de 37 ° C, 5% de CO2.
- Substituir o meio com huma completo frescon minigut média a cada 2 dias.
5. Passaging de Cultivadas Enteroids e Colonoids.
NOTA: Passage Enteroids e Colonoids cada 7 a 10 dias após o início do cultivo. Geralmente, dividir um bem em 3-4 poços.
- Preparar todos os reagentes antes do início da experiência. Descongelar a matriz da membrana basal em gelo e pré-incubar uma placa de 24 cavidades em uma incubadora de CO 2 a 37 ° C.
- Remova a mídia usando dicas estéreis e sobreposição com 1 ml de DPBS geladas.
- Pipeta para trás e para a frente com uma ponta de 1.000 l. Transferir a solução em um novo tubo cónico de 15 ml.
- Adicionar 2 ml de meio minigut humano suplementado com 5% de FBS por 1 ml de meio.
- Centrifuga-se a solução durante 5 min a 50 xg, 4 ° C. Descartar o sobrenadante.
- Ressuspender o sedimento com 2 mL de enzima de dissociação de células suplementadas com 10 uM Y-27632 (1: 1000 de diluição de estoque 10 mM). Incubar por 5 mno a 37 ° C em um banho de água.
- Dissociar os aglomerados de células usando a 3 ml Luer-Lock seringa equipada com um 18-G enchimento / agulha romba. Pipeta suavemente a solução para trás e para a frente utilizando a seringa 10 vezes.
- Centrifuga-se a suspensão durante 5 minutos a 500 xg, a 4 ° C. Descartar o sobrenadante.
- Usando pontas de pipetas de pré-refrigerada, ressuspender o sedimento celular em matriz de membrana basal.
- Aplicar 50 ul de suspensão cripta na matriz da membrana basal por poço na placa pré-aquecida. Lentamente ejectar a matriz da membrana basal no centro do poço.
- Colocar a placa de 24 cavidades em uma de 37 ° C, 5% de CO2 durante 20 min para permitir uma polimerização completa da matriz da membrana basal.
- Overlay a matriz da membrana basal com 500 mL de meio minigut humano completo suplementado com 10 mM Y-27632 (1: 1000 diluição de estoque 10 mM).
- Incubar a placa em uma temperatura de 37 ° C, 5% de CO2.
- Após 2 dias, Substituir o meio com meio completo minigut humano fresco suplementado com 10 uM Y-27632 (1: 1000 de diluição de estoque 10 mM). Depois disso, substituir o meio com fresco, meio completo minigut humano todos os dias.
6. Congelamento de Cultivadas Enteroids e Colonoids
NOTA: Normalmente, congelar um poço em 2-3 cryovials.
- Repita os passos de 5,1-5,8.
- Ressuspender o sedimento com meio frio. Transferir 1 ml de solução em um frasco de congelação congelando marcado. Inserir o frasco de congelação num recipiente de congelamento contendo 500 ml de álcool isopropílico.
- Transferir o recipiente de congelamento a 80 ° C um congelador durante 24 h, em seguida, transferir criotubo para armazenamento em azoto líquido.
NOTA: Loja Enteroids e Colonoids por até 1 ano.
Resultados
A Figura 2D mostra um exemplo típico de criptas recentemente isoladas a partir de tecido inteiro (Figura 2D). O número de criptas isolados a partir de uma biópsia é mais baixa do que no tecido todo. Utilizando uma pinça de biópsia capacidade padrão com agulha, que costumam fazer duas mordidas de biópsia em uma única passagem. Cada biopsia de mordida resulta numa superfície de 10 milímetros 2 com uma média de 50 a 100 criptas por biópsia (Figura 2F).
Depois de cultura na matriz da membrana basal, as criptas completam para formar enterospheres para intestino delgado e colonospheres para dois pontos. A cripta brotamento geralmente ocorre dentro de 5 a 6 dias, após a semeadura. No entanto, não é incomum ver tanto enteroids (enteroids) ou colonoids (colonoids) formando esferas na matriz da membrana basal (Figura 3A-C; Filme 1). O passaging pode ser feito depois de 7 dias, dependendo do tamanho dos enteroids. O enteroids ou colonoids establtada a partir de biópsias de submeter o mesmo desenvolvimento em cultura. No entanto, como a densidade cripta de sementeira é menor, o passaging é feito geralmente após 10 a 12 dias de cultura (Figura 4a, b). Enteroids colonoids culturas e expandir de uma maneira reprodutível.
Ambos os enteroids e colonoids apresentar um lado luminal e são revestidas com um epitélio (Figura 5A, B). Células proliferativas pode ser observado dentro dos enteroids e está localizado dentro das pontas de gemas (Figura 5C, D). Imagem confocal de enteroids manchadas de E-caderina (Ecad) mostra as células epiteliais (Figura 5E).
Ambos enteroids e colonoids pode ser estabelecida a partir de tecido obtidos de pacientes com doenças genéticas / congênitas. A Figura 6 mostra enteroids representativos que crescem de uma paciente com fibrose cística (Figura 6A) e uma enteropatia acolchoamento devido a uma mutação congênita no anúncio de células epiteliaisgene da molécula hesion (EpCAM) (Figura 6B). Ao lado do defeito genético, as enteroids não apresentam diferenças na condição basal.

Figura 1. Fluxo de Trabalho de criptas dissociação e geração de enteroids humanos e colonoids em cultura. Crypts (do intestino delgado ou do cólon humano) são isolados por quelante EDTA. Criptas cultivadas formar enteroids para o intestino delgado e colonoids para o cólon. Por favor, clique aqui para ver uma versão maior desta figura.
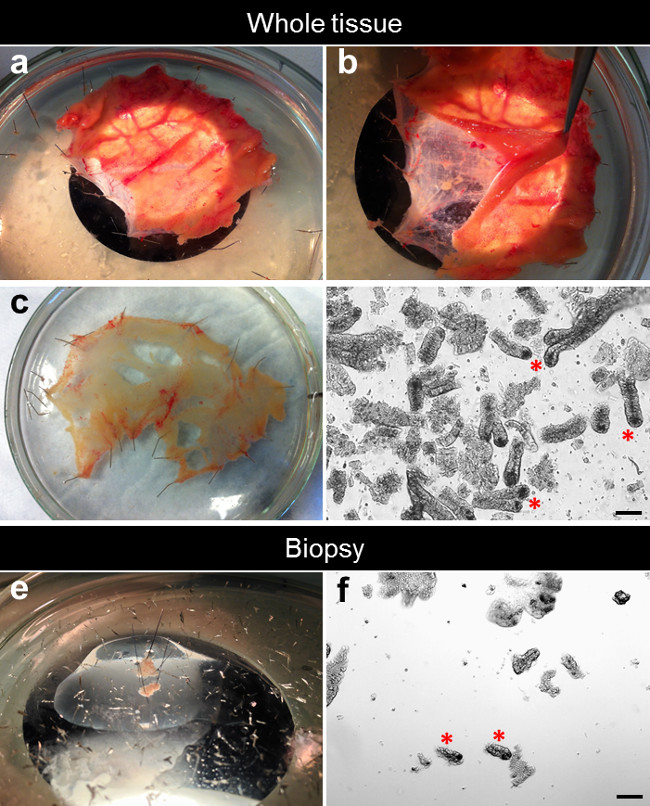
Figura 2. Processo de dissecação para o isolamento cripta. (A) O intestino pequeno specimen é esticado e preso plana em uma placa de Petri com revestimento de silicone. (B) A mucosa é separada a partir da submucosa subjacente. (C) A mucosa dissecada é esticado e preso liso para um prato de Petri com revestimento de silicone. (D) Depois quelante EDTA, as criptas são isoladas a partir do tecido. (E) Uma biópsia é esticado e preso plana em uma placa de Petri com revestimento de silicone. (F) Depois de quelante EDTA, criptas são isolados da biópsia. Por favor, clique aqui para ver uma versão maior desta figura.
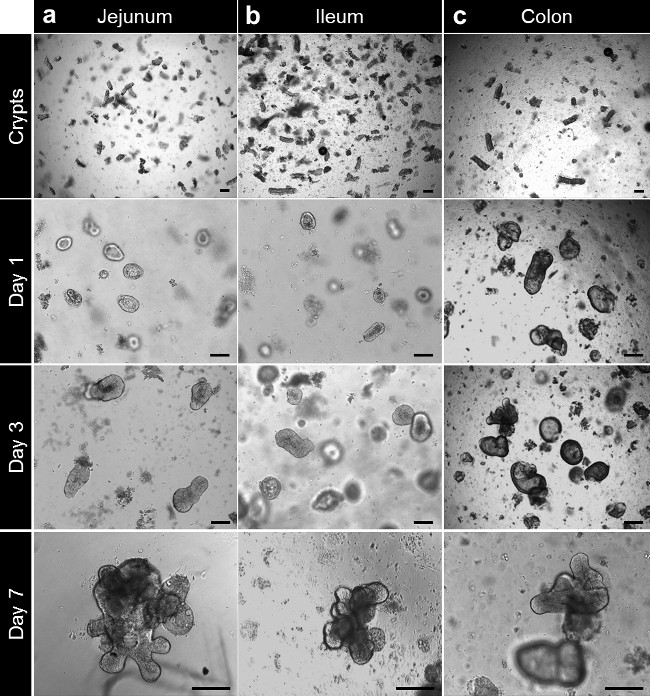
Figura 3. cultura Crypt e enteroid humano e geração colonoid a partir de tecido inteiro. (A) criptas Jejuno banhados na matriz da membrana basal após isolamento. As criptas estão fechando-se depois de 3 a 4 horas e começar a inflar-se para formar enterospheres além deste tempo. Aos 7 dias, os enteroids jejunais são formados. (B) Após o isolamento e cultura, as criptas do íleo se comportam como as criptas do jejuno e íleo formar enteroids. (C) criptas colônicas são banhados em matriz da membrana basal após o isolamento. As criptas próximos e formulário colonoids após 7 dias (barras de escala: 100 m). Por favor, clique aqui para ver uma versão maior desta figura.
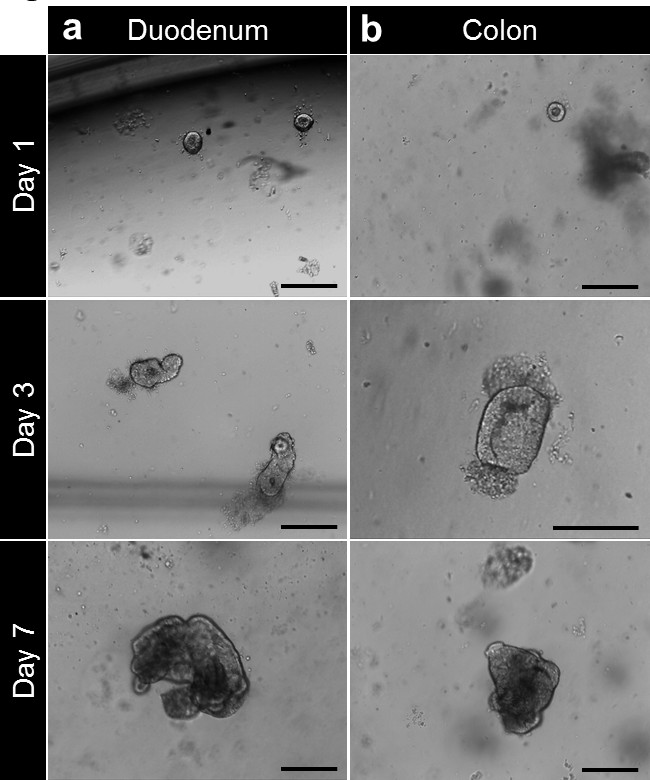
Figura 4. cultura Crypt e enteroid humano e geração colonoid de biópsia. (A) criptas duodenais banhados em matriz da membrana basal após o isolamento. As criptas estão fechando-se depois de 3 a 4 horas e começar a inflar-se Beyond este tempo para formar enterospheres. Aos 7 dias, os enteroids são formados. (B) Após o isolamento e cultura, criptas do cólon são plaqueadas em matriz de membrana basal. As criptas fechar-se para formar colonospheres então colonoids após 7 dias (barras de escala: 100 m). Por favor, clique aqui para ver uma versão maior desta figura.
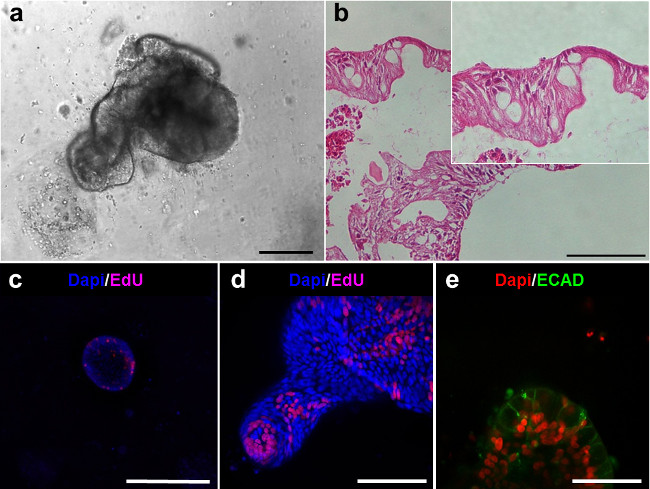
Figura 5. linhagens intestinais dos enteroids humanos. (A) enteroid humano após 6 dias em cultura. (B) secções com Hematoxilina-eosina dos enteroids em (A) demonstram o revestimento epitelial (Barras de escala: 100 uM). (CD) de imagem confocal de enteroids após coloração EdU (magenta) mostra a presença de células proliferativas. (E ) imagem confocal de enteroids demonstra a presença de: E-caderina em células epiteliais (ECAD, verde) (Escala:. 50 mm) Por favor, clique aqui para ver uma versão maior desta figura.
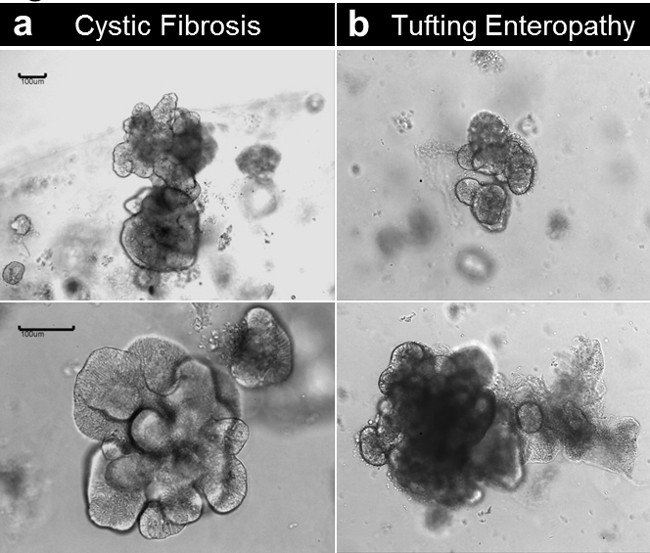
Figura 6. cultura cripta e geração enteroid humano a partir de tecido doente. (A) Enteroids estabelecida a partir de um espécime de fibrose cística. (B) Enteroids estabelecida a partir de uma amostra congênitas acolchoamento enteropatia (barras de escala: 100 mm). Por favor, clique aqui para ver uma versão maior desta figura.
Filme 1. Enterosphere formando enteroid humano em cultura. 32 hr de tempo voltase filme mostra um enterosphere estabelecida a partir de intestino delgado humano retraindo para formar um enteroid na cultura. Por favor clique aqui para ver este vídeo.
| Nome do Reagente | Companhia | Número de Catálogo | Solvente | Da Concentração | Concentração final | Comentário |
| Fosfato de Dulbecco solução salina tamponada Ca 2+, Mg 2+ livre (DPBS) | Tecnologias da vida; Gibco | 14190-144 | - | - | 1x | |
| Etilenodiamina ácido tetra-acético (EDTA) | Sigma-Aldrich | 431788 | Ultrapura dH2O | 0,5 M | 2 mM | |
| Sorbitol | Fischer Scientific | BP439-500 | DPBS | Pó | 2% | |
| Sacarose | Fischer Scientific | BP220-1 | DPBS | Pó | 1% | |
| Albumina de soro bovino (BSA) Fracção V | Fischer Scientific | BP1600-100 | DPBS | Pó | 1% | |
| Solução Gzntamycin / Anfotericina B | Tecnologias da vida; Gibco | R-015-10 | - | 500x | 1x | |
| Wnt-3A conditionned médio | em casa | - | - | - | - | |
| Avançada DMEM / F12 | Tecnologias da vida; Gibco | 12634-028 | - | - | - | |
| HEPES 1M | Tecnologias da vida; Gibco | 15630-080 | - | 1 H | 10 mM | |
| GlutaMAX (glutamina) | Tecnologias da vida; Gibco | 35050-061 | - | 100X | 1X | |
| Penicilina-estreptomicina (10.000 U / ml) | Tecnologias da vida; Gibco | 15140-148 | - | 100X | 1X | |
| N2 Suplemento | Tecnologias da vida; Gibco | 17502-048 | - | 100X | 1X | |
| B27 Supplement | Tecnologias da vida; Gibco | 17504-044 | - | 50X | 1X | |
| N-Acetilcisteína | Sigma-Aldrich | A9165-5G | DPBS | 1 H | 1 mM | |
| Nicotidamide | Sigma-Aldrich | N0636 | DPBS | 1 H | 10 mM | |
| Matrigel, GFR, Fenol (matriz da membrana basal) livre | Corning | 356231 | - | - | - | NECESSÁRIO |
| Noggin humana recombinante | R & D | 6057-NG / CF | DPBS | 100 ug / ml | 100 ng / ml | Outros fornecedores: I & D; Anaspec e PreproTech |
| humano recombinante R-espondina | PreproTech | 120-38 | DPBS | 1 mg / ml | 1 ug / ml | |
| EGF humano recombinante | Sigma-Aldrich | E9644-.2MG | DBPS | 500 ug / ml | 50 ng / mL | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | DPBS | 10 mM | 10 uM | |
| A-83-01 | Tocris | 2939 | DMSO | 500 uM | 500 nM | |
| SB202190 | Sigma-Aldrich | S7067-5MG | DMSO | 30 mM | 10 uM | |
| humano [Leu] 15 1-Gastrina | Sigma-Aldrich | G9145-.1MG | DPBS | 100 uM | 10 nM | |
| CHIR99021 | Stemgent | 04-0004 | DMSO | 10 mM | 2,5 uM | |
| Thiazovivin | Stemgent | 04-0017 | DMSO | 10 mM | 2,5 uM | |
| TrypLE expresso Enzima (1X), vermelho de fenol (enzima de dissociação de células) | Tecnologias da vida; Gibco | 12605-010 | - | - | - | Para passaging |
| Soro Bovino Fetal | Tecnologias da vida; Gibco | 10082-147 | - | - | - | Para passaging |
| CTS Synth-a-Freeze (meio de congelamento) Medium | Tecnologias da vida; Gibco | A13713-01 | - | - | - | Para congelamento |
| Linha de células L Wnt-3A | ATCC | CRL-2647 | - | - | - | Wnt-3A conditionned produção de mídia |
| Ensaio de luciferase de Renilla | Promega | E2710 | - | - | - | Wnt-3A conditionned atividade de mídia |
| humano recombinante Wnt-3A | R & D | 5036-WN / CF | DPBS | 100 ug / ml | 100 ng / ml | Wnt-3A conditionned atividade de mídia |
| Linha celular HEK293 TOPflash | - | - | - | - | - | Wnt-3A conditionned atividade de mídia; Presente de Hans Clevers laboratório |
Tabela 1. lista detalhada com reagente fabricante preferido e número de catálogo.
| Equipamento | Consumível | Ferramentas |
| Câmara de fluxo laminar | 15 e 50 ml tubos cônicos | Dumont # 5 fórceps padrão (FST; # 11251-20) |
| CO 2 Incubadora | Tubos de microcentrífuga | Dumont # 7, uma pinça fina curvas (FST; # 11274-20) |
| Stereo-microscópio | Placas de 24 poços | Tesoura fina (FST; # 14060-09) |
| Centrifugador | Filtros de 0,22 um (Sartorius) | Tesoura primavera Vannas (FST; # 15018-10) |
| Shaker Orbital | Pipetas sorológicas | Minutien diâmetro dos pinos 0,2 milímetros (FST; # 26002-20) |
| Recipiente de congelamento (Nalgene) | Dicas micropipeta | Diâmetro minutien pinos 0,1 milímetros (FST; # 26002-10) |
| Sylgard 184 de silicone (Dow Corning) | 150 mm aberturas de malha, uma triagem de nylon (Aqua-fornecimento dinâmico) | |
| Vidro placa de Petri | 5 ml tubos de polipropileno de fundo redondo (Falcon) | |
| Pipeta sorológica | 18G agulha de preenchimento sem corte (BD) | |
| Micropipeta | 3 ml lsyringes com pontas Luer-Lock (BD) | |
| Cryovials |
Tabela 2. detalhada de consumo, ferramentas e equipamentos necessários para o isolamento das criptas e da cultura.
Discussão
Este método oferece um sistema completo de reprodução de linhagens epiteliais do intestino e dinâmicas epiteliais, que constituem uma ferramenta útil para estudar biologia epitelial intestinal. O método aqui apresentado foi adaptado a partir do estudo original de murino por Sato e Clevers 22, que de forma eficiente resulta em enteroids humanos e colonoids. Aqui, nós colhidos manualmente até as criptas por microdissection para evitar quaisquer contaminantes celulares. Este método permite uma visualização direta das criptas e leva a horas extras consistência em relação à coleta cripta original por "agitação". Outros grupos desenvolveram técnicas similares usando abordagens ligeiramente diferentes especialmente substituindo a quelação pelo EDTA com colagenase 25. Além das diferenças de recolha cripta, essas técnicas usam um meio definido que é necessário para crescer as enteroids humanos em cultura 22. Para aumentar a eficiência de crescimento a cripta semeadura, nós adicionamos um inibidor da GSK3 (CHIR99021)para os dois primeiros dias 12.
A manipulação do tecido ou biópsias é importante e o isolamento cripta deve ser realizado logo que o tecido chega ao laboratório. No entanto, o isolamento e cultura cripta retardada pode ser realizada até 24 horas após a recolha de tecidos (dados não mostrados) tal como anteriormente descrito para o tecido 26 de murino. O tecido intestinal deve ser colocada num tubo cónico completamente preenchido com DPBS para evitar a ruptura de tecido e deve ser mantida a 4 ° C. A preparação atrasada permite o transporte do tecido, mas a variação de temperatura deve ser evitada durante o transporte. O tempo total necessário para o plaqueamento inicial cripta é de aproximadamente 2 horas com 15 a 30 min para processar o tecido e 1 a 2 horas para isolar e placa da cripta. O microdissection do tecido é um determinante crítico e predicado de uma preparação cripta limpo. No entanto, a liberação cripta por mão-agitando como descrito em vários protocolos é possível 22,23.
Apesar das semelhanças com o sistema enteroid murino (enteroids), os enteroids humanos exigem moléculas específicas para aumentar e sustentar seu crescimento ao longo do tempo. Os factores de crescimento, EGF, Noggin, R-espondina são utilizados de forma semelhante para os Organóides epiteliais murino. No entanto, o uso de Wnt-3A é crítica. Observou-se que a formação, bem como a eficiência do crescimento é maior utilizando um meio condicionado de Wnt-3A do que a proteína humana recombinante. Concomitantemente, que demonstrou melhoria das condições de cultura utilizando um inibidor da glicogénio sintase quinase 3 (CHIR99021) 12. Factores de crescimento recombinantes que podem ser substituídos por Wnt-3A, R-espondina, e Noggin condicionado meios. Uma linha de células L expressando Wnt-3A-se comercialmente disponível (ATCC). Outros grupos desenvolveram R-1- espondina 23,27, Noggin- 19, e Wnt-3A / R-spondin3 / Noggin- 28 linhas celulares que expressam. Dois inibidores de moléculas pequenas são utilizadas na cultura mediâmetro e são necessários para a manutenção da cultura 29. A-83-01 é um inibidor selectivo do factor de transformação de crescimento β e receptores de Activina / nodais (activina-quinase semelhante a 4, 5, 7) e SB202190 é um inibidor de proteína quinase p38 mitogen-activated (MAPK). Ambos os inibidores foram utilizados, respectivamente, para sustentar humana induzida células-tronco pluripotentes auto-renovação e estabelecer células pluripotentes ingênuos humanos tronco 30-32. Além disso, a nicotinamida, um precursor de dinucleótido nicotinamida adenina, é necessária para manter enteroids e expansão colonoids de forma a longo prazo 22,29.
A quelação de EDTA é um passo importante, uma vez que determina o rendimento a partir da preparação da cripta. Temos sido bem sucedidos com 2 tratamento EDTA mM. No entanto, a concentração de EDTA pode ser modificado a partir de 2 mM a 15 mM em relação ao tipo de tecido. Nesse caso, o tempo de incubação tem que ser determinado empiricamente. Após a colocação inicial, a cripta vai arredondar-up e, eventualmente, formar enteroids. No entanto, os enteroids ou colonoids muitas vezes demonstram um fenótipo "tronco", formando esferas com pouco ou nenhum células diferenciadas. Nesse caso, a diferenciação pode ser iniciada através da retirada de Wnt-3A, nicotinamida e o inibidor de p38 MAPK. O uso de inibidor de Notch, como DAPT ou DBZ ajuda a reforçar a diferenciação dentro dos enteroids 22.
Este modelo recapitula a fisiologia intestinal com eventos de brotamento cripta contínuas decorrentes de um compartimento de células estaminais, bem como domínios epiteliais vilo-como contendo tanto de absorção e secreção diferenciadas linhagens. Curiosamente, este sistema não contém células mesenquimais e usa condições de mídia específicos para atender às exigências de sinal nicho.
Como o modelo de murino, enteroids humanos podem ser gerados a partir de células epiteliais intestinais isoladas para testar a capacidade das referidas células para funcionar como uma célula estaminal. Several estudos usaram conjunto de marcadores de diferenciação (CD44, CD24 ou CD166) e células positivas EphB2 para enriquecimento em células estaminais com propriedades 12,23,33. Juntos, estes estudos demonstram a utilidade de enteroids humanos culturas para testar a stemness. Outros pesquisadores estão usando esse modelo para investigar doenças intestinais, como doenças infecciosas diarréicas, fibrose cística, ou câncer colorretal 22,34-37. Estes estudos demonstram que enteroids humanos constituem um modelo da doença humana confiável, com uma possibilidade de avançar para uma triagem personalizado. Enteroids humanos podem ser geneticamente modificadas utilizando transfecção de DNA ou a infecção com 38 partículas virais. Isto proporciona uma ferramenta poderosa para estudar as funções específicas do gene dentro das Organóides epiteliais humanas ou corrigir mutações genéticas. Recentemente, Cambaleas e colegas demonstraram a possibilidade de modificar o genoma com o sistema CRISPR / Cas9 e corrigir a mutação no gene de CFTR causando acfibrose ystic 24. Enteroids Humanos constituem um sistema valioso para estudar células-tronco intestinal e biologia da mucosa epitelial e servir como um sistema experimental novela para estudar fisiologia gastrointestinal normal e anormal.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We gratefully acknowledge Dr. Hans Clevers (Hubrecht Institute for Developmental Biology and Stem Cell Research, Netherlands) for the kind gift of TOPflash cells.
This project was supported in part by NIH-R01DK083325 (MAH); NIH P30 DK078392 (Digestive Health Center); NIH UL1RR026314 (CTSA).
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate buffered saline Ca2+, Mg2+ free (DPBS) | Life technologies; Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Sorbitol | Fischer Scientific | BP439-500 | |
| Sucrose | Fischer Scientific | BP220-1 | |
| Bovine serum albumin (BSA) Fraction V | Fischer Scientific | BP1600-100 | |
| Gzntamycin/Amphotericin B solution | Life technologies; Gibco | R-015-10 | |
| Wnt-3A conditioned medium | in house | ||
| Advanced DMEM/F12 | Life technologies; Gibco | 12634-028 | |
| HEPES 1M | Life technologies; Gibco | 15630-080 | |
| GlutaMAX (glutamine) | Life technologies; Gibco | 35050-061 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life technologies; Gibco | 15140-148 | |
| N2 Supplement | Life technologies; Gibco | 17502-048 | |
| B27 Supplement | Life technologies; Gibco | 17504-044 | |
| N-Acetylcysteine | Sigma-Aldrich | A9165-5G | |
| Nicotidamide | Sigma-Aldrich | N0636 | |
| Matrigel, GFR, Phenol free (basement membrane matrix) | Corning | 356231 | |
| human recombinant Noggin | R&D | 6057-NG/CF | |
| human recombinant R-Spondin | Preprotech | 120-38 | |
| human recombinant EGF | Sigma-Aldrich | E9644-.2MG | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | |
| A-83-01 | Tocris | 2939 | |
| SB202190 | Sigma-Aldrich | S7067-5MG | |
| human [Leu]15-Gastrin 1 | Sigma-Aldrich | G9145-.1MG | |
| CHIR99021 | Stemgent | 04-0004 | |
| Thiazovivin | Stemgent | 04-0017 | |
| TrypLE Express Enzyme (1X), phenol red (cell dissociation enzyme) | Life technologies; Gibco | 12605-010 | |
| Fetal Bovine Serum | Life technologies; Gibco | 10082-147 | |
| CTS Synth-a-Freeze Medium (freezing medium) | Life technologies; Gibco | A13713-01 | |
| L Wnt-3A cell line | ATCC | CRL-2647 | |
| Renilla luciferase assay | Promega | E2710 | |
| human recombinant Wnt-3A | R&D | 5036-WN/CF | |
| HEK293 TOPflash cell line |
Referências
- Noah, T. K., Donahue, B., Shroyer, N. F. Intestinal development and differentiation. Exp Cell Res. 317 (19), 2702-2710 (2011).
- Shroyer, N. F., Kocoshis, S., Hyams, J. R. W. . Pediatric Gastrointestinal and Liver Diseases. , 324-336 (2010).
- Leushacke, M., Barker, N. Ex vivo culture of the intestinal epithelium: strategies and applications. Gut. , (2014).
- Simon-Assmann, P., Turck, N., Sidhoum-Jenny, M., Gradwohl, G., Kedinger, M. In vitro models of intestinal epithelial cell differentiation. Cell Biol Toxicol. 23 (4), 241-256 (2007).
- Barker, N., et al. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 6 (1), 25-36 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Mahe, M. M., et al. Establishment of Gastrointestinal Epithelial Organoids. Current Protocols in Mouse Biology. 3, 217-240 (2013).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340 (6137), 1190-1194 (2013).
- Stelzner, M., et al. A nomenclature for intestinal in vitro cultures. Am J Physiol Gastrointest Liver Physiol. 302 (12), G1359-G1363 (2012).
- Ramalingam, S., Daughtridge, G. W., Johnston, M. J., Gracz, A. D., Magness, S. T. Distinct levels of Sox9 expression mark colon epithelial stem cells that form colonoids in culture. Am J Physiol Gastrointest Liver Physiol. 302 (1), G10-G20 (2012).
- Furstenberg, R. J., et al. Sorting mouse jejunal epithelial cells with CD24 yields a population with characteristics of intestinal stem cells. Am J Physiol Gastrointest Liver Physiol. 300 (3), G409-G417 (2011).
- Wang, F., et al. Isolation and Characterization of Intestinal Stem Cells Based on Surface Marker Combinations and Colony-Formation Assay. Gastroenterology. , (2013).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc Natl Acad Sci U S A. 109 (2), 466-471 (2012).
- Es, J. H., et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nat Cell Biol. 14 (10), 1099-1104 (2012).
- Yui, S., et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat Med. 18 (4), 618-623 (2012).
- Durand, A., et al. Functional intestinal stem cells after Paneth cell ablation induced by the loss of transcription factor Math1 (Atoh1). Proc Natl Acad Sci U S A. 109 (23), 8965-8970 (2012).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Akcora, D., et al. The CSF-1 receptor fashions the intestinal stem cell niche. Stem Cell Res. 10 (2), 203-212 (2013).
- Farin, H. F., Van Es, J. H., Clevers, H. Redundant sources of Wnt regulate intestinal stem cells and promote formation of Paneth cells. Gastroenterology. 143 (6), 1518-1529 (2012).
- Rothenberg, M. E., et al. Identification of a cKit(+) colonic crypt base secretory cell that supports Lgr5(+) stem cells in mice. Gastroenterology. 142 (5), 1195-1205 (2012).
- Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured 'miniguts. Mol Cell Biol. 32 (18), 3639-3647 (2012).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. , (2014).
- Fuller, M. K., et al. Intestinal stem cells remain viable after prolonged tissue storage. Cell Tissue Res. 354 (2), 441-450 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Miyoshi, H., Ajima, R., Luo, C. T., Yamaguchi, T. P., Stappenbeck, T. S. Wnt5a potentiates TGF-beta signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Koo, B. K., Clevers, H. Stem Cells Marked by the R-Spondin Receptor Lgr5. Gastroenterology. , (2014).
- Li, W., et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell. 4 (1), 16-19 (2009).
- Tojo, M., et al. The ALK-5 inhibitor A-83-01 inhibits Smad signaling and epithelial-to-mesenchymal transition by transforming growth factor-beta. Cancer Sci. 96 (11), 791-800 (2005).
- Gafni, O., et al. Derivation of novel human ground state naive pluripotent stem cells. Nature. 504 (7479), 282-286 (2013).
- Gracz, A. D., et al. Brief report: CD24 and CD44 mark human intestinal epithelial cell populations with characteristics of active and facultative stem cells. Stem Cells. 31 (9), 2024-2030 (2013).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med (Maywood). , (2014).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat Med. 19 (7), 939-945 (2013).
- Kovbasnjuk, O., et al. Human enteroids: preclinical models of non-inflammatory diarrhea. Stem Cell Res Ther. 4, S3 (2013).
- Fujii, M., Sato, T. Culturing intestinal stem cells: applications for colorectal cancer research. Front Genet. 5, 169 (2014).
- Koo, B. K., Sasselli, V., Clevers, H. Retroviral gene expression control in primary organoid cultures. Curr Protoc Stem Cell Biol. 27 (Unit 5A), 6 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados