Method Article
전체 조직과 조직 검사에서 인간 상피 Enteroids과 Colonoids 설립
요약
We describe a method to establish human enteroids from small intestinal crypts and colonoids from colon crypts collected from both surgical tissue and biopsies. In this methodological article, we present the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
초록
The epithelium of the gastrointestinal tract is constantly renewed as it turns over. This process is triggered by the proliferation of intestinal stem cells (ISCs) and progeny that progressively migrate and differentiate toward the tip of the villi. These processes, essential for gastrointestinal homeostasis, have been extensively studied using multiple approaches. Ex vivo technologies, especially primary cell cultures have proven to be promising for understanding intestinal epithelial functions. A long-term primary culture system for mouse intestinal crypts has been established to generate 3-dimensional epithelial organoids. These epithelial structures contain crypt- and villus-like domains reminiscent of normal gut epithelium. Commonly, termed “enteroids” when derived from small intestine and “colonoids” when derived from colon, they are different from organoids that also contain mesenchyme tissue. Additionally, these enteroids/colonoids continuously produce all cell types found normally within the intestinal epithelium. This in vitro organ-like culture system is rapidly becoming the new gold standard for investigation of intestinal stem cell biology and epithelial cell physiology. This technology has been recently transferred to the study of human gut. The establishment of human derived epithelial enteroids and colonoids from small intestine and colon has been possible through the utilization of specific culture media that allow their growth and maintenance over time. Here, we describe a method to establish a small intestinal and colon crypt-derived system from human whole tissue or biopsies. We emphasize the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
서문
위장관의 상피 라이닝 갱신 상수이다. 이 프로세스는 연속적으로 급격하게 변 위에 장내 상피 세포를 대체하는 자손을 생산 장 줄기 세포 (ISCS)의 증식에 의해 유발된다. ISCS 이루어지는 증식 구획 소낭의 바닥에 한정된다. ISCS는 결국 흡수 또는 분비 계통으로 분화 자손을 야기. 그들은 루멘 1로 각질 제거하기 전에 위쪽으로 마이그레이션 할 지하실에서 그리고 융모 또는 표면 상피에 이동, 세포가 점진적으로 차별화. ISCS는 장 세포, microfold 세포, 세포 enteroendocrine, 술잔 세포, 다발 Paneth 세포 및 세포를 포함한 모든 장내 상피 세포 유형을 야기. 콜론 흩어져 enteroendocrine과 술 세포를 2 주로 colonocytes과 술잔 세포로 구성 연장 지하실, 특징입니다.
생체 내 막 다른진짜야 시스템은 ISC 유지 보수 및 장 조직의 항상성 연구를위한 유망한 도구를 구성한다. 생리 학적 조건과는 완전히 재생 상피 미세 종종 3,4-을 변경하지 않는 한 그러나, 조직 배양 기술에 의존하는 것은 곤란하다. ISC 분야에서 중요한 발전을 유지하고 정상 장내 틈새 신호들을 대체하기 위해 정의 된 성장 인자를 사용하여 각각 뮤린 ISCS 확대를 조직 배양 기술을 확립했다. 장기 배양 조건이 사토 등의 알에 의해 설명되었다.,있는 하나의 지하실 또는 장내 상피 세포에서 고립 된 줄기 세포는 여러 토굴 같은 도메인 5-7를 포함하여 3 차원 상피 구조를 형성하기 위해 성장한다. 이러한 삼차원 구조는 계속 확장하는 핵분열 이벤트를 겪는다. 흥미롭게도, 원점의 모든 조직에 특정 장내 세포 유형이 생성되고,도 8 루멘으로 압출된다. 이 시스템의 수정을 사용하여, 상피organoids이 위장, 소장 및 결장에서 생성 될 수있다. 보다 구체적으로, 소장의 상피 organoids는 enteroids (9), 그리고 대장에서 사람들은 colonoids 9,10입니다. 이러한 상피 organoid 배양 시스템은 세포 격리 따라서 5,6,10-15의 "stemness"를 테스트하는 시험 관내에서 줄기 세포로서 기능 절연 단셀의 능력을 시험하는데 사용되어왔다. 다른 연구자들은 각각의 상피 세포 16 ~ 21의 기능을 연구하는 enteroids과 colonoids을 모두 사용했다. 따라서 enteroid 및 colonoid 배양 모두 줄기 및 비 줄기 세포의 기능을 평가하고 기본적인 셀룰러 창자 내의 상호 작용에 새로운 통찰력을 제공 할 수있다.
2011 년 사토와 동료들은 인간의 소장과 대장 (22, 23)에서 파생 된 상피 organoids의 장기 문화를 생성합니다. 미디어 조성, 인간 상피 enteroids의 차이 또한및 colonoids들은 뮤린과 마찬가지의 기능을 나타낸다. 또한, 그들은 그러한 바렛 식도, 선종 또는 선암종, 22, 24 및 낭포 성 섬유증과 같은 병에 걸린 조직으로부터 생성 될 수있다. 인간 enteroids 장내 줄기 세포와 상피 점막 생물학을 공부하고 정상 및 비정상 모두 위장관 생리학 3을 연구하는 새로운 실험 시스템 역할을 할 수있는 시스템을 구성한다.
여기에서 우리는 인간의 소장과 대장 지하실 (그림 1)에서 enteroids과 colonoids을 설정하는 방법을 설명합니다. 이 방법 론적 검토, 우리는 전체 조직 생검에서 토굴 수집을 강조한다. 우리는 성공적인 성장과 인간의 enteroids 및 colonoids이 모델에 의해 수행 가능한 실험 전략의 유지 보수에 필수적인 문화 양식을 요점을 되풀이.
프로토콜
참고 : 윤리 선언문 : CCHMC에서 IRB 승인을 받았다 여기에 설명 된 인체 조직을 사용하는 모든 실험 (IRB # 2012년부터 2858년까지 # 2014-0427). 조직 수집, 저장 및 사용을위한 시료는 동의서 CCHMC에서 공여자로부터 수득 하였다.
문화 1. 준비
참고 : 모든 시약은 표 1에 나열되어 있습니다.
- 다음과 같이 EDTA 주식 솔루션을 준비 : 0.5 M 에틸렌 디아민 테트라 아세트산, 초순수 H 2 O, 0.22 μm의 필터 살균 필터의 pH 8 (EDTA)를 준비합니다. 선택적으로, 무한 RT에서 EDTA 주식 솔루션을 저장합니다.
- 다음 킬레이트 버퍼 준비 : 2 % 소르비톨, 1 % 수크로오스, 1 % 소 혈청 알부민 분획 V (BSA)을 혼합하고 1X 젠타 마이신 / 둘 베코 인산 암포 테리 용액 칼슘없이 완충 식염수 2+ 및 Mg를 2+ (DPBS)는, 필터 멸균 0.22 μm의 필터. 킬레이트 버피 준비우퍼 신선한.
- 이 Wnt-3A-조정 배지는 제조업체의 지침 (ATCC, CRL-2647)에 따라 세포주 L의 Wnt-3A를 사용하여 집에서 만들어 다음과 같이 매체의 Wnt-3A는 에어컨 준비합니다. 0.22 μm의 필터로 멸균 2 mM의 글루타민, 10 mM의 HEPES, 100 U / ㎖ 페니실린, 100g / ml의 스트렙토 마이신, 1 N2 보충제, B27 보충제 (1), 1 % BSA 및 필터 매체를 보완.
참고 : 테스트 TOPflash 분석을 사용하여이 Wnt 활동에 대한 모든 배치. 제조업체의 지침에 따라 레 닐라 루시퍼 라제 분석 키트와 함께 안정된 HEK293 TOPflash 세포주 (한스 클레 버스 랩)를 사용합니다. 100 NG / ml의 인간 재조합의 Wnt-3A와 TOPflash 분석을 정상화. 대조군에 비해 조정 배지의 적어도 10 배의 활성 변화를 확인한다. 최대 6 개월 -20 ° C에서 15 ML 원뿔 튜브 및 동결에 10 ml의 분취 량에 신선한의 Wnt-3A-조정 배지를 나눈다. 스토어 활동의 손실없이 4 ° C에서 5 일 분량을 해동. - 홍보0.22 살균 2 mM의 글루타민, 10 mM의 HEPES, 100 U / ㎖ 페니실린 100 ㎍ / ㎖ 스트렙토 마이신, 1 N2 보충제, 1 B27 보충제, 1 % BSA 및 필터와 함께 보충 고급 DMEM은 / F12 배지를 다음과 같이 인간 minigut 매체 epare μm의 필터.
참고 : 최대 3 개월까지 -20 ° C에서 15 ML 원뿔 튜브 및 동결에 10 ml의 분취 량에 신선한 인간의 minigut 매체를 나눈다. 스토어 활동의 손실없이 4 ° C에서 5 일 분량을 해동. - 다음과 같이 완전한 인간 minigut 매체를 준비합니다 토굴 문화 또는 50 %의 Wnt-3A-조정 배지 (1.3 참조), 1 ㎍ / ㎖의 R-spondin 1 (1 보충 매체 변화 인간 minigut 매체 (1.4 참조) 전에 신선한 준비 : 1,000 1 ㎎ / ㎖ 주), (100) NG / ㎖ 소량의 희석 (1 : 1,000 100g / ㎖의 주), (50) NG / mL의 EGF (1 희석 : 500 ㎍ / ㎖의 주)의 10,000 희석, 500 nm의 A-83 -01 : 10 μM SB202190 (1 천 희석 500 M 주식) (1 : 3000 희석 30mm의 주식), 10 nM의 [레] 15 가스트린 1 (1 : 100 μM의 10,000 희석주식), 10 mM의 니코틴 아미드 (1 : 100 희석 한 M의 주)와 (1 mM의 N- 아세틸 시스테인 (N-acetylcysteine) : 1,000 희석 한 M 주식).
참고 : 활동의 손실없이 4 ℃에서 2 일 저장 완전한 인간 minigut 미디어.
전체 조직 2. 크립트 격리
주 : 조직 수집로부터, 식염수 샘플을 유지하는 것이 필수적이다. 이 운송 도중 얼음에 조직을 유지하는 것이 좋습니다. 토굴의 분리를위한 시료의 준비는 가능한 한 빨리 수행되어야한다.
참고 : 모든 시약은 표 1, 도구, 장비에 표시되고, 소모품을 표 2에 나열되어 있습니다.
- 실험을 시작하기 전에 모든 시약을 준비합니다. 얼음에 기저막 매트릭스 해동 사전 부화 37 ° C에서 CO 2 인큐베이터에서 24 웰 플레이트.
주 : 또는 웰 (24)의 중심에 / 15 μl를 이용하여 기저막 매트릭스의 박층을웰로는 37 ° C에서 CO 2 배양기에 배치합니다. 이 통성 단계는 중합 동안 드롭으로 기저막 행렬을 유지합니다. - 로 조직을 씻어 차가운 둘 베코의 인산이 칼슘과 마그네슘 2+ (DPBS)없이 완충 식염수. DPBS의 함유량이 깨끗해질 때까지 진행.
- 0.2 mm 직경 minutien 핀을 사용 빙냉 DPBS 가득 실리콘 피복 유리 페트리 접시에 조직을 확보. 스트레칭과 점막면이 위를 향하게 평면 조직을 고정.
- 해부 현미경, 마이크로 해부 가위와 미세 점 곡선 집게를 사용하여 점막하 층과 결합 조직에서 상부의 점막을 제거합니다 (그림 2A를, B).
- 스트레칭과 점막면이 위를 향하도록하여 실리콘 코팅 유리 페트리 접시에 해부 점막 평면 핀. 나머지 점막하 결합 조직은 폐기 또는 추가 실험 (도 2c)에 사용될 수있다.
- 부드럽게곡선 집게 점막 표면을 긁어. 이 단계는 제제의 품질을 향상시킬 필요가있다.
- 소장은 부드럽게 융모를 제거하기 위해 점막을 긁어.
- 콜론은 부드럽게 점액과 파편 제거 점막을 긁어.
- 융모와 파편을 제거하기 위해 얼음처럼 차가운 킬 버퍼와 점막을 3 ~ 4 회 반복한다.
- (49.6 ml의 킬 버퍼에 200 ㎕의 0.5 M EDTA) 갓 준비를 2mM EDTA 킬 레이션 버퍼와 점막을 커버.
- 얼음에 페트리 접시를 놓고 수평 진탕 기에서 30 분 동안 부드럽게 흔들어.
- EDTA없이 조직에게 얼음처럼 차가운 킬 버퍼에 3 ~ 4 회 반복한다. 세척 후, 얼음처럼 차가운 킬 버퍼의 점막을 둡니다.
- 곡선 미세 집게를 사용하여 해부 현미경 점막을 처리. 부드럽게 곡선 집게를 사용 장내 납골당을 해제 할 수있는 점막을 긁어.
- 부드럽게 파이를 사용하여 배양 접시에서 토굴 서스펜션을 제거pette은 50 ㎖ 원뿔형 튜브로 옮기고.
참고 : 거의 모든 납골당이 점막에서 제거되었는지 확인하기 위해 조직을 확인합니다. - 2 회 메쉬 150 μm의를 통해 지하실 정지를 필터링합니다.
참고 : 현미경 (그림 2D)에서 흐름을 통해 토굴 농축에 대한 확인하십시오. - 50 XG, 4 ° C에서 토굴 서스펜션 5 분 원심 분리기. 상층 액을 제거한다.
- 5 ㎖의 빙냉 완충액 킬레이트 펠렛을 재현 탁.
- 단계 2.15에서 정지에서 10 μL 드롭 당 지하실의 수를 계산합니다. 5 ml의 둥근 바닥 튜브에 도금에 필요한 지하실의 수를 전송합니다. enteroids 또는 colonoids을 설정하는 24 잘 접시 잘 당 200-500 납골당을 사용합니다.
- 원심 분리기 150g에서 10 분, 4 ° C의 토굴 부분. 상층 액을 제거합니다.
- 이후 문화 납골당을 사용합니다.
조직 검사 3. 크립트 격리
- 전에 모든 시약을 준비실험의 시작. 얼음에 기저막 매트릭스 해동 사전 부화 37 ° C에서 CO 2 인큐베이터에서 24 웰 플레이트.
- 와 조직 검사를 씻어 얼음처럼 차가운 둘 베코의 인산염은 칼슘과 마그네슘 2+ (DPBS)없이 완충 식염수.
- 0.1 mm 직경 minutien 핀을 사용하여, 얼음처럼 차가운 DPBS로 채워진 실리콘 코팅 유리 페트리 접시에 조직 검사를 고정합니다. 스트레칭과 점막면 (그림 2E)을 위로 향하게 평면 점막을 고정.
- 부드럽게 융모 이물질 및 기타 먼지를 제거하려면 곡선 집게와 점막의 표면을 긁어. 이 단계는 제제의 품질을 향상시킬 필요가있다.
- 융모와 파편을 제거하기 위해 얼음처럼 차가운 킬 버퍼와 조직 검사 3 ~ 4 회 반복한다.
- (49.8 ml의 킬 버퍼에 200 ㎕의 0.5 M EDTA) 갓 준비를 2mM EDTA 킬 레이션 버퍼와 조직 검사를 커버.
- 얼음에 페트리 접시를 놓고 수평 진탕 기에서 30 분 동안 부드럽게 흔들어. <리> EDTA없이 조직 검사에게 얼음처럼 차가운 킬 버퍼에 3 ~ 4 회 반복한다. 세척 후, 얼음처럼 차가운 킬 버퍼에 조직 검사를 둡니다.
- 곡선 및 미세 집게를 사용하여 해부 현미경으로 조직 검사를 처리합니다. 부드럽게 점막 곡선 집게를 사용하여 장 지하실을 해제 긁어.
- 조심스럽게 피펫을 사용하여 페트리 접시에서 토굴 서스펜션을 제거하고 50 ML 원뿔 튜브로 전송.
참고 : 거의 모든 납골당이 점막에서 제거되었는지 확인하기 위해 조직을 확인합니다. - 150 μm의 나일론을 통해 토굴 현탁액 2 회 메쉬 필터.
참고 : 현미경으로 흐름을 통해 토굴 농축에 대한 확인하십시오. - 50 XG, 4 ° C에서 토굴 서스펜션 5 분 원심 분리기. 상층 액을 제거한다.
- 1 ml의 빙냉 킬레이트 버퍼에 펠렛을 재현 탁. 1.5 ml의 미세 원심 분리 튜브에 토굴 서스펜션을 전송합니다.
- 원심 분리기 150 XG, 4 ° C에서 10 분 동안 토굴 부분. 상층 액을 제거합니다.
- 이후 문화 납골당을 사용합니다.
지하실 막 매트릭스 4. 크립트 문화
- 사전 냉장 피펫 팁을 사용하여, 기저막 매트릭스 (200-500 지하실 / 50 μL 기저막 매트릭스)에서 (단계 2.18 또는 3.15에서) 지하실 펠렛을 재현 탁.
- 예열 접시에 잘 당 기저막 행렬의 토굴 현탁액의 50 μl를 적용합니다. 천천히 웰의 중심에 기저막 매트릭스를 토출.
- 30 분 기저막 매트릭스의 완전한 중합을 허용하기 위해 37 ° C, 5 % CO 2 인큐베이터에서 24 웰 플레이트를 놓는다.
- 2.5 μM CHIR99021 보충 완전한 인간 minigut 매체의 500 μL와 기저막 행렬을 오버레이 (1 : 4,000 희석 된 10 mM 주식) 2.5 μM Thiazovivin (1 : 4,000 희석 된 10 mM 주식).
- 37 ° C, 5 % CO 2 배양기에서 접시를 품어.
- 신선한 완전한 구호 물자와 매체를 교체N minigut 매체 2 일마다.
교양 Enteroids 및 Colonoids 5.과 Passaging.
참고 : 항로 Enteroids 및 Colonoids 초기 도금 후 모든 7~10일. 일반적으로 3 ~ 4 우물에 잘 하나를 분할합니다.
- 실험을 시작하기 전에 모든 시약을 준비한다. 얼음에 기저막 매트릭스 해동 사전 부화 37 ° C에서 CO 2 인큐베이터에서 24 웰 플레이트.
- 얼음처럼 차가운 DPBS의 1 ml의 멸균 팁 오버레이를 사용하여 용지를 제거합니다.
- 앞뒤로 1,000 μL 팁과 피펫. 새로운 15 ML 원뿔 튜브에 솔루션을 전송합니다.
- 배지 1 ㎖ 당 5 % FBS가 보충 된 인간 minigut 배지 2 ㎖를 추가한다.
- 50 XG, 4 ℃에서 5 분 동안 솔루션을 원심 분리기. 상층 액을 제거한다.
- (10 mM의 주식 1,000 희석 1) 10 μM Y-27632 보충 세포 분리 효소의 2 ml의 펠렛을 재현 탁. 5m 품다물을 욕조에 37 ° C에서의.
- 18-G 채우기 / 무딘 바늘을 구비 한 3 ㎖ 루어 잠금 주사기를 이용하여 셀 덩어리를 해리. 부드럽게 주사기를 이용하여 10 회 앞뒤로 용액을 피펫.
- 500 XG, 4 ℃에서 5 분 동안 정지를 원심 분리기. 상층 액을 제거한다.
- 미리 냉각 된 피펫 팁을 사용하여, 기저막 매트릭스에서 세포 펠렛을 재현 탁.
- 예열 접시에 잘 당 기저막 행렬의 토굴 현탁액의 50 μl를 적용합니다. 천천히 웰의 중심에 기저막 매트릭스를 토출.
- 20 분 기저막 매트릭스의 완전한 중합을 허용하기 위해 37 ° C, 5 % CO 2 인큐베이터에서 24 웰 플레이트를 놓는다.
- (10 mM의 주식 1,000 희석 1) 10 μM Y-27632 보충 완전한 인간 minigut 매체의 500 μL와 기저막 행렬을 오버레이.
- 37 ° C, 5 % CO 2 배양기에서 접시를 품어.
- 이일 후10 μM Y-27632와 보충 신선한 완전한 인간 minigut 매체와 매체 교환 (1 : 1000 희석 된 10 mM 주식). 그 후, 매일 신선한, 완전한 인간 minigut 매체와 매체를 교체합니다.
교양 Enteroids 및 Colonoids 6. 동결
참고 : 일반적으로 2 ~ 3 크리오 바이알 (cryovial)로 잘 하나를 동결.
- 반복 5.1-5.8 단계를 반복합니다.
- 차가운 냉동 매체와 펠렛을 재현 탁. 전송 레이블 cryovial에 솔루션을 동결 1 ㎖. 이소 프로필 알콜을 함유하는 500ml의 용기에 동결 cryovial 배치.
- 다음 액체 질소 저장에 cryovial 전송, 24 시간 동안 80 ° C 냉장고에 냉동 컨테이너를 전송합니다.
최대 1 년 보관 Enteroids 및 Colonoids : 주.
결과
도 2D는 전체 조직 (도 2D)에서 갓 절연 소낭의 전형적인 예를 나타낸다. 생검으로부터 분리 소낭의 수는 전체의 조직에서보다 낮다. 바늘로 표준 용량 생검 겸자를 사용하여, 우리는 일반적으로 하나의 패스를 두 조직 검사 물기를 수행합니다. 조직 검사 당 50 ~ 100 지하실의 평균 (그림 2 층)와 10mm 두 표면의 각 조직 검사 물린 결과.
기저막 매트릭스에서 배양 한 후, 지하실은 콜론에 대한 소장 및 colonospheres에 대한 enterospheres를 형성하기 위해 반올림. 일반적으로 신진 토굴은 파종 후 5-6 일 이내에 발생합니다. (Movie 1 (동영상 1) 그림 3A-C) 그러나 지하실 막 매트릭스의 구체를 형성하는 하나 enteroids (enteroids) 또는 colonoids (colonoids)을 참조하는 드문 일이 아니다. 계대는 enteroids의 크기에 따라 7 일 후에 수행 될 수있다. enteroids 또는 colonoids establ입니다조직 검사에서 ished 문화에서 같은 개발을받을. 시딩에 토굴 밀도가 낮은 그러나, 계대 배양은 통상 10-12일 후에 수행된다 (도 4a, b). Enteroids 및 colonoids 문화는 재현 방식으로 확장합니다.
모두 enteroids 및 colonoids은 내강면을 제시하고 상피 줄 지어있다 (그림 5A, B). 증식 세포는 enteroids 내에서 관찰 할 수 있으며, 새싹 팁 (그림 5C, D) 내에 위치하고 있습니다. E-cadherin의 (ECAD)로 염색 enteroids의 공 초점 영상은 상피 세포 (그림 5E)를 보여줍니다.
enteroids 및 colonoids 모두가 유전 / 선천성 질환을 가진 환자에서 얻은 조직에서 설정할 수 있습니다. 그림 6 인해 상피 세포 광고의 선천성 돌연변이 낭포 성 섬유증 (그림 6A) 및 터프 팅 병증 환자에서 성장 대표 enteroids를 보여줍니다hesion 분자 유전자 (는 EpCAM) (도 6B). 유전 적 결함 옆에 enteroids 기저 상태의 차이를 나타내지 않는다.

지하실 해리 인간 enteroids와 문화 colonoids의 발생 그림 1. 워크 플로우. 납골당 (인간의 소장 또는 대장에서)는 EDTA 킬 레이션에 의해 격리됩니다. 배양 된 납골당은 대장의 소장과 colonoids에 대한 enteroids를 형성한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
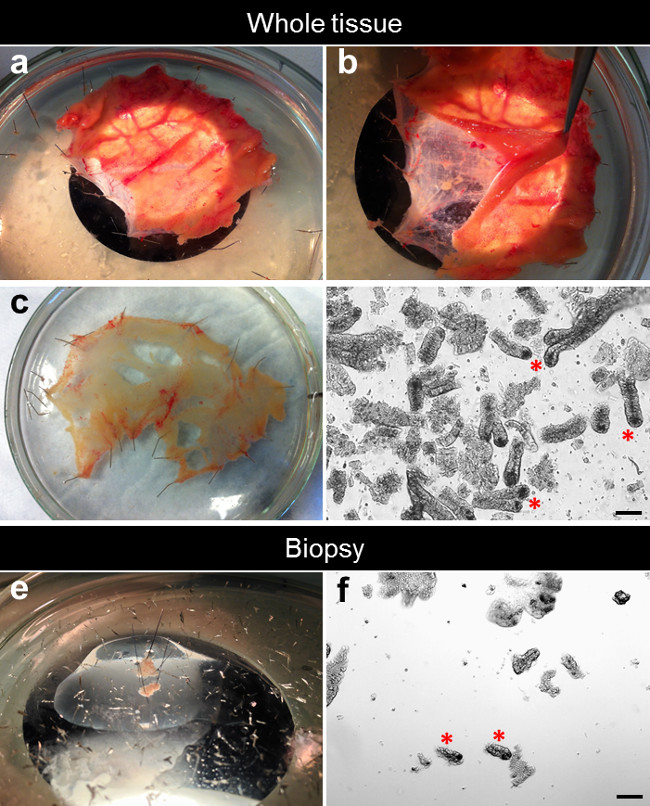
지하실 격리 그림 2. 해부 과정. (A) 소장 specimen은 뻗어 및 실리콘 코팅 페트리 접시에 평평하게 고정됩니다. (B) 하부 점막 점막하로부터 분리된다. (C)는 연신 점막 해부와 실리콘 코팅 된 배양 접시에 고정 된 평면이다. EDTA 킬레이트 후 (D)는, 소낭은 조직으로부터 분리된다. (E)는 신장 한 생검 및 실리콘 코팅 된 배양 접시에 고정 된 평면이다. (F)는 EDTA 킬 레이션 후, 지하실은 조직 검사에서 격리됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
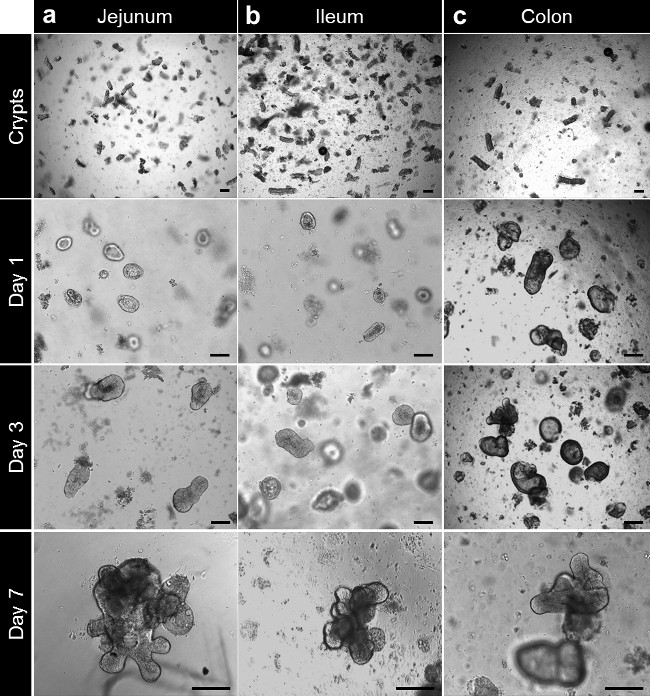
그림 3. 크립트 문화와 전체 조직에서 인간 enteroid과 colonoid 세대. (A) 차단 후 기저막 매트릭스에 도금 Jejunal의 납골당. 납골당은 3 ~ 4 시간 후 폐쇄하고이 시간 이후 enterospheres을 형성하도록 풍선을 시작한다. 칠일에서 jejunal enteroids 형성된다. 분리 및 배양 후 (B)는, 회장 지하실은 jejunal 지하실처럼 행동하고 회장 enteroids를 형성한다. (C) 결장 소낭은 분리 후에 기저막 매트릭스에 도금된다. 칠일 (스케일 바 : 100 ㎛) 후 납골당 가까이 형태 colonoids. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
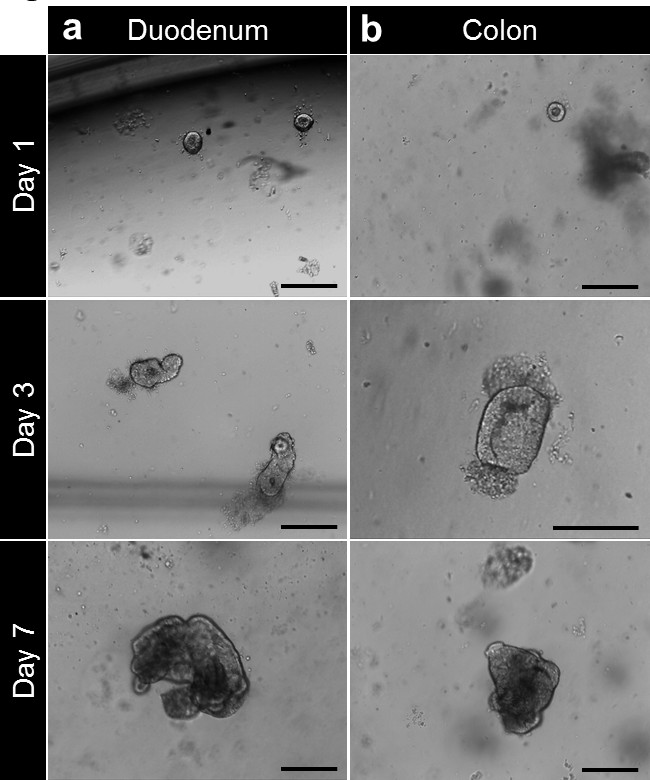
조직 검사에서 그림 4. 크립트 문화와 인간의 enteroid과 colonoid 세대. (A) 차단 후 기저막 매트릭스에 도금 십이지장 지하실. 납골당은 4 시간에 3 후 닫고 beyo을 풍선 시작된다차 이번에는 enterospheres을 형성한다. 칠일에서 enteroids 형성된다. (B) 분리 및 배양 한 후, 결장은 소낭 기저막 매트릭스에 도금된다. . : 지하실는 칠일 (100 μm의 스케일 바) 후 colonoids이 colonospheres을 형성 가까이 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
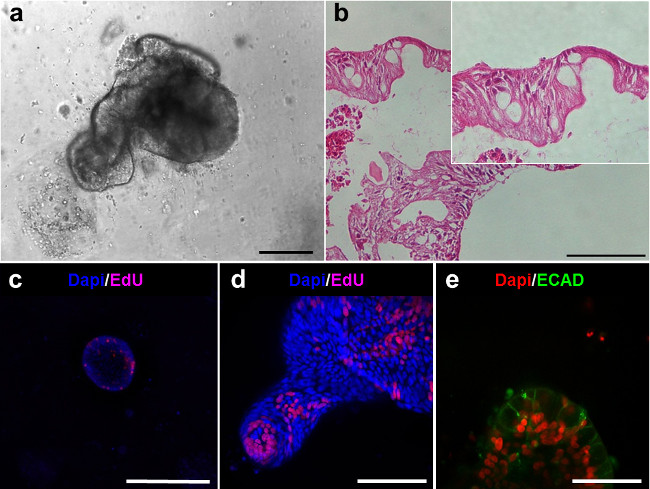
문화 6 일 후 그림 5. 인간 enteroids의 창자 계통. (A) 인간 enteroid. (B) (A) 안감 상피을 보여 주에 enteroids의 헤 마톡 실린 - 에오신 섹션 (스케일 바 : 100 ㎛). (CD) 에듀 염색 (마젠타) 후 enteroids의 공 초점 이미징은 증식 세포의 존재를 보여줍니다. (E ) enteroids의 공 초점 이미징의 존재 보여줍니다. 50 μm의) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
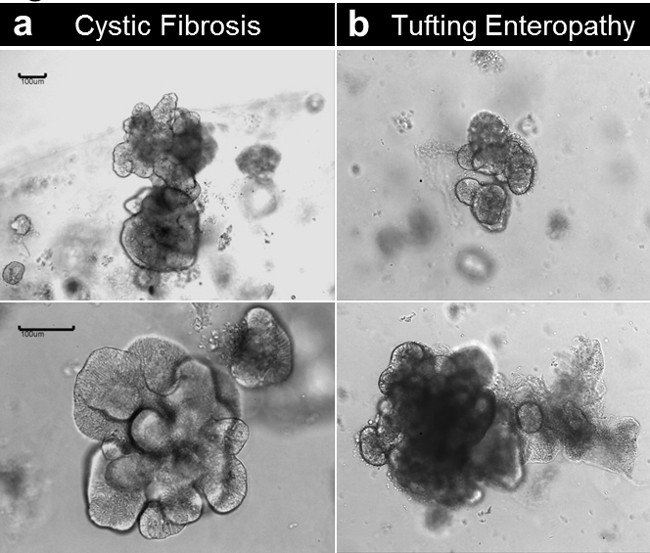
병에 걸린 조직에서 그림 6. 크립트 문화와 인간의 enteroid 세대. (A)은 낭포 성 섬유증 표본에서 설립 Enteroids. (B) Enteroids는 선천성 터프 팅 병증 표본에서 설립 (스케일 바 : 100 ㎛). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1. Enterosphere 문화에서 인간의 enteroid을 형성한다. 32 시간 시간 바퀴전자의 영화 문화에 enteroid을 형성 후퇴 인간의 소장에서 설립 된 enterosphere을 보여줍니다. 이 비디오를 시청하려면 여기를 클릭하십시오.
| 시약의 이름 | 회사 | 카탈로그 번호 | 용제 | 주식 농도 | 최종 농도 | 논평 |
| 둘 베코의 인산염은 식염수 칼슘, 마그네슘 2+ 무료 (DPBS) 버퍼 | Life 기술; 기브 | 14190-144 | - | - | 1 배 | |
| 에틸렌 디아민 디아민 테트라 아세트산 (EDTA) | 알드리치 | 431788 | 초순수 dH보다 2 O | 0.5 M | 2 mM의 | |
| 소르비톨 | 피셔 과학 | BP439-500 | DPBS | 가루 | 2 % | |
| 자당 | 피셔 과학 | BP220-1 | DPBS | 가루 | 1 % | |
| 소 혈청 알부민 (BSA) 분획 V | 피셔 과학 | BP1600-100 | DPBS | 가루 | 1 % | |
| Gzntamycin / 암포 테리 신 B 솔루션 | Life 기술; 기브 | R-015-10 | - | 500X | 1 배 | |
| 이 Wnt-3A는 매체를 conditionned | 집에서 | - | - | - | - | |
| 고급 DMEM / F12 | Life 기술; 기브 | 12634-028 | - | - | - | |
| HEPES 1M | Life 기술; 기브 | 15630-080 | - | 1 M | 10 mM의 | |
| 루타 (글루타민) | Life 기술; 기브 | 35050-061 | - | 100X | 1X | |
| 페니실린 - 스트렙토 마이신 (10,000 U / ㎖) | Life 기술; 기브 | 15140-148 | - | 100X | 1X | |
| N2 보충 | Life 기술; 기브 | 17502-048 | - | 100X | 1X | |
| B27 보충 | Life 기술; 기브 | 17504-044 | - | 50X | 1X | |
| N 아세틸 | 알드리치 | A9165-5G | DPBS | 1 M | 1 ㎜ | |
| Nicotidamide | 알드리치 | N0636 | DPBS | 1 M | 10 mM의 | |
| 마트 리겔, GFR, 페놀 무료 (기저막 매트릭스) | 코닝 | 356231 | - | - | - | 필수 |
| 인간 재조합 소량 | R & D | 6057-NG / CF | DPBS | 100 ㎍ / ㎖의 | 100ng의 / ㎖ | 다른 공급 업체 : R & D; Anaspec 및 Preprotech |
| 인간 재조합 R-Spondin | Preprotech | 120-38 | DPBS | 1 ㎎ / ㎖ | 1 ㎍ / ㎖의 | |
| 인간 재조합 EGF | 알드리치 | E9644-.2MG | admin으로 | 500 ㎍ / ㎖의 | 50 ng를 / ㎖ | |
| Y-27632 | 알드리치 | Y0503-1MG | DPBS | 10 mM의 | 10 μM | |
| A-83-01 | 토크리스 | 2,939 | DMSO | 500 μM | 500 nm의 | |
| SB202190 | 알드리치 | S7067-5MG | DMSO | 30 mM의 | 10 μM | |
| 인간의 [레] 15 가스트린 1 | 알드리치 | G9145-.1MG | DPBS | 100 μM | 10 nM의 | |
| CHIR99021 | Stemgent | 04-0004 | DMSO | 10 mM의 | 2.5 μM | |
| Thiazovivin | Stemgent | 04-0017 | DMSO | 10 mM의 | 2.5 μM | |
| TrypLE 익스프레스 효소 (1X), 페놀 레드 (세포 분해 효소) | Life 기술; 기브 | 12605-010 | - | - | - | 계대를 들어 |
| 태아 소 혈청 | Life 기술; 기브 | 10082-147 | - | - | - | 계대를 들어 |
| CTS 신디 동결 중간 (동결 중) | Life 기술; 기브 | A13713-01 | - | - | - | 동결 |
| L의 Wnt-3A 세포주 | ATCC | CRL-2647 | - | - | - | 이 Wnt-3A 미디어 생산 conditionned |
| 레 닐라 루시퍼 라제 분석 | 프로 메가 | E2710 | - | - | - | 이 Wnt-3A는 미디어 작동 conditionned |
| 인간의 재조합이 Wnt-3A | R & D | 5036-WN / CF | DPBS | 100 ㎍ / ㎖의 | 100ng의 / ㎖ | 이 Wnt-3A conditionned 미디어 활동 |
| HEK293 TOPflash 세포주 | - | - | - | - | - | 이 Wnt-3A는 미디어 작동 conditionned; 한스 클레 버스 실험실에서 선물 |
선호하는 제조 및 카탈로그 번호 표 1. 자세한 시약의 목록입니다.
| 장비 | 소모품 | 도구 |
| 층류 후드 | 15, 50 ML 원뿔 튜브 | 뒤몽 # 5 표준 집게 (FST # 11251-20) |
| CO 2 인큐베이터 | 미세 원심 튜브 | 뒤몽 # 7, 곡선 미세 집게 (FST # 11274-20) |
| 스테레오 현미경 | 24 웰 플레이트 | 미세 가위 (FST # 14060-09) |
| 원심 분리기 | 0.22 μm의 필터 (는 Sartorius) | Vannas 스프링 가위 (FST # 15018-10) |
| 진탕 | 혈청 학적 피펫 | 0.2 mm 직경 minutien 핀 (FST # 26002-20) |
| 냉동 컨테이너 (낼진) | 마이크로 피펫 팁 | 0.1 mm 직경 minutien 핀 (FST # 26002-10) |
| 실 가드 (184) 실리콘 (다우 코닝) | 150 μm의 메쉬 구멍, 나일론 검사 (동적 아쿠아 공급) | |
| 유리 페트리 접시 | 5 ml의 둥근 바닥 폴리 프로필렌 튜브 (팔콘) | |
| 혈청 학적 피펫 | 18G 무딘 채우기 바늘 (BD) | |
| 마이크로 피펫 | 루어 잠금 팁 3 ㎖ lsyringes (BD) | |
| 크리오 바이알 (cryovial) |
표 2. 자세한 소모품, 도구 및 장비.
토론
이 방법은 장내 상피 생물학을 연구하는 유용한 도구를 구성하는 장 상피 계통 및 상피 역학을 재생하는 완벽한 시스템을 제공합니다. 여기에 제공된 방법은 효율적으로 인간의 enteroids과 colonoids 결과 사토 Clevers (22)에 의해 원래의 쥐 연구에서 적응했다. 여기서 우리는 수동으로 세포 오염을 방지하기 위해 미세 절제하여 지하실을 집어 들었다. 이 방법은 지하실의 직접적인 시각화를 허용하고 "흔들어"에 의해 원래의 토굴 컬렉션에 비해 일관성 초과 근무로 이어집니다. 다른 그룹은 특히 콜라게나 제 (25) EDTA에 의해 킬레이트를 교체 약간 다른 접근 방법을 사용하여 비슷한 학술적 개발했다. 토굴 컬렉션의 차이 외에, 그 학술적 문화 (22)에 인간의 enteroids 성장하는 데 필요한 정의 용지를 사용합니다. 토굴 시드에서의 성장 효율을 높이기 위해 (CHIR99021)을 GSK3 억제제를 추가이틀간 12.
조직 또는 생검의 처리는 중요하며 토굴 아이솔레이션 즉시 티슈 랩에 도착하는대로 수행되어야한다. 그러나, 지연 토굴 격리 및 배양 조직 수집 후 24 시간까지 수행 될 수 뮤린 이전 조직 26에서 기술 한 바와 같이 (데이터는 보이지 않음). 장 조직이 완전히 조직의 혼란을 방지하기 위해 4 ℃로 유지되어야한다 DPBS로 채워진 원뿔 튜브에 배치해야합니다. 지연 준비는 조직 배송이 가능하지만 온도 변화는 운송 중에 피해야한다. 초기 토굴 도금에 필요한 전체 시간은 분리하고 토굴 판 조직이 1 시간에 처리하기 위해 15 ~ 30 분으로 약 2 시간이다. 조직의 미세 절제 깨끗한 토굴 준비의 중요한 결정 요인과 조건입니다. 그러나, 다양한 프로토콜에 설명 된대로 손-흔들어 지하실 해제 가능 22,23.
쥐 enteroid (enteroids) 시스템과의 유사성에도 불구하고, 인간의 enteroids 개선하고 시간이 지남에 따라 자신의 성장을 유지하기 위해 특정 분자를 필요로한다. 성장 인자는 EGF, 소량, R-spondin는 뮤린 상피 organoids 유사하게 사용된다. 그러나,이 Wnt-3A의 사용은 중요하다. 우리는 형성뿐만 아니라 성장 효율보다 인간 재조합 단백질의 Wnt-3A 조정 배지를 사용하여 큰 주목. 부수적으로, 우리는 글리코겐 합성 효소 키나아제 3 (CHIR99021) (12)의 억제제를 사용하여 배양 조건 개선을 보여 주었다. 재조합 성장 인자의 Wnt-3A, R-spondin 및 소량 조절 미디어에 의해 대체 될 수있다. 이 Wnt-3A 발현 L-세포주 (ATCC) 상업적으로 사용할 수 있습니다. 다른 그룹은 R-spondin 1 (23,27), Noggin- (19)을 개발하고,이 Wnt-3A / R-spondin3 / Noggin- 28 세포 라인을 표현했다. 두 개의 작은 분자 억제제는 배양에 사용되는 저직경과 문화 (29)의 유지 보수를 위해 필요하다. A-83-01는 성장 인자 β 및 티빈 / 노달 수용체 변환의 선택적 억제제이다 (티빈 형 키나제 4, 5, 7) 및 SB202190는 P38 미토 겐 활성화 단백질 키나제 억제제 (MAPK)이다. 두 억제제는 인간 유도 다 능성 줄기 세포는자가 재생 (self-renewal)을 유지하고 나이브 인간 다 능성 줄기 세포 (30-32)을 각각 수립하기 위해 사용되어왔다. 또한, 니코틴 아미드, 니코틴 아미드 아데닌 디 뉴클레오티드의 전구체는, 장기적인 방식으로 22,29 enteroids colonoids 및 확장을 유지하기 위해 요구된다.
이 토굴 준비에서 수율을 결정으로 EDTA 킬 레이션은 중요한 단계입니다. 우리는 2 mM의 EDTA 치료에 성공했다. 그러나, EDTA 농도는 조직의 유형에 대한 15 mM의 2 ㎜ 내지 수정 될 수있다. 이 경우, 배양 시간은 경험적으로 결정되어야한다. 초기 도금 후, 지하실 반올림-U를합니다P 결국은 enteroids를 형성한다. 그러나, enteroids 또는 colonoids은 종종 더 분화 세포에 작은 분야와 형성하여 "줄기"표현형을 보여줍니다. 그 경우에, 분화의 Wnt-3A, 니코틴 및 P38의 MAPK 억제제 인출에 의해 개시 될 수있다. 이러한 DAPT DBZ 같은 노치 또는 억제제의 사용은 22 enteroids 내 분화를 향상 돕는다.
이 모델은 흡 분비 분화 계통 모두를 포함하는 줄기 세포 구획으로 인한 지속적인 토굴-신진 이벤트뿐만 아니라 형상 융모 상피 도메인과 장내 생리 되풀이. 흥미롭게도,이 시스템은 임의의 중간 엽 세포를 포함하고 틈새 신호 요건을 충족하는 조건으로 특정 미디어를 사용하지 않는다.
뮤린 모델과 마찬가지로, 인간 enteroids는 줄기 세포로서 기능하도록 이들 세포의 능력을 테스트하기 위해 격리 장 상피 세포에서 생성 될 수있다. 세비RAL 연구는 줄기 속성 12,23,33과 세포 풍부하게 분화 마커 (CD44, CD24 또는 CD166) 및 EPHB2 양성 세포의 클러스터를 사용했다. 함께, 이러한 연구는 stemness을 테스트하기 위해 인간의 enteroids 문화의 유틸리티를 보여줍니다. 다른 연구자들은 감염성 설사 질환, 낭포 성 섬유증, 또는 대장 암 22,34-37 등의 장 질환을 조사하기 위해이 모델을 사용하고 있습니다. 이러한 연구는 인간 enteroids 맞춤 스크리닝 부분으로 이동할 가능성이 안정적인 인간 질병 모델을 구성하는 것을 보여준다. 인간 enteroids 유 전적으로 바이러스 입자 (38)와 DNA 형질이나 감염을 사용하여 수정할 수 있습니다. 이것은 인간의 상피 organoids 또는 정확한 유전 적 돌연변이 유전자 내 특정 기능을 연구 할 수있는 강력한 도구를 제공합니다. 최근 슈 방크와 동료들은 CFTR 유전자의 원인이 교류에 돌연변이를 CRISPR / Cas9 시스템 게놈을 편집하고 보정 할 수있는 가능성을 보여 주었다ystic 섬유증 (24). 인간 enteroids 장내 줄기 세포와 상피 점막 생물학을 공부하고 정상 및 비정상 모두 위장관 생리학을 연구하는 새로운 실험 시스템 역할을 할 수있는 시스템을 구성한다.
공개
The authors have nothing to disclose.
감사의 말
We gratefully acknowledge Dr. Hans Clevers (Hubrecht Institute for Developmental Biology and Stem Cell Research, Netherlands) for the kind gift of TOPflash cells.
This project was supported in part by NIH-R01DK083325 (MAH); NIH P30 DK078392 (Digestive Health Center); NIH UL1RR026314 (CTSA).
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate buffered saline Ca2+, Mg2+ free (DPBS) | Life technologies; Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Sorbitol | Fischer Scientific | BP439-500 | |
| Sucrose | Fischer Scientific | BP220-1 | |
| Bovine serum albumin (BSA) Fraction V | Fischer Scientific | BP1600-100 | |
| Gzntamycin/Amphotericin B solution | Life technologies; Gibco | R-015-10 | |
| Wnt-3A conditioned medium | in house | ||
| Advanced DMEM/F12 | Life technologies; Gibco | 12634-028 | |
| HEPES 1M | Life technologies; Gibco | 15630-080 | |
| GlutaMAX (glutamine) | Life technologies; Gibco | 35050-061 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life technologies; Gibco | 15140-148 | |
| N2 Supplement | Life technologies; Gibco | 17502-048 | |
| B27 Supplement | Life technologies; Gibco | 17504-044 | |
| N-Acetylcysteine | Sigma-Aldrich | A9165-5G | |
| Nicotidamide | Sigma-Aldrich | N0636 | |
| Matrigel, GFR, Phenol free (basement membrane matrix) | Corning | 356231 | |
| human recombinant Noggin | R&D | 6057-NG/CF | |
| human recombinant R-Spondin | Preprotech | 120-38 | |
| human recombinant EGF | Sigma-Aldrich | E9644-.2MG | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | |
| A-83-01 | Tocris | 2939 | |
| SB202190 | Sigma-Aldrich | S7067-5MG | |
| human [Leu]15-Gastrin 1 | Sigma-Aldrich | G9145-.1MG | |
| CHIR99021 | Stemgent | 04-0004 | |
| Thiazovivin | Stemgent | 04-0017 | |
| TrypLE Express Enzyme (1X), phenol red (cell dissociation enzyme) | Life technologies; Gibco | 12605-010 | |
| Fetal Bovine Serum | Life technologies; Gibco | 10082-147 | |
| CTS Synth-a-Freeze Medium (freezing medium) | Life technologies; Gibco | A13713-01 | |
| L Wnt-3A cell line | ATCC | CRL-2647 | |
| Renilla luciferase assay | Promega | E2710 | |
| human recombinant Wnt-3A | R&D | 5036-WN/CF | |
| HEK293 TOPflash cell line |
참고문헌
- Noah, T. K., Donahue, B., Shroyer, N. F. Intestinal development and differentiation. Exp Cell Res. 317 (19), 2702-2710 (2011).
- Shroyer, N. F., Kocoshis, S., Hyams, J. R. W. . Pediatric Gastrointestinal and Liver Diseases. , 324-336 (2010).
- Leushacke, M., Barker, N. Ex vivo culture of the intestinal epithelium: strategies and applications. Gut. , (2014).
- Simon-Assmann, P., Turck, N., Sidhoum-Jenny, M., Gradwohl, G., Kedinger, M. In vitro models of intestinal epithelial cell differentiation. Cell Biol Toxicol. 23 (4), 241-256 (2007).
- Barker, N., et al. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 6 (1), 25-36 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Mahe, M. M., et al. Establishment of Gastrointestinal Epithelial Organoids. Current Protocols in Mouse Biology. 3, 217-240 (2013).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340 (6137), 1190-1194 (2013).
- Stelzner, M., et al. A nomenclature for intestinal in vitro cultures. Am J Physiol Gastrointest Liver Physiol. 302 (12), G1359-G1363 (2012).
- Ramalingam, S., Daughtridge, G. W., Johnston, M. J., Gracz, A. D., Magness, S. T. Distinct levels of Sox9 expression mark colon epithelial stem cells that form colonoids in culture. Am J Physiol Gastrointest Liver Physiol. 302 (1), G10-G20 (2012).
- Furstenberg, R. J., et al. Sorting mouse jejunal epithelial cells with CD24 yields a population with characteristics of intestinal stem cells. Am J Physiol Gastrointest Liver Physiol. 300 (3), G409-G417 (2011).
- Wang, F., et al. Isolation and Characterization of Intestinal Stem Cells Based on Surface Marker Combinations and Colony-Formation Assay. Gastroenterology. , (2013).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc Natl Acad Sci U S A. 109 (2), 466-471 (2012).
- Es, J. H., et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nat Cell Biol. 14 (10), 1099-1104 (2012).
- Yui, S., et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat Med. 18 (4), 618-623 (2012).
- Durand, A., et al. Functional intestinal stem cells after Paneth cell ablation induced by the loss of transcription factor Math1 (Atoh1). Proc Natl Acad Sci U S A. 109 (23), 8965-8970 (2012).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Akcora, D., et al. The CSF-1 receptor fashions the intestinal stem cell niche. Stem Cell Res. 10 (2), 203-212 (2013).
- Farin, H. F., Van Es, J. H., Clevers, H. Redundant sources of Wnt regulate intestinal stem cells and promote formation of Paneth cells. Gastroenterology. 143 (6), 1518-1529 (2012).
- Rothenberg, M. E., et al. Identification of a cKit(+) colonic crypt base secretory cell that supports Lgr5(+) stem cells in mice. Gastroenterology. 142 (5), 1195-1205 (2012).
- Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured 'miniguts. Mol Cell Biol. 32 (18), 3639-3647 (2012).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. , (2014).
- Fuller, M. K., et al. Intestinal stem cells remain viable after prolonged tissue storage. Cell Tissue Res. 354 (2), 441-450 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Miyoshi, H., Ajima, R., Luo, C. T., Yamaguchi, T. P., Stappenbeck, T. S. Wnt5a potentiates TGF-beta signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Koo, B. K., Clevers, H. Stem Cells Marked by the R-Spondin Receptor Lgr5. Gastroenterology. , (2014).
- Li, W., et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell. 4 (1), 16-19 (2009).
- Tojo, M., et al. The ALK-5 inhibitor A-83-01 inhibits Smad signaling and epithelial-to-mesenchymal transition by transforming growth factor-beta. Cancer Sci. 96 (11), 791-800 (2005).
- Gafni, O., et al. Derivation of novel human ground state naive pluripotent stem cells. Nature. 504 (7479), 282-286 (2013).
- Gracz, A. D., et al. Brief report: CD24 and CD44 mark human intestinal epithelial cell populations with characteristics of active and facultative stem cells. Stem Cells. 31 (9), 2024-2030 (2013).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med (Maywood). , (2014).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat Med. 19 (7), 939-945 (2013).
- Kovbasnjuk, O., et al. Human enteroids: preclinical models of non-inflammatory diarrhea. Stem Cell Res Ther. 4, S3 (2013).
- Fujii, M., Sato, T. Culturing intestinal stem cells: applications for colorectal cancer research. Front Genet. 5, 169 (2014).
- Koo, B. K., Sasselli, V., Clevers, H. Retroviral gene expression control in primary organoid cultures. Curr Protoc Stem Cell Biol. 27 (Unit 5A), 6 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유