Method Article
Mise en place d'épithéliales humaines Enteroids et Colonoids de tout le tissu et la biopsie
Dans cet article
Résumé
We describe a method to establish human enteroids from small intestinal crypts and colonoids from colon crypts collected from both surgical tissue and biopsies. In this methodological article, we present the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Résumé
The epithelium of the gastrointestinal tract is constantly renewed as it turns over. This process is triggered by the proliferation of intestinal stem cells (ISCs) and progeny that progressively migrate and differentiate toward the tip of the villi. These processes, essential for gastrointestinal homeostasis, have been extensively studied using multiple approaches. Ex vivo technologies, especially primary cell cultures have proven to be promising for understanding intestinal epithelial functions. A long-term primary culture system for mouse intestinal crypts has been established to generate 3-dimensional epithelial organoids. These epithelial structures contain crypt- and villus-like domains reminiscent of normal gut epithelium. Commonly, termed “enteroids” when derived from small intestine and “colonoids” when derived from colon, they are different from organoids that also contain mesenchyme tissue. Additionally, these enteroids/colonoids continuously produce all cell types found normally within the intestinal epithelium. This in vitro organ-like culture system is rapidly becoming the new gold standard for investigation of intestinal stem cell biology and epithelial cell physiology. This technology has been recently transferred to the study of human gut. The establishment of human derived epithelial enteroids and colonoids from small intestine and colon has been possible through the utilization of specific culture media that allow their growth and maintenance over time. Here, we describe a method to establish a small intestinal and colon crypt-derived system from human whole tissue or biopsies. We emphasize the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Introduction
L'épithélium de muqueuse du tractus gastro-intestinal est en constant renouvellement. Ce processus est déclenché par une prolifération de cellules souches intestinales (CSI) qui produisent en continu descendants pour remplacer rapidement l'épithélium intestinal il se avère terminée. Le compartiment prolifératif comprenant les CSI est confiné au fond des cryptes. Les CSI donnent lieu à la descendance qui différencient finalement en absorbant ou lignées sécrétoires. Sortir de la crypte et sur la surface des villosités ou épithélium, les cellules se différencient fur et à mesure qu'ils migrent vers le haut avant l'exfoliation dans la lumière 1. CSI donner naissance à tous les types de cellules épithéliales de l'intestin, y compris les entérocytes, des cellules, des cellules entéro-endocrines Microfold, les cellules caliciformes, des cellules et des cellules de Paneth touffes. Le côlon est caractérisée par cryptes allongées composées principalement de colonocytes et cellules caliciformes, avec entéroendocrine dispersée et les cellules de touffes 2.
Ex vivo culsystèmes de ture constituent outil prometteur pour l'étude ISC entretien et l'homéostasie du tissu intestinal. Cependant, il est difficile de se appuyer sur les technologies de culture de tissus comme des conditions physiologiques ne sont pas reproduits intégralement et le micro-environnement epithelial souvent modifiées 3,4. Une avancée majeure dans le domaine ISC était la mise en place de techniques de culture de tissus pour maintenir et développer CSI murins individuels en utilisant des facteurs de croissance définis pour remplacer les signaux de niche intestinale normale. Conditions de culture à long terme ont été décrites par Sato et al., Dans laquelle cryptes individuelles ou de cellules souches isolées à partir de l'épithélium intestinal croître pour former des structures épithéliales trois dimensions, y compris de multiples domaines de la crypte comme 5-7. Ces structures tridimensionnelles subissent les événements de fission d'élargir en permanence. Fait intéressant, tous les types de cellules intestinales spécifiques au tissu d'origine et sont produites ainsi sont extrudées dans une lumière 8. En utilisant des modifications de ce système, épithélialeorganites peuvent être générés à partir de l'estomac, l'intestin grêle et du côlon. Plus précisément, les organites épithéliales de l'intestin grêle sont enteroids 9, et ceux des deux points sont colonoids 9,10. Ces systèmes de culture organoïdes épithéliales ont été utilisées pour tester la capacité des cellules uniques isolées à fonctionner comme des cellules souches in vitro, en testant ainsi le "caractère souche" de cellules isolées 5,6,10-15. D'autres chercheurs ont utilisé deux enteroids et colonoids pour étudier la fonction des cellules épithéliales individuelles 16-21. Ainsi, les cultures et enteroid colonoid peuvent être utilisés pour évaluer à la fois les fonctions de souches et de cellules non-souches et de donner un nouvel éclairage sur les interactions cellulaires fondamentaux dans les intestins.
En 2011, Sato et ses collègues ont généré culture à long terme des organites épithéliales dérivées de l'intestin grêle et du côlon humain 22,23. Outre les différences dans la composition des médias, les enteroids épithéliales humainescolonoids et présentent les mêmes caractéristiques que son homologue murin. En outre, ils peuvent être générés à partir de tissus malades tels que l'oesophage, l'adénome ou adénocarcinome de Barrett, et la fibrose kystique 22,24. Enteroids humaines constituent un système précieux pour étudier les cellules souches épithéliales de la muqueuse intestinale et de la biologie et de servir comme un système expérimental roman étudier la physiologie gastro-intestinal à la fois normal et anormal 3.
Nous décrivons ici les méthodes d'établir enteroids et colonoids de l'intestin grêle humain et cryptes du côlon (Figure 1). Dans cette revue méthodologique, nous insistons sur la collection de la crypte du tissu et des biopsies ensemble. Nous récapitulons les modalités de culture qui sont essentiels pour la croissance et l'entretien des enteroids et colonoids humaines et les stratégies expérimentales possibles menées par ce modèle de réussite.
Protocole
NOTE: Déclaration éthique: toute expérimentation en utilisant des tissus humains décrits ici a été approuvé par un IRB au CCHMC (CEE n ° 2012 à 2858; # 2014-0427). Le consentement éclairé pour la collecte de tissus, stockage et l'utilisation des échantillons a été obtenu à partir des donateurs à CCHMC.
1. Préparation de la Culture
REMARQUE: Tous les réactifs sont énumérées dans le tableau 1.
- Préparer EDTA solution stock comme suit: préparer l'acide éthylènediaminetétraacétique 0,5 M, pH 8 (EDTA) dans ultrapure H 2 O, stérilisée par filtration avec filtre de 0,22 um. Eventuellement, conserver la solution EDTA de stock chez RT indéfiniment.
- Préparer du tampon de chelation comme suit: mélanger 2% de sorbitol, 1% de saccharose, 1% de fraction de l'albumine de sérum bovin V (BSA) et 1x gentamicine / solution d'amphotéricine dans du phosphate de Dulbecco tamponnée saline sans Ca2 + et Mg2 + (DPBS), filtre stérilisé avec filtre de 0,22 um. Préparer le buf chélateurfrais fer.
- Préparez moyenne Wnt-3A-conditionné comme suit: moyenne Wnt-3A-conditionné est fait maison en utilisant la lignée cellulaire L Wnt-3A selon les instructions du fabricant (ATCC, CRL-2647). Compléter le milieu avec de la glutamine 2 mM, HEPES 10 mM, 100 U / ml de pénicilline, 100 g / ml de streptomycine, 1 supplément N2, 1 B27 supplément, 1% de BSA et stérilisé par filtration avec un filtre de 0,22 um.
REMARQUE: Test chaque lot pour l'activité Wnt en utilisant un dosage de TOPflash. Utilisez une lignée cellulaire HEK293 TOPflash stable (Hans Clevers de laboratoire) avec un kit de dosage de la luciférase Renilla selon les instructions du fabricant. Normaliser le dosage de TOPflash avec 100 ng / ml Wnt-3A humaine recombinante. Confirmer au moins un facteur de variation activité 10 des milieux conditionnés par rapport au témoin. Divisez milieu frais Wnt-3A-conditionné en portions de 10 ml à 15 ml tubes coniques et congeler à -20 ° C pendant jusqu'à 6 mois. Magasin aliquotes décongelées jusqu'à 5 jours à 4 ° C sans perte d'activité. - Prepare milieu minigut humain comme suit: Supplément avancée milieu DMEM / F12 avec de la glutamine 2 mM, HEPES 10 mM, de la pénicilline 100 U / ml, 100 g / ml de streptomycine, 1 N2 supplément, 1 B27 supplément, 1% de BSA et stérilisé par filtration à 0,22 filtre um.
REMARQUE: Diviser milieu frais de minigut humain en portions de 10 ml dans 15 ml tubes coniques et congeler à -20 ° C pour un maximum de trois mois. Magasin aliquotes décongelées jusqu'à 5 jours à 4 ° C sans perte d'activité. - Préparer milieu complet de minigut humaine comme suit: Préparer frais avant la culture de la crypte ou du changement de milieu milieu de minigut humaine (voir 1.4) additionné de Wnt-3A-milieu conditionné de 50% (voir 1.3), 1 pg / ml R-spondine 1 (1: 1 000 dilution de 1 mg / stock ml), 100 Noggin ng / ml (1: 1000 dilution de 100 g / stock ml), 50 ng / ml EGF (1: 10,000 dilution de 500 pg / mL stock), 500 nM A-83 -01 (1: 1000 dilution de 500 M stock), 10 uM SB202190 (1: 3000 dilution de 30 mM), 10 nM [Leu] 15 Gastrine 1 (1: 10,000 dilution de 100 umstock), 10 mM nicotinamide (1: 100 dilution de 1 M stock) et 1 mM N-acétylcystéine (1: 1000 dilution de 1 M stock).
REMARQUE: Conservez les supports de minigut humains complets jusqu'à 2 jours à 4 ° C sans perte d'activité.
2. Isolement Crypte de tout le tissu
NOTE: De la collection de tissus, il est essentiel de maintenir l'échantillon dans une solution saline. Il est recommandé de garder le tissu sur la glace pendant le transport. Préparation de l'échantillon pour l'isolement de la crypte devrait être effectuée dès que possible.
REMARQUE: Tous les réactifs sont énumérées dans le tableau 1, les outils, l'équipement et les consommables sont énumérés dans le tableau 2.
- Préparer tous les réactifs avant de commencer l'expérience. Décongeler la matrice de membrane basale sur de la glace et de pré-incuber une plaque à 24 puits dans un incubateur à CO2 à 37 ° C.
NOTE: Vous pouvez également faire une fine couche de matrice de membrane basale en utilisant 15 pl / puits dans le centre d'un 24eh bien la plaque et le placer dans un incubateur CO 2 à 37 ° C. Cette étape facultative maintient la matrice de membrane basale comme une goutte lors de la polymérisation. - Laver le tissu avec glacée de phosphate de Dulbecco tamponnée saline sans Ca2 + et Mg2 + (DPBS). Continuez jusqu'à le contenu de DPBS est clair.
- Utilisation de 0,2 mm de diamètre minuties épingles, fixez le tissu sur une boîte de Pétri en verre enduit de silicone remplie de DPBS glacées. Étirez et épingler le tissu plat avec le côté de la muqueuse vers le haut.
- Sous un microscope de dissection, retirez la muqueuse sus-jacente de la sous-muqueuse et des tissus conjonctifs l'aide de micro-dissection des ciseaux et pointe fine pince courbe (Figure 2A, B).
- Étirer et épingler le disséqué muqueuse plane sur le verre plat revêtu de silicone Petri avec le côté muqueuse vers le haut. La sous-muqueuse restant et du tissu conjonctif peuvent être jetés ou utilisés pour d'autres expériences (figure 2C).
- Doucementracler la surface de la muqueuse avec des pinces incurvées. Cette étape est nécessaire pour améliorer la qualité de la préparation.
- Pour intestin grêle, grattez délicatement la muqueuse de supprimer les villosités.
- Pour côlon, grattez délicatement la muqueuse pour éliminer le mucus et les débris.
- Laver la muqueuse 3-4 fois avec un tampon de chélation glace froide pour enlever villosités et les débris.
- Couvrir la muqueuse avec fraîchement préparé tampon de chélation EDTA 2 mM (200 pi 0,5 M EDTA dans 49,6 ml de tampon de chélation).
- Placez la boîte de Pétri sur de la glace et agiter doucement pendant 30 min sur un agitateur orbital horizontal.
- Laver le tissu 3-4 fois avec le tampon de chélation glacée sans EDTA. Après lavage, on laisse la muqueuse dans un tampon de chélation glacée.
- Traiter la muqueuse sous un microscope de dissection en utilisant des pinces courbes et fines. Grattez délicatement la muqueuse de libérer cryptes intestinales en utilisant les forceps incurvés.
- Retirez délicatement la suspension de la crypte de la boîte de Pétri en utilisant une pipipette et la transfère dans un tube conique de 50 ml.
REMARQUE: Vérifiez le tissu pour se assurer que presque tous les cryptes ont été retirés de la muqueuse. - Filtrer la suspension des cryptes à travers un maillage de 150 um deux fois.
REMARQUE: vérifier la accréditives pour l'enrichissement de crypte sous un microscope (Figure 2D). - Centrifuger la crypte suspension à 5 min à 50 xg, 4 ° C. Jeter le surnageant.
- Remettre en suspension le culot dans 5 ml de tampon glacé chélation.
- Comptez le nombre de cryptes par chute de 10 ul de la suspension de l'étape 2.15. Transférer le nombre de cryptes nécessaires pour le placage à 5 ml de tubes à fond rond. Utilisez 200-500 cryptes par puits d'un plat de 24 puits d'établir enteroids ou colonoids.
- Centrifuger la fraction crypte pendant 10 min à 150 g, 4 ° C. Eliminer le surnageant.
- Utilisez cryptes pour la culture subséquente.
3. Isolation Crypte de biopsie
- Préparer tous les réactifs avant ladébut de l'expérience. Décongeler la matrice de membrane basale sur de la glace et de pré-incuber une plaque à 24 puits dans un incubateur à CO2 à 37 ° C.
- Laver la biopsie avec glacée Phosphate de Dulbecco saline tamponnée sans Ca 2+ et Mg 2+ (DPBS).
- Utilisation de 0,1 mm de diamètre minuties broches, sécuriser la biopsie sur une boîte de Pétri en verre enduit de silicone remplie de DPBS glacées. Étirez et épingler la muqueuse plane avec le côté de la muqueuse vers le haut (figure 2E).
- Racler délicatement la surface de la muqueuse avec une pince pour enlever courbes villosités et les débris. Cette étape est nécessaire pour améliorer la qualité de la préparation.
- Laver la biopsie 3-4 fois avec un tampon de chélation glace froide pour enlever villosités et les débris.
- Couvrir la biopsie avec fraîchement préparé tampon de chélation EDTA 2 mM (200 pi 0,5 M EDTA dans 49,8 ml de tampon de chélation).
- Placez la boîte de Pétri sur de la glace et agiter doucement pendant 30 min sur un agitateur orbital horizontal.
- Lavez la biopsie 3-4 fois avec le tampon de chélation glacée sans EDTA. Après lavage, laisser la biopsie dans un tampon de chélation glacée.
- Traiter la biopsie sous un microscope de dissection en utilisant des pinces courbes et fines. Gratter doucement la muqueuse de libérer les cryptes intestinales en utilisant une pince courbes.
- Retirez délicatement la suspension de la crypte de la boîte de Pétri à l'aide d'une pipette et le transférer à un tube conique de 50 ml.
REMARQUE: Vérifiez le tissu pour se assurer que presque tous les cryptes ont été retirés de la muqueuse. - Filtrer la suspension de la crypte à travers un nylon de 150 um maille 2 fois.
REMARQUE: vérifier la accréditives pour l'enrichissement de crypte sous un microscope. - Centrifuger la crypte suspension à 5 min à 50 xg, 4 ° C. Jeter le surnageant.
- Remettre en suspension le culot dans 1 ml de tampon de chélation glacée. Transférer la suspension de la crypte à un tube de 1,5 ml.
- Centrifuger la fraction crypte pendant 10 minutes à 150 xg, 4 ° C. Eliminer le surnageant.
- Utilisez cryptes pour la culture subséquente.
4. Crypte Culture dans la membrane basale Matrice
- En utilisant des pointes de pipette pré-réfrigérés, remettre le culot de la crypte (de l'étape 2.18 ou 3.15) au sous-sol matrice de membrane (200-500 cryptes / 50 pi-sol matrice de la membrane).
- Appliquer 50 pi de suspension crypte en sous-sol matrice de la membrane par puits sur la plaque préchauffée. Éjecter lentement la matrice de membrane basale dans le centre du puits.
- Placer la plaque à 24 puits dans un 37 ° C, 5% de CO 2 incubateur pendant 30 min pour permettre une polymérisation complète de la matrice de membrane basale.
- Superposer la matrice de la membrane basale avec 500 pi de milieu complet de minigut humaine complété avec 2,5 uM CHIR99021 (1: 4000 dilution de 10 mM) et 2,5 uM Thiazovivin (1: 4000 dilution de 10 mM).
- Incuber la plaque à une 37 ° C, 5% de CO 2 incubateur.
- Remplacez le support avec huma complet fraisn minigut moyenne tous les deux jours.
5. Le repiquage de Cultured Enteroids et Colonoids.
REMARQUE: Passage Enteroids et Colonoids tous les 7 à 10 jours après étalement initial. Généralement, diviser un bien dans 3-4 puits.
- Préparer tous les réactifs avant le début de l'expérience. Décongeler la matrice de membrane basale sur de la glace et de pré-incuber une plaque à 24 puits dans un incubateur à CO2 à 37 ° C.
- Retirez le support à l'aide des conseils et superposition stériles avec 1 ml de DPBS glacées.
- Pipette d'avant en arrière avec une pointe de 1 000 pi. Transférer la solution dans un nouveau tube conique de 15 ml.
- Ajouter 2 ml de milieu de minigut humain supplémenté avec 5% de FBS par 1 ml de milieu.
- Centrifuger la solution pendant 5 mn à 50 x g, 4 ° C. Jeter le surnageant.
- Remettre en suspension le culot avec 2 ml de dissociation cellulaire enzyme supplémenté avec 10 uM Y-27632 (1: 1000 dilution de 10 mM). Incuber pendant 5 mdans à 37 ° C dans un bain-marie.
- Dissocier les amas de cellules en utilisant un 3 ml Luer-Lock seringue munie d'une 18-G de remplissage / aiguille émoussée. Pipette doucement la solution en arrière en utilisant la seringue 10 fois.
- Centrifuger la suspension pendant 5 min à 500 g, 4 ° C. Jeter le surnageant.
- En utilisant des pointes de pipette pré-réfrigérés, remettre en suspension le culot cellulaire dans la matrice de la membrane basale.
- Appliquer 50 pi de suspension crypte en sous-sol matrice de la membrane par puits sur la plaque préchauffée. Éjecter lentement la matrice de membrane basale dans le centre du puits.
- Placer la plaque à 24 puits dans un 37 ° C, 5% de CO 2 incubateur pendant 20 min pour permettre une polymérisation complète de la matrice de membrane basale.
- Superposer la matrice de la membrane basale avec 500 pi de milieu complet de minigut humaine complété avec 10 uM Y-27632 (1: 1000 dilution de 10 mM).
- Incuber la plaque à une 37 ° C, 5% de CO 2 incubateur.
- Après 2 jours, Remplacer le milieu avec un milieu de minigut humain complet frais complété avec 10 uM Y-27632 (1: 1000 dilution de 10 mM). Par la suite, remplacer le milieu par un milieu frais, complète minigut humaine tous les autres jours.
6. Gel des Cultured Enteroids et Colonoids
NOTE: Habituellement geler un puits en 2-3 cryotubes.
- Répétez les étapes 5.1 à 5.8.
- Reprendre le culot avec un milieu de congélation froid. Transfert 1 ml de solution dans un cryovial marqué congélation. Placer le tube cryogénique dans un récipient de congélation contenant 500 ml d'alcool isopropylique.
- Transférer le récipient de congélation à une congélation 80 ° C pendant 24 h, puis à transférer cryovial stockage d'azote liquide.
REMARQUE: Magasin Enteroids et Colonoids jusqu'à 1 année.
Résultats
La figure 2D montre un exemple typique de cryptes fraîchement isolées à partir de tissu ensemble (figure 2D). Le nombre de cryptes isolées à partir d'une biopsie est plus faible que dans les tissus ensemble. Utilisation de standards pince capacité de biopsie avec une aiguille, nous réalisons habituellement deux piqûres biopsie sur un seul passage. Chaque résultat de la biopsie de morsure dans une surface de 10 mm 2 avec une moyenne de 50 à 100 cryptes par biopsie (figure 2F).
Après la culture dans la matrice de la membrane basale, les cryptes complètent pour former enterospheres pour l'intestin grêle et du côlon colonospheres. La crypte en herbe se produit habituellement dans les 5 à 6 jours, après le semis. Toutefois, il ne est pas rare de voir soit enteroids (enteroids) ou colonoids (colonoids) formant sphères dans la matrice de la membrane basale (figure 3A-C; films 1). Le repiquage peut être effectuée au bout de 7 jours, en fonction de la taille des enteroids. Le enteroids ou colonoids établMINE partir de biopsies subissent la même évolution dans la culture. Cependant, comme la densité de la crypte à l'ensemencement est inférieur, le repiquage se fait habituellement après 10 à 12 jours de culture (figure 4a, b). Enteroids et colonoids cultures étendent d'une manière reproductible.
Les deux enteroids et colonoids présentent une face luminale et sont alignés avec un épithélium (figure 5A, B). Cellules prolifératives peuvent être observés dans les enteroids et sont situés dans les extrémités des bourgeons (figure 5C, D). L'imagerie confocale de enteroids colorées avec la E-cadhérine (Ecad) montre les cellules épithéliales (figure 5E).
Les deux enteroids et colonoids peuvent être établies à partir de tissus obtenus à partir de patients atteints de troubles génétiques / congénitales. La figure 6 montre enteroids représentatifs de croissance d'un patient atteint de fibrose kystique (figure 6A) et une entéropathie à touffeter en raison d'une mutation congénitale dans la épithéliale annonce cellulairegène de la molécule d'hésion (EpCAM) (Figure 6B). Outre le défaut génétique, les enteroids ne présentent pas de différences dans l'état basal.

Figure 1. workflow de cryptes dissociation et génération de enteroids humaines et colonoids en culture. Cryptes (de l'intestin grêle ou côlon humain) sont isolés par chélation EDTA. Cryptes culture forment enteroids pour l'intestin grêle et colonoids pour le côlon. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
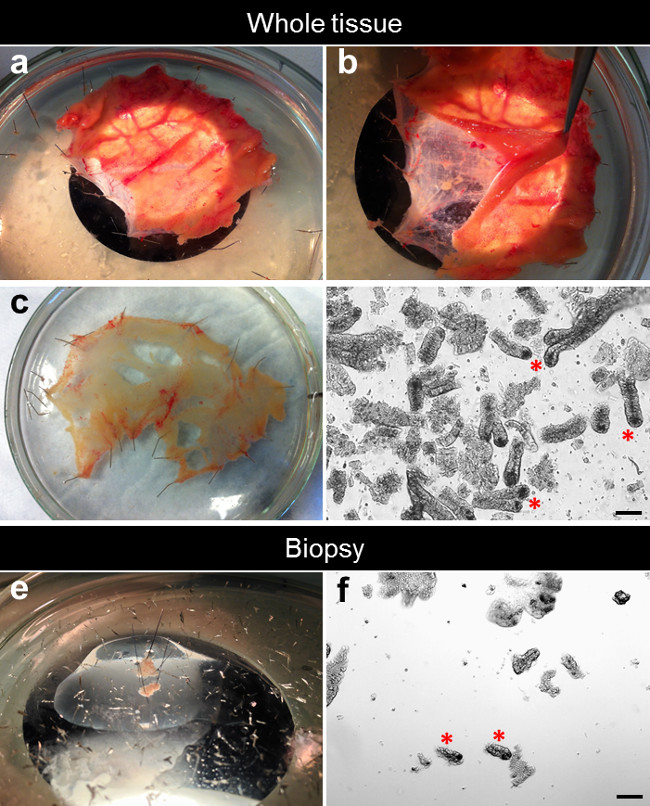
Figure 2. Procédé de dissection pour l'isolement crypte. (A) Le petit intestin specimen est étirée et épinglé à plat dans une boîte de Pétri siliconé. (B) La muqueuse est séparé de la sous-muqueuse sous-jacente. (C) La muqueuse disséqué est étirée et épinglé à plat dans une boîte de Pétri siliconé. (D) Après EDTA chélation, les cryptes sont isolées à partir du tissu. (E) Une biopsie est étirée et épinglée à plat dans une boîte de Pétri siliconé. (F) Après EDTA chélation, cryptes sont isolés de la biopsie. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
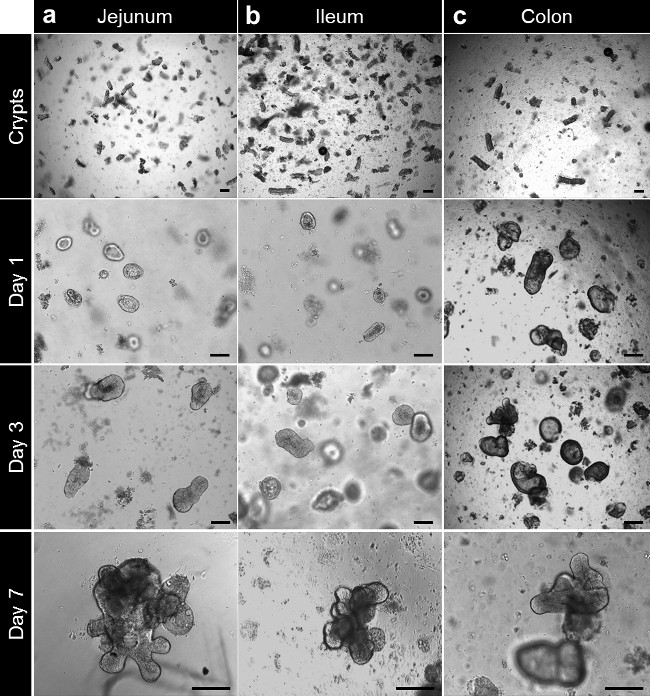
Figure 3. crypte culture et enteroid humain et colonoid génération de tissu ensemble. (A) cryptes jéjunales plaquées dans une matrice de membrane basale après isolement. Les cryptes ferment après 3-4 heures et commencent à gonfler pour former enterospheres delà de cette durée. A 7 jours, les enteroids jéjunum sont formés. (B) Après isolement et la culture, cryptes iléon se comporter comme les cryptes du jéjunum et de l'iléon former enteroids. (C) cryptes du côlon sont étalés dans une matrice de membrane basale après isolement. Les cryptes colonoids proches et forment après 7 jours (barres d'échelle: 100 um). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
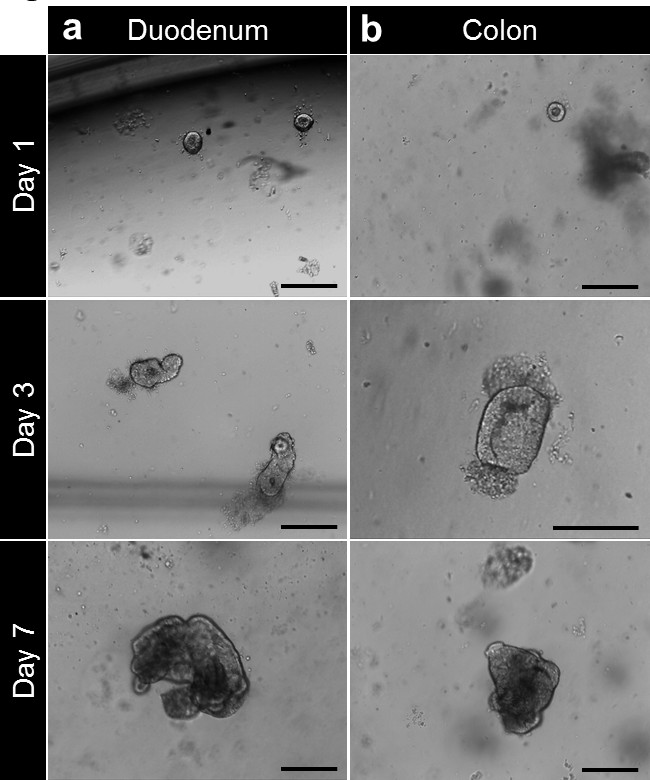
Figure 4. crypte culture et enteroid humaine et la génération colonoid partir d'une biopsie. (A) cryptes duodénales plaqués dans la matrice de la membrane basale après isolement. Les cryptes ferment après 3-4 heures et commencent à gonfler jusqu'à Beyoe cette fois pour former enterospheres. A 7 jours, les enteroids sont formés. (B) Après isolement et culture, cryptes coliques sont étalés dans une matrice de membrane basale. Les cryptes fermer pour former colonospheres puis colonoids après 7 jours (barres d'échelle: 100 um). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
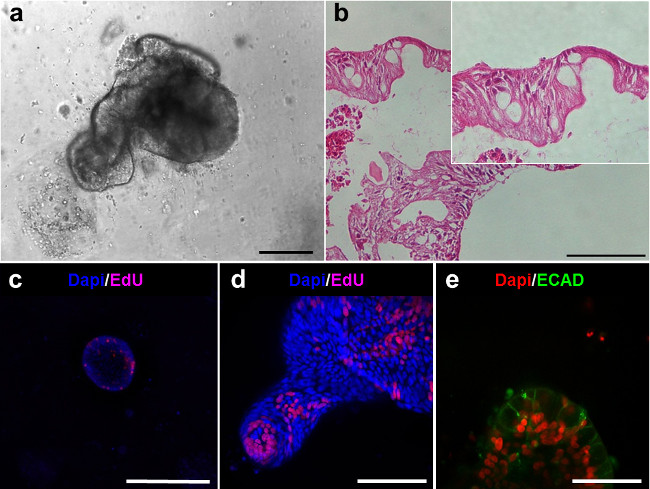
Figure 5. lignées intestinales des enteroids humaines. (A) enteroid humain après 6 jours de culture. (Barres d'échelle: 100 um) sections hématoxyline-éosine des enteroids dans (A) démontrer la paroi épithéliale (B). (CD) d'imagerie confocale de enteroids EdU après coloration (magenta) montre la présence de cellules proliferatives. (E ) imagerie confocale de enteroids démontre la présence de: E-cadhérine pour les cellules épithéliales (ECAD, vert) (Barre d'échelle:. 50 um) Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
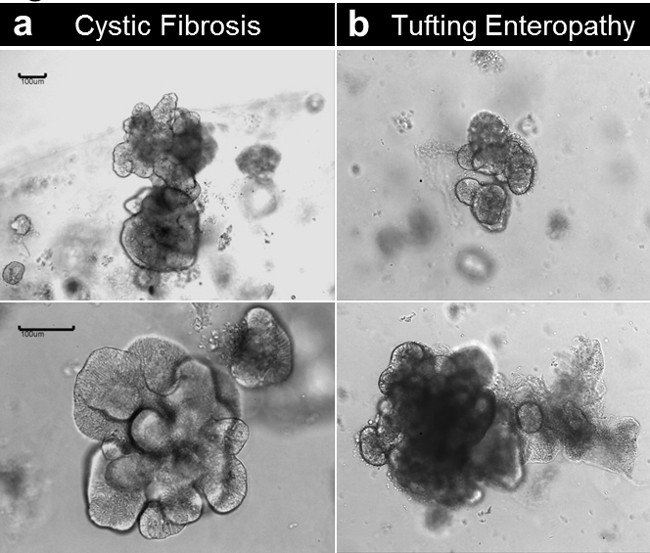
Figure 6. Crypte la culture et la production enteroid humaine de tissus malades. (A) Enteroids établies à partir d'un échantillon de fibrose kystique. (B) Enteroids établies à partir d'un spécimen congénitales touffes de entéropathie (Barres d'échelle: 100 um). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Film 1. Enterosphere formant enteroid humaine dans la culture. 32 h temps-tourse film montre un enterosphere établie à partir de l'intestin grêle humain rétracter pour former un enteroid dans la culture. Se il vous plaît cliquer ici pour voir cette vidéo.
| Nom du Réactif | Société | Numéro de catalogue | Solvant | Stock Concentration | Concentration finale | Commentaire |
| Phosphate de Dulbecco saline tamponnée Ca 2+, Mg 2+ libre (DPBS) | technologies de la vie; Gibco | 14190-144 | - | - | 1x | |
| Ethylenediamine tétraacétique (EDTA) | Sigma-Aldrich | 431788 | Ultrapure dH 2 O | 0,5 M | 2 mM | |
| Sorbitol | Fischer Scientific | BP439-500 | DPBS | Poudre | 2% | |
| Saccharose | Fischer Scientific | BP220-1 | DPBS | Poudre | 1% | |
| Albumine de sérum bovin (BSA) Fraction V | Fischer Scientific | BP1600-100 | DPBS | Poudre | 1% | |
| Solution Gzntamycin / amphotéricine B | technologies de la vie; Gibco | R-015 à 10 | - | 500x | 1x | |
| Wnt-3A conditionné moyenne | dans la maison | - | - | - | - | |
| Avancée DMEM / F12 | technologies de la vie; Gibco | 12634-028 | - | - | - | |
| HEPES 1M | technologies de la vie; Gibco | 15630-080 | - | M 1 | 10 mM | |
| GlutaMAX (glutamine) | technologies de la vie; Gibco | 35050-061 | - | 100X | 1X | |
| Pénicilline-streptomycine (10 000 U / ml) | technologies de la vie; Gibco | 15140-148 | - | 100X | 1X | |
| Supplément N2 | technologies de la vie; Gibco | 17502-048 | - | 100X | 1X | |
| Supplément B27 | technologies de la vie; Gibco | 17504-044 | - | 50X | 1X | |
| N-acétylcystéine | Sigma-Aldrich | A9165-5G | DPBS | M 1 | 1 mM | |
| Nicotidamide | Sigma-Aldrich | N0636 | DPBS | M 1 | 10 mM | |
| Matrigel, GFR, phénol (matrice de membrane basale) gratuit | Corning | 356231 | - | - | - | REQUIS |
| Noggin humaine recombinante | R & D | 6057-NG / FC | DPBS | 100 pg / ml | 100 ng / ml | Autres fournisseurs: R & D; Anaspec et PreproTech |
| R-Spondin recombinant humain | PreproTech | 120-38 | DPBS | 1 mg / ml | 1 pg / ml | |
| EGF recombinant humain | Sigma-Aldrich | E9644-.2MG | SPD | 500 pg / ml | 50 ng / ml | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | DPBS | 10 mM | 10 pM | |
| A-83-01 | Tocris | 2939 | DMSO | 500 pM | 500 nM | |
| SB202190 | Sigma-Aldrich | S7067-5MG | DMSO | 30 mM | 10 pM | |
| humain [Leu] La gastrine-15 1 | Sigma-Aldrich | G9145-.1MG | DPBS | 100 pM | 10 nM | |
| CHIR99021 | Stemgent | 04-0004 | DMSO | 10 mM | 2,5 pM | |
| Thiazovivin | Stemgent | 04-0017 | DMSO | 10 mM | 2,5 pM | |
| TrypLE express Enzyme (1X), le rouge de phénol (cellulaire dissociation enzyme) | technologies de la vie; Gibco | 12605-010 | - | - | - | Pour passages |
| Sérum de veau fœtal | technologies de la vie; Gibco | 10082-147 | - | - | - | Pour passages |
| CTS Synth-a-Freeze (milieu de congélation) Medium | technologies de la vie; Gibco | A13713-01 | - | - | - | Pour la congélation |
| L Wnt-3A lignée cellulaire | ATCC | CRL-2647 | - | - | - | Wnt-3A conditionné la production des médias |
| Dosage de la luciférase de Renilla | Promega | E2710 | - | - | - | Wnt-3A conditionné l'activité des médias |
| recombinant humain Wnt-3A | R & D | 5036-WN / FC | DPBS | 100 pg / ml | 100 ng / ml | L'activité des médias Wnt-3A conditionné |
| Lignée cellulaire HEK293 TOPflash | - | - | - | - | - | Wnt-3A conditionné l'activité des médias; Cadeau du laboratoire Hans Clevers |
Tableau 1. Liste des réactif détaillée avec le fabricant préféré et le numéro de catalogue.
| Équipement | Consommable | Outils |
| hotte à flux laminaire | De 15 et 50 ml tubes coniques | Dumont # 5 pince standards (FST; # 11251-20) |
| CO 2 incubateur | Tubes Microfuge | Dumont # 7, pinces fines courbes (TVF; # 11274-20) |
| Stéréo-microscope | Plaques à 24 puits | Ciseaux fins (FST; # 14060-09) |
| Centrifuger | 0,22 um (Sartorius) filtres | Vannas ciseaux à ressort (FST; # 15018-10) |
| Agitateur orbital | Pipettes sérologiques | Diamètre minuties broches de 0,2 mm (FST; # 26002-20) |
| Freezing Container (Nalgene) | conseils de micropipettes | Diamètre minuties broches de 0,1 mm (FST; # 26002-10) |
| Sylgard 184 silicone (Dow Corning) | 150 um ouvertures mailles, le dépistage de nylon (Dynamic Aqua-approvisionnement) | |
| Plat en verre Petri | 5 ml tubes en polypropylène à fond rond (Falcon) | |
| Pipette sérologique | 18G aiguille de remplissage émoussée (BD) | |
| Micropipette | 3 ml lsyringes avec conseils Luer-Lock (BD) | |
| Cryovials |
Tableau 2. détaillée des consommables, des outils et équipements nécessaires pour l'isolement et la culture crypte.
Discussion
Cette méthode fournit un système complet reproduisant lignées épithéliales intestinales et la dynamique épithéliales qui constituent un outil utile pour étudier la biologie épithéliale intestinale. La méthode présentée ici a été adapté à partir de l'étude d'origine murine par Sato et Clevers 22 qui entraîne efficacement dans enteroids humaines et colonoids. Ici, nous avons choisi manuellement les cryptes par microdissection pour éviter les contaminants cellulaires. Cette méthode permet une visualisation directe des cryptes et conduit à la cohérence des heures supplémentaires par rapport à la collection de la crypte originale de "secouer". D'autres groupes ont développé des techniques similaires en utilisant des approches légèrement différentes en particulier en remplacement de la chélation par l'EDTA avec de la collagénase 25. Outre les différences dans la collecte crypte, ces techniques utilisent un support défini qui est nécessaire pour développer les enteroids humaines en culture 22. Pour accroître l'efficacité de la croissance au crypte ensemencement, on ajoute un inhibiteur de GSK3 (CHIR99021)pour les deux premiers jours 12.
Le traitement du tissu ou des biopsies est important et l'isolement de la crypte doit être effectuée dès que le tissu arrive dans le laboratoire. Cependant, l'isolement de la culture et crypte retardée peuvent être effectuées jusqu'à 24 heures après le prélèvement de tissus (données non représentées) comme décrit précédemment pour le tissu murin 26. Le tissu intestinal doit être placé dans un tube conique complètement rempli avec du DPBS à éviter toute perturbation des tissus et devrait être maintenu à 4 ° C. La préparation retardée permet pour l'expédition de tissus, mais la variation de température doit être évitée pendant le transport. Le temps total nécessaire pour le placage de crypte initial est d'environ 2 heures avec 15 à 30 min pour traiter le tissu et de 1 à 2 heures à isoler et à plaquer la crypte. La microdissection des tissus est un déterminant critique prédicat et d'une préparation de crypte propre. Cependant, la libération de la crypte à la main-secouant comme décrit dans divers protocoles est possible 22,23.
Malgré les similitudes avec le système enteroid murin (enteroids), les droits nécessitent enteroids molécules spécifiques pour améliorer et soutenir leur croissance au fil du temps. Les facteurs de croissance EGF, Noggin, R-spondine sont utilisés de manière similaire aux organites épithéliales murines. Cependant, l'utilisation de Wnt-3A est critique. Nous avons remarqué que la formation ainsi que le rendement de croissance est supérieur en utilisant un milieu conditionné Wnt-3A de la protéine recombinante humaine. En même temps, nous avons démontré l'amélioration des conditions de culture en utilisant un inhibiteur de la glycogène synthase kinase 3 (CHIR99021) 12. Des facteurs de croissance recombinants pourraient être remplacés par Wnt-3A, R-spondine, et Noggin conditionné-media. Une ligne de cellules L Wnt-3A exprimant est disponible dans le commerce (ATCC). D'autres groupes ont développé R-1- 23,27 spondine, Noggin- 19, et Wnt-3A / R-spondin3 / Noggin- 28 lignées cellulaires exprimant. Deux inhibiteurs de petites molécules sont utilisées dans la culture media et sont nécessaires pour le maintien de la culture 29. A-83 à 01 est un inhibiteur sélectif de la transformation de β du facteur de croissance et des récepteurs d'activine / nodales (kinase analogue à l'activine 4, 5, 7) et SB202190 est un inhibiteur de p38 mitogen-activated protein kinase (MAPK). Les deux inhibiteurs ont été utilisés respectivement pour soutenir pluripotentes induites cellules souches auto-renouvellement de l'homme et d'établir des cellules pluripotentes humaines naïfs souches 30-32. En outre, le nicotinamide, un précurseur de nicotinamide adénine dinucléotide, est nécessaire pour maintenir enteroids et l'extension de la colonoids de manière à long terme 22,29.
La chélation EDTA est une étape importante car elle détermine le rendement de la préparation de la crypte. Nous avons réussi avec un traitement EDTA 2 mM. Toutefois, la concentration de l'EDTA peut être modifié à partir de 2 mM à 15 mM en ce qui concerne le type de tissu. Dans ce cas, le temps d'incubation doit être déterminée de manière empirique. Après l'étalement initial, la crypte sera arrondir-up et finissent par former enteroids. Cependant, les enteroids ou colonoids démontrent souvent un phénotype «tige» en formant des sphères avec peu ou pas de cellules différenciées. Dans ce cas, la différenciation peut être déclenchée par le retrait de Wnt-3A, le nicotinamide et l'inhibiteur de la MAPK p38. L'utilisation d'un inhibiteur de Notch comme DAPT ou DBZ aide améliorant la différenciation dans les enteroids 22.
Ce modèle reprend la physiologie intestinale avec les événements de la crypte-herbe continuelles découlant d'un compartiment de cellules souches ainsi que des domaines épithéliales des villosités-comme contenant à la fois absorption et sécrétoires différenciées lignées. Fait intéressant, ce système ne contient pas de cellules mésenchymateuses et utilise des conditions de supports spécifiques pour satisfaire aux exigences de signal de créneau.
Comme le modèle murin, enteroids humains peuvent être générés à partir de cellules épithéliales intestinales isolées pour tester la capacité de ces cellules à fonctionner comme une cellule souche. SeveRAL études ont utilisé grappe de marqueurs de différenciation (CD44, CD24 ou CD166) et de cellules positives EphB2 pour enrichir en cellules souches ayant des propriétés 12,23,33. Ensemble, ces études démontrent l'utilité de enteroids droits cultures pour tester le caractère souche. D'autres chercheurs utilisent ce modèle pour étudier les maladies intestinales telles que les maladies infectieuses diarrhéiques, la fibrose kystique, ou les cancers colorectaux 22,34-37. Ces études démontrent que enteroids humaines constituent un modèle de maladie humaine fiable avec une possibilité d'aller vers un dépistage personnalisé. Enteroids humains peuvent être génétiquement modifiées en utilisant la transfection d'ADN ou d'infection avec des particules virales 38. Cela fournit un outil puissant pour étudier les fonctions spécifiques de gènes dans les organites épithéliales humaines ou des mutations génétiques correctes. Récemment, Schwank et ses collègues ont démontré la possibilité de modifier le génome avec le système de CRISPR / Cas9 et corriger la mutation sur le gène CFTR courant alternatif provoquantfibrose ystic 24. Enteroids humaines constituent un système précieux pour étudier les cellules souches épithéliales de la muqueuse intestinale et de la biologie et de servir comme un système expérimental roman étudier la physiologie gastro-intestinal normal et anormal.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We gratefully acknowledge Dr. Hans Clevers (Hubrecht Institute for Developmental Biology and Stem Cell Research, Netherlands) for the kind gift of TOPflash cells.
This project was supported in part by NIH-R01DK083325 (MAH); NIH P30 DK078392 (Digestive Health Center); NIH UL1RR026314 (CTSA).
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate buffered saline Ca2+, Mg2+ free (DPBS) | Life technologies; Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Sorbitol | Fischer Scientific | BP439-500 | |
| Sucrose | Fischer Scientific | BP220-1 | |
| Bovine serum albumin (BSA) Fraction V | Fischer Scientific | BP1600-100 | |
| Gzntamycin/Amphotericin B solution | Life technologies; Gibco | R-015-10 | |
| Wnt-3A conditioned medium | in house | ||
| Advanced DMEM/F12 | Life technologies; Gibco | 12634-028 | |
| HEPES 1M | Life technologies; Gibco | 15630-080 | |
| GlutaMAX (glutamine) | Life technologies; Gibco | 35050-061 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life technologies; Gibco | 15140-148 | |
| N2 Supplement | Life technologies; Gibco | 17502-048 | |
| B27 Supplement | Life technologies; Gibco | 17504-044 | |
| N-Acetylcysteine | Sigma-Aldrich | A9165-5G | |
| Nicotidamide | Sigma-Aldrich | N0636 | |
| Matrigel, GFR, Phenol free (basement membrane matrix) | Corning | 356231 | |
| human recombinant Noggin | R&D | 6057-NG/CF | |
| human recombinant R-Spondin | Preprotech | 120-38 | |
| human recombinant EGF | Sigma-Aldrich | E9644-.2MG | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | |
| A-83-01 | Tocris | 2939 | |
| SB202190 | Sigma-Aldrich | S7067-5MG | |
| human [Leu]15-Gastrin 1 | Sigma-Aldrich | G9145-.1MG | |
| CHIR99021 | Stemgent | 04-0004 | |
| Thiazovivin | Stemgent | 04-0017 | |
| TrypLE Express Enzyme (1X), phenol red (cell dissociation enzyme) | Life technologies; Gibco | 12605-010 | |
| Fetal Bovine Serum | Life technologies; Gibco | 10082-147 | |
| CTS Synth-a-Freeze Medium (freezing medium) | Life technologies; Gibco | A13713-01 | |
| L Wnt-3A cell line | ATCC | CRL-2647 | |
| Renilla luciferase assay | Promega | E2710 | |
| human recombinant Wnt-3A | R&D | 5036-WN/CF | |
| HEK293 TOPflash cell line |
Références
- Noah, T. K., Donahue, B., Shroyer, N. F. Intestinal development and differentiation. Exp Cell Res. 317 (19), 2702-2710 (2011).
- Shroyer, N. F., Kocoshis, S., Hyams, J. R. W. . Pediatric Gastrointestinal and Liver Diseases. , 324-336 (2010).
- Leushacke, M., Barker, N. Ex vivo culture of the intestinal epithelium: strategies and applications. Gut. , (2014).
- Simon-Assmann, P., Turck, N., Sidhoum-Jenny, M., Gradwohl, G., Kedinger, M. In vitro models of intestinal epithelial cell differentiation. Cell Biol Toxicol. 23 (4), 241-256 (2007).
- Barker, N., et al. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 6 (1), 25-36 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Mahe, M. M., et al. Establishment of Gastrointestinal Epithelial Organoids. Current Protocols in Mouse Biology. 3, 217-240 (2013).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340 (6137), 1190-1194 (2013).
- Stelzner, M., et al. A nomenclature for intestinal in vitro cultures. Am J Physiol Gastrointest Liver Physiol. 302 (12), G1359-G1363 (2012).
- Ramalingam, S., Daughtridge, G. W., Johnston, M. J., Gracz, A. D., Magness, S. T. Distinct levels of Sox9 expression mark colon epithelial stem cells that form colonoids in culture. Am J Physiol Gastrointest Liver Physiol. 302 (1), G10-G20 (2012).
- Furstenberg, R. J., et al. Sorting mouse jejunal epithelial cells with CD24 yields a population with characteristics of intestinal stem cells. Am J Physiol Gastrointest Liver Physiol. 300 (3), G409-G417 (2011).
- Wang, F., et al. Isolation and Characterization of Intestinal Stem Cells Based on Surface Marker Combinations and Colony-Formation Assay. Gastroenterology. , (2013).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc Natl Acad Sci U S A. 109 (2), 466-471 (2012).
- Es, J. H., et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nat Cell Biol. 14 (10), 1099-1104 (2012).
- Yui, S., et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat Med. 18 (4), 618-623 (2012).
- Durand, A., et al. Functional intestinal stem cells after Paneth cell ablation induced by the loss of transcription factor Math1 (Atoh1). Proc Natl Acad Sci U S A. 109 (23), 8965-8970 (2012).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Akcora, D., et al. The CSF-1 receptor fashions the intestinal stem cell niche. Stem Cell Res. 10 (2), 203-212 (2013).
- Farin, H. F., Van Es, J. H., Clevers, H. Redundant sources of Wnt regulate intestinal stem cells and promote formation of Paneth cells. Gastroenterology. 143 (6), 1518-1529 (2012).
- Rothenberg, M. E., et al. Identification of a cKit(+) colonic crypt base secretory cell that supports Lgr5(+) stem cells in mice. Gastroenterology. 142 (5), 1195-1205 (2012).
- Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured 'miniguts. Mol Cell Biol. 32 (18), 3639-3647 (2012).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. , (2014).
- Fuller, M. K., et al. Intestinal stem cells remain viable after prolonged tissue storage. Cell Tissue Res. 354 (2), 441-450 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Miyoshi, H., Ajima, R., Luo, C. T., Yamaguchi, T. P., Stappenbeck, T. S. Wnt5a potentiates TGF-beta signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Koo, B. K., Clevers, H. Stem Cells Marked by the R-Spondin Receptor Lgr5. Gastroenterology. , (2014).
- Li, W., et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell. 4 (1), 16-19 (2009).
- Tojo, M., et al. The ALK-5 inhibitor A-83-01 inhibits Smad signaling and epithelial-to-mesenchymal transition by transforming growth factor-beta. Cancer Sci. 96 (11), 791-800 (2005).
- Gafni, O., et al. Derivation of novel human ground state naive pluripotent stem cells. Nature. 504 (7479), 282-286 (2013).
- Gracz, A. D., et al. Brief report: CD24 and CD44 mark human intestinal epithelial cell populations with characteristics of active and facultative stem cells. Stem Cells. 31 (9), 2024-2030 (2013).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med (Maywood). , (2014).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat Med. 19 (7), 939-945 (2013).
- Kovbasnjuk, O., et al. Human enteroids: preclinical models of non-inflammatory diarrhea. Stem Cell Res Ther. 4, S3 (2013).
- Fujii, M., Sato, T. Culturing intestinal stem cells: applications for colorectal cancer research. Front Genet. 5, 169 (2014).
- Koo, B. K., Sasselli, V., Clevers, H. Retroviral gene expression control in primary organoid cultures. Curr Protoc Stem Cell Biol. 27 (Unit 5A), 6 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon