Method Article
Establecimiento de Human epitelial Enteroids y Colonoids de Whole Tejidos y Biopsia
En este artículo
Resumen
We describe a method to establish human enteroids from small intestinal crypts and colonoids from colon crypts collected from both surgical tissue and biopsies. In this methodological article, we present the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Resumen
The epithelium of the gastrointestinal tract is constantly renewed as it turns over. This process is triggered by the proliferation of intestinal stem cells (ISCs) and progeny that progressively migrate and differentiate toward the tip of the villi. These processes, essential for gastrointestinal homeostasis, have been extensively studied using multiple approaches. Ex vivo technologies, especially primary cell cultures have proven to be promising for understanding intestinal epithelial functions. A long-term primary culture system for mouse intestinal crypts has been established to generate 3-dimensional epithelial organoids. These epithelial structures contain crypt- and villus-like domains reminiscent of normal gut epithelium. Commonly, termed “enteroids” when derived from small intestine and “colonoids” when derived from colon, they are different from organoids that also contain mesenchyme tissue. Additionally, these enteroids/colonoids continuously produce all cell types found normally within the intestinal epithelium. This in vitro organ-like culture system is rapidly becoming the new gold standard for investigation of intestinal stem cell biology and epithelial cell physiology. This technology has been recently transferred to the study of human gut. The establishment of human derived epithelial enteroids and colonoids from small intestine and colon has been possible through the utilization of specific culture media that allow their growth and maintenance over time. Here, we describe a method to establish a small intestinal and colon crypt-derived system from human whole tissue or biopsies. We emphasize the culture modalities that are essential for the successful growth and maintenance of human enteroids and colonoids.
Introducción
El epitelio de revestimiento del tracto gastrointestinal está en constante renovación. Este proceso es activado por la proliferación de las células madre intestinales (SICS) que producen continuamente progenie para reemplazar rápidamente el epitelio intestinal, ya que da la vuelta. El compartimento proliferativo que comprende las ISC se limita a la parte inferior de las criptas. Los ISC dan lugar a la progenie que finalmente diferenciarse en linajes de absorción o secretoras. Salir de la cripta y en el epitelio de las vellosidades o superficie, las células se diferencian progresivamente a medida que migran hacia arriba antes de la exfoliación en el lumen 1. ISC dan lugar a todos los tipos de células epiteliales intestinales incluyendo los enterocitos, células de micropliegues, células enteroendocrinas, células caliciformes, células de mechones y células de Paneth. El colon se caracteriza por criptas alargados compuestos principalmente de colonocitos y células caliciformes, con enteroendocrinas dispersa y células penacho 2.
Ex vivo culsistemas tura constituyen herramienta prometedora para el estudio de mantenimiento ISC y la homeostasis del tejido intestinal. Sin embargo, es difícil confiar en las tecnologías de cultivo de tejidos como condiciones fisiológicas no están completamente la reproducción y el microambiente epitelial menudo alterados 3,4. Un gran avance en el campo de ISC fue el establecimiento de técnicas de cultivo de tejidos para mantener y ampliar los CSI murinos individuales utilizando factores de crecimiento definidos para reemplazar las señales de nicho intestinal normal. Condiciones de cultivo a largo plazo fueron descritos por Sato et al., En el que criptas individuales o células madre aisladas de el epitelio intestinal crecen para formar estructuras epiteliales 3-dimensionales incluyendo múltiples dominios de cripta 5-7. Estas estructuras tridimensionales experimentan eventos de fisión para expandir continuamente. Curiosamente, se producen todos los tipos de células intestinales específicas para el tejido de origen y así se extruyen en un lumen 8. Utilizando modificaciones de este sistema, epitelialesorganoides se pueden generar desde el estómago, intestino delgado y colon. Más específicamente, organoides epiteliales de intestino delgado son enteroids 9, y los de colon son colonoids 9,10. Estos sistemas de cultivo de organoides epiteliales se han utilizado para probar la capacidad de las células individuales aisladas para funcionar como células madre in vitro, probando así la "stemness" de células aisladas 5,6,10-15. Otros investigadores han utilizado ambos enteroids y colonoids para estudiar la función de las células epiteliales individuales 16-21. Así, las culturas enteroide y colonoid pueden utilizarse para evaluar tanto las funciones de madre y de células no tallo y dar una nueva visión de las interacciones celulares fundamentales dentro de los intestinos.
En 2011, Sato y sus colegas generaron cultivo a largo plazo de los organoides epiteliales derivadas de intestino delgado y colon 22,23 humano. Además de las diferencias en la composición de los medios de comunicación, los enteroids epiteliales humanasy colonoids exhiben las mismas características que su homólogo murino. Además, pueden generarse a partir de los tejidos enfermos, tales como el esófago, el adenoma o adenocarcinoma de Barrett, y la fibrosis quística 22,24. Enteroids humanos constituyen un sistema valioso para estudiar intestinal de células madre y la biología de la mucosa epitelial y servir como un novedoso sistema experimental para estudiar la fisiología gastrointestinal normal y anormal 3.
Aquí se describen los métodos para establecer enteroids y colonoids de intestino delgado humano y criptas del colon (Figura 1). En esta revisión metodológica, destacamos la colección cripta de todo el tejido y biopsias. Nos Recapitulemos las modalidades de cultivo que son esenciales para el crecimiento y mantenimiento de enteroids y colonoids humanos y las posibles estrategias experimentales llevadas a cabo por este exitoso modelo.
Protocolo
Declaración de Ética: NOTA: Todos los experimentos usando tejidos humanos descritos en el presente documento fue aprobado por un IRB en CCHMC (IRB # 2012-2858; # 2014 hasta 0427). El consentimiento informado para la recogida de tejidos, almacenamiento y uso de las muestras se obtuvo de los donantes en CCHMC.
1. Preparación para la Cultura
NOTA: Todos los reactivos se enumeran en la Tabla 1.
- Preparar solución madre de EDTA como sigue: preparar 0,5 M de ácido etilendiaminotetraacético, pH 8 (EDTA) en ultrapura H 2 O, filtro esterilizado con filtro de 0,22 micras. Opcionalmente, almacenar la solución de EDTA acciones en RT indefinidamente.
- Preparar tampón quelante como sigue: mezclar 2% de sorbitol, 1% de sacarosa, 1% de albúmina sérica bovina fracción V (BSA) y 1x gentamicina / anfotericina solución en fosfato de Dulbecco solución salina tamponada sin Ca2 + y Mg2 + (DPBS), filtro esterilizado con 0,22 micras filtro. Prepare el buf quelantefresco fer.
- Prepare medio Wnt-3A-condicionado como sigue: medio acondicionado-Wnt-3A está hecha en casa usando la línea celular L Wnt-3A de acuerdo con las instrucciones del fabricante (ATCC, CRL-2647). Suplemento el medio con glutamina 2 mM, HEPES 10 mM, 100 U / ml de penicilina, 100 g / ml de estreptomicina, 1 suplemento N2, 1 suplemento B27, 1% de BSA y esterilizar por filtración con filtro de 0,22-micras.
NOTA: Prueba de cada lote para la actividad Wnt utilizando un ensayo TOPflash. Utilice una línea celular HEK293 estable TOPflash (laboratorio de Hans Clevers) con un kit de ensayo de luciferasa de Renilla de acuerdo con las instrucciones del fabricante. Normalizar el ensayo TOPflash con 100 ng / ml Wnt-3A recombinante humano. Confirmar al menos una actividad de 10 veces el cambio de los medios condicionados comparación con el control. Divida medio condicionado-Wnt-3A fresco en alícuotas de 10 ml en 15 ml tubos cónicos y congelación a -20 ° C durante un máximo de 6 meses. Tienda descongelado alícuotas hasta 5 días a 4 ° C sin pérdida de actividad. - Prepare medio minigut humano como sigue: Suplemento Advanced medio DMEM / F12 con glutamina 2 mM, HEPES 10 mM, 100 U / ml de penicilina, / ml de estreptomicina, 1 suplemento de 100 g N2, 1 suplemento B27, 1% de BSA y esterilizar por filtración con 0,22 filtro de micras.
NOTA: Divida medio minigut humana fresca en alícuotas de 10 ml en 15 ml tubos cónicos y congelación a -20 ° C hasta por 3 meses. Tienda descongelado alícuotas hasta 5 días a 4 ° C sin pérdida de actividad. - Preparar medio completo minigut humano de la siguiente manera: Prepare fresco antes cripta cultura o cambio de medio a medio minigut humana (véase 1.4), complementado con un 50% de medio Wnt-3A acondicionado (véase 1.3), 1 mg / ml R-espondina 1 (1: 1000 dilución de 1 mg / ml stock), 100 ng Noggin / ml (1: 1000 dilución de 100 g / mL stock), 50 ng / ml EGF (dilución 1: 10.000 de 500 mg / ml stock), 500 nM A-83 -01 (1: 1000 dilución de 500 M stock), 10 mM SB202190 (1: 3000 dilución de 30 mM stock), 10 nM de [Leu] 15-gastrina 1 (dilución 1: 10.000 de 100 mu Mstock), nicotinamida 10 mM (dilución 1: 100 de 1 M) y 1 mM de N-acetilcisteína (1: 1000 dilución de 1 M).
NOTA: Guarde medio completo minigut humanos hasta 2 días a 4 ° C sin pérdida de actividad.
2. Cripta aislados del Tejido
NOTA: A partir de la recogida de tejido, es esencial para mantener la muestra en solución salina. Se recomienda mantener el tejido en hielo durante el transporte. Preparación de la muestra para el aislamiento de las criptas se debe realizar lo más pronto posible.
NOTA: Todos los reactivos se enumeran en la Tabla 1, las herramientas, equipos y consumibles se enumeran en la Tabla 2.
- Preparar todos los reactivos antes de comenzar el experimento. Descongelar la matriz de la membrana basal en hielo y se pre-incubar una placa de 24 pocillos en un incubador de CO 2 a 37 ° C.
NOTA: Alternativamente hacer una capa delgada de matriz de membrana basal utilizando 15 l / pocillo en el centro de un 24placa -bueno y colóquelo en una incubadora de CO 2 a 37 ° C. Este paso facultativa mantiene la matriz de membrana basal como una caída durante la polimerización. - Lavar el tejido con fosfato de Dulbecco solución salina tamponada sin Ca2 + y Mg2 + (DPBS) enfriado con hielo. Continúe hasta que el contenido de DPBS es clara.
- Uso de 0,2 mm de diámetro pasadores minutien, asegurar el tejido en una placa de Petri de vidrio recubierto de silicona llena con DPBS enfriado con hielo. Estire y el pin del tejido plana con el lado de la mucosa hacia arriba.
- Bajo un microscopio de disección, retire la mucosa suprayacente de la submucosa y el tejido conectivo con tijeras micro-disección y de punto fino curvas pinzas (Figura 2A, B).
- Estirar y echar la diseccionado mucosa plana en el cristal Petri plato recubierto de silicona con el lado de la mucosa hacia arriba. La submucosa restante y el tejido conectivo pueden ser descartados o usados para experimentos adicionales (Figura 2C).
- Suavementeraspar la superficie de la mucosa con unas pinzas curvas. Este paso es necesario para mejorar la calidad de la preparación.
- Para intestino delgado, raspar suavemente la mucosa para eliminar las vellosidades.
- Para colon, raspar suavemente la mucosa para eliminar la mucosa y los escombros.
- Lave la mucosa 3-4 veces con tampón de quelación helada para eliminar las vellosidades y escombros.
- Cubrir la mucosa con tampón de quelación EDTA 2 mM recién preparada (200 l 0,5 M EDTA en 49,6 ml de tampón de quelación).
- Coloque la placa de Petri en el hielo y agite suavemente durante 30 minutos en un agitador orbital horizontal.
- Lave el tejido 3-4 veces con tampón de quelación helado sin EDTA. Después del lavado, dejar la mucosa en tampón de quelación enfriado con hielo.
- Procesar la mucosa con un microscopio de disección utilizando pinzas curvas y finos. Raspar suavemente la mucosa para liberar criptas intestinales utilizando las pinzas curvas.
- Retire con cuidado la suspensión cripta de la placa de Petri utilizando un pipette y la transfiere en un tubo cónico de 50 ml.
NOTA: compruebe el tejido para asegurarse de que casi todas las criptas se han eliminado de la mucosa. - Se filtra la suspensión a través de criptas a 150 micras de malla 2 veces.
NOTA: compruebe el flujo a través de enriquecimiento cripta bajo el microscopio (Figura 2D). - Centrifugar la cripta suspensión 5 min a 50 xg, 4 ° C. Eliminar el sobrenadante.
- Resuspender el precipitado en 5 ml de tampón enfriado con hielo quelación.
- Cuente el número de criptas por 10 l gota de la suspensión del paso 2.15. Transferir el número de criptas necesarios para el recubrimiento de un 5 ml de tubos de fondo redondo. Use 200 a 500 criptas por pocillo de una placa de 24 pocillos para establecer enteroids o colonoids.
- Centrifugar la fracción cripta durante 10 min a 150 g, 4 ° C. Eliminar el sobrenadante.
- Utilice criptas para el cultivo posterior.
3. Cripta Aislamiento de biopsia
- Preparar todos los reactivos antes de lainicio del experimento. Descongelar la matriz de la membrana basal en hielo y se pre-incubar una placa de 24 pocillos en un incubador de CO 2 a 37 ° C.
- Lavar la biopsia con fosfato de Dulbecco solución salina tamponada sin Ca2 + y Mg2 + (DPBS) enfriado con hielo.
- Uso de 0,1 mm de diámetro pasadores minutien, asegure la biopsia en una placa de Petri de vidrio recubierto de silicona llena con DPBS enfriado con hielo. Estirar y el pin de la mucosa plana con el lado de la mucosa hacia arriba (Figura 2E).
- Raspar suavemente la superficie de la mucosa con pinzas curvas para eliminar las vellosidades y escombros. Este paso es necesario para mejorar la calidad de la preparación.
- Lave la biopsia 3-4 veces con tampón de quelación helada para eliminar las vellosidades y escombros.
- Cubrir la biopsia con tampón de quelación EDTA 2 mM recién preparada (200 l 0,5 M EDTA en 49,8 ml de tampón de quelación).
- Coloque la placa de Petri en el hielo y agite suavemente durante 30 minutos en un agitador orbital horizontal.
- Lave la biopsia de 3-4 veces con tampón de quelación helado sin EDTA. Después del lavado, dejar la biopsia en tampón de quelación enfriado con hielo.
- Procesar la biopsia bajo un microscopio de disección utilizando pinzas curvas y finos. Raspar suavemente la mucosa para liberar las criptas intestinales utilizando pinzas curvas.
- Retire suavemente la suspensión cripta de la placa de Petri con una pipeta y transferirlo a un tubo cónico de 50 ml.
NOTA: compruebe el tejido para asegurarse de que casi todas las criptas se han eliminado de la mucosa. - Filtrar la suspensión cripta a través de un nylon de 150 micras de malla 2 veces.
NOTA: compruebe el flujo a través de enriquecimiento cripta bajo el microscopio. - Centrifugar la cripta suspensión 5 min a 50 xg, 4 ° C. Eliminar el sobrenadante.
- Resuspender el precipitado en 1 ml de tampón de quelación enfriado con hielo. Transferir la suspensión cripta a un tubo de microcentrífuga de 1,5 ml.
- Centrifugar la fracción cripta durante 10 min a 150 xg, 4 ° C. Eliminar el sobrenadante.
- Utilice criptas para el cultivo posterior.
4. Cripta Cultura en Sótano Matrix Membrana
- Utilizando puntas de pipeta preenfriados, resuspender el precipitado cripta (del paso 2.18 o 3.15) en el sótano matriz de la membrana (200 a 500 criptas / 50 l sótano matriz de la membrana).
- Aplicar 50 l de suspensión cripta en la matriz de la membrana basal por pocillo en la placa de pre-calentado. Lentamente expulsar la matriz de la membrana basal en el centro del pozo.
- Coloque la placa de 24 pocillos en un 37 ° C, 5% de CO 2 incubadora durante 30 min para permitir una polimerización completa de la matriz de la membrana basal.
- Superposición de la matriz de la membrana basal con 500 l de medio de minigut humano completo suplementado con 2,5 mM CHIR99021 (1: 4000 dilución de almacén 10 mM) y 2,5 mM Thiazovivin (1: 4000 dilución de stock 10 mM).
- Incubar la placa en un 37 ° C, 5% de CO2.
- Sustituya el medio sens completo frescon minigut medio cada 2 días.
5. pases de Cultivadas Enteroids y Colonoids.
NOTA: Paso Enteroids y Colonoids cada 7 a 10 días después de placas inicial. Generalmente, dividir un pocillo en 3 a 4 pozos.
- Preparar todos los reactivos antes del comienzo del experimento. Descongelar la matriz de la membrana basal en hielo y se pre-incubar una placa de 24 pocillos en un incubador de CO 2 a 37 ° C.
- Retire los medios de comunicación utilizando puntas estériles y superposición con 1 ml de DPBS heladas.
- Pipeta de ida y vuelta con una punta de 1.000 l. Transferir la solución en un nuevo tubo cónico de 15 ml.
- Añadir 2 ml de medio de minigut humano suplementado con FBS al 5% por 1 ml de medio.
- Centrifugar la solución durante 5 min a 50 xg, 4 ° C. Eliminar el sobrenadante.
- Resuspender el sedimento con 2 ml de la enzima de disociación celular suplementado con 10 mM Y-27632 (1: 1000 dilución de stock 10 mM). Incubar durante 5 men a 37 ° C en un baño de agua.
- Disociar los grupos de células usando un 3 ml Luer-Lock jeringa equipada con una aguja de llenado 18-G / romo. Pipetear suavemente la solución de un lado a otro con la jeringa 10 veces.
- Se centrifuga la suspensión durante 5 minutos a 500 xg, 4 ° C. Eliminar el sobrenadante.
- Utilizando puntas de pipeta pre-refrigerados, resuspender el sedimento celular en la matriz de la membrana basal.
- Aplicar 50 l de suspensión cripta en la matriz de la membrana basal por pocillo en la placa de pre-calentado. Lentamente expulsar la matriz de la membrana basal en el centro del pozo.
- Coloque la placa de 24 pocillos en un 37 ° C, 5% de CO 2 incubadora durante 20 min para permitir una polimerización completa de la matriz de la membrana basal.
- Superposición de la matriz de la membrana basal con 500 l de medio de minigut humano completo suplementado con 10 mM Y-27632 (1: 1000 dilución de stock 10 mM).
- Incubar la placa en un 37 ° C, 5% de CO2.
- Después de 2 días, Sustituir el medio con medio minigut humano completo fresco suplementado con 10 mM Y-27632 (1: 1000 dilución de stock 10 mM). A partir de entonces, sustituir el medio con medio minigut humana fresca, completa cada dos días.
6. Congelación de Cultivadas Enteroids y Colonoids
NOTA: Por lo general, congelar un pozo en 2-3 crioviales.
- Repita los pasos 5.1 a 5.8.
- Resuspender el pellet con medio de congelación frío. Transferencia de 1 ml de solución de congelación en un criovial etiquetado. Coloque el criovial en un recipiente de congelación que contiene 500 ml de alcohol isopropílico.
- Transferir el contenedor de congelación a un congelador 80 ° C durante 24 h, a continuación, transferir criovial de almacenamiento de nitrógeno líquido.
NOTA: Guarde Enteroids y Colonoids por hasta 1 año.
Resultados
La Figura 2D muestra un ejemplo típico de las criptas recién aisladas de tejido completo (Figura 2D). El número de criptas aisladas a partir de una biopsia es menor que en todo el tejido. Con unas pinzas de biopsia capacidad estándar con aguja, normalmente realizamos dos bocados de biopsia en una sola pasada. Cada resultados de la biopsia de la mordedura en una superficie de 10 mm 2 con un promedio de 50 a 100 criptas por biopsia (Figura 2F).
Después de la cultura en la matriz de la membrana basal, las criptas completan para formar enterospheres de intestino delgado y colonospheres de colon. La cripta de florecimiento ocurre generalmente dentro de 5 a 6 días, después de la siembra. Sin embargo, no es raro ver a cualquiera enteroids (enteroids) o colonoids (colonoids) que forman esferas en la matriz de la membrana basal (Figura 3A-C; Movie 1). El pases se puede hacer después de 7 días, dependiendo del tamaño de los enteroids. El enteroids o colonoids establISHED de biopsias sufren el mismo desarrollo en la cultura. Sin embargo, como la densidad cripta de siembra es menor, el pases se realiza generalmente después de 10 a 12 días en cultivo (Figura 4a, b). Enteroids y culturas colonoids se expanden de una manera reproducible.
Ambos enteroids y colonoids presentan un lado luminal y se alinean con un epitelio (Figura 5A, B). Células proliferativas se pueden observar dentro de los enteroids y se encuentran dentro de las puntas de yemas (Figura 5C, D). Imagen confocal de enteroids teñidas con E-cadherina (cadE) muestra las células epiteliales (Figura 5E).
Ambos enteroids y colonoids se pueden establecer a partir de tejido obtenidas de pacientes con trastornos genéticos / congénitas. La Figura 6 muestra enteroids representativos de crecimiento de un paciente con fibrosis quística (Figura 6A) y una enteropatía tufting debido a una mutación congénita en el anuncio de células epitelialesgen molécula cohe- (EpCAM) (Figura 6B). Al lado del defecto genético, los enteroids no muestran diferencias en la condición basal.

Figura 1. Flujo de trabajo de las criptas disociación y la generación de enteroids humanos y colonoids en cultivo. Criptas (de intestino delgado o el colon humano) están aislados por quelación con EDTA. Criptas cultivadas forman enteroids para el intestino delgado y colonoids para el colon. Por favor, haga clic aquí para ver una versión más grande de esta figura.
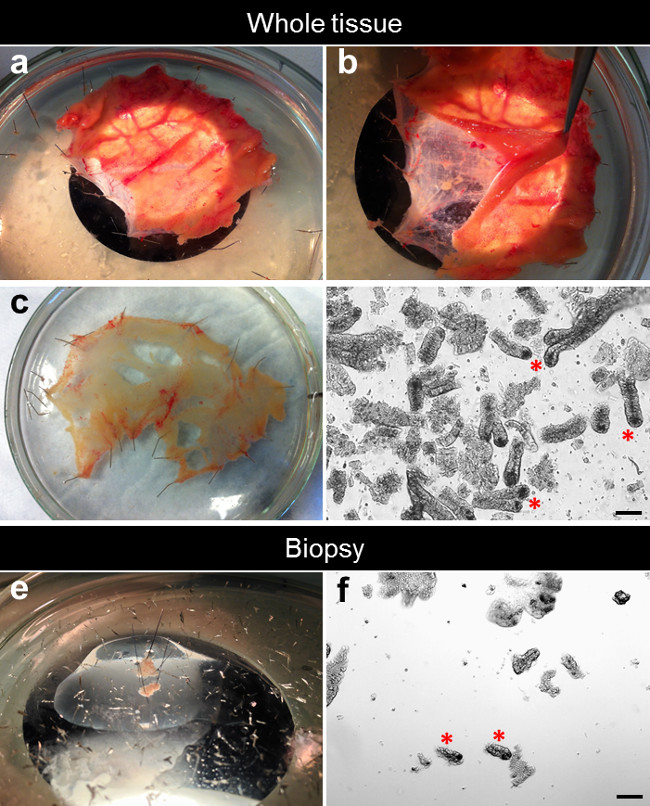
Figura 2. proceso de disección para el aislamiento cripta. (A) El pequeño specime intestinon se estira y se fijó plano en una placa de Petri recubierta de silicona. (B) La mucosa se separa de la submucosa subyacente. (C) La mucosa diseccionado se estira y se fijó plano en una placa de Petri recubierta de silicona. (D) Después de quelación con EDTA, las criptas están aislados del tejido. (E) Una biopsia se estira y se fijó plano en una placa de Petri recubierta de silicona. (F) Después de la quelación con EDTA, criptas están aislados de la biopsia. Por favor, haga clic aquí para ver una versión más grande de esta figura.
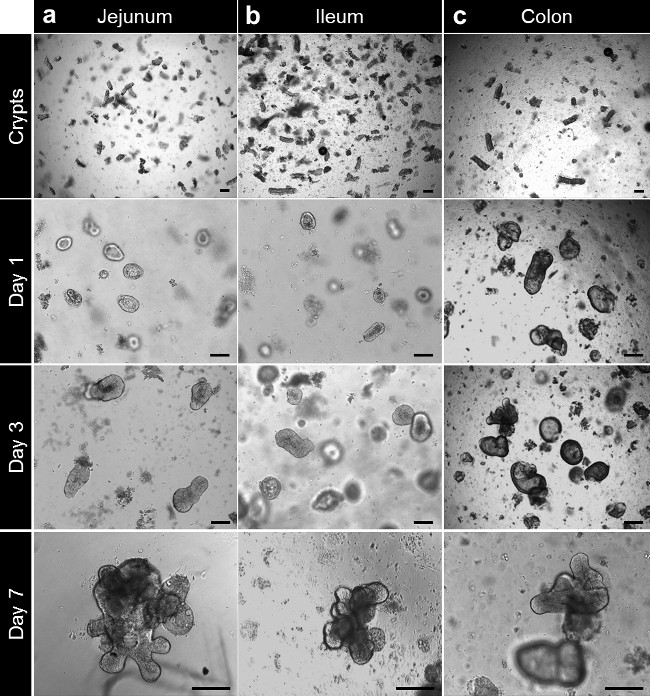
Figura 3. cultura Cripta y enteroide humano y la generación colonoid de todo el tejido. (A) criptas yeyunal chapados en la matriz de la membrana basal después del aislamiento. Las criptas están cerrando después de 3 a 4 horas y se empiezan a hinchar hasta formar enterospheres más allá de este tiempo. A los 7 días, se forman los enteroids yeyunales. (B) Después del aislamiento y la cultura, criptas ileales se comportan como las criptas del yeyuno y forman enteroids ileal. (C) criptas colónicas se siembran en la matriz de la membrana basal después del aislamiento. Las criptas colonoids cercanos y formar después de 7 días (barras de escala: 100 micras). Haga clic aquí para ver una versión más grande de esta figura.
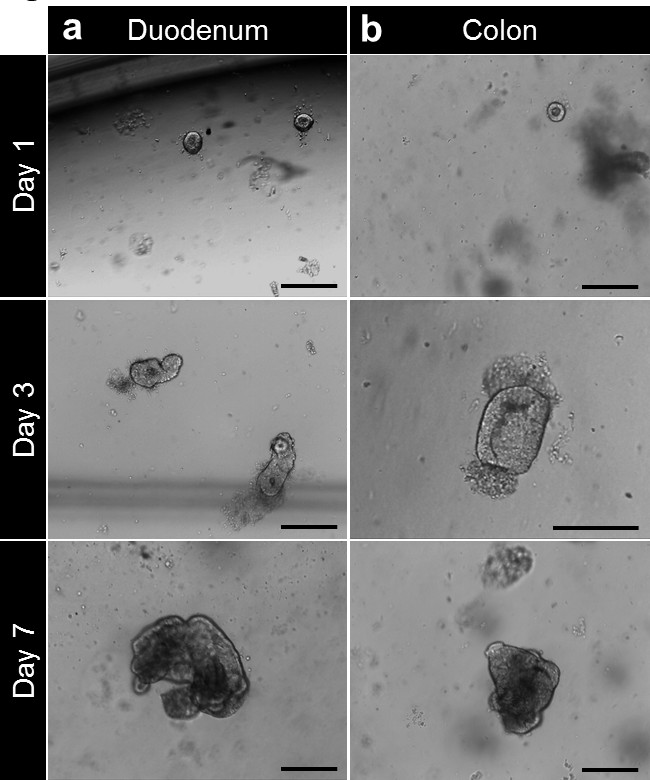
Figura 4. cultura Cripta y enteroide humano y la generación colonoid de biopsia. (A) criptas duodenales chapados en la matriz de la membrana basal después del aislamiento. Las criptas están cerrando después de 3 a 4 horas y se comienzan a inflarse beyond esta vez para formar enterospheres. A los 7 días, se forman los enteroids. (B) Después del aislamiento y de la cultura, las criptas del colon se siembran en la matriz de la membrana basal. Las criptas de cerca para formar colonospheres entonces colonoids después de 7 días (barras de escala: 100 micras). Por favor, haga clic aquí para ver una versión más grande de esta figura.
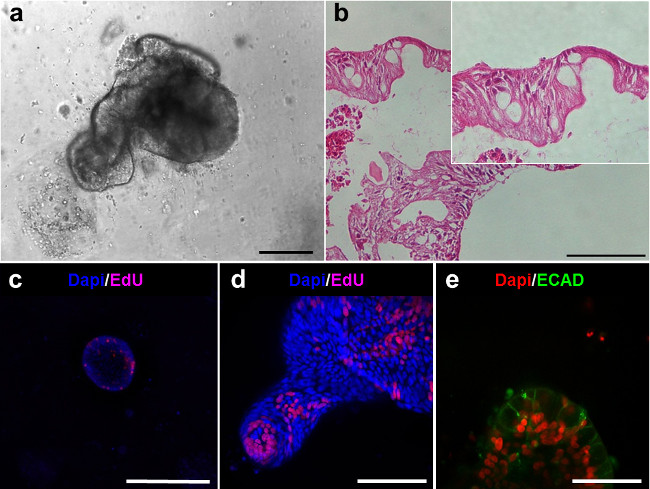
Figura 5. intestinales linajes de los enteroids humanos. (A) enteroide humano después de 6 días de cultivo. (Las barras de escala: 100 micras) secciones hematoxilina-eosina de los enteroids en (A) demostrar el epitelio de revestimiento (B). (CD) de formación de imágenes confocal de enteroids Después de la tinción EdU (magenta) muestra la presencia de células proliferativas. (E ) Confocal de imágenes de enteroids demuestra la presencia de: E-cadherina en las células epiteliales (ECAD, verde) (barra de escala:. 50 micras) Haga clic aquí para ver una versión más grande de esta figura.
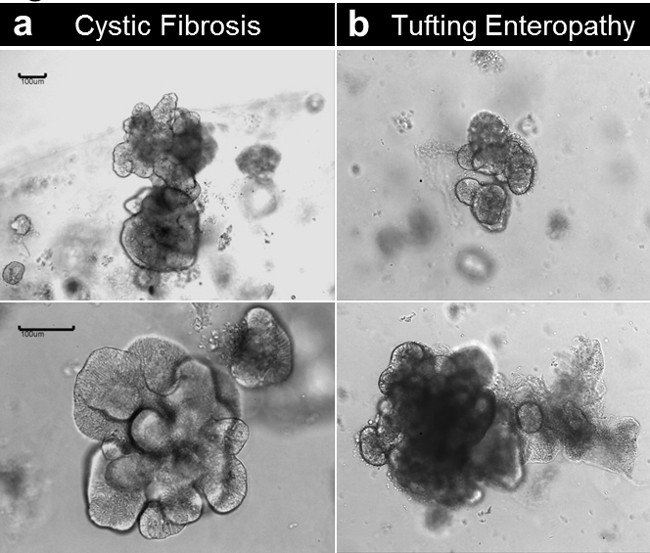
Figura 6. cripta cultura y la generación de enteroide humano a partir de tejido enfermo. (A) Enteroids establecieron a partir de una muestra de fibrosis quística. (B) Enteroids establecieron a partir de una muestra congénitas enteropatía insertar mechones (barras de escala: 100 micras). Haga clic aquí para ver una versión más grande de esta figura.
Película 1. Enterosphere formando enteroide humana en la cultura. 32 h de tiempo de vueltase grabación muestra un enterosphere establecido a partir de intestino delgado humano retraer para formar una enteroide en la cultura. Por favor, haga clic aquí para ver el vídeo.
| Nombre de Reactivo | Empresa | Número de catálogo | Solvente | Stock Concentración | Concentración final | Comentario |
| Fosfato de Dulbecco tamponada salina Ca 2+, Mg 2+ libre (DPBS) | Tecnologías de la vida; Gibco | 14190-144 | - | - | 1x | |
| Etilendiamina ácido tetraacético (EDTA) | Sigma-Aldrich | 431788 | Ultrapura H2Od | 0,5 M | 2 mM | |
| Sorbitol | Fischer Scientific | BP439-500 | DPBS | Polvo | 2% | |
| La sacarosa | Fischer Scientific | BP220-1 | DPBS | Polvo | 1% | |
| Albúmina de suero bovino (BSA) fracción V | Fischer Scientific | BP1600-100 | DPBS | Polvo | 1% | |
| Solución Gzntamycin / anfotericina B | Tecnologías de la vida; Gibco | R-015 a 10 | - | 500x | 1x | |
| Wnt-3A acondicionado en toda medio | en casa | - | - | - | - | |
| Advanced DMEM / F12 | Tecnologías de la vida; Gibco | 12634-028 | - | - | - | |
| HEPES 1M | Tecnologías de la vida; Gibco | 15630-080 | - | 1 M | 10 mM | |
| GlutaMAX (glutamina) | Tecnologías de la vida; Gibco | 35050-061 | - | 100X | 1X | |
| Penicilina-estreptomicina (10.000 U / ml) | Tecnologías de la vida; Gibco | 15140-148 | - | 100X | 1X | |
| N2 Suplemento | Tecnologías de la vida; Gibco | 17502-048 | - | 100X | 1X | |
| B27 Suplemento | Tecnologías de la vida; Gibco | 17504-044 | - | 50X | 1X | |
| N-acetilcisteína | Sigma-Aldrich | A9165-5G | DPBS | 1 M | 1 mM | |
| Nicotidamide | Sigma-Aldrich | N0636 | DPBS | 1 M | 10 mM | |
| Matrigel, TFG, Fenol (matriz de membrana basal) gratis | Corning | 356231 | - | - | - | SE REQUIERE |
| Noggin recombinante humana | I + D | 6057-NG / CF | DPBS | 100 mg / ml | 100 ng / ml | Otros proveedores: I + D; Anaspec y Preprotech |
| humana recombinante R-Spondin | Preprotech | 120-38 | DPBS | 1 mg / ml | 1 mg / ml | |
| EGF humano recombinante | Sigma-Aldrich | E9644-.2mg | SPD | 500 mg / ml | 50 ng / ml | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | DPBS | 10 mM | 10 mM | |
| A-83-01 | Tocris | 2939 | DMSO | 500 mM | 500 nM | |
| SB202190 | Sigma-Aldrich | S7067-5MG | DMSO | 30 mM | 10 mM | |
| humana [Leu] 15-gastrina 1 | Sigma-Aldrich | G9145-.1MG | DPBS | 100 mu M | 10 nM | |
| CHIR99021 | Stemgent | 04-0004 | DMSO | 10 mM | 2,5 mM | |
| Thiazovivin | Stemgent | 04-0017 | DMSO | 10 mM | 2,5 mM | |
| TrypLE expreso Enzyme (1X), rojo fenol (enzima de disociación celular) | Tecnologías de la vida; Gibco | 12605-010 | - | - | - | Para passaging |
| Suero bovino fetal | Tecnologías de la vida; Gibco | 10082-147 | - | - | - | Para passaging |
| CTS Synth-a-Freeze (medio de congelación) Medio | Tecnologías de la vida; Gibco | A13713-01 | - | - | - | Para la congelación |
| Línea celular L Wnt-3A | ATCC | CRL-2647 | - | - | - | Wnt-3A acondicionado en toda la producción de los medios |
| Ensayo de luciferasa Renilla | Promega | E2710 | - | - | - | Wnt-3A acondicionado en toda la actividad de los medios |
| humana recombinante Wnt-3A | I + D | 5036-WN / CF | DPBS | 100 mg / ml | 100 ng / ml | Wnt-3A climatizado actividad de los medios |
| Línea celular HEK293 TOPflash | - | - | - | - | - | Wnt-3A acondicionado en toda la actividad de los medios; Regalo del laboratorio Hans Clevers |
Tabla 1. reactivo lista detallada con el fabricante preferido y el número de catálogo.
| Equipo | Consumible | Instrumentos |
| Campana de flujo laminar | De 15 y 50 ml tubos cónicos | Dumont # 5 pinzas estándar (FST; # 11251-20) |
| CO 2 incubadora | Tubos de microcentrífuga | Dumont # 7, pinzas finas curvas (FST; # 11274-20) |
| Estereomicroscopio | Placas de 24 pocillos | Bellas tijeras (FST; # 14060-09) |
| Centrífugo | 0,22 micras (Sartorius) filtros | Tijeras de primavera Vannas (FST; # 15018-10) |
| Agitador orbital | Pipetas serológicas | Pasadores de diámetro minutien 0.2 mm (FST; # 26002-20) |
| Contenedor de congelación (Nalgene) | Puntas de micropipeta | Pasadores de diámetro minutien 0.1 mm (FST; # 26002-10) |
| Sylgard 184 de silicona (Dow Corning) | 150 micras aberturas de la malla, la detección de nylon (Dynamic Aqua-oferta) | |
| Plato de cristal Petri | 5 ml tubos de polipropileno de fondo redondo (Falcon) | |
| Pipeta serológica | 18G aguja de llenado romo (BD) | |
| Micropipetas | 3 ml lsyringes con puntas Luer-Lock (BD) | |
| Crioviales |
Tabla 2. detallada consumibles, herramientas y equipos necesarios para el aislamiento y cultivo cripta.
Discusión
Este método proporciona un sistema completo de reproducción de linajes epiteliales intestinales y la dinámica epiteliales que constituyen una herramienta útil para estudiar la biología epitelial intestinal. El método presentado en este documento es una adaptación del estudio murino original por Sato y Clevers 22 que resulta eficiente en enteroids humanos y colonoids. Aquí, nos recogieron manualmente las criptas por microdisección para evitar contaminantes celulares. Este método permite una visualización directa de las criptas y conduce a las horas extraordinarias consistencia en comparación con la colección cripta original de "agitación". Otros grupos desarrollaron técnicas similares utilizando enfoques ligeramente diferentes, especialmente la sustitución de la quelación con EDTA con colagenasa 25. Además de las diferencias en la recopilación de cripta, esas técnicas utilizan un medio definido que se requiere para crecer las enteroids humanas en cultivo 22. Para aumentar la eficiencia de crecimiento en la siembra cripta, añadimos un inhibidor de GSK3 (CHIR99021)durante los dos primeros días de 12.
La manipulación del tejido o biopsias es importante y el aislamiento cripta debe realizarse tan pronto como llega el tejido en el laboratorio. Sin embargo, el retraso en el aislamiento y cultivo cripta se podían realizar hasta 24 horas después de la recogida de tejidos (datos no mostrados) como se describe previamente para el tejido murino 26. El tejido intestinal se debe colocar en un tubo cónico completamente lleno con DPBS para evitar la interrupción del tejido y debe mantenerse a 4 ° C. La preparación retardada permite el envío tejido, pero la variación de temperatura se debe evitar durante el transporte. El tiempo total necesario para el cultivo inicial cripta es de aproximadamente 2 horas con 15 a 30 min para procesar el tejido y de 1 a 2 horas para aislar y la placa de la cripta. La microdisección del tejido es un determinante crítico y el predicado de una preparación cripta limpio. Sin embargo, el comunicado de la cripta por agitación manual como se describe en varios protocolos es posible 22,23.
A pesar de las similitudes con el sistema enteroide murino (enteroids), los enteroids humanos requieren moléculas específicas para mejorar y sostener su crecimiento en el tiempo. Los factores de crecimiento, EGF, Noggin, R-espondina se utilizan de manera similar a los organoides epiteliales murinas. Sin embargo, el uso de Wnt-3A es crítica. Hemos observado que la formación, así como la eficiencia de crecimiento es mayor utilizando un medio acondicionado Wnt-3A de la proteína recombinante humana. Al mismo tiempo, hemos demostrado la mejora de las condiciones de cultivo utilizando un inhibidor de la glucógeno sintasa quinasa 3 (CHIR99021) 12. Factores de crecimiento recombinantes podrían ser reemplazadas por Wnt-3A, R-espondina, y Noggin acondicionado medios de comunicación. Una línea de células L Wnt-3A-expresión está disponible comercialmente (ATCC). Otros grupos han desarrollado R-espondina 1- 23,27, Noggin- 19, y Wnt-3A / R-spondin3 / Noggin- 28 líneas celulares que expresan. Dos inhibidores de moléculas pequeñas se utilizan en la cultura mede diámetro y son necesarios para el mantenimiento de la cultura 29. A-83-01 es un inhibidor selectivo de la transformación del factor de crecimiento β y activina / receptores nodal (activina-quinasa como 4, 5, 7) y SB202190 es un inhibidor de la proteína quinasa activada por mitógenos p38 (MAPK). Tanto los inhibidores se han utilizado respectivamente para sostener inducidas pluripotentes células madre de auto-renovación humana y establecer células pluripotentes ingenuos humanos madre 30-32. Además, la nicotinamida, un precursor de la nicotinamida adenina dinucleótido, se requiere para mantener enteroids y expansión colonoids de una manera a largo plazo 22,29.
La quelación con EDTA es un paso importante, ya que determina el rendimiento de la preparación cripta. Hemos tenido éxito con el tratamiento 2 mM EDTA. Sin embargo, la concentración de EDTA se puede modificar desde 2 mM a 15 mM con respecto al tipo de tejido. En ese caso, el tiempo de incubación tiene que ser determinado empíricamente. Después de la placa inicial, la cripta redondeará-up y, finalmente, forman enteroids. Sin embargo, los enteroids o colonoids menudo demuestran un fenotipo "tallo" mediante la formación de esferas con poco o nada de células diferenciadas. En ese caso, la diferenciación se puede iniciar mediante la retirada de Wnt-3A, la nicotinamida y el inhibidor de p38 MAPK. El uso de inhibidores de Notch como DAPT o DBZ ayuda a aumentar la diferenciación dentro de los enteroids 22.
Este modelo recapitula la fisiología intestinal con los eventos de las criptas-ciernes continuas derivadas de un compartimento de células madre, así como dominios epiteliales de las vellosidades similares que contienen tanto de absorción y secretoras diferenciadas linajes. Curiosamente, este sistema no contiene células mesenquimales y utiliza condiciones de medios específicos para cumplir con los requisitos de la señal nicho.
Al igual que el modelo murino, enteroids humanos pueden ser generados a partir de células epiteliales intestinales aislados para poner a prueba la capacidad de estas células para funcionar como una célula madre. SeveRAL estudios han utilizado grupo de marcadores de diferenciación (CD44, CD24 o CD166) y células positivas EPHB2 para enriquecer en células madre con propiedades 12,23,33. Juntos, estos estudios demuestran la utilidad de las culturas enteroids humanos para probar la stemness. Otros investigadores están utilizando este modelo para investigar las enfermedades intestinales, como enfermedades infecciosas diarreicas, la fibrosis quística, o cánceres colorrectales 22,34-37. Estos estudios demuestran que enteroids humanos constituyen un modelo fiable de la enfermedad humana, con la posibilidad de avanzar hacia una proyección personalizada. Enteroids humanos pueden ser modificados genéticamente mediante transfección de ADN o infección con partículas virales 38. Esto proporciona una poderosa herramienta para estudiar las funciones de genes específicos dentro de los organoides epiteliales humanas o mutaciones genéticas correctas. Recientemente, Schwank y sus colegas demostraron la posibilidad de editar el genoma con el sistema CRISPR / Cas9 y corregir la mutación en el gen CFTR que causa acfibrosis ystic 24. Enteroids humanos constituyen un sistema valioso para estudiar intestinal de células madre y la biología de la mucosa epitelial y servir como un novedoso sistema experimental para estudiar la fisiología gastrointestinal tanto normal como anormal.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We gratefully acknowledge Dr. Hans Clevers (Hubrecht Institute for Developmental Biology and Stem Cell Research, Netherlands) for the kind gift of TOPflash cells.
This project was supported in part by NIH-R01DK083325 (MAH); NIH P30 DK078392 (Digestive Health Center); NIH UL1RR026314 (CTSA).
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate buffered saline Ca2+, Mg2+ free (DPBS) | Life technologies; Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Sorbitol | Fischer Scientific | BP439-500 | |
| Sucrose | Fischer Scientific | BP220-1 | |
| Bovine serum albumin (BSA) Fraction V | Fischer Scientific | BP1600-100 | |
| Gzntamycin/Amphotericin B solution | Life technologies; Gibco | R-015-10 | |
| Wnt-3A conditioned medium | in house | ||
| Advanced DMEM/F12 | Life technologies; Gibco | 12634-028 | |
| HEPES 1M | Life technologies; Gibco | 15630-080 | |
| GlutaMAX (glutamine) | Life technologies; Gibco | 35050-061 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life technologies; Gibco | 15140-148 | |
| N2 Supplement | Life technologies; Gibco | 17502-048 | |
| B27 Supplement | Life technologies; Gibco | 17504-044 | |
| N-Acetylcysteine | Sigma-Aldrich | A9165-5G | |
| Nicotidamide | Sigma-Aldrich | N0636 | |
| Matrigel, GFR, Phenol free (basement membrane matrix) | Corning | 356231 | |
| human recombinant Noggin | R&D | 6057-NG/CF | |
| human recombinant R-Spondin | Preprotech | 120-38 | |
| human recombinant EGF | Sigma-Aldrich | E9644-.2MG | |
| Y-27632 | Sigma-Aldrich | Y0503-1MG | |
| A-83-01 | Tocris | 2939 | |
| SB202190 | Sigma-Aldrich | S7067-5MG | |
| human [Leu]15-Gastrin 1 | Sigma-Aldrich | G9145-.1MG | |
| CHIR99021 | Stemgent | 04-0004 | |
| Thiazovivin | Stemgent | 04-0017 | |
| TrypLE Express Enzyme (1X), phenol red (cell dissociation enzyme) | Life technologies; Gibco | 12605-010 | |
| Fetal Bovine Serum | Life technologies; Gibco | 10082-147 | |
| CTS Synth-a-Freeze Medium (freezing medium) | Life technologies; Gibco | A13713-01 | |
| L Wnt-3A cell line | ATCC | CRL-2647 | |
| Renilla luciferase assay | Promega | E2710 | |
| human recombinant Wnt-3A | R&D | 5036-WN/CF | |
| HEK293 TOPflash cell line |
Referencias
- Noah, T. K., Donahue, B., Shroyer, N. F. Intestinal development and differentiation. Exp Cell Res. 317 (19), 2702-2710 (2011).
- Shroyer, N. F., Kocoshis, S., Hyams, J. R. W. . Pediatric Gastrointestinal and Liver Diseases. , 324-336 (2010).
- Leushacke, M., Barker, N. Ex vivo culture of the intestinal epithelium: strategies and applications. Gut. , (2014).
- Simon-Assmann, P., Turck, N., Sidhoum-Jenny, M., Gradwohl, G., Kedinger, M. In vitro models of intestinal epithelial cell differentiation. Cell Biol Toxicol. 23 (4), 241-256 (2007).
- Barker, N., et al. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 6 (1), 25-36 (2010).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Mahe, M. M., et al. Establishment of Gastrointestinal Epithelial Organoids. Current Protocols in Mouse Biology. 3, 217-240 (2013).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340 (6137), 1190-1194 (2013).
- Stelzner, M., et al. A nomenclature for intestinal in vitro cultures. Am J Physiol Gastrointest Liver Physiol. 302 (12), G1359-G1363 (2012).
- Ramalingam, S., Daughtridge, G. W., Johnston, M. J., Gracz, A. D., Magness, S. T. Distinct levels of Sox9 expression mark colon epithelial stem cells that form colonoids in culture. Am J Physiol Gastrointest Liver Physiol. 302 (1), G10-G20 (2012).
- Furstenberg, R. J., et al. Sorting mouse jejunal epithelial cells with CD24 yields a population with characteristics of intestinal stem cells. Am J Physiol Gastrointest Liver Physiol. 300 (3), G409-G417 (2011).
- Wang, F., et al. Isolation and Characterization of Intestinal Stem Cells Based on Surface Marker Combinations and Colony-Formation Assay. Gastroenterology. , (2013).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc Natl Acad Sci U S A. 109 (2), 466-471 (2012).
- Es, J. H., et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nat Cell Biol. 14 (10), 1099-1104 (2012).
- Yui, S., et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat Med. 18 (4), 618-623 (2012).
- Durand, A., et al. Functional intestinal stem cells after Paneth cell ablation induced by the loss of transcription factor Math1 (Atoh1). Proc Natl Acad Sci U S A. 109 (23), 8965-8970 (2012).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Akcora, D., et al. The CSF-1 receptor fashions the intestinal stem cell niche. Stem Cell Res. 10 (2), 203-212 (2013).
- Farin, H. F., Van Es, J. H., Clevers, H. Redundant sources of Wnt regulate intestinal stem cells and promote formation of Paneth cells. Gastroenterology. 143 (6), 1518-1529 (2012).
- Rothenberg, M. E., et al. Identification of a cKit(+) colonic crypt base secretory cell that supports Lgr5(+) stem cells in mice. Gastroenterology. 142 (5), 1195-1205 (2012).
- Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured 'miniguts. Mol Cell Biol. 32 (18), 3639-3647 (2012).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. , (2014).
- Fuller, M. K., et al. Intestinal stem cells remain viable after prolonged tissue storage. Cell Tissue Res. 354 (2), 441-450 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Miyoshi, H., Ajima, R., Luo, C. T., Yamaguchi, T. P., Stappenbeck, T. S. Wnt5a potentiates TGF-beta signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Koo, B. K., Clevers, H. Stem Cells Marked by the R-Spondin Receptor Lgr5. Gastroenterology. , (2014).
- Li, W., et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell. 4 (1), 16-19 (2009).
- Tojo, M., et al. The ALK-5 inhibitor A-83-01 inhibits Smad signaling and epithelial-to-mesenchymal transition by transforming growth factor-beta. Cancer Sci. 96 (11), 791-800 (2005).
- Gafni, O., et al. Derivation of novel human ground state naive pluripotent stem cells. Nature. 504 (7479), 282-286 (2013).
- Gracz, A. D., et al. Brief report: CD24 and CD44 mark human intestinal epithelial cell populations with characteristics of active and facultative stem cells. Stem Cells. 31 (9), 2024-2030 (2013).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med (Maywood). , (2014).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat Med. 19 (7), 939-945 (2013).
- Kovbasnjuk, O., et al. Human enteroids: preclinical models of non-inflammatory diarrhea. Stem Cell Res Ther. 4, S3 (2013).
- Fujii, M., Sato, T. Culturing intestinal stem cells: applications for colorectal cancer research. Front Genet. 5, 169 (2014).
- Koo, B. K., Sasselli, V., Clevers, H. Retroviral gene expression control in primary organoid cultures. Curr Protoc Stem Cell Biol. 27 (Unit 5A), 6 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados