Method Article
Eficiente Geração induzida pelo homem células-tronco pluripotentes a partir de células somáticas humanas com Sendai-vírus
Neste Artigo
Resumo
Aqui, apresentamos o nosso método estabelecido para reprogramar células somáticas humanas em iPSCs humanos sem transgene com o vírus Sendai, que mostra resultado consistente e maior eficiência.
Resumo
Há alguns anos, a criação de células-tronco pluripotentes induzidas (iPSCs humanos) marcou o início de uma nova era na área da biomedicina. Os usos potenciais de iPSCs humanos incluem modelagem patogênese de doenças genéticas humanas, a terapia celular autóloga após a correção do gene, e triagem de drogas personalizado, fornecendo uma fonte de células relevantes e sintomas específicos para cada paciente. No entanto, existem vários obstáculos a ultrapassar, tais como a eliminação da expressão do transgene factor de reprogramação remanescente após a produção iPSCs humanos. Mais importante ainda, a expressão do transgene residual em iPSCs humanos indiferenciadas poderia dificultar diferenciações adequadas e desencaminhar a interpretação em fenótipos vitro relevante doença. Com isso, iPSCs humanos sem transgene livre de integração e / ou que tenham sido desenvolvidos usando vários métodos, tais como adenovírus, o sistema piggyBac, minicírculo vetor, vetores epissomais, entrega direta e proteína sintetizada mRNA. No entanto, a eficiência de reprogramming usando métodos livre de integração é bastante baixo na maioria dos casos.
Aqui, apresentamos um método para isolar iPSCs humanos usando Sendai-vírus (vírus RNA) sistema de reprogramação base. Este método de reprogramação mostra resultados consistentes e de alta eficiência em termos de rentabilidade.
Introdução
Células estaminais embrionárias humanas (hESCs) têm a capacidade de se auto-renovar pluripotência in vitro e têm, o que poderia ser potencialmente útil para a modelagem de doenças, para a triagem de drogas e para desenvolver terapias baseadas em células para tratar lesões e doenças do tecido. No entanto, hESCs tem uma limitação para a terapia de reposição celular por causa de barreiras imunológicas, oncológicas e éticos, e estudar genes de doenças relacionadas, hESCs específicos da doença poderia ser isolado por meio de diagnóstico genético pré-implantação (PGD) se aproxima, mas ainda é tecnicamente desafiador e as doações de embriões são muito raros. Estes problemas estão relacionados com o progresso na biologia das células estaminais, o que levou ao desenvolvimento de células estaminais pluripotentes induzidas (hiPSCs).
IPSCs humanos são geneticamente reprogramadas a partir de células somáticas adultas humanas e abrigam células-tronco pluripotentes como características semelhantes a hESCs, o que os torna uma fonte útil para a medicina regenerativa, como ddescoberta tapete, modelagem de doença e terapia celular em pacientes específicos 1,2 maneira.
Até agora, existem vários métodos para gerar iPSCs humanos, incluindo mediada por vírus (retrovírus e adenovírus) 3, non-vírus mediada (sistema BAC e vetores de transfecção) 4 transduções genes e proteínas do sistema de entrega 5-7.
Embora a entrega de genes mediada por vírus pode garantir um certo nível de eficiência, vectores virais pode deixar pegada genética, porque eles se integram nos cromossomas do hospedeiro para expressar genes de reprogramação de uma maneira descontrolada. Mesmo quando a integração viral de fatores de transcrição podem ativar ou desativar genes do hospedeiro 8, ele pode causar uma aberração genética inesperado eo risco de desenvolvimento de neoplasias 5,9. Por outro lado, a introdução directa de proteínas ou RNA em células somáticas foram relatados, mas tem algumas desvantagens, tais como, transf repetido trabalho intensivoexão e baixo nível de reprogramação 7,10. Mesmo epissómico e não integrante de adenovírus, de vírus adeno-associados, vectores de plasmídeo e ainda são relativamente menos eficiente 11. Por estas razões, é plausível para escolher métodos de reprogramação não-integração com alta eficácia de geração iPSC e menos anormalidades genéticas. Neste estudo, utilizamos uma reprogramação baseado Sendai-vírus. Este método é conhecido como sendo não integrado no genoma do hospedeiro e produz consistentemente iPSCs humanos sem integração do transgene.
Protocolo
1. Preparação de celular e Mídia (Dia 1)
- Cultura e expandir de fibroblastos humanos com meio DMEM contendo 10% de FBS.
- Placa de fibroblastos humanos (Figura 1) para uma placa de 24 poços a uma densidade apropriada por poço no dia antes da transdução.
NOTA: As seguintes diluições em série são recomendados (200K, 100K, 50K, 25K, 12.5K e 6.25K) porque diferentes tipos de células têm diferentes capacidade de fixação. - Incubar as células durante mais um dia em 37 ° C, 5% de CO2, garantindo as células foram totalmente colada e estendida.
2. Execute Transdução (dia 2)
- No dia da transdução, verificar a densidade celular e escolheu os poços de densidade mais eficientes (Figura 2). É melhor escolher três densidades diferentes: alta (80 ~ 90%), médio (50 ~ 70%) e baixa (20 ~ 40%).
- Pelo menos 1 hora antes de transdução, aspirar o fibroblmeios de ast a partir das células e alterar novas 300 ul de meio de fibroblastos.
- Remover um conjunto de quatro diferentes tubos de vírus Sendai da -80 ° C de armazenamento. Descongelar a cada tubo ao mesmo tempo em um banho de água a 37 C ° por alguns segundos e, em seguida, tomar os tubos fora do banho de água. Depois disso, o descongelamento à temperatura ambiente; tubos de centrifugação a 6.000 xg por 10 segundos e coloque-os em gelo até o uso. Não voltar a congelar e descongelar o vírus uma vez que os títulos não vai manter.
- Adicionar os volumes indicados de cada um dos quatro tubos de vírus Sendai (Oct-4, Klf-4, c-Myc e Sox-2) para tubos de micro-centrífuga. Certifique-se de que a solução é bem misturada, pipetando cuidadosamente.
Por exemplo, se 50K células / poço de uma placa de 24 poços para a transdução lookwell:
(Titer base no Certificado de Análise da Life Technologies, pode ser diferente de um lote para outro)
Tubo hOct-4 = 6,0 x 10 7 OIC, 3 MOI = 5 mL
Tubo hSox-2 = 6,5 x 10 7 OIC, 3 MOI = 4,6 μ; L
Tubo hKlf-4 = 6,3 x 10 7 OIC, 3 MOI = 4,8 mL
Tubo hc-Myc = 7,8 x 10 7 OIC, 3 MOI = 3,8 mL
Total = 18.2 ul de mistura de quatro factores de vírus / um poço (50K células) de placa de 24 poços - Dependendo densidades celulares; adicionar 2X, 1X, e volume de 0,5 X de a mistura de vírus no poço. Agitar suavemente a placa da frente para trás, esquerda e direita (2X: 36,4 mL de mistura de vírus, 1X: 18,2 ul e 0,5 X: 9,1 mL).
- Colocar as células em 37 ° C, 5% de CO 2 incubadora e incubar durante a noite.
3. Substituição de Meio de Cultura (dia 3 e dia 5)
- 24 horas após a transdução, substituir o meio com 500 mL meio de fibroblastos fresco.
- No dia 5, mudar Médio com a mídia de fibroblastos fresco.
4. Prepare MEF Pratos para o Co-cultura (dia 8)
- Preparar células MEF em placas de cultura de 60 milímetros, com 10% de FBS continha um meio DMEM day antes passaging o fibroblasto transdução em células-alimentadoras MEF.
Nota: Estamos usando 5 x 10 5 de MEF em cada 60 milímetros prato.
5. Comecem a co-cultura com células transduzidas células alimentadoras MEF (dia 9)
- Antes de cultivo de células transduzidas, aspirado 10% FBS contida meios DMEM de pratos alimentadoras MEF e adicione fresco 10% FBS continha meio DMEM.
- Remover o meio a partir dos fibroblastos transduzidos que estão na placa de 24 poços e lavam as células uma vez com STP-D. Adicionar 200 mL de 0,25% tripsina / EDTA para as células de fibroblasto inthe placa de 24 poços. Depois de menos de 5 minutos de incubação com tripsina / EDTA, quando as células começam a separar a partir da placa, recolher as células com meio de crescimento no tubo de 15 ml. Em seguida, centrifugar-los em 6000 xg por 4 min.
NOTA: O agrupamento 2X, 1X, 0.5X e vírus fibroblastos transduzidas é recomendado. - Remova o meio sobrenadante e lavar a re-suspensãoo aglomerado de células com 4-5 ml de meio fresco para a neutralização de fibroblastos a partir de tripsina. Em seguida, centrifugar-los em 135 g durante 4 min.
- Células da placa como série de diluição de densidade e começam a co-cultura com os meios de fibroblastos para MEF: tal como 1/2, 1/4, 1/8, 1/16, 1/32, 1/64 e 1/128 por 60 mm prato. Dependendo da taxa de morte celular durante a primeira semana de transdução, não ser necessário diluir a 1/2 ou 1/128 densidade. Pôr de lado as restantes células para extrair o RNA total como um controlo positivo para o transgene de RT-PCR.
- Colocar placas de 60 mm em 37 ° C, 5% de CO2 durante a noite.
6. Alimente embrionárias humanas Médio Stem Cell e monitorar o Cells (dia 10)
- No dia seguinte, mudar de mídia para mídia ES fibroblastos humanos com 10 mM Y-27632. Depois disso, alterar médio diário com meio ES humano: 800 ml + 200 ml de DMEM/F12 KO substituição Serum + 10 ml de L-glutamina + 10 ml de MEM 10 mM de ácidos aminados mínimos não essenciais+ 1 ml de 2-mercaptoetanol + 10 ng / mL de Factor de Crescimento de Fibroblastos básico.
- Fazer uma mudança de mídia diária com a mídia ES humanos frescos. Depois de uma semana, verifique os pratos uma vez por 2 a 3 dias sob um microscópio para a formação de aglomerados de células ES de colônia-like. Dependendo do tipo de célula, a cultura irá demorar mais ou menos tempo, antes colónias são encontrados.
7. Escolher o-tronco pluripotentes induzidas colônias de células e expandir as células (dia 20 ~)
- Três semanas após a transdução, as colônias devem aparecer crescido adequadamente para a colheita.
- Um dia antes de escolher as colônias, preparar alimentador MEF em placa de 24 poços.
NOTA: Nós estamos usando 12,5 x 10 5 de MEF em uma placa de 24 poços. - No dia seguinte, mudar médio de pratos MEF de mídia para mídia ES fibroblastos humanos com 10 mM Y-27632. Escolher manualmente uma colônia de cada vez sob o microscópio no picking-capa e fazer pedaços menores por pipetagem e transferi-lospara recém-preparado MEF dishes.Try escolher vários clones.
- Passagem e expandir-se a cada poço de uma placa de 24 poços para uma placa de 6 bem inicialmente. Então, a partir de 6 bem-placa a um 60 milímetros pratos antes ainda de propagação.
8. Caracterização de iPSCs Humana (após 10 passagens)
- Imunofluorescência
- Placa iPSCs humanos em placa de 24 poços e cultura durante 4-5 dias com mudança de mídia diária.
- Para iniciar ensaio de imunofluorescência, lavar a placa com D-PBS uma vez. Em seguida, fixar as células imediatamente em 0,4% de paraformaldeído durante 30 min. Depois disso lavar três vezes em D-PBS durante 5 min.
- Tratar as células fixas com 0,1% de Triton X-100 em PBS durante 15 min à temperatura ambiente.
- Aspirar a solução permeablization (0,1% de triton X-100 a solução), em seguida, adicionar uma solução de bloqueio de BSA a 0,5% durante 1 hora à temperatura ambiente.
- Executar uma detecção de Nanog, Oct-4, SSEA (específico do estágio embrionário antigbr) e TRA-1-81 (antigénio de rejeição de tumor) através de um anticorpo anti-humano em solução de BSA a 0,5% (veja a tabela de materiais para a taxa de diluição do anticorpo). Incubar Anticorpo primário durante 2 horas à temperatura ambiente. Em seguida, lavar três vezes em D-PBS durante 5 min cada.
- Verifique usando microscopia de fluorescência após 1 hora de incubação com 488 anticorpos IgG de cabra anti-rato Alexa Fluor como 2 nd anticorpo, que são diluídos 1:2000 em solução de BSA a 0,5% à temperatura ambiente. Mancha todos os núcleos de cada células alimentadoras MEF e hiPSCs com DAPI.
- RT-PCR de Confirmação Transgene
- Extrair ARNm total de sedimento celular utilizando reagentes de extracção do ARN.
- Fazer uma transcrição reversa em alíquotas (1 jig) do ARN total e o cDNA resultante para a amplificação por PCR de transcriptase reversa.
- Preparar as misturas de PCR para conter 2 ul de molde de ADNc, 10 ul de 2X PCR master mix, 2 ul de 2 pmol de iniciadores(Para frente: 1 ml e inverter: 1 ml) e 6 mL de DW. Para detectar a expressão do gene, fazer a RT-PCR com os iniciadores listados na Tabela 1.
- Realizar a RT-PCR com o gene GAPDH como um controlo para a eficiência das reacções de amplificação. Visualizar e analisar o produto de PCR por electroforese em gel de agarose 1%.
Resultados
Normalmente fibroblastos infectados não apresentam quaisquer alterações morfológicas nos vários dias após a transdução de vírus Sendai, mas cinco dias depois, eles começam a ter formas diferentes (Figura 1). Conforme descrito em um painel direito da Figura 1, as células não têm morfologia de fibroblastos típico mais. Eles têm uma forma redonda e núcleo maior do que o citoplasma. Mesmo quando a transdução é realizada em 80% de confluência celular, parece que eles são menos confluentes no bem depois eles começam a reprogramar. Se estes tipos de alterações morfológicas começar a ser visto na maior parte do poço, fibroblastos transduzidos está pronto para ser semeadas em placas de cultura de MEF-alimentadoras.
Em nosso protocolo, minimizamos escala de cultura de células e também deu várias possibilidades de reprogramação, como empregando diferente densidade de células de fibroblastos e título do vírus, e posterior vários proporção re-chapeamento MEF, o que aumentará a eficiência hiPSCs geração ( Figura 2). Antes de transdução, os poços com confluência diferentes (baixa, média e alta) pode ser selecionado para mais de transdução de Sendai-vírus; representado como vermelho, verde e amarelo na placa.
No início da reprogramação em alimentadores MEF, é difícil distinguir os tipos de células transduzidas, mas depois de mais de uma semana a partir de co-cultura, os fibroblastos parcialmente reprogramadas aparecer e olhar como forma ES-like afrouxou (Figura 3). Por essa razão, quando as colônias iPSC humanos estão prontos para o passaging em novo alimentador prato MEF, colheita manual é maneira mais eficiente para a transferência em vez de dissociação com a enzima.
Na Figura 3 e Figura 4, sob o microscópio apenas iPSCs humanos têm bordas claras, que fazem uma distinção clara entre iPSCs humanos (considerados como "células totalmente reprogramadas ') e das células reprogramadas incompleta" por morfologia. Células totalmente reprogramadas look como compacto e bem embalado. Especialmente as colônias têm uma fronteira clara, enquanto que as células reprogramadas parcialmente parecer reunindo para fazer colônia, mas muito a perder e frágil a quebrar. Mesmo se fizermos uma pipeta suavemente é facilmente retirado. Mesmo após a exclusão parcialmente reprogramadas iPSCs humanos colônias (durante expandi-las e passaging), iPSCs humanos totalmente reprogramadas precisa ser mantida pela colheita manual.
Depois de escolher colônias e da expansão dos clones hiPSC em algumas semanas, expressão de marcadores stemness precisa ser determinado. Após a expansão dos clones hiPSC, verifica-los com diferentes conjuntos de testes, incluindo coloração do anticorpo (SSEA4, Oct-4, TRA-81 e Nanog) e RT-PCR do marcador pluripotentes (dados não mostrados) como um controlo de qualidade.
Comparado a H9, dois hiPSCs diferentes são positivos para SSEA4, Oct-4, TRA-81, e Nanog. Este resultado demonstra que iPSCs humanos isolados adquiriu qualidade pluripotentes ( Figura 5).
Finalmente, a Figura 6 mostra que não é possível detectar qualquer expressão de transgenes em clones hiPSC por RT-PCR. Pelo menos mais de 10 passagens, hiPSCs iniciadores específicos (Tabela 1) para exógeno Oct-4, Sox-2, Klf-4 e c-Myc podem ser utilizados com as amostras de controlo positivo com o elevado nível de expressão do transgene.
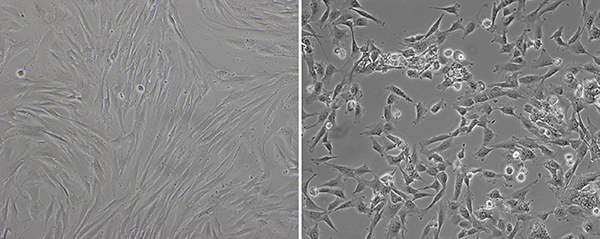
Figura 1. Mudança morfológica após a transdução do vírus Sendai. Antes da transdução, os fibroblastos mostrar a forma fusiforme típico (esquerda). Aproximadamente oito dias após a transdução, a morfologia da mudança de células transduzidas como muito mais forma redonda (direita). Clique here para ver uma versão maior desta figura.

Figura 2. Diagrama do plano de indução para garantir a máxima eficiência. Mais de quatro tipos diferentes de células podem ser colocadas numa placa de 24 poços (de 1 a 4). Devido sua capacidade de fixação e a sobrevivência das células pode ser diferente dependem dos tipos de células, sugere-se a placa a densidade celular diferente (de 200K a 6.25K células por poço). Além disso, a concentração de vírus pode ser ajustado (0,5 X, 1X e 2X).

Figura 3. Formação de recursos humanos induzida colônia de células-tronco pluripotentes a partir de transdução fibroblast. Em cerca de duas semanas após a re-plaqueamento em MEFs, colônias redondas devem aparecer e se parecem com colônias de células-tronco embrionárias humanas. Normalmente as colônias iPSC humanos totalmente reprogramadas têm limites muito claros. (Arrow: totalmente reprogramado colônias humanas CIPS, ponta de seta: parcialmente reprogramadas iPSCs humano). Clique aqui para ver a imagem ampliada .

Figura 4. Pegando pluripotentes estaminais colônias de células humanas induzido. Colônias iPSC humanos são muitas vezes rodeado por células parcialmente reprogramadas (esquerda). Sob o microscópio, pegando a colônia ES-like só, quebrar em pequenos pedaços e depois de transferência (à direita). Depois de 2 a 3 passagens, há colônias hiPSC indiferenciadas (fundo e à esquerda). (Arrow: colônias totalmente reprogramadas humanos CIPS, ponta de seta: humano parcialmente reprogramadas iPSCs) Clique aqui para ver a imagem ampliada .
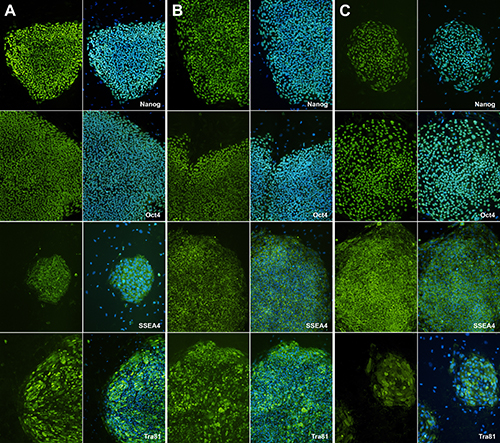
Coloração Figura 5. Imunofluorescência com marcadores de células-tronco pluripotentes. Ensaio de imunofluorescência mostra iPSCs humanos têm stemness features.SSEA-4, TRA-81, Nanog, marcadores pluripotentes Oct-4aS e DAPI é um controle para a coloração de núcleo. (A) representa coloração H9 como uma amostra de controlo. (B) e (C) mostram IPSC clones humanos.et = "_blank"> Clique aqui para ver imagem ampliada.

Figura 6. Confirmação do nível de expressão do transgene. Pelo menos depois de cultura de 10 passagem de iPSCs humanos, silenciamento de Sox2 exógena, Oct-4 níveis de expressão de genes Klf-4, c-Myc, e é confirmada por reações reversa da cadeia de polimerase transcriptase. hGAPDH é um controle interno. Para um controlo positivo, o ARN é extraído a partir de fibroblastos sobra transduzidas (dia 7 após a infecção Sendai-vírus). (pista 1: marcador, pistas 2-6: GAPDH, Klf4, c-Myc, Oct-4, Sox-2 e no controle positivo, pistas 7-11: GAPDH, Klf4, c-Myc, Oct-4, Sox e -2 em hiPSCs).
| Nome do iniciador | Sequence |
| hOCT4 (F) | CCC GAA GAA AGA AGC GAA CCA G |
| hOCT4 (R) | AAT GTA TCG AAG GTG CTC AA |
| hMYC (F) | TAA CTG ACT AGC AGG CTT GTC G |
| hMYC (R) | TCC ACA TAC CCT AGT GGA TGA TGA TG |
| hSOX2 (F) | ACA AGA GAA AAA ACA TGT ATG G |
| hSOX2 (R) | ATG CGC TGG TTC ACG CCC GCG CCC AGG |
| hKLF4 (F) | ACA AGA GAA AAA ACA TGT ATG G |
| hKLF4 (R) | CGC GCT GGC AGG GCC GCT GCT CGA C |
| hGAPDH (F) | AGG TCG TCA GAG ACG GAT TTG |
| hGAPDH (R) | GTG ATG GCA TGG ACT GTG GT |
Tabela 1. Iniciadores de RT-PCR para a confirmação do transgene. Estas são as sequências dos iniciadores que são utilizados para traconfirmação nsgene. T m é de 50,6 ° C em todos os conjuntos de iniciadores.
Discussão
Reprogramação de células somáticas humanas para hiPSCs detém promessas sem precedentes na biologia básica, medicina pessoal, e transplante 12. Anteriormente, as gerações iPSC humanos necessários vírus de DNA que tem risco de integração no genoma do hospedeiro, que pode criar mutações genéticas indesejáveis que limitam outras aplicações clínicas, tais como desenvolvimento de medicamentos e terapias de transplante 13. Com esta razão, muitos estudos foram relatados para gerar sistema iPSCs humanos livres de vector do transgene e através de vários métodos alternativos, mas, ao mesmo tempo, a eficiência do isolamento "pegada livre 'iPSCs humanos devem ser considerados. Por exemplo, o vírus RNA deve ter um nível mínimo de aberração genética comparar com outros métodos de 14, embora não haja publicação para o seqüenciamento do genoma inteiro para demonstrar a "segurança genómica" de Sendai geração iPSC mediada por vírus ainda. Aqui, apresentamos um método para gerar hiPSCs com oSendai-vírus que tem uma alta eficiência de reprogramação de forma rentável. As iPSCs humanos resultantes são livres de transgene com a manutenção das semelhanças moleculares e celulares para hESCs em potencial proliferativo e de desenvolvimento.
Podemos reprogramar diferentes origens dos fibroblastos (> 4) ao mesmo tempo com apenas um conjunto de Sendai-vírus. E no nosso método, podemos aplicar várias confluências celulares e diferenças de dosagem vírus. Este "mix and match" técnica combinação pode maximizar a eficácia de reprogramação. Os fibroblastos (de um único paciente) em cada poço tem um nível de infecção por vírus diferentes, mas através da reunião, a possibilidade de fazer hiPSCs colônias pode aumentar com base em nossa experiência. Outras questões da variação clonal entre linhas hiPSC são taxa de proliferação, adesão celular / sobrevivência, estado de inativação do cromossomo X 15, diferenciação potenciais de 16, etc Na verdade, observamos que cada clone tem um diferement propensão neural, que pode ser previsto através da medição do nível de um cluster de miR-371 de expressão. Além disso temos conseguido gerar iPSCs humanos a partir de mioblastos humanos com este método, o que sugere que o vírus Sendai, pode ser usada para muitos tipos diferentes de células em processo de reprogramação. Além disso, utilizando o nosso método, geramos hiPSCs em mais de 10 fibroblastos de doenças relacionadas diferentes. Em média, de 5 a 10 clones hiPSC poderia ser obtido a partir de um fibroblasto.
Embora a derivação de células iPS humanas sem transgene com a Sendai-vírus é o método de reprogramação mais eficiente que poderia ser os caminhos mais práticos, existem algumas limitações que devem ser considerados neste protocolo;
- Dependendo de cada lote de vírus Sendai, o título do vírus deve ser calculada para consistente MOI (como descrito em 2.4).
- Observou-se a variação de infectividade entre diferentes células somáticas, que também necessita de titulação adicional para Robuinfecção viral rua.
- A reprogramação mediada vírus Sendai pode ser considerada como uma das melhores opções para fins de investigação. Mas, para o ensaio clínico, pode não ser a primeira escolha, já que não é uma questão de licenciamento com a empresa que originalmente desenvolveu o sistema de vírus Sendai.
- Demora cerca de dois meses até que as células somáticas reprogramadas estão livres de transgenes, que é por isso que precisamos de verificar a expressão do transgene após pelo menos 10 passagens.
- Parece que o número passagem do fibroblasto cultivados primária pode afetar a eficiência da reprogramação com a Sendai-vírus, embora não temos uma comparação direta. A taxa de proliferação também precisa ser determinado. Mais estudos são necessários para determinar o efeito de fibroblastos números de passagem e sua proliferação na eficiência de reprogramação.
- Neste estudo, usamos uma camada de alimentação do mouse para a geração e manutenção hiPSC, mas um sistema livre de alimentação pode ser uma alternative forma em um estudo futuro.
Nosso protocolo atual tem sido um passo importante para estudar hiPSCs específicas do paciente para a modelagem de doenças, medicina regenerativa, e outras aplicações.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer aos membros do laboratório Lee pelas valiosas discussões sobre o manuscrito. Trabalho no laboratório Lee foi apoiada por doações de Robertson Investigator Award of New York Stem Cell Foundation e de Maryland Stem Cell Research Fund (Tedco).
Materiais
| Name | Company | Catalog Number | Comments |
| CytoTune-iPS Reprogramming Kit | Invitrogen | A1378002 | |
| CF-6,MEFs, neomycin-resistant, mitomycin C treated | Global stem | GSC-6105M | 5 x 105/6 cm or 12.5 x 105/24-well plate |
| Trypsin EDTA 0.25% Trypsin with EDTA 4Na 1X | Invitrogen | 25200114 | |
| DMEM/F-12 medium | Invitrogen | 11330-032 | |
| 24-well Cell Culture Plate, flat-bottom with lid | BD | 353935 | |
| Y-27632 | TOCRIS | 1254 | 10 μM (Stock: 10 mM) |
| basic fibroblast growth factor | LIFE TECHNOLOGIES | PHG0263 | 10 ng (Stock : 100 ug) |
| Knock-out serum replacement | Gibco | 10828028 | |
| Dulbecco's Modified Eagle Medium (D-MEM, DMEM) (1X), liquid (high glucose) | Invitrogen | 11965118 | |
| Fetal bovine serum | Thermo Scientific Fermentas | SH30071.03 | |
| L-Glutamine-200 mM (100X), liquid | GIBCO | 25030-081 | 1/100 |
| MEM Non-Essential Amino Acids Solution, 100X | LIFE TECHNOLOGIES | 11140050 | 1/100 |
| 2-Mercaptoethanol (1,000X), liquid | GIBCO | 21985023 | 1/1,000 |
| Hausser Phase Contrast Hemacytometers | Hausser Scientific | 02-671-54 | |
| EmbryoMax 0.1% Gelatin Solution | Millipore | ES-006-B | |
| SSEA-4 | DSHB | MC-813-70 | 1/200 |
| anti-Tra-1-81 | Cell Signaling | 4745S | 1/200 |
| mouse monoclonal Oct4 antibody | Santa Cruz | SC-5279 | 1/1,000 |
| Nanog | R&D | AF1997 | 1/1,000 |
| Alexa Flouor 488 goat anti-mouse | Invitrogen | 948492 | 1/2,000 |
| DPBS (Dulbecco's Phosphate-Buffered Saline), 1X without calcium & magnesium | Cellgro | 21-031-CV | |
| QuantiTect Reverse Transcription Kit | QIAGEN | 205313 | |
| PCR Master Mix [2X] | Thermo Scientific Fermentas | K0171 | |
| Trizol | Invitrogen | 15596018 | |
| picking hood | NuAire | NU-301 | |
| dissecting scope | Nikon | SMZ745 |
Referências
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322, 949-953 (2008).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Yusa, K., Rad, R., Takeda, J., Bradley, A. Generation of transgene-free induced pluripotent mouse stem cells by the piggyBac transposon. Nature Methods. 6, 363-369 (2009).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Okita, K., Ichisaka, T., Yamanaka, S. Generation of germline-competent induced pluripotent stem cells. Nature. 448, 313-317 (2007).
- Yoshioka, N., et al. Efficient Generation of Human iPSCs by a Synthetic Self-Replicative RNA. Cell Stem Cell. 13, 246-254 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nature Protocols. 7, 2013-2021 (2012).
- Fluri, D. A., et al. Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures. Nature Methods. 9, 509-516 (2012).
- Nakagawa, M., et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature Biotechnology. 26, 101-106 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. P Jpn Acad B-Phys. 85, 348-362 Forthcoming.
- Silva, S. S., Rowntree, R. K., Mekhoubad, S., Lee, J. T. X-chromosome inactivation and epigenetic fluidity in human embryonic stem cells. P Natl Acad Sci USA. 105, 4820-4825 (2008).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8, 695-706 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados