Method Article
Eficiente generación, por actividad humana células madre pluripotentes de células somáticas humanas con virus Sendai-
En este artículo
Resumen
A continuación, presentamos nuestro método establecido para reprogramar las células somáticas humanas en transgenes libre iPSCs humanas con virus Sendai, que muestra resultados consistentes y una mayor eficiencia.
Resumen
Hace unos años, la creación de células madre pluripotentes inducidas humanas (iPSCs) marcó el comienzo de una nueva era en la biomedicina. Los usos potenciales de iPSCs humanos incluyen el modelado patogénesis de enfermedades genéticas humanas, la terapia celular autóloga después de la corrección de genes, y la detección de drogas personalizada, proporcionando una fuente de células relevantes y los síntomas específicos del paciente. Sin embargo, hay varios obstáculos que superar, como la eliminación del factor de reprogramación transgén expresión restante después de la producción iPSCs humanos. Más importante aún, la expresión transgénica residual en iPSCs humanas indiferenciadas podría obstaculizar diferenciaciones adecuadas y confundir a la interpretación de los fenotipos in vitro relevantes enfermedad. Con este motivo, se han desarrollado-la integración libre y / o iPSCs humanos transgenes gratis con varios métodos, como el adenovirus, el sistema piggyBac, minicircle vector, vectores episomales, entrega directa de proteínas y ARNm sintetizado. Sin embargo, la eficiencia de reprogramming utilizando métodos de integración libre es bastante bajo en la mayoría de los casos.
A continuación, presentamos un método para aislar iPSCs humanos mediante el uso de Sendai-virus (virus RNA) sistema de reprogramación en base. Este método de reprogramación muestra resultados consistentes y de alta eficiencia en forma rentable.
Introducción
Las células madre embrionarias (hESCs) tienen una capacidad de auto-renovación in vitro y tienen la pluripotencia, lo que podría ser potencialmente útil para el modelado de la enfermedad, para la detección de drogas, y para el desarrollo de terapias basadas en células para tratar lesiones de la enfermedad y del tejido. Sin embargo, hESCs tienen una limitación para la terapia de reemplazo de la célula debido a las barreras inmunológicas, oncológicas y éticas, y para estudiar los genes relacionados con la enfermedad, hESCs específicos de la enfermedad pueden ser aislados a través de pre-implantación diagnóstico genético (PGD) se acerca, pero sigue siendo un reto técnico y las donaciones de embriones son bastante raros. Estos problemas están relacionados con el progreso en la biología de células madre, lo que ha llevado al desarrollo de células madre pluripotentes inducidas (hiPSCs).
IPSCs humanos se reprograman genéticamente a partir de células somáticas adultas humanas y albergan características madre pluripotentes similares a células similares a hESCs, que los convierte en una fuente útil para la medicina regenerativa, como ddescubrimiento alfombra, el modelado de la enfermedad y la terapia celular en forma específica para cada paciente 1,2.
Hasta ahora, hay varios métodos para generar iPSCs humanos, incluyendo mediada por virus (retrovirus y adenovirus) 3, no el virus mediada (sistema de BAC y vectores de transfección) 4 transducciones de genes, y del sistema de administración de proteínas 5-7.
Aunque una entrega de genes mediada por virus puede garantizar un cierto nivel de eficiencia, vectores virales podrían dejar huella genética, debido a que se integran en los cromosomas del hospedador para expresar genes de reprogramación de una manera incontrolada. Incluso cuando la integración viral de factores de transcripción puede activar o inactivar genes de acogida 8, que puede causar una aberración genética inesperado y el riesgo de 5,9 tumorigénesis. Por otra parte, se informó de la introducción directa de proteínas o ARN en las células somáticas, pero tienen algunas desventajas tales como, transf repetida mano de obra intensivaexión, y el bajo nivel de la reprogramación de 7,10. Incluso episomal y no la integración de adenovirus, virus adeno-asociados, y vectores plasmídicos son todavía relativamente menos eficiente 11. Por estas razones, es plausible para elegir métodos de reprogramación no-integración con alta eficacia de generación de IPSC y un menor número de anomalías genéticas. En este estudio, utilizamos una reprogramación basada Sendai-virus. Este método es conocido por ser no integrado en el genoma huésped y produce consistentemente iPSCs humanos sin integraciones transgén.
Protocolo
1. Preparación de la célula y Medios de Comunicación (Día 1)
- Cultura y ampliar fibroblastos humanos con medio DMEM que contiene 10% de SFB.
- Placa fibroblastos humanos (Figura 1) en una placa de 24 pocillos a una densidad apropiada por pozo en el día antes de la transducción.
NOTA: Se recomiendan las siguientes diluciones en serie (200K, 100K, 50K, 25K, 12.5K y 6,25), ya que los diferentes tipos de células tienen diferente capacidad de unión. - Se incuban las células durante un día más en un 37 ° C, 5% de CO 2 incubadora, lo que garantiza que las células han cumplido plenamente y extendida.
2. Realizar Transducción (Día 2)
- En el día de la transducción, comprobar la densidad celular y elegir los pozos de densidad más eficientes (Figura 2). Es mejor escoger tres densidades diferentes: alto (80 ~ 90%), media (50 ~ 70%) y baja (20 ~ 40%).
- Por lo menos 1 hora antes de la transducción, aspirar el fibroblmedios de AST de las células y cambiar nuevos 300 l de medio de fibroblastos.
- Retire un conjunto de 4 tubos de virus Sendai de formas diferentes por -80 ° C de almacenamiento. Descongele cada tubo al mismo tiempo en un 37 ° C baño de agua durante unos segundos, y luego tomar los tubos fuera del baño de agua. Después de eso, descongelar a temperatura ambiente; tubos de centrifugación a 6.000 xg durante 10 segundos y los colocan en hielo hasta su uso. No vuelva a congelar y descongelar el virus ya que los títulos no se mantendrán.
- Agregue los volúmenes indicados de cada uno de los cuatro tubos de virus Sendai (Oct-4, Klf-4, c-Myc y Sox-2) al tubo de microcentrífuga. Asegúrese de que la solución se mezcla bien con la pipeta suavemente.
Por ejemplo, si 50K células / un pocillo de 24 pocillos Lookwell placa para la transducción:
(Concentración basada en el certificado de análisis de Life Technologies, puede ser diferente de lote a lote)
Tube hOct-4 = 6,0 x 10 7 CIU, 3 MOI = 5 l
Tube hSox-2 = 6,5 x 10 7 CIU, 3 MOI = 4,6 μ; L
Tube hKlf-4 = 6,3 x 10 7 CIU, 3 MOI = 4,8 l
Tube hc-Myc = 7,8 x 10 7 CIU, 3 MOI = 3,8 l
Total = 18,2 l de cuatro factores de virus / mezcla de un pocillo (50K células) de placa de 24 pocillos - Dependiendo de las densidades de células; añadir 2X, 1X, 0,5 X y el volumen de la mezcla de virus en el pozo. Agite suavemente la placa frontal a la parte posterior, izquierda y derecha (2X: 36,4 l de mezcla de virus, 1X: 18,2 ly 0.5X: 9,1 l).
- Colocar las células en un 37 ° C, 5% de CO 2 incubadora y se incuba durante la noche.
3. Sustitución del medio de cultivo (día 3 y el día 5)
- 24 horas después de la transducción, sustituir el medio con 500 l medio de fibroblastos fresco.
- En el Día 5, cambio de medio con los medios de comunicación de fibroblastos fresco.
4. Preparar platos MEF para la Co-cultura (Día 8)
- Preparar las células MEF en 60 mm placas de cultivo con 10% de FBS contenía medio DMEM uno daY antes de pasar las fibroblastos transducidos en alimentador células MEF.
Nota: Estamos utilizando 5 x 10 5 de MEF en cada placa de 60 mm.
5. Start Co-cultura transducidas células con células alimentadoras MEF (Día 9)
- Antes de chapado células transducidas, aspirado 10% de SFB contenía medio DMEM desde platos MEF alimentador y añadir fresca 10% de SFB contenía medio DMEM.
- Retire el medio de los fibroblastos transducidos que se encuentran en la placa de 24 pocillos y se lavan las células una vez con D-PBS. Añadir 200 l de 0,25% de tripsina / EDTA en las células de fibroblastos enel placa de 24 pocillos. Después de menos de 5 min de incubación con tripsina / EDTA, cuando las células comienzan a desprenderse de la placa, recoger las células con medio de crecimiento en 15 ml de tubo cónico. Entonces centrifúguelas en 6000 × g durante 4 min.
NOTA: El agrupamiento de 2X, 1X, 0,5 X y el virus se recomienda fibroblastos transducidos. - Retire el medio sobrenadante y lavar para resuspenderel sedimento celular con 4-5 ml de medio fresco de fibroblastos para la neutralización de tripsina. Entonces centrifúguelas a 135 g durante 4 min.
- Células de la placa como la densidad de dilución en serie y empezar a co-cultivo con medios de fibroblastos en MEF: tal como 1/2, 1/4, 1/8, 1/16, 1/32, 1/64, y 1/128 por 60 mm plato. Dependiendo de la tasa de muerte celular durante la primera semana de la transducción, uno no puede tener que diluir a 1/2 o 1/128 de la densidad. Dejar a un lado las células restantes para extraer el ARN total como control positivo para el transgen de RT-PCR.
- Coloque placas de 60 mm en 37 ° C, 5% de CO 2 incubadora durante la noche.
6. Alimente Embrionarias Humanas Medio de Células Madre y Monitorear las células (Día 10)
- El día siguiente, cambiar los medios de comunicación a los medios de fibroblastos ES humano con 10 mM de Y-27632. Después de eso, cambio de medio al día con medio ES humana: 800 ml de DMEM/F12 + 200 ml Knockout suero reemplazo + 10 ml de L-glutamina + 10 ml de 10 aminoácidos no esenciales mínimos mM MEM+ 1 ml de 2-mercaptoetanol + 10 ng / ml de factor de crecimiento básico de los fibroblastos.
- Hacer un cambio de medio día con nuevos medios embrionarias humanas. Después de una semana, revise los platos una vez por 2 ~ 3 días bajo un microscopio para detectar la formación de ES-colonias como grupos de células. Dependiendo del tipo de células, la cultura va a tomar más o menos tiempo antes de que se encontraron colonias.
7. Elegir la madre pluripotentes inducidas colonias de células y expandir las células (Día 20 ~)
- Tres semanas después de la transducción, las colonias deben aparecer crecido adecuadamente para su recolección.
- El día antes de recoger las colonias, preparar alimentador de MEF en placa de 24 pocillos.
NOTA: Estamos utilizando 12,5 x 10 5 de MEF en una placa de 24 pocillos. - El día siguiente, cambio de medio de platos MEF a partir de medios de fibroblastos a los medios ES humano con 10 mM de Y-27632. Recoger manualmente una colonia en cada momento bajo el microscopio en la cosecha del capó y hacer montones más pequeños con la pipeta y transferirlosen recién preparado MEF dishes.Try para recoger varios clones.
- Pasaje y ampliar la cada pocillo de una placa de 24 pocillos de una placa de 6 inicialmente. Luego de una placa de 6 pocillos a un 60 mm platos antes de seguir propagando.
8. Caracterización de iPSCs Humano (después de 10 pasajes)
- Inmunofluorescencia
- Placa iPSCs humanas en placas de 24 pocillos y la cultura durante 4-5 días con cambio de medio día.
- Para comenzar el ensayo de inmunofluorescencia, se lava la placa con D-PBS una vez. Entonces fijar las células inmediatamente en 0,4% de paraformaldehído durante 30 min. Después de que lavar tres veces en D-PBS durante 5 min.
- Tratar las células fijas con 0,1% de Triton X-100 en PBS solución durante 15 min a temperatura ambiente.
- Aspirar la solución de permeabilización (Triton X-100 0,1% solución), a continuación, agregar solución de bloqueo BSA al 0,5% durante 1 hora a temperatura ambiente.
- Lleve a cabo una detección de Nanog, Oct-4, SSEA (antig embrionaria etapa específicaes) y TRA-1-81 (rechazo antígeno tumoral) usando un anticuerpo anti-humano en solución de BSA al 0,5% (comprobar la tabla de materiales para la tasa de dilución de anticuerpo). Incubar anticuerpo primario durante 2 horas a temperatura ambiente. A continuación, lavar tres veces en D-PBS durante 5 minutos cada uno.
- Compruebe mediante microscopía de fluorescencia después de 1 h de incubación con Alexa Fluor 488 cabra anti-ratón anticuerpos IgG como anticuerpo 2 ª, que se diluyó 1:2000 en solución de BSA al 0,5% a temperatura ambiente. Teñir todos los núcleos de cada MEF células alimentadoras y hiPSCs con DAPI.
- RT-PCR del transgén Confirmación
- Extracto total de ARNm de sedimento celular mediante el uso de reactivos de extracción de RNA.
- Hacer una transcripción inversa en partes alícuotas (1 g) de ARN total y el ADNc resultante para la amplificación de PCR por transcriptasa inversa.
- Preparar las mezclas de PCR para contener 2 l de molde de ADNc, 10 l de mezcla maestra de PCR 2X, 2 l de 2 pmol de cebadores(Hacia adelante: 1 l e invertir: 1 l) y 6 l de DW. Para detectar la expresión del gen, hacer la RT-PCR con los cebadores listados en la Tabla 1.
- Realizar la RT-PCR con el gen de GAPDH como control para la eficiencia de las reacciones de amplificación. Visualizar y analizar el producto de PCR en un 1% electroforesis en gel de agarosa.
Resultados
Por lo general, los fibroblastos infectados no muestran cambios morfológicos en varios días después de la transducción de virus Sendai, pero cinco días después, empiezan a tener diferentes formas (Figura 1). Como se describe en un panel de la derecha de la Figura 1, las células no tienen la morfología típica de fibroblastos más. Ellos tienen una forma redonda y el núcleo más grande que el citoplasma. Incluso cuando la transducción se realiza en el 80% de confluencia celular, parece que son menos confluentes en el pozo después de que empiecen a reprogramar. Si este tipo de cambios morfológicos comienzan a ser visto en la mayor parte de la bien, fibroblastos transducidos están listos para ser chapada en placas de cultivo de MEF-subordinado.
En nuestro protocolo, minimizamos escala cultivo celular y también dimos varias posibilidades de reprogramación, tales como el empleo de diferentes densidades de células de fibroblastos y el título del virus, y la posterior relación de varias re-chapado MEF, lo que aumentará la eficiencia de la generación (hiPSCs Figura 2). Antes de transducción, los pozos con diferentes confluencia (bajo, medio y alto) se pueden seleccionar para su posterior transducción Sendai-virus; representado como el color rojo, verde, y amarillo en la placa.
Al comienzo de la reprogramación en los alimentadores del MEF, es difícil de distinguir tipos de células transducidas, pero después de más de una semana a partir de co-cultivo, fibroblastos parcialmente reprogramadas aparece y parece aflojado forma ES-like (Figura 3). Debido a esta razón, cuando las colonias IPSC humanos están listos para la pases a un nuevo plato alimentador de MEF, picking manual es la forma más eficiente para la transferencia en lugar de la disociación con enzima.
En la Figura 3 y la Figura 4, bajo el microscopio sólo iPSCs humanos tienen bordes claros, que hacen una clara distinción entre iPSCs humanos (considerados como "células totalmente reprogramadas ') y' células incompletamente reprogramadas" por la morfología. Totalmente células reprogramadas look como compacto y muy llena. Especialmente las colonias tienen límites claros, mientras que las células reprogramadas parcialmente parecen reunir para hacer colonia pero muy pierden y frágil a descomponerse. Incluso si no hacemos una pipeta suavemente se separa fácilmente. Incluso después de excluir parcialmente reprogramadas colonias iPSCs humanos (durante la expansión de ellos y los pases), iPSCs humanos completamente reprogramadas necesitan ser mantenidos por la recolección manual.
Después de recoger las colonias y la expansión de los clones hiPSC en varias semanas, la expresión de marcadores stemness necesita ser determinado. Después de la expansión de clones hiPSC, verificamos ellos con diferentes conjuntos de pruebas, incluyendo la tinción de anticuerpos (SSEA4, Oct-4, TRA-81 y Nanog) y RT-PCR del marcador pluripotentes (datos no se muestra) como un control de calidad.
En comparación con el H9, dos hiPSCs diferentes son positivos para SSEA4, Oct-4, TRA-81, y Nanog. Este resultado demuestra que iPSCs humanas aisladas adquieren calidad pluripotentes ( Figura 5).
Finalmente, la Figura 6 muestra que no podemos detectar cualquier expresión de los transgenes en los clones hiPSC por RT-PCR. Por lo menos más de 10 hiPSCs pasajes, cebadores específicos (Tabla 1) para exógeno Oct-4, Sox-2, Klf-4 y C-Myc se pueden utilizar con muestras de control positivas con fuerte nivel de expresión del transgén.
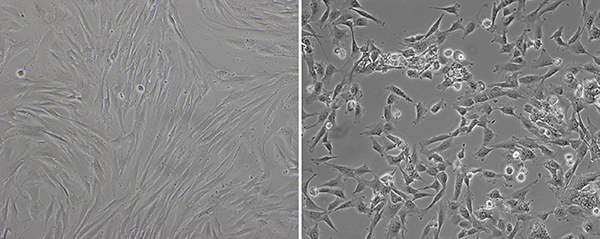
Figura 1. El cambio morfológico después de la transducción de virus Sendai. Antes de la transducción, fibroblastos muestran la forma de tipo huso típico (izquierda). Aproximadamente ocho días después de la transducción, la morfología de las células transducidas cambio como mucho más la forma redonda (derecha). Haga clic here para ver una versión más grande de esta figura.

Figura 2. Diagrama del plan de acogida para garantizar la máxima eficiencia. Más de cuatro diferentes tipos de células se pueden sembrar en una placa de 24 pocillos (de 1 a 4). Debido a su capacidad de fijación y la supervivencia celular podrían ser diferentes dependerá de los tipos de células, se sugiere a la placa diferente densidad celular (de 200K a 6,25 células por pocillo). Además, la concentración del virus se puede ajustar (0.5X, 1X y 2X).

Figura 3. Formación de inducida por el hombre de colonias de células madre pluripotentes a partir de f transducidasibroblast. En unas dos semanas después de la re-plating ellos en MEFs, colonias redondas deben aparecer y se parecen a las colonias de células madre embrionarias humanas. Normalmente las colonias IPSC humanos totalmente reprogramadas tienen límites muy claros. (Arrow: reprogramado totalmente colonias humanas IPSC, punta de flecha: parcialmente reprogramado iPSCs humanas). Haga clic aquí para ver la imagen más grande .

Figura 4. Recogiendo pluripotentes colonias de células madre de origen humano. Colonias IPSC humanos están a menudo rodeadas por células parcialmente reprogramadas (izquierda). Bajo el microscopio, recogiendo la colonia ES-como única, se descomponen en pequeños grupos y luego la transferencia (a la derecha). Después de 2 ~ 3 pasajes, hay colonias hiPSC indiferenciadas (abajo izquierda) y. (Arrow: colonias totalmente reprogramadas humanos IPSC, punta de flecha: humana parcialmente reprogramado iPSCs) Haz click aquí para ver la imagen más grande .
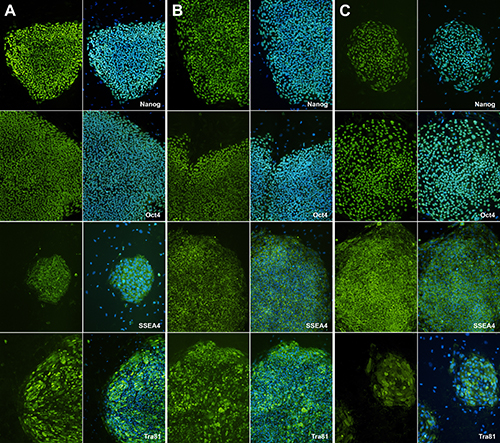
Figura 5. La tinción de inmunofluorescencia con marcadores de células madre pluripotentes. Ensayo de inmunofluorescencia muestra iPSCs humanos tienen stemness features.SSEA-4, TRA-81, Nanog, Oct-marcadores pluripotentes 4aS y DAPI es un control para la tinción del núcleo. (A) representa la tinción H9 como muestra de control. (B) y (C) muestran los clones IPSC humanos.et = "_blank"> Haga clic aquí para ver la imagen más grande.

Figura 6. Confirmación del nivel de expresión del transgén. Al menos después de cultivo de 10 paso de iPSCs humanos, silenciamiento de Sox2 exógeno, Oct-4 niveles de expresión génica Klf-4, c-Myc, y se confirma por reacciones inversas de la cadena de la polimerasa con transcriptasa. hGAPDH es un control interno. Para un control positivo, el ARN se extrae a partir de fibroblastos de sobra transducidas (día 7 después de la infección de virus Sendai-). (Carril 1: Marcador, carriles 2-6: GAPDH, Klf4, c-Myc, Oct-4 y Sox-2 en el control positivo, carriles 7-11: GAPDH, Klf4, c-Myc, Oct-4 y Sox -2 en hiPSCs).
| Nombre Primer | Secuencia |
| hOCT4 (F) | CCC GAA AGA GAA GAA AGC CCA T |
| hOCT4 (R) | AAT GTA TCG AAG GTG CTC AA |
| hMYC (F) | TAA CTG ACT AGC AGG CTT GTC T |
| hMYC (R) | TCC ACA TAC AGT CCT GGA TGA TGA TG |
| hSOX2 (F) | ACA AGA GAA AAA ACA TGT ATG T |
| hSOX2 (R) | ATG CGC TGG TTC ACG CCC GCG CCC AGG |
| hKLF4 (F) | ACA AGA GAA AAA ACA TGT ATG T |
| hKLF4 (R) | CGC GCT GGC AGG GCC GCT GCT CGA C |
| hGAPDH (F) | AGG TCG GAG TCA ACG GAT TTG |
| hGAPDH (R) | GTG ATG ACG TGG ACT GTG GT |
Tabla 1. Cebadores de RT-PCR para la confirmación transgén. Estas son las secuencias de los cebadores que se utilizan para TRAconfirmación NsGene. Tm es 50,6 ° C en todos los conjuntos de cebadores.
Discusión
La reprogramación de las células somáticas humanas con hiPSCs sostiene promesas sin precedentes en la biología básica, la medicina personal, y el trasplante 12. Anteriormente, las generaciones IPSC humanos necesarios virus de ADN que tiene riesgo de integración en el genoma huésped, que puede crear mutaciones genéticas indeseables que limitan otras aplicaciones clínicas tales como el desarrollo de medicamentos y terapias de trasplante 13. Con este motivo, se ha informado de muchos estudios para generar vectores y sistemas iPSCs humanos transgenes libre por varios métodos alternativos, pero, al mismo tiempo, la eficiencia de aislamiento de "libre huella 'iPSCs humanos deben ser considerados. Por ejemplo, el virus de ARN deben tener un nivel mínimo de la aberración genética en comparación con otros métodos 14, aunque no hay ninguna publicación para la secuenciación de todo el genoma para demostrar la 'seguridad genómico' de Sendai generación de IPSC mediada por virus todavía. A continuación, presentamos un método para generar hiPSCs con elSendai virus que tiene una alta eficiencia de reprogramación en forma rentable. Los iPSCs humanos resultantes están libres de transgenes con el mantenimiento de las similitudes moleculares y celulares de hESCs en potencial proliferativo y de desarrollo.
Podemos reprogramar diferentes orígenes de los fibroblastos (> 4) al mismo tiempo con un solo juego de la de virus Sendai. Y en nuestro método, aplicamos diversas confluencias celulares y las diferencias de dosis de virus. Esta técnica de combinación 'mix and match' puede maximizar la eficacia de reprogramación. Los fibroblastos (de un solo paciente) en cada pocillo tienen un nivel de infección por virus diferentes, pero poniendo en común en conjunto, la posibilidad de hacer hiPSCs colonias podrían aumentar en base a nuestra experiencia. Otros temas de la variación clonal entre líneas hiPSC son la tasa de proliferación, la unión de las células / supervivencia, el estado de inactivación del cromosoma X 15, la diferenciación de los potenciales de 16, etc De hecho, hemos observado que cada clon tiene una diferenteEnt propensión neuronal, el que podría predecirse midiendo el nivel de expresión de un clúster de miR-371. Además hemos tenido éxito en la generación de iPSCs humanos a partir de mioblastos humanos con este método, lo que sugiere que el virus Sendai puede utilizarse para muchos tipos diferentes de células en proceso de reprogramación. Además, el uso de nuestro método, hemos generado hiPSCs en más de 10 fibroblastos relacionados con la enfermedad diferentes. En promedio, del 5 al 10 clones hiPSC podrían obtenerse a partir de uno de fibroblastos.
Aunque la obtención de células iPS humanas transgenes libre con el virus Sendai es el método de reprogramación más eficiente que podría ser los caminos más prácticos, hay algunas limitaciones que deben ser considerados en este protocolo;
- Dependiendo de cada lote de virus Sendai, el título de virus tiene que ser calculado para MOI coherente (tal como se describe en 2.4).
- Se observó la variación de la infectividad entre diferentes células somáticas, que también necesita titulación adicional para Robuinfección viral st.
- La reprogramación mediada por el virus Sendai puede ser considerado como una de las mejores opciones para fines de investigación. Pero para el ensayo clínico, podría no ser la primera opción, ya que hay un problema de licencias con la empresa que desarrolló originalmente el sistema de virus Sendai.
- Se toma alrededor de dos meses, hasta que las células somáticas reprogramadas están libres de transgenes, y por eso tenemos que comprobar la expresión del transgen después de al menos 10 pasajes.
- Parece como que el número de pases de los fibroblastos cultivados primaria puede afectar a la eficiencia de la reprogramación con el virus Sendai, a pesar de que no tenemos una comparación directa. También se debe determinar la tasa de proliferación. Se necesitan más estudios para determinar el efecto de fibroblastos números de pases y su proliferación en la eficiencia de la reprogramación.
- En este estudio, utilizamos una capa alimentadora de ratón para la generación y mantenimiento hiPSC, pero un sistema libre de alimentación puede ser una alternative manera en un estudio futuro.
Nuestro protocolo actual ha sido un paso importante para el estudio de hiPSCs específicos del paciente para el modelado de la enfermedad, la medicina regenerativa, y otras aplicaciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría dar las gracias a los miembros del laboratorio Lee valiosa para los debates sobre el manuscrito. El trabajo en el laboratorio de Lee fue apoyado por becas de Robertson Investigator Award de la Fundación de Células Madre de Nueva York y de Maryland Stem Cell Research Fund (TEDCO).
Materiales
| Name | Company | Catalog Number | Comments |
| CytoTune-iPS Reprogramming Kit | Invitrogen | A1378002 | |
| CF-6,MEFs, neomycin-resistant, mitomycin C treated | Global stem | GSC-6105M | 5 x 105/6 cm or 12.5 x 105/24-well plate |
| Trypsin EDTA 0.25% Trypsin with EDTA 4Na 1X | Invitrogen | 25200114 | |
| DMEM/F-12 medium | Invitrogen | 11330-032 | |
| 24-well Cell Culture Plate, flat-bottom with lid | BD | 353935 | |
| Y-27632 | TOCRIS | 1254 | 10 μM (Stock: 10 mM) |
| basic fibroblast growth factor | LIFE TECHNOLOGIES | PHG0263 | 10 ng (Stock : 100 ug) |
| Knock-out serum replacement | Gibco | 10828028 | |
| Dulbecco's Modified Eagle Medium (D-MEM, DMEM) (1X), liquid (high glucose) | Invitrogen | 11965118 | |
| Fetal bovine serum | Thermo Scientific Fermentas | SH30071.03 | |
| L-Glutamine-200 mM (100X), liquid | GIBCO | 25030-081 | 1/100 |
| MEM Non-Essential Amino Acids Solution, 100X | LIFE TECHNOLOGIES | 11140050 | 1/100 |
| 2-Mercaptoethanol (1,000X), liquid | GIBCO | 21985023 | 1/1,000 |
| Hausser Phase Contrast Hemacytometers | Hausser Scientific | 02-671-54 | |
| EmbryoMax 0.1% Gelatin Solution | Millipore | ES-006-B | |
| SSEA-4 | DSHB | MC-813-70 | 1/200 |
| anti-Tra-1-81 | Cell Signaling | 4745S | 1/200 |
| mouse monoclonal Oct4 antibody | Santa Cruz | SC-5279 | 1/1,000 |
| Nanog | R&D | AF1997 | 1/1,000 |
| Alexa Flouor 488 goat anti-mouse | Invitrogen | 948492 | 1/2,000 |
| DPBS (Dulbecco's Phosphate-Buffered Saline), 1X without calcium & magnesium | Cellgro | 21-031-CV | |
| QuantiTect Reverse Transcription Kit | QIAGEN | 205313 | |
| PCR Master Mix [2X] | Thermo Scientific Fermentas | K0171 | |
| Trizol | Invitrogen | 15596018 | |
| picking hood | NuAire | NU-301 | |
| dissecting scope | Nikon | SMZ745 |
Referencias
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322, 949-953 (2008).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Yusa, K., Rad, R., Takeda, J., Bradley, A. Generation of transgene-free induced pluripotent mouse stem cells by the piggyBac transposon. Nature Methods. 6, 363-369 (2009).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Okita, K., Ichisaka, T., Yamanaka, S. Generation of germline-competent induced pluripotent stem cells. Nature. 448, 313-317 (2007).
- Yoshioka, N., et al. Efficient Generation of Human iPSCs by a Synthetic Self-Replicative RNA. Cell Stem Cell. 13, 246-254 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nature Protocols. 7, 2013-2021 (2012).
- Fluri, D. A., et al. Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures. Nature Methods. 9, 509-516 (2012).
- Nakagawa, M., et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature Biotechnology. 26, 101-106 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. P Jpn Acad B-Phys. 85, 348-362 Forthcoming.
- Silva, S. S., Rowntree, R. K., Mekhoubad, S., Lee, J. T. X-chromosome inactivation and epigenetic fluidity in human embryonic stem cells. P Natl Acad Sci USA. 105, 4820-4825 (2008).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8, 695-706 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados