Method Article
仙台ウイルスのヒト体細胞からの効率的な次世代ヒューマン誘導多能性幹細胞
要約
ここでは、一貫性のある成果と効率向上を示しているセンダイウイルスと導入遺伝子のない人間性IPSCにヒト体細胞を再プログラムする当社の確立された手法を提案する。
要約
数年前、人間の人工多能性幹細胞(iPS細胞)の設立は、生物医学の新時代が幕を開けた。ヒトiPS細胞の潜在的な使用は、ヒト遺伝性疾患の病因モデリング、遺伝子修正後の自己細胞療法、および患者特有の症状と関連する細胞の供給源を提供することによってパーソナライズされた薬剤スクリーニングが挙げられる。しかしながら、このようなヒトiPS細胞の製造後に残留する初期化因子の導入遺伝子発現を排除するような克服するため、いくつかのハードルが存在する。さらに重要なことは、未分化ヒトiPS細胞の残留導入遺伝子の発現は、適切な分化を阻害し、in vitroの表現型における疾患関連の解釈を誤った方向へ導くことができます。このような理由で、統合のない、および/または導入遺伝子のない人間性IPSCは、アデノウイルスは、piggyBacシステム、ミニサークルベクター、エピソームベクター、直接のタンパク質送達と合成されたmRNAのようないくつかの方法を使用して開発されている。しかし、reprograの効率統合のない方法を用いてmmingは、ほとんどの場合、非常に低い。
ここでは、センダイウイルス(RNAウイルス)ベースの再プログラミングシステムを用いてヒトiPS細胞を単離するための方法を提示する。この初期化方法は、費用対効果の高い方法で一貫した結果、高効率を示している。
概要
ヒト胚性幹細胞(hESC)は、自己再生をインビトロで多能性を有し、薬物スクリーニング、疾患のモデリングのための潜在的に有用である可能性があり、疾患および組織傷害を治療するための細胞ベースの治療法を開発するための能力を有する。しかし、ヒトES細胞が原因、免疫学、腫瘍学、倫理的な障壁の細胞置換療法には限界があり、病気に関連する遺伝子を研究するために、疾患特異的ヒトES細胞は、着床前遺伝子診断(PGD)アプローチによって単離することができたが、それはまだ技術的に困難であるおよび胚の寄付はかなり稀である。これらの問題は、誘導多能性幹細胞(hiPSCs)の開発につながっている幹細胞生物学の進歩に関連している。
人間性IPSCは、遺伝的にヒト成人の体細胞から再プログラムし、それらには、Dなどの再生医療のための有用な供給源となるヒトES細胞に類似した多能性幹細胞のような特性を抱いている患者固有の方法1,2での敷物の発見、病気のモデリングと細胞療法。
今まで、ウイルス媒介(レトロウイルスおよびアデノウイルス)を含むヒトiPS細胞を生成するためのいくつかの方法、3、非ウイルス媒介(BAC系およびベクターのトランスフェクション)4遺伝子形質導入、およびタンパク質送達システム5-7が存在する。
ウイルス媒介性遺伝子の送達効率をある程度確保することができるが、それらは制御されない様式で初期化遺伝子を発現するために宿主染色体に統合するので、ウイルスベクターは、遺伝的フットプリントを残すことができる。転写因子のウイルス組込みは、宿主遺伝子を活性化する8又は不活性化することができる場合であっても、予想外の遺伝子異常5,9および腫瘍形成のリスクを引き起こす可能性がある。一方、体細胞へのタンパク質又はRNAの直接的な導入が報告されているが、このような労働集約的な繰り返し変圧などのいくつかの欠点を有したECTION、および7,10の再プログラミングの低レベル。偶数エピソームおよび非組み込み型アデノウイルス、アデノ随伴ウイルス、およびプラスミドベクターは、依然として比較的効率的である11。これらの理由から、IPSCの発生の高い有効性と少ない遺伝子異常を持つ非統合書き換え方法を選択することが妥当である。本研究では、仙台ウイルスベースのプログラミングを使用しています。この方法は、宿主ゲノムに統合されていないと一貫して導入遺伝子の統合なしにヒトiPS細胞を産生することが知られている。
プロトコル
1。細胞の作製とメディア(1日目)
- 文化DMEM培地を10%FBSを含むヒト線維芽細胞を展開します。
- 形質導入の前日に、ウェル当たり、適切な密度で24穴プレートにプレートヒト線維芽細胞( 図1)。
注:異なる種類の細胞が別の添付ファイルの能力を持っているので、次の段階希釈は(200K、100K、50K、25K、12.5Kと6.25K)をお勧めします。 - 細胞が完全に付着して拡張している確保し、37℃、5%CO 2インキュベーター内でもう一日のために細胞をインキュベートする。
2。伝達を行います(2日目)
- 形質導入当日、細胞密度を確認し、最も効率的な濃度ウェル( 図2)を選んだ。高い(80〜90%)、中間(50〜70%)と低い(20〜40%)という3つの異なる密度を選択することをお勧めします。
- 少なくとも1時間の形質導入の前に、fibroblを吸引AST細胞からの培地および線維芽細胞培地を新しい300μLを変更してください。
- -80℃保存から4異なるセンダイウイルス管の1セットを削除。数秒間37℃の水浴中で同時に各チューブを解凍し、次いで水浴から取り出し、チューブを取る。その後、室温にそれらを解凍する;遠心管10秒6000×gで、使用するまで氷の上に置きます。価が維持されませんので、凍結の再、ウイルスを解凍しないでください。
- マイクロ遠心チューブに4センダイウイルスチューブ(10月 - 4、KLF-4、C-MycおよびSOX-2)のそれぞれの示されたボリュームを追加します。溶液を静かにピペッティングすることによって十分に混合されていることを確認してください。
例えば、50K細胞/形質導入のために、24ウェルプレートlookwellの1つのウェルの場合:
(ライフ·テクノロジーズからの分析証明書に基づいて力価は、バッチ間とは異なる場合があります)
チューブhOct-4 = 6.0×10 7 CIU、3 MOI = 5μL
チューブhSox-2 = 6.5×10 7 CIU、3 MOI = 4.6μ; L
チューブhKlf-4 = 6.3×10 7 CIU、3 MOI = 4.8μL
チューブHC-Mycを= 7.8×10 7 CIU、3 MOI = 3.8μL
4ウイルス要因の混合物の合計= 18.2μL/ 1 24ウェルプレートの(50K細胞) - 細胞密度に応じて;ウェルにウイルス混合物の2X、1X、および0.5Xボリュームを追加。優しく(2X:ウイルス混合物の36.4μL、1X:18.2μLおよび0.5X:9.1μl)を左右にバックアップする板前を振る。
- 37℃、5%CO 2インキュベーター中で細胞を置き、一晩インキュベートする。
3。培養液の交換(3日目·5日目)
- 形質導入後24時間は、500μlの新鮮な線維芽細胞培地で培地を交換してください。
- 5日目に、新鮮な線維芽細胞培地による培地交換。
4。共培養のためのMEFの料理を準備(8日目)
- 10%60mm培養皿でMEF細胞を調製FBSをDMEM培地を一ダを含有MEFフィーダー細胞上に形質導入線維芽細胞を継代する前に、Y。
注:我々は、各60ミリメートル皿にMEFの5×10 5を使用しています。
5。MEFフィーダー細胞(9日目)との共培養形質導入細胞を開始します
- 形質導入した細胞をプレーティングする前に、吸引FBSをMEFフィーダー皿からDMEM培地を含有し、新しい10%FBSを追加10%DMEM培地を含有した。
- 24ウェルプレートである形質導入線維芽細胞から培地を除去し、D-PBSで細胞を1回洗浄します。 24ウェルプレートinthe線維芽細胞に0.25%トリプシン/ EDTAを200μlを加える。細胞をプレートから剥離を開始したときにトリプシン/ EDTAで5分未満のインキュベーションの後、15mlのコニカルチューブに、増殖培地で細胞を集める。その後4分間6000×gで、それらを遠心分離する。
注:プーリング2X、1X、および0.5Xウイルス形質導入線維芽細胞を推奨します。 - 上清培地を除去して再懸濁する洗うトリプシンの中和のための新鮮な線維芽細胞培地4〜5 mlの細胞ペレット。その後、4分間135×gで、それらを遠心する。
- プレート連続希釈濃度として細胞およびMEF上に線維芽細胞培地で共培養を開始する:例えば、1/64、1/32、1/16、1/8、1/4、1/2など、及び1/128 60あたりmmディッシュ。形質導入の最初の週の間の細胞死率に応じて、1、1/2または1/128の濃度に希釈する必要はないかもしれません。導入遺伝子のRT-PCRのポジティブコントロールとして、全RNAを抽出するために脇に残った細胞を入れた。
- 一晩37℃、5%CO 2インキュベーター内で60ミリメートルの皿を置きます。
6。ヒト胚性幹細胞培地をフィードし、細胞(10日目)を監視します
- 翌日、10μMのY-27632で、ヒトESメディアに線維芽細胞のメディアを変更してください。その後、ヒトES培地により毎日培地交換:800ミリリットルDMEM/F12 + 200ミリリットルノックアウト血清代替+ 10mlのL-グルタミン+10 10 mMのMEM最小非必須アミノ酸の中塩基性線維芽細胞成長因子の2 - メルカプトエタノール+ 10 ng / mlの+の1ミリリットル。
- 新鮮なヒトESメディアで毎日の培地交換を行います。週間後に、ESコロニー様細胞塊の形成のために、顕微鏡下で一回あたり2〜3日の料理をご確認ください。コロニーが発見される前に、細胞型に応じて、培養物は、多かれ少なかれ時間がかかる。
7。人工多能性をピッキングすると、細胞コロニーをステムと細胞(20日目〜)を展開
- 三週間の形質導入後、コロニーピッキング適切に成長し表示されます。
- コロニーピッキング前日に、24ウェルプレートにMEFフィーダーを用意。
注:我々は1つの24ウェルプレートにMEFの12.5×10 5を使用しています。 - 翌日、10μMのY-27632で、ヒトESメディアに線維芽メディアからMEF料理のメディアを変更してください。手動でピッキング·フード内で顕微鏡下たびに1コロニーを採取し、ピペッティングにより小さい塊を作り、それらを転送新たにいくつかのクローンを選択するMEF dishes.Tryを準備の上。
- 通路及び当初は6ウェルプレートに24ウェルプレートから各ウェル展開します。その後、6ウェルプレートからさらに伝播する前に、60ミリメートル料理に。
(10継代後に)人間性IPSCの8。キャラ
- 免疫蛍光
- 毎日培地を交換して4〜5日間、24ウェルプレートや文化の中でプレート人間性IPSC。
- 免疫蛍光アッセイを開始するため、かつてのD-PBSでプレートを洗浄する。その後、30分間、0.4%パラホルムアルデヒド中で、すぐに細胞を固定。その後5分間D-PBSで3回洗浄する。
- 室温で15分間、PBS中0.1%トリトンX-100溶液で固定した細胞を治療する。
- 透過化溶液(0.1%トリトンX-100溶液)を吸引し、次いで室温で1時間0.5%BSAブロッキング溶液を加える。
- Nanogの、10月〜4、SSEA(段階特異的胚性antigの検出を行うエン)及びTRA-1-81、0.5%BSA溶液中の抗ヒト抗体を用いた(腫瘍拒絶抗原)(抗体希釈率の材料テーブルをチェック)。室温で2時間一次抗体をインキュベートする。その後、5分ごとにD-PBSで3回洗浄する。
- 室温で0.5%のBSA溶液で1:2000に希釈された第 2 抗体としてAlexa Fluor 488ヤギ抗マウスIgG抗体とのインキュベーションの1時間後に蛍光顕微鏡を用いて確認する。 DAPIで各MEFフィーダー細胞とhiPSCsの全ての核を染色する。
- 導入遺伝子の確認のRT-PCR
- RNA抽出試薬を用いて細胞ペレットから全mRNAを抽出する。
- 逆転写酵素によるPCR増幅のための全RNAおよび得られたcDNAの分量に逆転写(1μgのを)やる。
- cDNAテンプレートの2μL、2X PCRマスターミックスを10μl、プライマーの2ピコモルの2液を含むようにPCR混合物を準備します(フォワード:1μLおよびリバース:1μL)とDWの6μL。 表1に列挙されるプライマーを用いてRT-PCRを行い、遺伝子発現を検出する。
- 増幅反応の効率のコントロールとしてGAPDH遺伝子を用いたRT-PCRを行う。 1%アガロースゲル電気泳動でPCR産物を可視化して分析する。
結果
通常感染した線維芽細胞は、センダイウイルス形質導入後数日内のいずれかの形態学的変化を示していないが、5日後に、それらは異なる形状( 図1)を有することを開始します。 図1の右側のパネルで説明したように、細胞は、任意のより典型的な繊維芽細胞の形態を有していない。彼らは、細胞質よりも丸みを帯びた形状と大きな核を持っている。伝達は80%の細胞の集密度で行ったとしても、彼らは再プログラムするために開始した後、彼らは十分に少ない集密であるように、それは見えます。形態学的変化のこれらの種類は、ウェルのほとんどで見られることを開始する場合、形質導入された線維芽細胞は、MEFフィーダー培養皿上に播種される準備ができている。
我々のプロトコルでは、細胞培養スケールを最小化し、またhiPSCs発生効率を増加させるような異なる線維芽細胞密度およびウイルス力価を採用するような様々な再プログラミングの可能性、およびその後のいくつかの再めっき比MEFを、(与え図2)。伝達する前に、別の集密度(低、中、高)でウェルは、さらに仙台ウイルス形質導入のために選択することができます。プレート中の赤、緑、黄色のように表される。
MEFフィーダー上の再プログラミングの開始時に、それが形質導入された細胞のタイプを区別することは困難であるが、共培養から1週間以上後に、部分的に再プログラム線維芽細胞が出現し、緩んES様な形状( 図3)のように見える。なぜなら、人間のIPSCコロニーが新しいMEFフィーダー皿に継代の準備ができているこのような理由のため、手動のピッキングは、酵素との転送ではなく、解離のためのより効率的な方法です。
図3と図4に、顕微鏡下でのみ、人間性IPSCは、人間性IPSC( '完全に再プログラムされた細胞」と考えられる)と形態による「不完全に再プログラムされた細胞」の間に明確な区別を明確にエッジを持っている。完全に再プログラムされた細胞LOコンパクトで密に充填されたように[OK]をクリックします。部分的に再プログラムされた細胞がコロニーを作るために一緒に集まるように見えるが、非常に失い、分解する脆弱なのに対し、特にコロニーは、明確な境界を持っている。我々は静かにピペッティングをしていても、それが容易に取り外される。でも、(彼らと継代を拡大中の)部分的に再プログラムされた人間性IPSCコロニーを除外した後、完全に再プログラム人間性IPSCは、マニュアルピッキングによって維持される必要がある。
コロニーをピッキングし、数週間にhiPSCクローンを展開した後、幹細胞性マーカーの発現を決定する必要がある。 hiPSCクローンの拡大の後、我々は、品質管理などの(データは示されていない)抗体染色(SSEA4、10月〜4、TRA-81及びNanog)および多能性マーカーのRT-PCRを含むテストの異なるセット、それらを確認してください。
H9と比較すると、二つの異なるhiPSCsはSSEA4、10月〜4、TRA-81、及びNanogに対して陽性である。この結果は、(単離されたヒトiPS細胞が多能性質を獲得したことを示している図5)。
最後に、 図6は、我々 は RT-PCRによってhiPSCクローン内の任意の導入遺伝子の発現を検出することができないことを示している。少なくとも10継代のhiPSCs、外因性Oct-4のための特異的プライマー( 表1)、ソックス-2上で、KLF-4、c-Mycの強力な導入遺伝子発現レベルを有する陽性対照サンプルと共に使用することができる。
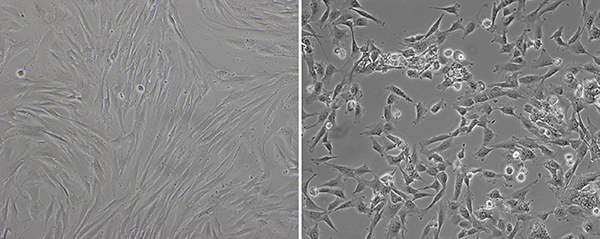
図1。センダイウイルス形質導入後の形態変化。伝達する前に、線維芽細胞( 左 )は、典型的な紡錘状の形状を示している。形質導入後約8日間、ずっと丸型( 右 )のように形質導入された細胞の変化の形態。 時間をクリックしてくださいこの図の拡大版を表示するには、ERE。

図2の誘導計画のダイアグラム最大効率を確保する 。 4年以上の異なる細胞型(1〜4)を24ウェルプレートにプレーティングすることができる。それらの結合能および細胞生存が異なる細胞型に依存することができるので、(ウェルあたり20万個の細胞から6.25K)異なる細胞密度をメッキすることが提案されている。また、ウイルス濃度は(0.5X、1Xおよび2X)を調節することができる。

図3。形質導入Fからの人間の人工多能性幹細胞のコロニーの形成ibroblast。のMEFにそれらを再メッキ後約2週間で、丸いコロニーが表示されますし、ヒト胚性幹細胞のコロニーのように見える。通常、完全に再プログラム人間IPSCコロニーは非常に明確な境界を有する。 (矢印:完全ヒトIPSCコロニー、矢じり再プログラム:部分的に再プログラム人間性IPSC)を。 拡大画像を表示するには、ここをクリックしてください 。

図4:ヒト誘導多能性幹細胞のコロニーを拾い 。人間のIPSCコロニーは、多くの場合、部分的に再プログラムされた細胞( 左 )に囲まれている。顕微鏡下で、ES様コロニーを選ぶことだけ、小さな塊に分解してから転送( 右 )。 2〜3継代後に、未分化hiPSCコロニー( 下 · 左 ) があります。 (矢印:完全再プログラムされた人間のIPSCコロニー、矢じり:部分的に再プログラムされた人間性IPSC)は拡大画像を表示するには、ここをクリックしてください 。
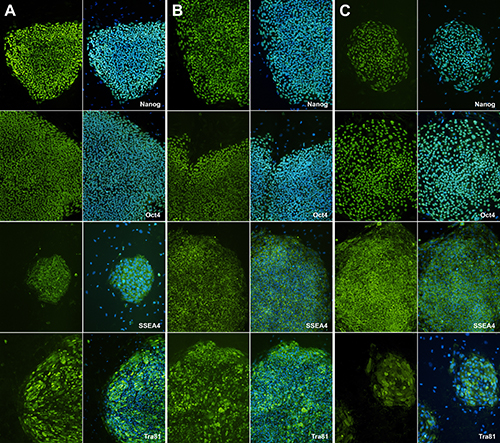
図5。幹細胞の多能性マーカーと免疫蛍光染色。蛍光抗体法TRA-81、人間性IPSCは、幹細胞性のfeatures.SSEA-4を持って示し、Nanogの、10月-4AS多能性マーカーおよびDAPI核染色のための制御である。(A)は、H9染色を表し、対照試料(B)および(C)のようなヒトIPSCクローンを示す。らは= "_blank">拡大画像を表示するにはここをクリックしてください。

導入遺伝子の発現レベルを図6確認が。少なくともヒトiPS細胞は、外因性Sox2のサイレンシング、KLF-4、c-Mycの、およびOct-4遺伝子の発現レベルの10継代培養した後に逆転写酵素ポリメラーゼ連鎖反応によって確認される。 hGAPDH内部統制である。陽性対照のために、RNAは残りの形質導入線維芽細胞(仙台ウイルス感染後7日目)から抽出されます。 (レーン1:マーカー、レーン2から6:GAPDH、Klf4の、c-Mycの、10月〜4、および陽性対照におけるSOX-2、レーン7から11:GAPDH、Klf4の、c-Mycの、10月〜4、およびソックス-2)hiPSCs中。
| プライマー名 | シーケンス |
| hOCT4(F) | CCC GAA、AGA、GAAのAGC GAA CCA G |
| hOCT4(R) | AAT GTA TCG AAG GTG CTC AA |
| hMYC(F) | TAA CTG ACT AGC AGG CTT GTC G |
| hMYC(R) | TCC ACA TAC AGT CCT GGA TGA TGA TG |
| hSOX2(F) | ACA AGA、GAA AAA、ACA TGT ATG G |
| hSOX2(R) | ATG CGC TGG TTC ACG CCC GCG CCC AGG |
| hKLF4(F) | ACA AGA、GAA AAA、ACA TGT ATG G |
| hKLF4(R) | CGC GCT GGCのAGGのGCC GCT GCT CGA C |
| hGAPDH(F) | AGG TCG GAG TCA ACG GAT TTG |
| hGAPDH(R) | GTG ATG GCA TGG ACT GTG GT |
導入遺伝子の確認のために表1 RT-PCRプライマーは 、 これらがTRAのために使用されるプライマー配列であるnsgene確認。 T mは 、すべてのプライマーセットにおいて50.6°Cである。
ディスカッション
hiPSCsにヒト体細胞を再プログラミングすることは、基本的な生物学、個人的な医学、移植12で前例のない約束を保持している。このような薬剤の開発および移植治療13などのさらなる臨床応用を制限する望ましくない遺伝子変異を作成することができ、宿主ゲノムへと統合リスクが以前に、人間のIPSC世代に必要なDNAウイルス。このような理由で、多くの研究は、いくつかの代替方法によってベクターおよび導入遺伝子を含まないヒトiPS細胞系を生成することが報告されているが、同時に、「フットプリントフリー」ヒトiPS細胞を単離するの効率が考慮されるべきである。まだセンダイウイルス媒介IPSC世代の「ゲノム安全性を「証明する全ゲノムシーケンシングのための出版物がありませんが、例えば、RNAウイルスは、他の方法と比較して14遺伝子異常の最低限のレベルを持っている必要があります。ここでは、とのhiPSCsを生成する方法を提示費用対効果の高い方法で、再プログラミング効率を有するセンダイウイルス。その結果、人間性IPSCは、増殖や発生能におけるヒトES細胞への細胞および分子の類似点を維持しながら、導入遺伝子を含まない。
私たちは、仙台ウイルスの1セットのみと同時に、線維芽細胞の異なる起源(> 4)を再プログラムすることができます。そして、我々の手法では、様々な細胞合流し、ウイルス投与量の違いを適用します。この「ミックスとマッチ '組み合わせ技術は、再プログラミングの有効性を最大化することができます。各ウェルの(一人の患者からの)線維芽細胞は、様々なウイルス感染のレベルを持っていますが、一緒にプールすることにより、hiPSCsコロニーを作る可能性は、私たちの経験に基づいて増加する可能性があります。 hiPSC線のうちクローン変異の他の問題は、増殖速度、細胞接着/生存、X染色体不活性化15の状態であり、分化等、16を電位実際に、我々は、各クローンが異なるを有することが観察されのmir-371クラスターの発現レベルを測定することによって予測することができる耳鼻咽喉科神経性向。加えて、我々は、センダイウイルスは、再プログラミングプロセスにおける多くの異なる細胞型に用いることができることを示唆しているこの方法で、ヒト筋芽細胞からのヒトiPS細胞の生成に成功した。さらに、我々の方法を使用して、我々は10以上の異なる疾患に関連する線維芽細胞でhiPSCsを生成した。 5〜10 hiPSCクローンから、平均上の一線維芽細胞から得ることができる。
仙台ウイルスで導入遺伝子のないヒトiPS細胞の誘導が最も実用的なパス可能性が最も効率的な再プログラミング方法であるが、このプロトコルで考慮すべきいくつかの制限があります。
- (2.4に記載のように)各センダイウイルスバッチに依存して、ウイルス力価は、一貫性のMOIについて計算する必要がある。
- 我々はまた、robuのための追加の滴定を必要とするさまざまな体細胞間の感染性の変化を観察STウイルス感染。
- センダイウイルス媒介性の再プログラミングは、研究目的のための最良の選択肢の一つと考えることができる。もともとセンダイウイルスシステムを開発した会社とのライセンスの問題があるのでしかし、臨床試験のために、それは、最初の選択肢ではないかもしれません。
- 再プログラム体細胞が導入遺伝子を含まないまで、私たちは、少なくとも10継代後に導入遺伝子の発現を確認する必要がある理由である、約2ヶ月かかります。
- それは我々が直接の比較はありませんが、初代培養線維芽細胞の継代数は、仙台ウイルスとの再プログラミングの効率に影響を与える可能性があることのように思える。増殖速度も決定する必要がある。さらなる研究は、線維芽細胞の継代数およびリプログラミング効率に対するそれらの増殖の効果を決定するために必要とされる。
- 本研究では、hiPSCの生成と維持のために、マウスのフィーダー層を使用していますが、フィーダーフリーシステムはalternativかもしれ今後の研究におけるE道。
私たちの現在のプロトコルは、病気のモデリングのための患者固有hiPSCs、再生医療、およびその他のアプリケーションを研究に向けた重要なステップとなっている。
開示事項
著者らは、開示することは何もありません。
謝辞
私たちは、原稿上で貴重な議論のためにイ·ラボのメンバーに感謝したいと思います。李研究室での作業は、細胞研究基金(TEDCO)を幹ニューヨーク幹細胞財団のロバートソン研究者賞からメリーランド州からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| CytoTune-iPS Reprogramming Kit | Invitrogen | A1378002 | |
| CF-6,MEFs, neomycin-resistant, mitomycin C treated | Global stem | GSC-6105M | 5 x 105/6 cm or 12.5 x 105/24-well plate |
| Trypsin EDTA 0.25% Trypsin with EDTA 4Na 1X | Invitrogen | 25200114 | |
| DMEM/F-12 medium | Invitrogen | 11330-032 | |
| 24-well Cell Culture Plate, flat-bottom with lid | BD | 353935 | |
| Y-27632 | TOCRIS | 1254 | 10 μM (Stock: 10 mM) |
| basic fibroblast growth factor | LIFE TECHNOLOGIES | PHG0263 | 10 ng (Stock : 100 ug) |
| Knock-out serum replacement | Gibco | 10828028 | |
| Dulbecco's Modified Eagle Medium (D-MEM, DMEM) (1X), liquid (high glucose) | Invitrogen | 11965118 | |
| Fetal bovine serum | Thermo Scientific Fermentas | SH30071.03 | |
| L-Glutamine-200 mM (100X), liquid | GIBCO | 25030-081 | 1/100 |
| MEM Non-Essential Amino Acids Solution, 100X | LIFE TECHNOLOGIES | 11140050 | 1/100 |
| 2-Mercaptoethanol (1,000X), liquid | GIBCO | 21985023 | 1/1,000 |
| Hausser Phase Contrast Hemacytometers | Hausser Scientific | 02-671-54 | |
| EmbryoMax 0.1% Gelatin Solution | Millipore | ES-006-B | |
| SSEA-4 | DSHB | MC-813-70 | 1/200 |
| anti-Tra-1-81 | Cell Signaling | 4745S | 1/200 |
| mouse monoclonal Oct4 antibody | Santa Cruz | SC-5279 | 1/1,000 |
| Nanog | R&D | AF1997 | 1/1,000 |
| Alexa Flouor 488 goat anti-mouse | Invitrogen | 948492 | 1/2,000 |
| DPBS (Dulbecco's Phosphate-Buffered Saline), 1X without calcium & magnesium | Cellgro | 21-031-CV | |
| QuantiTect Reverse Transcription Kit | QIAGEN | 205313 | |
| PCR Master Mix [2X] | Thermo Scientific Fermentas | K0171 | |
| Trizol | Invitrogen | 15596018 | |
| picking hood | NuAire | NU-301 | |
| dissecting scope | Nikon | SMZ745 |
参考文献
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322, 949-953 (2008).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Yusa, K., Rad, R., Takeda, J., Bradley, A. Generation of transgene-free induced pluripotent mouse stem cells by the piggyBac transposon. Nature Methods. 6, 363-369 (2009).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Okita, K., Ichisaka, T., Yamanaka, S. Generation of germline-competent induced pluripotent stem cells. Nature. 448, 313-317 (2007).
- Yoshioka, N., et al. Efficient Generation of Human iPSCs by a Synthetic Self-Replicative RNA. Cell Stem Cell. 13, 246-254 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nature Protocols. 7, 2013-2021 (2012).
- Fluri, D. A., et al. Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures. Nature Methods. 9, 509-516 (2012).
- Nakagawa, M., et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature Biotechnology. 26, 101-106 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. P Jpn Acad B-Phys. 85, 348-362 Forthcoming.
- Silva, S. S., Rowntree, R. K., Mekhoubad, S., Lee, J. T. X-chromosome inactivation and epigenetic fluidity in human embryonic stem cells. P Natl Acad Sci USA. 105, 4820-4825 (2008).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8, 695-706 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved