Method Article
O
Neste Artigo
Resumo
A abordagem lacuna vaselina cut-aberto é usado para obter baixos gravações de ruídos de correntes iônicas e gating de canais iônicos dependentes de voltagem expressos em oócitos de Xenopus com alta resolução de cinética de canais rápidos. Com modificações menores, fixador de tensão fluorometria pode ser acoplado com o protocolo do oócito corte aberto.
Resumo
A vaselina oócito lacuna cut-aberto (COVG) técnica braçadeira de tensão permite a análise das propriedades eletrofisiológicas e cinéticos de canais iônicos heterólogas em oócitos. Gravações do setup cut-aberto são particularmente úteis para a resolução de correntes de baixa magnitude gating, rápida ativação corrente iônica e desativação. As principais vantagens sobre a tensão de dois eléctrodos de aperto (TEVC) técnica incluem o aumento da velocidade de fixação, uma melhor relação sinal-ruído, e a capacidade de modular o intracelular e meio extracelular.
Aqui, nós empregamos o canal de sódio cardíaco humano (HNA V 1.5), expressa em oócitos de Xenopus, para demonstrar a configuração cut-aberto e protocolo, bem como as modificações que são necessárias para adicionar capacidade de fluorometria braçadeira de tensão.
As propriedades dos canais iônicos de ativação rápida, como HNA V 1.5, não pode ser totalmente resolvido em temperatura ambiente usando TEVC, em which, a totalidade da membrana do oócito é apertado, tornando difícil o controlo da tensão. No entanto, na técnica de corte-aberto, o isolamento de apenas uma pequena porção da membrana celular permite a fixação rápida necessária para registar com precisão cinética rápida evitando canal degradado associado com técnicas de fixação de membranas.
Em conjunção com a técnica COVG, cinética do canal de iões e propriedades electrofisiológicas pode ser ainda analisada utilizando fluorimetria fixador de tensão, onde o movimento é controlado por meio da proteína de cisteína de conjugação de fluoróforos extracelularmente aplicadas, a inserção de proteínas fluorescentes codificados geneticamente, ou a incorporação de aminoácidos não naturais na região de interesse 1. Esta informação adicional produz informação cinética sobre rearranjos conformacionais dependentes de voltagem da proteína através de alterações no microambiente em torno da molécula fluorescente.
Introdução
Técnicas de fixação de tensão especializados permitir a gravação de correntes iônicas de potenciais de membrana controladas. Amplamente utilizado braçadeira de tensão de dois eletrodos (TEVC) e técnicas de patch clamp fornecer informações eletrofisiológico confiável sobre as propriedades de muitos canais iônicos. No entanto, ambos os métodos têm desvantagens que impedem a obtenção de dados confiáveis para os canais de sódio dependentes da voltagem rápidos e outros canais de ativação rápida nas membranas, como as de oócitos de Xenopus. Os laboratórios Bezanilla e Stefani, consequentemente, desenvolveu a técnica lacuna vaselina braçadeira de tensão cut-aberto (COVG) para ovócitos 2. A técnica tem sido amplamente aplicada para gravar, Na +, K +, Ca 2 + e canais de 3-8.
Durante a gravação COVG, uma membrana do oócito expressando a proteína heteróloga é dividido em três regiões. Os dados de corrente iônica é gravado a partir da região superior do oócito como obanho em torno da região superior é presa a um potencial de comando, que pode ser fácil e rapidamente mudado. Os guardas região meio contra correntes de fuga ao ser fixada ao mesmo potencial que a região superior 9. A região inferior é onde a abertura do oócito (cut-open) ocorre através do uso de uma solução de saponina ou uma cânula. Química ou a abertura manual da membrana na região do fundo permite um controlo do potencial interno, que está fixada ao solo, e torna a célula contígua com a solução interior da câmara inferior. Perfusão de soluções para a câmara inferior pode ajustar as propriedades do ambiente interno, enquanto troca da solução na câmara de topo altera o ambiente externo. 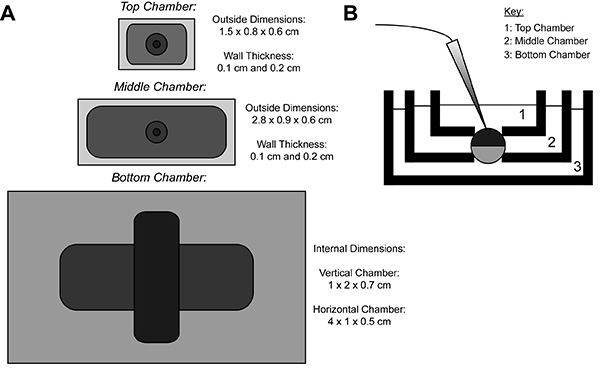
Figura 1. Oocyte Cut-Open Voltage-Clamp Bath Setup Diagram. (A) Topabaixo da vista dos três banhos separados um do outro. As dimensões das câmaras para COVG são apresentados na figura. (B) Vista lateral da configuração banhos em posição de teste. Clique aqui para ver a imagem ampliada .
As vantagens da técnica COVG incluem baixo nível de ruído atual (1 nA a 3 kHz), o controle da composição iônica dos meios externos, a capacidade de modular os meios de comunicação interna, resolução de tempo rápido (20-100 constante ms de tempo de decaimento do capacidade transitória), e gravações estáveis por várias horas 9. As desvantagens são que requer equipamento especializado e é mais difícil de realizar em comparação com dois de fixação de tensão de eléctrodo (TEVC) 10.
Embora a abordagem COVG requer equipamentos altamente especializados e elementos processuais complexas, pode permitir a aquisição de valiosodados eletrofisiológicos capazes. Estes dados, como gating correntes com cinética rápida e correntes cauda 4, podem ser gravadas sem alguns dos problemas associados com outros protocolos de fixação de tensão, incluindo canal degradado. Pequenas modificações na configuração COVG pode permitir o uso de controladores de temperatura e fluorometria braçadeira de tensão (VCF). A inclusão de elementos de fluorometria braçadeira de tensão dentro da montagem COVG pode aumentar a saída de dados, conferindo a capacidade de monitorar mudanças conformacionais de proteínas e ao mesmo tempo de gravação atual 11-13.
Protocolo
1. Configuração do equipamento inicial
- Coloque o palco eo manipulador de microeletrodos em um sistema de vibração de isolamento (por exemplo, uma mesa de ar) com uma gaiola de Faraday circundante, para evitar o ruído elétrico e mecânico.
- Solda seis pelotas Ag / AgCl para comprimentos de 24 AWG de seis polegadas. Para um desses comprimentos (para ser ligado a P1), tala num segundo fio de modo a formar um "Y". Nas extremidades de cada fio de soldar um pino BNC ouro, que está incluído com o amplificador.
- Conecte os cinco pelotas Ag / AgCl soldadas a 24 AWG para a headstage Banheira / Guarda (P1, P2, CC, GS1 e GS2). Conecte o "I" Ag / AgCl pelota para o "eu" eo segundo headstage fio saindo de P1 para o headstage V2.
- Ligue o amplificador para a unidade de aquisição de dados de acordo com as instruções dos manuais de equipamentos.
- Coloque epóxi e os termistores do controlador de temperatura. Passe o termistor bloco através de um buraco na scaffol de metald diretamente acima do centro do elemento de aquecimento / arrefecimento. Coloque epóxi e o banho de termistor num furo no corpo da câmara de fundo condutora de temperatura muito perto, mas não contactar a solução.
2. Oócitos e preparação preliminar
- Para gravar um canal heterologamente expressa como HNA V 1.5, sintetizar mRNA (derivado de hSCN5a) e injetá-lo em um oócito de Xenopus cerca de 4-5 dias antes de realizar o Protocolo no 4. Para hSCN5a, pico de expressão é obtido após uma incubação de 4-5 dias a 19 ° C. Consulte Richards e Dempski 14 e 15 de Cohen et al. Para instruções detalhadas sobre oócito, preparação de mRNA, e injeção de oócitos.
- Cloreto o fio AgCl e pelotas AgCl antes de iniciar o Protocolo no 4. Para fazer isso, colocar uma extremidade do fio e as pelotas em água sanitária, pelo menos, 20 min e desde que O / N. Uma vez que os peletes foram Chlorided, fixá-las no colector usando adesivo.
Nota: A corrente de condução através dos fios também pode ser usado para o fio de cloretos e pelotas. Esta técnica irá aumentar a velocidade de chloridation mas também exige mais equipamento. Veja Técnicas para Chloriding Prata Fios para outras instruções 16.
3. Agar Ponte Preparação
- Fazer pelo menos seis pontes agar, aquecendo-se uma extremidade de um tubo capilar de borosilicato de uma chama média. Certifique-se de que a extremidade do tubo capilar é na parte de cima da chama azul. Fazer pontes extras em caso de danos aos originais.
- Uma vez que o tubo capilar foi aquecido, utilizar uma pinça para fazer um ângulo de curvatura de 90 ° no tubo. Apontar para uma curvatura com uma curvatura suave, em vez de um canto abrupta ou pode reduzir de forma significativa o diâmetro interno do vaso, o que torna mais difícil o enchimento e aumenta a resistência da ponte.
- Faça uma segunda curva de 90 °no mesmo sentido 25 milímetros de deslocamento do tubo capilar a partir da primeira curva utilizando os mesmos passos.
Nota: O comprimento exacto da ponte não interessa, desde que o tamanho da ponte é consistente, mas, essencialmente, o comprimento deve ser adequado para o equipamento que vai ser usada. Tenha em atenção que a resistência da ponte é proporcional ao seu comprimento e deve ser minimizado. - Uma vez que os tubos capilares esfriaram, usar um cortador de vidro com ponta de diamante para cortar as "pernas" da ponte de aproximadamente 5 mm.
- Coloque pedaços de fio de platina nos tubos capilares dos três "atual de fornecimento de" pontes para melhorar o desempenho, reduzir a resistência no agar 17. Cortar qualquer fio de platina em excesso, de modo que não há fios expostos no exterior do tubo.
Nota: Devido ao alto custo da platina, recuperar e reutilizar qualquer fio de pontes quebradas. - Empurre o fio de platina mais para o tubo capilar com uma ponta fina implementar como uma micropipeta tip, de modo que o fio é de 1 mm mais curto do que o vidro em ambas as extremidades do tubo capilar.
- Adicione 100 ml de 1 M NMDG tamponadas com 1,2 g de HEPES. Usar um medidor de pH e adicionar MES hidrato de pó até um pH de 7,4 é atingida (~ 10 g). Uma vez que um pH de 7,4 foi atingido, remover o eléctrodo de pH. Separe 40 ml da solução para se manter como uma solução de armazenamento.
- Adicionar agar granulado para produzir uma mistura de 2-3% de agar. Mexa e calor até que a solução agar é dissolvido e clara. Não sobreaquecer ou ferver a solução uma vez que irá tornar-se excessivamente viscoso e enchendo as pontes vai ser difícil.
- Mova a solução agar para um novo recipiente e adicionar uma pequena barra de agitação. Continuar o aquecimento e a agitação a uma velocidade moderada.
- Adicionar as pontes de capilares, um de cada vez, com as pernas viradas para cima. Ao longo do tempo as pontes irá encher-se com ágar. Alternativamente, enchem as pontes empurrando solução de agar por meio de uma seringa ligada a uma ponta de pipeta pequena.
- Uma vez que não há bolhas no briDGES, recuperar as pontes da solução de ágar e colocar as pontes sobre um papel toalha para secar. Quaisquer pontes com bolhas residuais podem ser agitado com uma pinça para facilitar a bolha de saída.
Nota: ágar Estabelecido com bolhas pode ser completamente removida por imersão das pontes em água a ferver. Uma vez que o agar é removido, utilizar uma linha de vácuo para remover a água residual. As pontes podem então ser reutilizados para tratamento de agar. - Remover o excesso de ágar a partir das pontes quando secos. Adicionar 60 ml de água à solução de reserva de 40 ml e colocar as pontes na solução de armazenamento.
4. Rig Preparação Cut-aberto
- Ligue a fonte de água para o controlador de temperatura e, em seguida, o interruptor de alimentação para o controlador de temperatura. Aguardar até que a temperatura do banho atingir a temperatura especificada (19 ° C).
- Puxe microeletrodos de borosilicato tubo capilar com um extrator de microeletrodos para uma resistência de 0,2-0,5 mohms.
Nota: A redução pipresistência ette melhora a velocidade de fixação. No entanto, as pipetas de baixa resistência são mais propensos a danificar o oócito. Experimentação é necessário para determinar o melhor valor de resistência pipeta para cada aplicação. - Preparar a solução de saponina através da mistura de 0,125 g de saponina seca com 50 ml de solução interna. Isto vai levar a uma solução de 0,25%. Inverta suavemente para misturar.
- Sob um microscópio de dissecação aplicar uma pequena quantidade de vaselina em torno do bordo do orifício, no lado superior da câmara intermediária e do lado inferior da câmara superior, com um objecto muito de ponta fina.
Nota: O "rosquinha" de vaselina vai ajudar a manter o oócito no lugar em cima do buraco e vai ajudar na formação do selo. No entanto, muita vaselina vai bolhas armadilha e impedir que as soluções de alcançar a superfície do ovócito. - Adicionar solução 3 M KCl nas ranhuras múltiplas prendem pelotas de Ag / AgCl, para que não haja excesso de as ranhuras, mas as pastilhas e as extremidades das pernas da ponte são enseadavermelho. Limpe gotas extras de KCl para evitar ligações elétricas indesejadas entre slots.
- Adicionar solução externa para as câmaras de banho média e baixa.
- Coloque as pontes de ágar nas ranhuras no coletor de pellet AgCl para que uma perna por ponte está em cada slot. A outra perna das pontes mais tarde serão colocados nas respectivas câmaras (P1, P2, CC superior; GS1, GS2 meio (guarda), eu inferior). Certifique-se de que as pontes de fio de platina estão no GS2, P2, e slots de I.
Nota: Certifique-se de pontes são lavadas com água destilada e completamente seco antes de colocar em banho de câmara. - Ligue o sistema de aquisição de dados e do PC. Inicie o software de gravação.
5. Procedimento Cut-aberto
- Instale as câmaras de ovócitos superior e intermediário sem um oócito. Deslize a câmara superior fora do centro de modo que os furos nas duas câmaras não se sobrepõem. Encha com todas as câmaras de solução externa e colocar todos os eléctrodos nas suas respectivas câmaras.
Nota: Não empurre a câmara superior todo o caminho até ao instalar as câmaras. Certifique-se de uma pequena lacuna permanece entre as duas câmaras. A disposição descentrada aumenta a resistência do sistema de câmara para melhor simular a presença de uma célula. Esse processo, chamado de "equilibrar as pontes", compensa os potenciais de compensação que podem surgir a partir de heterogeneidade entre as pontes de ágar.- Desligue o comando externo e os dois grampos. Verifique a leitura atual no amplificador. Ajuste com uma pequena chave de fenda o P compensado na parte de trás da cabeça em estágio banheira / guarda corrente zero.
- Coloque o interruptor de banho / guarda no amplificador para ativo e ajustar as GS compensados obter corrente zero.
- Repita entre "ativa" e "passiva", até que ambos são razoavelmente perto de zero (<100 nA).
- Retire a câmara superior e transferir um ovócito para a câmara de banho meio usando uma bomba de pipeta. Verifique se o oocyte é posicionada sobre o buraco no centro do banho.
Nota: Quando se prepara um óvulo para VCF, coloque o celular rotulados para a câmara com o pólo de animais (lado mais obscuro) voltado para cima. Orientação celular não importa se VCF não está sendo realizada. - Remover o excesso de solução externa a partir do banho de baixo usando um aspirador para criar uma vedação entre o oócito e a superfície do banho.
- Coloque a câmara de banho de topo sobre o oócito de modo que o orifício da câmara está centrada em cima do oócito. Usando o polegar e o dedo médio, aplica-se lentamente a pressão para baixo na câmara até que é pressionado firmemente contra o oócito de modo a expor apenas uma pequena parte da membrana para o banho através do furo superior.
Nota: O oócito pode inchar sob a pressão da câmara de topo. Não aplique força excessiva na câmara superior, pois isso fará com que o ovócito à ruptura. Pinça pontas colocadas em cantos diagonais da câmara superior pode ser utilizado como uma alternativa para os dedos para applpressão descendente y. - Adicionar solução externa para os banhos superior e inferior até que eles são quase completa.
- Coloque as pernas livres das pontes de agar na solução externa de cada banho, como visto na Figura 2 (a colocação da ponte). Certifique-se de que cada ponte está descansando em seu local de banho correta. (I ponte em banho de baixo, GS1 e GS2 pontes em banho de meio, e P1, P2 e pontes CC em banho superior). Coloque o interruptor de banho / guarda no amplificador para ativo.
Nota: Certifique-se de que não há conexões 3 M KCl entre as pontes, os poços, e as câmaras de gravação. Além disso, certifique-se de pontes são formados de modo que eles são levantados acima das soluções da câmara de gravação.
Figura 2. Locais Agar Ponte Setup Localização Diagram. Colocação das extremidades livres das pontes de ágarnos vários banhos. Clique aqui para ver a imagem ampliada . - Iniciar um protocolo de teste do software de gravação. Se o pulso mostra o deslocamento vertical da secção horizontal entre os dois picos, ao aplicar um pulso 100 mV, que é superior a 100 nA (correspondente a 0,3 mohms com o banho / guarda em passiva), em seguida, aumentar a estanqueidade da tampa do banho. Ver Figura 3 para um exemplo de um pulso de teste ideal.
Nota: O protocolo de ensaio emite um impulso de tensão, para ver se a tampa do banho é apertado o suficiente e todos os componentes foram montados correctamente. Em alternativa, a função de teste do amplificador podem ser utilizadas.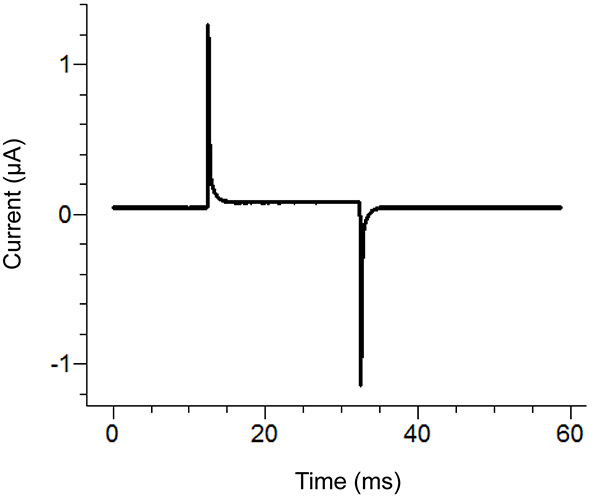
Figura 3. Pulso de teste ideal do software de gravação. O pulso de testedeve ser semelhante ao pulso acima, dependendo do protocolo aplicado. A corrente de retenção (centro de referência) deve ser próximo de zero. Clique aqui para ver a imagem ampliada . - Remover a solução externa no banho inferior e substituí com solução saponina. Tenha cuidado para evitar a criação de bolhas ao adicionar a saponina. Para assegurar a substituição máximo, aplicar sucção na extremidade oposta do banho de fundo, enquanto a adição da solução.
- Depois foi adicionada a solução de saponina, observar o pulso de teste de repetição. Se o pico do protocolo de teste reduz ou desaparece, então este é um sinal de que existe uma bolha localizado abaixo do oócito. Neste caso, remova completamente a solução de saponina e, em seguida, substituí-lo.
Nota: A permeabilização é normalmente completa dentro de 30 segundos com uma solução de saponina fresco. As soluções podem ter dificuldade em atingir a célula se há bolhas presasou, se a camada folicular permanece num oócito mal digeridos. O oócito foi permeabilizadas (aberto) quando o declive do pico de tensão diminui (aumento constante de tempo de decaimento).
Figura 4. Pulso Teste Traços Durante Oocyte Permeabilização. Traços selecionados do protocolo de pulso de teste depois de uma solução de saponina 0,25% foi introduzida na câmara de oócitos de fundo. O aumento da constante de tempo de decaimento visto nos traços demonstra um aumento de permeabilização oócito. Clique aqui para ver a imagem ampliada . - Uma vez que a célula é permeabilizada, remover a solução de saponina e encher o banho com uma solução interna. Pare o protocolo do teste.
Nota: Embora saponina permite o acesso aointerior da célula por permeabilização da membrana, o equilíbrio das concentrações de iões entre o banho inferior e do citoplasma do oócito por difusão é um processo muito lento. Este processo pode exigir dezenas de minutos, dependendo das condições (Figura 5). - Verifique se há níveis elevados de solução nos banhos e cristalizada KCl entre os poços do colector como estes podem causar curto-circuitos e comportamento errático.
- Usar a seringa modificada para injectar 3 M KCl numa microeléctrodo. Flick o microeletrodos várias vezes com um dedo enquanto se preparando com os outros dedos.
Nota: Esta etapa é necessária para remover quaisquer bolhas de ar dentro do microeletrodos. - Monte o eletrodo KCl-cheia no braço micromanipulador inserindo o filamento fio no final de microeletrodos aberto. Empurre o fim do microeletrodos no suporte do filamento e certifique-se o eletrodo não está solto. Aperte o fecho do eletrodo.
Nota: Make se de que o fio tem um revestimento AgCl mesmo para o eletrodo a funcionar normalmente. - Balance o braço para a posição sobre os banhos de ovócitos e aperte as braçadeiras para evitar mais movimento do braço.
- Usando os botões do manipulador, a pé o eletrodo para dentro do banho. Certifique-se de que nenhum pulso de teste é aplicada e que o recurso de teste de membrana não é ativado neste momento.
Nota: antes de a ponta do eléctrodo é inserido dentro do líquido, V1-V2 no fixador de tensão irá ler uma tensão positiva. Uma vez que a ponta do eléctrodo é inserido dentro do líquido, o medidor de tensão sobre o fixador de tensão deve mudar para um valor próximo de zero. Para gravações VCF, o eletrodo deve abordar o celular em um ângulo bastante rasa para deixar espaço para o objetivo. Empalar a célula com o eletrodo fora do centro, mais perto da borda do isolado remendo de membrana também ajuda a evitar a colisão do objetivo com o eletrodo. - Pare de andar o eletrodo para baixo. Definir o deslocamento do eletrodopotencial de zero pressionando o botão V1 e reduzindo, em seguida, a tensão V1 a zero, ajustando o deslocamento V1. Além disso, realizar o mesmo ajuste para V2. A diferença de potencial V1-V2 deve ler 000 mV.
- Volte para V1 e virar Z-teste para medir a resistência do eletrodo. O valor vai cair gradualmente e se aproximar da resistência real. Apontar para um valor de resistência de 0,2-0,5 mohms.
- Continue caminhando o eletrodo em direção ao remendo visível do ovócito no top banho. Uma vez que o microeletrodo é muito perto do oócito, assistir a leitura V1-V2 para ver quando o eletrodo entra no oócito, a tensão V1-V2 passará a ser negativa quando o microeletrodos entra na célula.
Nota: O valor indicado neste momento é o potencial de membrana da célula e podem ser afectados pelos canais expressas e as soluções utilizadas. Inserindo o microeletrodos demais pode danificar a membrana celular. - Abra o protocolo de coleta de dados nosoftware de gravação.
- Virar o interruptor de braçadeira na braçadeira de tensão e ajustar o potencial para combinar com o comando (por exemplo, -100 mV), ajustando o botão localizado sobre o "eu" headstage.
- Virar o interruptor de capacitância e compensação de resistência.
- Virar o "Teste" ligar no "Comandos" região da braçadeira de tensão. Use o osciloscópio para visualizar o sinal. Ajuste os botões de compensação Cm no segmento de sinal condicionado para reduzir os transitórios capacitivas no osciloscópio. Não excesso de compensar os picos para o ponto em que ocorrem os picos inversos complementares ou os picos de começar a desenvolver uma curvatura sigmoidal, que pode introduzir artefacto na gravação.
- Uma vez que a capacidade foi reduzida manualmente para um nível satisfatório, desligue o interruptor de teste.
- Começar o protocolo de registro de dados no software de gravação.
6. Limpeza
- Quando as gravações de abelhan concluída, desligue todos os vários parâmetros sobre a braçadeira de tensão, incluindo o grampo e banheira / interruptores de guarda.
- Use uma pinça para remover as pontes de agar a partir dos vários banhos.
- Retire o topo banho e aspirar todas as soluções e ovócito de todos os banhos.
- Use uma garrafa de água deionizada para lavar todos os banhos e, em seguida, aspirar os banhos com um vácuo. Repita este passo 3-5x.
- Wipe cristalizado KCl as pontes e colocar as pontes na solução de armazenamento. Pontes podem ser reutilizados por muitas semanas, desde que eles sejam devidamente armazenados.
- Aspirar a solução de KCl dos poços múltiplos e lavar o colector com água deionizada várias vezes.
- Desligue todos os equipamentos diversos, incluindo o controle de temperatura e do software de gravação.
7. A adição de tensão da braçadeira Fluorometria
- Siga os passos na secção de 1 a 6 em um protocolo JOVE publicado anteriormente 16 Examining o conformacional Dynamics de Proteínas de Membrana in situ com o Site dirigido Fluorescência Labeling: Clique aqui para ver a página.
- Execute as etapas na Seção 4 a 5.22 do protocolo COVG mencionado acima usando um microscópio VCF fixado em 4X foco.
Nota: gravações VCF exigem câmaras de banho oócito maiores do que o exigido nas medições COVG. (As dimensões das câmaras VCF personalizados estão localizados na lista de materiais.) Esta câmara FCR maior deve ser capaz de acomodar simultaneamente a lente objectiva, microeléctrodo, e as pontes de agar. Além disso, o pólo de animais (lado escuro do ovócito) precisa ser virada para cima na câmara para baixo fundo gravações VCF. - Traga a porção superior do oócito em foco usando uma objectiva de 40x de imersão em água.
Nota: alternar do 4X ao objectivo 40X exige uma ge específicoometry de componentes de corte-aberto e muita atenção para não bater no eletrodo, pontes, ou câmaras quando baixar a objetiva de 40X. Além disso, devido ao aumento do volume no topo da guarda, garantir que o volume de banho a partir do topo da guarda não está conectado com a guarda do meio quando a objetiva de 40X é fixado no local. - Concentre-se um anel em torno do perímetro da superfície de oócito exposto, de modo a que o topo do oócito é ligeiramente acima do plano de foco.
Nota: Ajuste no plano xy pode ser necessário de modo que o campo de visão é mais cheio com membrana e não da câmara. Tradução XY é mais facilmente realizado através da colocação do microscópio sobre uma fase de tradução. - Mova o cubo filtro no caminho óptico e mudar o caminho da luz da lente para o detector (diodo).
- Ligue a fonte de luz FCR.
- Desligue as luzes do teto, o iluminador de luz de fibra, e outras fontes de luz.
Nota: O ideal é que VCFgravações devem ser realizadas em uma sala completamente escura. - Executar um protocolo de fluorescência no software de gravação.
Resultados
A Figura 4 mostra a variação na permeabilidade do oócito como uma solução de saponina é aplicada à parte inferior do oócito. Figura 5 mostra a taxa de troca da solução intracelular por difusão seguinte permeabilização saponina. 20-40 min são necessárias para chegar a um estado de equilíbrio 2,18.
A Figura 6A mostra vestígios gerados a partir do protocolo de gravação. A figura mostra as correntes iónicas (após subtracção P/-8 vazamento), em resposta ao protocolo de voltagem (inset). Cada traço na figura representa uma tensão aplicada diferente. Os traços com mais lentos cinética representam os menores potenciais em que o canal de sódio pode abrir. Tipicamente, usando os métodos tradicionais, é difícil manter o controlo de voltagem para estas potenciais mais baixos, porque a corrente interna despolariza a membrana. Esta despolarização por sua vez ativa mais canais criando um loop de feedback positivo . A velocidade de fixação melhorada da técnica de corte-aberto permite o controle de tensão necessária para a gravação do canal, mesmo a esses potenciais difíceis.
A Figura 6B mostra a curva de corrente / tensão, o qual foi gerado a partir de vestígios na Figura 6A. Sem o controle de tensão observado acima, a corrente de pico nas primeiras potenciais (~ -60 mV) seria sobre-estimado. Isso impediria descrição precisa da relação corrente-tensão.
A Figura 7 mostra um exemplo dos resultados de fluorometria grampo de voltagem para um ovócito. Os sinais de fluorescência foram registados a partir de um ovócito marcado com MTS-TAMRA a uma cisteína inserido na posição 805 no domínio DII do canal de sódio cardíaco humano Na V 1.5.
"width =" _upload/51040/51040fig5.jpg 500px "/>
Figura 5. Cinética de citoplasmática Na + Concentração mudança por difusão. A taxa de equilíbrio solução interna foi avaliada através da aplicação de 90 mM de Na + para ambos os lados interno e externo da célula e, em seguida, medir o potencial de inversão de Na + através da gravação de relações IV a cada 2 min. Se o meio interno foram perfeitamente substituídos, E rev seria 0 mV. Medições de tempo foram iniciados quando saponina permeabilizadas a membrana do oócito. Clique aqui para ver a imagem ampliada .
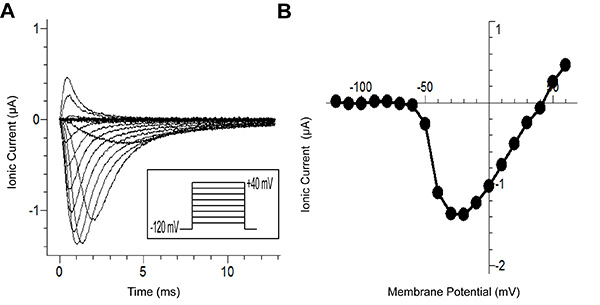
Figura 6. Tipo Selvagem Na v 1.5Os resultados dos canais de sódio de Cut-Open de tensão de aperto. (A) Traços de gravado atual de diferentes tensões de estímulos a partir de um potencial de realização de -80 mV até -120 mV para 100 ms, o pulso de teste (-120 mV a +40 mV em incrementos de 10 mV) para 200 milissegundos e, finalmente, a repolarização -120 mV. (B) A curva IV, que representa a tensão de dependência do pico de corrente no painel A. Aqui, a corrente de pico para pulsos até 60 mV é mostrada. Clique aqui para ver a imagem ampliada .

Figura 7. Na v 1.5 Sódio canal de tensão da braçadeira Fluorometria Recordings. (A) Ionic correntes registradas a partir de um óvulorotulado com MTS-TAMRA a uma cisteína inserido na posição 805 no domínio DII-S4 do canal de sódio cardíaco humano Na V 1.5. Impulsos de tensão que vão desde -170 mV a 70 mV foram aplicadas em intervalos de 20 mV para uma duração de 20 ms depois de uma pré-pulso de -120 mV. (B) Os sinais de fluorescência associados. Cada outro traço de fluorescência é omitida para maior clareza. Af / F representa a mudança relativa da intensidade de fluorescência induzida pelo pulso de voltagem. Clique aqui para ver a imagem ampliada .
Discussão
A vaselina oócito tensão lacuna técnica braçadeira cut-aberto permite a resolução rápida de dados, baixo ruído, maior controle sobre a solução interna e composição da solução externa e gravações estáveis através de protocolos relativamente longos 19. Estas vantagens definir esta técnica além de o grampo de voltagem de dois eléctrodos padrão e técnicas de fixação de membranas. Apesar de equipamento especializado é necessária e que o protocolo é relativamente difícil, muito poucos problemas ocorrem quando o sistema foi otimizado. Isto permite uma gravação reprodutíveis de sódio (HNA V 1.5) e outros canais de activação rápida.
Os passos mais críticos no protocolo são a colocação da câmara superior no oócito eo empalamento com o eletrodo V1. O aperto da selagem entre a célula e os bordos dos orifícios da câmara tem um grande impacto sobre a qualidade da gravação. A câmara de topo deve ser empurrado para baixo no celular para atingir o mais alto possível resistência sem danificar o óvulo. Isso será necessário fazer o bojo do oócito e achatar, mas a experiência ea consideração da qualidade de célula é necessário para determinar a pressão ideal para evitar a ruptura. Gravação rápida requer a utilização da maior abertura da pipeta possível que pode ser utilizado de forma consistente, sem danificar as células. Especial atenção deve ser dada para o cone da pipeta, que deve ser rasa o suficiente para não expandir significativamente a ferida como a ponta da pipeta está inserido. Impalement deve ser feita devagar e com cuidado, imediatamente parar o avanço do eléctrodo, quando do aparecimento do potencial de membrana de leitura.
Danos à membrana do ovócito e menos de selos perfeitos oócito / Câmara pode levar a altas correntes de fuga. Altas correntes de fuga sempre deteriorar a qualidade das gravações. Assim, as gravações devem ter sempre as correntes de fuga baixas (de preferência <150-200 NA). Circuito de compensação do amplificador, o uso de P / N em linha vazamento-coprocedimentos rrection, ou off-line pode compensar atual vazamento.
Solução de problemas deve começar por duplo controlo que todos os componentes estejam conectados corretamente ou ajustados, que geralmente resolve a maioria dos problemas. Durante a preparação ea própria experiência, especial atenção deve ser dada a todos os níveis de fluidos derramados ou transbordando e cristalizada KCl como estes podem conectar eletricamente compartimentos que se destinam a ser isolado. Se o sistema se comporta de forma inesperada, procurar ligações em falta ou indesejados entre pontes e câmaras. As bolhas de ar dentro das pontes de agar, nas extremidades das pontes agar, ou preso por baixo da célula, também pode causar problemas de conectividade que são difíceis de detectar.
As modificações, tal como descrito acima, são necessárias para executar fluorometria fixador de tensão (VCF) juntamente com COVG. A modificação principal envolve o uso de um design banho alterada. A fim de acomodar a utilização de uma objectiva de 40x de imersão em águano microscópio, o banho câmara superior deve ser maior do que seria necessário para uma configuração de corte de padrão aberto. Outros aspectos e necessidades de equipamentos de gravação de VCF no modo COVG são semelhantes a gravação VCF em dois eletrodos modo de tensão-clamp 14. Conforme salientado anteriormente, a principal vantagem da técnica COVG é o controle de tensão muito mais rápido e preciso em relação ao TEVC num emplastro de membrana que expressa tanto mais canais de iões que podem ser atingidas em sistemas de expressão de células de mamíferos. Assim, a técnica é ideal para a FCR e gating estudos actuais, onde tanto alta resolução temporal e os números de canal elevadas são necessárias para sinais detectáveis.
Embora, em princípio, as trocas de soluções tanto extra e intracelulares são possíveis, a sua integridade e velocidade da troca definir algumas limitações em certos tipos de experimentos. Como mostrado na Figura 5, a taxa de equilíbrio de concentrações iónicas entre o citoplasma e o cham menorber é bastante lento seguinte saponina permeabilização. Mudando concentrações iônicas deve, portanto, ser considerados durante longos experimentos antes da célula que chegam a um estado estacionário. As taxas de câmbio pode variar em grande medida, dependendo das condições. Expressão alta do canal, grande força motriz, e maior resultado temperatura em taxas mais rápidas. Na nossa experiência, a célula foi arrefecida a 19 ° C, a expressão do canal era moderada, e a carga líquida conduzido pelos protocolos de IV foi mínima, devido à direcção da corrente mudando. Nesses ambientes a técnica COVG normal é inferior a várias configurações de patch-clamp. Para aplicações que requerem COVG substituição rápida do meio citoplasmático pode ser utilizada uma cânula de perfusão. No futuro, câmaras COVG projetados com portas internas de perfusão pode permitir um melhor controle sobre as características taxas de soluções extracelulares.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Todos os membros da Universidade de Washington em St. Louis Cardiac Molecular Laboratório de Engenharia. A Burroughs Bem-vindo Fundo Prémio Carreira na Interface Científica - 1010299 (para JS).
Materiais
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Referências
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , Wiley-VCH. (2006).
- Susan, G. A. Methods in enzymology. 296, Academic Press. 566-578 (1998).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Techniques for Chloriding Silver Wires. , Available from: http://www.warneronline.com/pdf/whitepapers/chloriding_wire.pdf (1999).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R. Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. Roberts, G. , Springer-Verlag Berlin Heidelberg. New York. (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados