Method Article
Il
In questo articolo
Riepilogo
L'approccio gap vaselina cut-aperto viene utilizzato per ottenere bassi registrazioni sonore di correnti ioniche e gating di canali ionici voltaggio-dipendenti espressi in oociti di Xenopus con alta risoluzione di canale cinetiche veloci. Con piccola modifica, morsetto di tensione fluorometria può essere accoppiato al protocollo ovocita cut-open.
Abstract
L'ovocita vaselina gap cut-open (COVG) clamp di tensione permette l'analisi delle proprietà elettrofisiologiche e cinetiche dei canali ionici eterologa in oociti. Registrazioni dalla configurazione cut-open sono particolarmente utili per risolvere basse correnti di magnitudo gating, rapida attivazione corrente ionica e disattivazione. I principali vantaggi rispetto al morsetto di tensione a due elettrodi (TEVC) tecnica includono maggiore velocità morsetto, miglior rapporto segnale-rumore, e la capacità di modulare la intracellulare ed extracellulare.
Qui, impieghiamo canale del sodio cardiaco umano (HNA 1,5 V), espresso in oociti di Xenopus, per dimostrare la configurazione e protocollo cut-open nonché modifiche necessarie per aggiungere capacità fluorometria morsetto di tensione.
Le proprietà dei canali ionici veloci attivanti, come HNA 1,5 V, non possono essere completamente risolti a temperatura ambiente usando TEVC, in which la totalità della membrana dell'oocita è serrato, rendendo difficile il controllo della tensione. Tuttavia, nella tecnica cut-aperto, separazione di solo una piccola porzione della membrana cellulare consente il bloccaggio rapido necessaria per registrare accuratamente cinetica veloce evitando canale run-down associato a tecniche di patch clamp.
In concomitanza con la tecnica COVG, cinetica del canale ionico e proprietà elettrofisiologiche possono essere ulteriormente analizzati mediante morsetto fluorometria tensione, in cui il movimento proteina viene monitorato tramite cisteina coniugazione di fluorofori applicate extracellulare, inserimento di proteine fluorescenti geneticamente codificati, o l'incorporazione di amminoacidi non naturali nella regione di interesse 1. Questi dati aggiuntivi produce informazioni cinetiche su voltaggio-dipendenti riarrangiamenti conformazionali della proteina attraverso cambiamenti nel microambiente circostante la molecola fluorescente.
Introduzione
Tecniche tensione di serraggio specializzati permettono la registrazione di correnti ioniche a potenziali di membrana controllate. Ampiamente usato voltage clamp a due elettrodi (TEVC) e tecniche di patch clamp forniscono informazioni elettrofisiologiche attendibili sulle proprietà di molti canali ionici. Tuttavia, entrambi questi metodi hanno inconvenienti che impediscono l'acquisizione di dati affidabili per i canali del sodio voltaggio-dipendenti veloci e altri canali attivanti veloce nelle membrane come quelle di ovociti di Xenopus. I laboratori Bezanilla e Stefani quindi sviluppato la tecnica del clamp di tensione gap vaselina cut-open (COVG) per ovociti 2. La tecnica è stata ampiamente applicata per registrare, Na +, K + e Ca 2 + canali 3-8.
Durante la registrazione COVG, una membrana dell'oocita-proteina eterologa esprimere è diviso in tre regioni. I dati corrente ionica viene registrata dalla regione superiore del ovocita comebagno circonda la regione superiore è fissata ad un potenziale di comando, che può essere cambiata facilmente e rapidamente. Le guardie regione del Medio contro le correnti di dispersione di essere bloccato allo stesso potenziale come la regione top 9. La regione inferiore è dove apertura ovocita (cut-open) avviene mediante l'utilizzo di una soluzione di saponina o una cannula. Chimica o apertura manuale della membrana nella regione inferiore permette il controllo del potenziale interno, che viene fissato al terreno, e rende l'interno della cellula contigua con la soluzione camera inferiore. Perfusione di soluzioni nella camera inferiore può regolare le proprietà dell'ambiente interno, mentre lo scambio di soluzione nella camera superiore altera l'ambiente esterno. 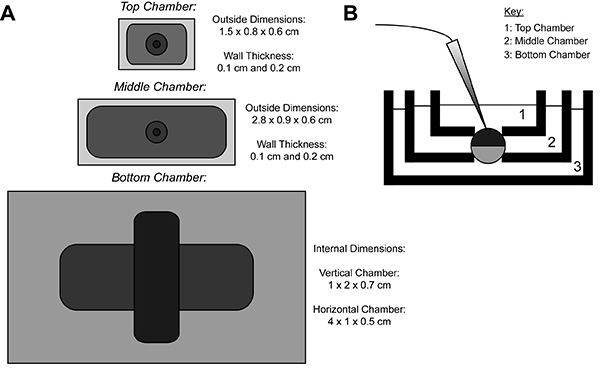
Figura 1. Ovociti Cut-Open Voltage-Clamp Bath Diagramma di installazione. (A) Topdown vista di tre bagni separati l'uno dall'altro. Le dimensioni delle camere per COVG vengono visualizzati sulla figura. (B) Vista laterale della configurazione bagni in posizione di prova. Clicca qui per vedere l'immagine ingrandita .
I vantaggi della tecnica COVG includono basso rumore corrente (1 nA a 3 kHz), il controllo della composizione ionica del supporto esterno, la capacità di modulare il supporto interno, risoluzione temporale veloce (20-100 costante msec tempo di decadimento della capacità transitorio), e le registrazioni stabili per diverse ore 9. Gli svantaggi sono che richiede attrezzature specializzate ed è più difficile da eseguire rispetto a due serraggio tensione elettrodo (TEVC) 10.
Mentre l'approccio COVG richiede attrezzature altamente specializzate e elementi procedurali complessi, può consentire l'acquisizione di Valudati elettrofisiologici grado. Questi dati, come gating correnti con cinetica veloce e correnti di coda 4, può essere registrata senza alcuni dei problemi associati con altri protocolli tensione di chiusura comprese canale run-down. Piccole modifiche alla configurazione COVG possono consentire l'uso di regolatori di temperatura e morsetto di tensione fluorometria (VCF). L'inclusione di tensione morsetto elementi fluorometria all'interno dell'assembly COVG può aumentare output di dati conferendo la possibilità di monitorare cambiamenti conformazionali proteiche e contemporaneamente la registrazione corrente 11-13.
Protocollo
1. Setup Equipaggiamento iniziale
- Posizionare il palco e il manipolatore microelettrodo su un sistema di vibrazione-isolamento (ad esempio una tabella d'aria) con una gabbia di Faraday circostante per evitare disturbi elettrici e meccanici.
- Saldare sei pellets Ag / AgCl a lunghezze sei pollici di 24 AWG. Per una di queste lunghezze (da collegare P1), splice in un secondo filo per formare una "Y". Alle estremità di ogni filo saldare un oro BNC perno, che è incluso con l'amplificatore.
- Collegare le cinque palline Ag / AgCl saldati al 24 AWG alla headstage Bagno / Guardia (P1, P2, CC, GS1 e GS2). Collegare la "I" Ag / AgCl pellet alla "I" headstage e il secondo filo venuta fuori P1 al headstage V2.
- Collegare l'amplificatore all'unità di acquisizione dati secondo le istruzioni nei manuali delle attrezzature.
- Posizionare ed epossidici i termistori regolatore di temperatura. Infilare il termistore blocco attraverso un buco nel ponteggio metallicod direttamente sopra il centro dell'elemento di riscaldamento / raffreddamento. Posizionare e resina epossidica del termistore bagno in un foro praticato nel corpo della camera inferiore temperatura conduce molto vicino ma non contattando la soluzione.
2. Ovociti e preparazione preliminare
- Per registrare un canale eterologamente espressa come HNA V 1.5, sintetizzare mRNA (derivato da hSCN5a) e iniettare in un oocita di Xenopus circa 4-5 giorni prima di eseguire il protocollo 4. Per hSCN5a, espressione di picco si ottiene dopo incubazione per 4-5 giorni a 19 ° C. Fare riferimento a Richards e Dempski 14 e Cohen et al. 15 per le istruzioni dettagliate su dell'ovocita, la preparazione mRNA, e l'iniezione degli ovociti.
- Chloride il filo AgCl e pellets AgCl prima di iniziare protocollo 4. A tale scopo, posizionare una estremità del filo e il pellet in candeggina per almeno 20 min e finché O / N. Una volta che i pellet sono stati cloruroed, li apporre al collettore con adesivo.
Nota: corrente di pilotaggio attraverso i fili può essere utilizzato anche per cloruro di filo e pellet. Questa tecnica aumenterà la velocità di chloridation ma anche richiedere ulteriori apparecchiature. Vedere Tecniche di Chloriding Fili d'argento per ulteriori istruzioni 16.
3. Agar Ponte Preparazione
- Fare almeno sei ponti agar riscaldando una estremità di un tubo capillare borosilicato a fiamma media. Assicurarsi che l'estremità del tubo capillare è nella parte superiore della fiamma blu. Fai ponti supplementari in caso di danni agli originali.
- Una volta che il tubo capillare è riscaldato, utilizzare pinze per fare un angolo di piegatura a 90 ° nel tubo. Obiettivo per una curva con una curvatura liscia piuttosto che un angolo brusco o può ridurre significativamente il diametro interno del bicchiere, che rende più difficile il riempimento e aumenta la resistenza del ponte.
- Effettuare una seconda curva a 90 °nella stessa direzione 25 millimetri verso il capillare dalla prima curva utilizzando la stessa procedura.
Nota: La lunghezza esatta del ponte non importa finché la dimensione ponte è coerente, ma alla fine le lunghezze dovrebbe essere adatto per l'impianto saranno utilizzati su. Tenete a mente che la resistenza ponte è proporzionale alla sua lunghezza e deve essere ridotto al minimo. - Una volta che i capillari si sono raffreddati, utilizzare un tagliatore di vetro diamantato per tagliare le "gambe" del ponte di circa 5 mm.
- Inserire lunghezze di filo di platino nei tubi capillari dei tre ponti "corrente forniscono" per migliorare le prestazioni riducendo la resistenza nel agar 17. Tagliare il filo di platino in eccesso in modo che non vi sia filo esposto all'esterno del tubo.
Nota: a causa del costo elevato del platino, recuperare e riutilizzare qualsiasi filo da ponti rotti. - Spingere il filo di platino ulteriormente nel tubo capillare con una punta fine attuare come una micropipetta tip in modo che il filo è di 1 mm più corto del vetro su entrambe le estremità del tubo capillare.
- Rendere 100 ml di 1 M NMDG tamponato con 1,2 g di HEPES. Utilizzare un pH-metro e aggiungere MES idrato in polvere fino ad ottenere un pH di 7,4 (~ 10 g). Una volta che è stato raggiunto un pH di 7,4, rimuovere l'elettrodo pH. Mettere da parte 40 ml della soluzione di mantenere come soluzione di archiviazione.
- Aggiungere agar granulato per produrre una miscela agar 2-3%. Mescolare e calore finché la soluzione agar è sciolta e chiara. Non surriscaldare o far bollire la soluzione, visto che sarebbe troppo viscoso e riempiendo i ponti saranno difficili.
- Spostare la soluzione di agar per un nuovo bicchiere e aggiungere una piccola ancoretta. Continuare a riscaldare e mescolare a velocità moderata.
- Aggiungere i ponti capillari uno alla volta con le gambe rivolte verso l'alto. Nel corso del tempo i ponti si riempiranno di agar. In alternativa, riempire i ponti spingendo soluzione agar attraverso una siringa collegata ad un piccolo puntale.
- Una volta che non vi siano bolle nella briDGE, recuperare i ponti dalla soluzione agar e posizionare i ponti su un tovagliolo di carta per asciugarsi. Tutti i ponti con le bolle residue possono essere agitati con una pinza per facilitare l'uscita della bolla.
Nota: agar Fondata con le bolle può essere completamente rimosso immergendo i ponti in acqua bollente. Una volta che l'agar viene rimosso, utilizzare una linea di vuoto per rimuovere l'acqua residua. Ponti possono quindi essere riutilizzate per il trattamento agar. - Rimuovere l'eccesso agar dai ponti quando asciutti. Aggiungere 60 ml di acqua alla soluzione di riserva 40 ml e posizionare i ponti nella soluzione di conservazione.
4. Cut-open Rig Preparazione
- Accendere la fonte d'acqua per il regolatore di temperatura e quindi l'interruttore di alimentazione al regolatore di temperatura. Attendere che la temperatura del bagno raggiunge la temperatura indicata (19 ° C).
- Tirare microelettrodi dal tubo capillare borosilicato con un estrattore microelettrodo ad una resistenza di 0.2-0.5 mW.
Nota: Abbassamento pipresistenza ette migliora la velocità di bloccaggio. Tuttavia, pipette di resistenza più bassi sono più propensi a danneggiare l'ovocita. La sperimentazione è necessaria per determinare il miglior valore di resistenza pipetta per ogni applicazione. - Preparare la soluzione saponina mescolando 0,125 g di saponina secco con 50 ml di soluzione interna. Questo porterà a una soluzione 0,25%. Capovolgere delicatamente per mescolare.
- Sotto un microscopio da dissezione applicare una piccola quantità di vaselina intorno al bordo del foro sul lato superiore della camera centrale e il lato inferiore della camera superiore con un oggetto molto a punta fine.
Nota: la "ciambella" di vaselina contribuirà a mantenere l'ovocita in posizione sul foro e sarà di aiuto nella formazione del sigillo. Tuttavia, troppo vaselina sarà intrappolare bolle e prevenire le soluzioni di raggiungere la superficie ovocita. - Aggiungere 3 M KCl soluzione nelle fessure molteplici tengono pellets Ag / AgCl in modo che non ci sia troppo pieno dalle fessure ma i pellets e ponte estremità delle gambe sono coverosso. Pulire gocce supplementari KCl per impedire le connessioni elettriche indesiderate tra le fessure.
- Aggiungi soluzione esterna alle camere bagno medio-bassi.
- Posizionare i ponti agar nelle fessure nel collettore pellet AgCl in modo che una gamba per ogni ponte è in ogni slot. L'altra gamba dei ponti sarà poi inserito nelle rispettive camere (P1, P2, top CC, GS1, GS2 centrale (guardia), io in basso). Assicurarsi che i ponti filo di platino sono nel GS2, P2, e io gli slot.
Nota: Assicurarsi che i ponti vengono lavati con acqua distillata e completamente asciutta prima di inserirli nel bagno della camera. - Accendere il sistema di acquisizione dati e il PC. Avviare il software di registrazione.
5. Cut-Procedura aperta
- Installare le camere di ovociti superiore e di mezzo senza un ovocita. Far scorrere la camera superiore fuori centro in modo che i fori nelle due camere non si sovrappongano. Riempire tutte le camere con soluzione esterna e posizionare tutti gli elettrodi nelle loro rispettive camere.
Nota: non forzare la camera superiore fino in fondo durante l'installazione nelle camere. Assicurarsi che un piccolo divario resta tra le due camere. La disposizione fuori centro aumenta la resistenza del sistema camerale meglio simulare la presenza di una cellula. Questo processo, chiamato "equilibra i ponti", compensa le potenzialità di offset che possono derivare da disomogeneità tra i ponti agar.- Spegnere il comando esterno ed entrambe le pinze. Controllare la lettura corrente dell'amplificatore. Regolare con un piccolo cacciavite P compensati sul retro del bagno / caschetto fasi di corrente zero.
- Accendere l'interruttore bagno / guardia sul dell'amplificatore attivo e regolare le GS di offset per ottenere corrente zero.
- Ripetere tra "attivo" e "passivo" fino a quando entrambi sono ragionevolmente vicino allo zero (<100 nA).
- Rimuovere la camera superiore e trasferire un ovocita nella camera bagno centrale utilizzando una pompa pipetta. Assicurarsi che il oocyTE è posizionata sopra il foro al centro della vasca.
Nota: Quando si prepara un ovocita per VCF, posizionare la cella etichettata nella camera con il polo animale (lato oscuro) rivolto verso l'alto. L'orientamento delle cellule non importa se non viene eseguita VCF. - Rimuovere soluzione esterna eccesso dalla vasca inferiore utilizzando un aspiratore per creare una tenuta tra l'ovocita e superficie del bagno.
- Posizionare la camera vasca superiore sopra l'ovocita modo che il foro nella camera è centrato sopra l'ovocita. Usando il pollice e il dito medio, lentamente applicare pressione verso il basso sulla camera finché non viene premuto strettamente contro l'ovocita modo da esporre solo una piccola porzione della membrana al bagno superiore attraverso il foro.
Nota: L'ovocita potrebbero piegarsi sotto la pressione dalla camera superiore. Non applicare una forza eccessiva alla camera superiore, ciò causerebbe l'ovocita la rottura. Pinzetta suggerimenti poste agli angoli diagonali della camera superiore possono essere usati come alternativa alle dita di apply pressione verso il basso. - Aggiungere la soluzione esterna ai bagni superiore e inferiore fino quasi pieno.
- Collocare le parti libere dei ponti agar nella soluzione esterna di ogni vasca, come visibile in figura 2 (posizionamento ponte). Assicurarsi che ogni ponte si riposa nella sua posizione corretta bagno. (I ponte a bagno fondo, GS1 e GS2 ponti in bagno mezzo, e P1, P2, ponti e CC in bagno superiore). Accendere l'interruttore bagno / guardia sul amplificatore attivo.
Nota: Assicurarsi che non ci sono 3 connessioni M KCl tra i ponti, i loro pozzi, e le camere di registrazione. Inoltre, assicurarsi che i ponti sono formate in modo che siano sollevate sopra le soluzioni camera di registrazione.
Figura 2. Località Agar Ponte di installazione Posizione Diagramma. Posizionamento delle estremità libere dei ponti agarnei vari bagni. Clicca qui per vedere l'immagine ingrandita . - Avviare un protocollo di test del software di masterizzazione. Se l'impulso mostra spostamento verticale della sezione orizzontale tra i due picchi sulla applicando un impulso di 100 mV che è maggiore di 100 nA (corrispondenti a 0,3 mW con il bagno / guardia passiva) quindi aumentare la tenuta del coperchio vasca. Vedi Figura 3 per un esempio di un impulso di prova ideale.
Nota: Il protocollo di test emette un impulso di tensione per vedere se la copertura bagno è abbastanza stretto e tutti i componenti sono stati montati correttamente. In alternativa, può essere utilizzata la funzione test dell'amplificatore.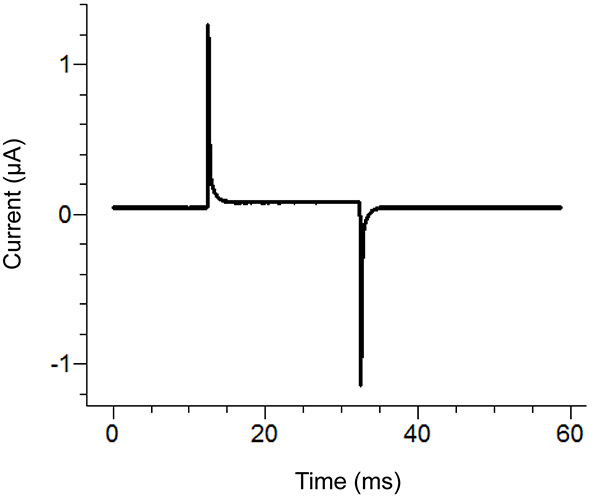
Figura 3. Prova a impulsi ideale dal software di masterizzazione. L'impulso di provadovrebbe essere simile a l'impulso precedente in base al protocollo applicato. La corrente di mantenimento (centro di riferimento) dovrebbe essere vicino allo zero. Clicca qui per vedere l'immagine ingrandita . - Rimuovere la soluzione esterna nella vasca inferiore e sostituirla con una soluzione saponina. Fare attenzione a non creare bolle durante l'aggiunta della saponina. Per garantire la massima rimontaggio, applicare il vuoto sul lato opposto della vasca inferiore, mentre l'aggiunta della soluzione.
- Dopo aver aggiunto la soluzione di saponina, osservare l'impulso di prova ripetuta. Se il picco del protocollo di test riduce o scompare allora questo è un segno che c'è una bolla situato sotto l'ovocita. In questo caso, rimuovere completamente la soluzione di saponina e sostituirlo.
Nota: Permeabilization è in genere completata entro 30 secondi con la soluzione di saponina fresca. Le soluzioni possono avere difficoltà a raggiungere la cella se ci sono bolle intrappolateo se lo strato follicolare rimane su un oocita mal digerito. L'oocita è stato permeabilizzate (aperto) quando la pendenza del picco di tensione diminuisce (aumento della costante di tempo di decadimento).
Figura 4. Pulse Test Tracce Durante ovociti Permeabilization. Tracce selezionate dal protocollo di impulso test dopo una soluzione di saponina 0,25% è stato introdotto nella camera di ovocita fondo. L'aumento della costante di tempo di decadimento visto nelle tracce dimostra un aumento di ovocita permeabilizzazione. Clicca qui per vedere l'immagine ingrandita . - Una volta che la cella è permeabilizzate, rimuovere la soluzione di saponina e riempire la vasca con soluzione interna. Arrestare il protocollo di test.
Nota: Anche se saponina consente l'accesso alinterno della cella permeabile la membrana, equilibrazione delle concentrazioni ioniche tra la vasca inferiore e citoplasma dell'ovocita per diffusione è un processo molto lento. Questo processo può richiedere decine di minuti a seconda delle condizioni (Figura 5). - Verificare la presenza di livelli elevati di soluzione per i bagni e cristallizzato KCl tra i pozzi del collettore in quanto questi possono causare cortocircuiti e comportamento irregolare.
- Usare la siringa modificata per iniettare 3 M KCl in un microelettrodo. Flick la microelettrodo più volte con un dito, mentre rinforzo con le altre dita.
Nota: Questo passaggio è necessario per eliminare eventuali bolle d'aria intrappolate all'interno del microelettrodo. - Montare l'elettrodo KCl pieno sul braccio micromanipolatore inserendo il filamento filo nell'estremità aperta microelettrodo. Inserire l'estremità del microelettrodo nel supporto filamento e assicurarsi che l'elettrodo non è allentata. Serrare il fissaggio dell'elettrodo.
Nota: Make Assicurarsi che il filo ha un rivestimento anche AgCl per l'elettrodo a funzionare normalmente. - Ribaltare il braccio in posizione sopra i bagni ovocita e stringere le fascette per impedire un ulteriore movimento del braccio.
- Usando le manopole manipolatore, a piedi l'elettrodo giù nella vasca da bagno. Assicurarsi che nessun impulso di prova viene applicata e che la funzione di test membrana non è attivato, a questo punto.
Nota: Prima della punta dell'elettrodo è inserita nel liquido, V1-V2 sul morsetto tensione leggerà una tensione positiva. Una volta che la punta dell'elettrodo è inserita nel liquido, il misuratore di tensione sul morsetto di tensione dovrebbe cambiare un valore vicino a zero. Per le registrazioni VCF, l'elettrodo ha bisogno di avvicinarsi alla cella con un angolo abbastanza superficiale per lasciare spazio per l'obiettivo. Impalare la cella con l'elettrodo fuori centro, vicino al bordo della pezza di membrana isolate aiuta anche per evitare la collisione dell'obiettivo con l'elettrodo. - Smettere di camminare l'elettrodo verso il basso. Impostare l'offset dell'elettrodopotenziale a zero premendo il tasto V1 e quindi riducendo la tensione V1 a zero regolando la V1 offset. Inoltre, eseguire la stessa regolazione per V2. La differenza di potenziale V1-V2 dovrebbe leggere 000 mV.
- Tornare alla V1 e girare Z-test per misurare la resistenza degli elettrodi. Il valore gradualmente cadere e avvicinare l'effettiva resistenza. Obiettivo per un valore di resistenza di 0.2-0.5 mW.
- Continua cammina l'elettrodo verso il cerotto visibile dell'ovocita nella vasca superiore. Una volta che il microelettrodo è molto vicino al ovocita, guardare la lettura V1-V2 per vedere quando l'elettrodo entra dell'oocita, la tensione V1-V2 diventa negativo quando il microelettrodo entra nella cellula.
Nota: Il valore mostrato a questo punto è il potenziale di membrana della cellula e verrà influenzata dai canali espressi e le soluzioni utilizzate. Inserimento della microelettrodo troppo danneggia la membrana cellulare. - Aprire il protocollo di raccolta dati nellasoftware di registrazione.
- Capovolgere l'interruttore morsetto sul morsetto di tensione e regolare il potenziale per abbinare il comando (ad esempio -100 mV) regolando la manopola posta sulla "I" headstage.
- Capovolgere l'interruttore capacità e compensazione della resistenza.
- Capovolgere il "Test" accendere nella regione "Comandi" del morsetto tensione. Utilizzare l'oscilloscopio per visualizzare il segnale. Regolare le manopole di compensazione Cm nel segmento del segnale di condizionamento per ridurre i transienti capacitivi sul oscilloscopio. Non più che compensare i picchi al punto in cui ulteriori picchi inversa si verificano o le cime cominciano a sviluppare una curvatura sigmoidale, che può introdurre artefatti nella registrazione.
- Una volta che la capacità è stata ridotta manualmente ad un livello soddisfacente, spegnere l'interruttore di prova.
- Iniziare il protocollo di registrazione dei dati nel software di registrazione.
6. Cleanup
- Quando le registrazioni hanno apen, spegnere tutti i vari interruttori sul morsetto di tensione compreso il morsetto e bagno / interruttori di sicurezza.
- Usare pinze per rimuovere i ponti agar dai vari bagni.
- Rimuovere la vasca superiore e aspirare tutte le soluzioni e ovocita da tutti i bagni.
- Utilizzare una bottiglia di acqua deionizzata per sciacquare tutti i bagni e poi aspirare il bagno con un vuoto. Ripetere questa operazione 3-5x.
- Pulire cristallizzato KCl i ponti e posizionare i ponti nella soluzione di conservazione. Ponti possono essere riutilizzati per molte settimane purché siano correttamente memorizzati.
- Aspirare la soluzione KCl dai pozzetti molteplici e sciacquare il collettore con acqua deionizzata diverse volte.
- Spegnere tutte le varie attrezzature tra cui il controllo della temperatura e il software di registrazione.
7. Aggiunta di tensione morsetto fluorometria
- Seguire i passaggi della Sezione 1 a 6 in un protocollo JoVE già pubblicato 16 Examining la conformazionale dinamica di proteine di membrana in situ con Site-diretto fluorescenza Etichettatura: Clicca qui per visualizzare la pagina.
- Eseguire i passaggi nella sezione 4 grazie 5.22 del protocollo COVG suddetta utilizzando un microscopio VCF fissato a 4X fuoco.
Nota: le registrazioni VCF richiedono grandi camere bagno ovocita di quanto richiesto nelle misure COVG. (Le dimensioni delle camere VCF personalizzati si trovano nella lista dei materiali.) Questa camera di FCR più grande deve essere in grado di accogliere contemporaneamente la lente dell'obiettivo, microelettrodi e ponti agar. Inoltre, il polo animale (lato oscuro della dell'ovocita) deve essere rivolto verso l'alto nella camera di basso fondo registrazioni VCF. - Portare la parte superiore della oocita a fuoco usando un obiettivo 40X immersione in acqua.
Nota: Passare dalla 4X con l'obiettivo 40X richiede una specifica getria di componenti di taglio-open e attenzione in modo da non colpire l'elettrodo, ponti, o camere quando si abbassa l'obiettivo 40X. Inoltre, a causa del maggior volume nella protezione superiore, assicurarsi che il volume bagno dalla protezione superiore non è collegato con la guardia mezzo quando l'obiettivo 40X è impostato in posizione. - Concentrarsi su un anello intorno al perimetro della superficie ovocita esposta, in modo che il vertice della oocita è leggermente al di sopra del piano focale.
Nota: Regolazione nel piano xy può essere necessario in modo che il campo visivo è in gran parte riempito con membrana e non la camera. Traslazione XY è più facilmente realizzabile posizionamento del microscopio su una fase di traduzione. - Spostare il cubo filtro nel percorso ottico e cambiare il percorso della luce dall'oculare al rivelatore (diodo).
- Accendere la sorgente di luce VCF.
- Spegnere le luci generali, alla luce della fibra illuminatore, e altre fonti di luce.
Nota: Idealmente, VCFle registrazioni devono essere effettuate in una stanza completamente buia. - Eseguire un protocollo di fluorescenza del software di masterizzazione.
Risultati
Figura 4 mostra la variazione di permeabilità del ovocita come soluzione saponina viene applicata alla parte inferiore della ovocita. Figura 5 mostra il tasso di conversione soluzione intracellulare per diffusione seguente permeabilizzazione saponina. 20-40 min sono tenuti a venire a uno stato stazionario 2,18.
Figura 6A mostra tracce generate dal protocollo di registrazione. La figura mostra correnti ioniche (dopo P/-8 perdita sottrazione) in risposta al protocollo tensione (riquadro). Ciascuna traccia in figura rappresenta una tensione applicata differente. Le tracce con cinetiche più lente rappresentano le potenzialità minima in cui il canale di sodio può aprire. Tipicamente, con metodi tradizionali, è difficile mantenere il controllo di tensione per questi potenziali inferiori perché la corrente entrante depolarizza la membrana. Questa depolarizzazione a sua volta attiva più canali creando un circolo virtuoso . La velocità morsetto miglioramento della tecnica cut-open consente il controllo tensione richiesta per la registrazione del canale anche a questi potenziali difficili.
Figura 6B mostra la curva di corrente / tensione, generata dalle tracce in Figura 6A. Senza il controllo della tensione osservato in precedenza, la corrente di picco al più presto potenziali (~ -60 mV) sarebbe sopravvalutato. Ciò impedirebbe descrizione accurata della relazione corrente-tensione.
La Figura 7 mostra un esempio di tensione morsetto risultati fluorometria per un oocita. I segnali di fluorescenza sono stati registrati da un oocita marcato con MTS-TAMRA ad una cisteina inseriti alla posizione 805 nel dominio DII del canale del sodio cardiaco umano Na V 1.5.
_upload/51040/51040fig5.jpg "width =" 500px "/>
Figura 5. Cinetica di citoplasmatica Na + Concentrazione Change di Diffusion. L'aliquota di soluzione di equilibrazione interna è stata valutata applicando 90 mM Na + ad entrambi i lati esterni ed interni della cella e quindi misurando il potenziale di inversione Na + registrando relazioni IV ogni 2 min. Se il milieu interno erano perfettamente sostituito, E rev sarebbe 0 mV. Misure di tempo sono stati avviati quando saponina permeabilizzate la membrana dell'ovocita. Clicca qui per vedere l'immagine ingrandita .
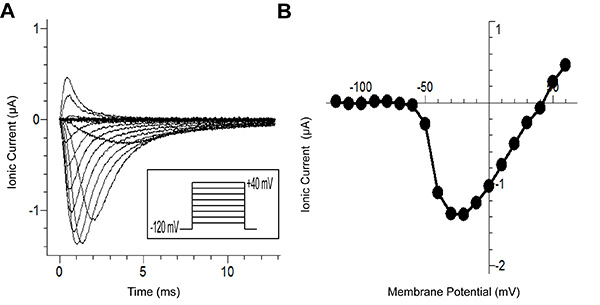
Figura 6. Selvaggio Tipo Na v 1.5Risultati canale del sodio da Cut-Open tensione di serraggio. (A) Tracce di corrente da diverse tensioni stimoli da un potenziale detenzione di -80 mV fino a -120 mV per 100 msec, l'impulso di test (-120 mV a 40 mV in registrata incrementi di 10 mV) per 200 msec, e, infine, repolarizing a -120 mV. (B) La curva IV, che rappresenta la tensione-dipendenza della corrente di picco nel pannello A. Qui, la corrente di picco per gli impulsi fino a +60 mV viene mostrato. Clicca qui per vedere l'immagine ingrandita .

Figura 7. Na v 1.5 Sodio Canale di tensione morsetto fluorometria Recordings. (A) ioniche correnti registrate da un ovocitamarcato con MTS-TAMRA a cisteina inseriti alla posizione 805 nel dominio DII-S4 del canale del sodio cardiaco umano Na V 1.5. Impulsi di tensione che vanno da -170 mV a +70 mV sono stati applicati in incrementi di 20 mV per una durata di 20 msec a seguito di una prepulse a -120 mV. (B) I segnali di fluorescenza associati. Ogni altra traccia fluorescenza viene omesso per chiarezza. Af / F rappresenta la variazione relativa dell'intensità di fluorescenza indotta dal impulso di tensione. Clicca qui per vedere l'immagine ingrandita .
Discussione
L'ovocita vaselina tensione gap clamp cut-open consente una rapida risoluzione dei dati, a basso rumore, aumentato il controllo sulla soluzione interna e la composizione soluzione esterna, e registrazioni stabili nel relativamente lunghi protocolli 19. Questi vantaggi impostate questa tecnica a parte il voltage clamp a due elettrodi standard e le tecniche di patch clamp. Sebbene attrezzature specializzate è necessaria e il protocollo è relativamente difficile, molto pochi problemi si verificano quando il sistema è stato ottimizzato. Questo permette registrazioni riproducibili di sodio (HNA V 1.5) e altri canali rapida attivazione.
Le fasi più critiche del protocollo sono il posizionamento della camera superiore sul ovocita e l'impalamento con l'elettrodo V1. La tenuta della guarnizione tra la cella e bordi dei fori di alloggiamento ha un grande impatto sulla qualità di registrazione. La camera superiore deve essere spinto verso il basso sulla cella di raggiungere il massimo possibile riresistenza senza danneggiare l'ovocita. Ciò richiederà rendendo il rigonfiamento ovocita e appiattire, ma è necessaria l'esperienza e la considerazione della qualità delle cellule per determinare la pressione ottimale per evitare la rottura. Registrazione veloce richiede l'uso di più grande apertura pipetta possibile che può essere utilizzato in modo coerente senza danneggiare la cella. Particolare attenzione dovrebbe essere prestata al cono della pipetta, che dovrebbe essere abbastanza bassa da non espandere significativamente come si inserisce la punta della pipetta la ferita. Impalement dovrebbe essere fatto lentamente e delicatamente, l'arresto immediato elettrodo avanzamento sulla comparsa del potenziale di membrana lettura.
Danni alla membrana dell'ovocita e meno perfetti sigilli ovocita / camera può portare a correnti elevate perdite. Correnti elevate perdite deteriorano sempre la qualità delle registrazioni. Così, le registrazioni dovrebbero sempre avere correnti di fuga basse (preferibilmente <150-200 Na). Circuito di compensazione dell'amplificatore, l'uso di P / N linea leak-coprocedure rrection, o off-line possono compensare corrente di dispersione.
Risoluzione dei problemi dovrebbe iniziare con un doppio controllo che tutti i componenti sono collegati o regolate correttamente, che generalmente risolvere la maggior parte dei problemi. Durante la preparazione e l'esperimento in sé, particolare attenzione deve essere rivolta a tutti i livelli di liquido versato o traboccanti e cristallizzato KCl in quanto questi possono collegare elettricamente compartimenti che sono destinati ad essere isolati. Se il sistema si comporta in modo imprevisto, controllare le connessioni mancanti o indesiderati tra i ponti e le camere. Le bolle d'aria all'interno dei ponti agar, alle estremità dei ponti agar, o intrappolati sotto la cella può anche causare problemi di connettività che sono difficili da rilevare.
Le modifiche, come sopra descritto, sono tenuti a svolgere morsetto fluorometria tensione (VCF) insieme a COVG. La modifica principale comporta l'uso di un design per il bagno alterato. Per accogliere uso di un obiettivo ad immersione in acqua 40Xsul microscopio, il bagno camera superiore deve essere maggiore di quanto sarebbe bisogno di essere per una configurazione di taglio standard aperto. Altri aspetti e le esigenze apparecchi di registrazione VCF in modalità COVG sono simili alla registrazione VCF in due elettrodi modalità di tensione-clamp 14. Come sottolineato in precedenza, il vantaggio principale della tecnica COVG è il controllo della tensione molto più veloce ed accurata rispetto a TEVC in una patch membrana che esprime molti più canali ionici che possono essere raggiunti in sistemi di espressione di cellule di mammifero. Così, la tecnica è ideale per VCF e gating studi attuali dove sono richieste sia ad alta risoluzione temporale e un numero elevato di canali per i segnali rilevabili.
Anche se in linea di principio sono possibili scambi soluzione sia extra-e intracellulare, la completezza e la velocità di conversione fissati alcune limitazioni su determinati tipi di esperimenti. Come mostrato in Figura 5, il tasso di equilibrazione di concentrazione ionica tra il citoplasma e la camera di bassaber è abbastanza lento seguendo saponina permeabilizzazione. Modifica concentrazioni ioniche dovrebbe pertanto essere considerato durante i lunghi esperimenti che arrivano in uno stato stazionario prima della cella. I tassi di cambio possono variare in larga misura a seconda delle condizioni. Espressione alta del canale, grande forza motrice, e più alto risultato della temperatura dei tassi più veloci. Nel nostro esperimento la cella è stata raffreddata a 19 ° C, espressione dei canali era moderata, e la carica netta guidato dai protocolli IV era minimo dovuto alla direzione della corrente cambia. In queste impostazioni la normale tecnica COVG è inferiore a varie configurazioni di patch-clamp. Per applicazioni che richiedono COVG rapida sostituzione del mezzo citoplasmatica può essere utilizzata una cannula di perfusione. In futuro, le camere COVG progettate con porte built-in perfusione possono consentire un migliore controllo sulle caratteristiche di scambio delle soluzioni extracellulari.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Tutti i membri della Washington University di St. Louis Cardiac molecolare Engineering Lab. Un Burroughs Welcome Fondo Premio alla Carriera al Interface scientifico - 1010299 (JS).
Materiali
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Riferimenti
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon