Method Article
La
Dans cet article
Résumé
L'approche de l'écart de vaseline découpe ouverte est utilisée pour obtenir des enregistrements à faible bruit des courants ioniques et dérogeant canaux ioniques voltage-dépendants exprimées dans des ovocytes de Xenopus à haute résolution de la cinétique de canaux rapides. Avec des modifications mineures, la tension de serrage fluorimétrie peut être couplé au protocole d'ovocytes découpe ouverte.
Résumé
L'écart ovocyte vaseline coupe-ouvert (COVG) technique tension de serrage permet d'analyser les propriétés électrophysiologiques et cinétiques des canaux ioniques hétérologues dans les ovocytes. Les enregistrements de la configuration du coupe-ouvert sont particulièrement utiles pour résoudre des courants faibles ampleur de déclenchement, l'activation du courant ionique rapide, et la désactivation. Les principaux avantages par rapport à la tension à deux électrodes pince (TEVC) comprennent la technique d'augmenter la vitesse de serrage, l'amélioration de rapport signal-sur-bruit, et la capacité de moduler la intracellulaire et milieu extracellulaire.
Ici, nous utilisons le canal sodique cardiaque humain (HNA V 1.5), exprimé dans des ovocytes de Xenopus, pour démontrer l'installation et le protocole coupe-ouverte ainsi que les modifications qui sont nécessaires pour ajouter la capacité de fluorimétrie tension de serrage.
Les propriétés des canaux ioniques rapides d'activation, comme HNA V 1.5, ne peuvent pas être entièrement résolus proche de la température ambiante en utilisant TEVC, dans which, la totalité de la membrane de l'ovocyte est serré, ce qui rend difficile le contrôle de la tension. Cependant, dans la technique de découpe ouverte, l'isolement de seulement une petite partie de la membrane cellulaire permet la fixation rapide requis pour enregistrer avec précision une cinétique rapide, tout en empêchant canal course vers le bas associée à des techniques de patch-clamp.
En liaison avec la technique de COVG, la cinétique des canaux ioniques et les propriétés électrophysiologiques peuvent encore être dosée à l'aide de la tension de serrage fluorimétrie, où le mouvement de la protéine est suivi par l'intermédiaire de la cystéine conjugaison de fluorophores extracellulaire appliqués, l'insertion de protéines fluorescentes codés génétiquement, ou l'incorporation d'acides aminés non naturels dans la région d'intérêt 1. Ces données supplémentaires donne des informations sur les réarrangements conformationnels cinétique de la protéine dépendant de la tension par des changements dans le microenvironnement autour de la molécule fluorescente.
Introduction
Techniques spécialisées tension de serrage permettent l'enregistrement des courants ioniques à des potentiels de membrane contrôlées. Largement utilisé tension à deux électrodes pince (TEVC) et des techniques de patch-clamp fournissent des informations électrophysiologique fiable sur les propriétés de nombreux canaux ioniques. Cependant, ces deux méthodes présentent des inconvénients qui empêchent l'acquisition de données fiables pour les canaux sodiques voltage-dépendants rapides et d'autres canaux d'activation rapide dans les membranes tels que ceux des ovocytes de Xenopus. Les laboratoires Bezanilla et Stefani donc développé la technique écart de vaseline tension pince coupe-ouvert (COVG) pour 2 ovocytes. La technique a été largement appliqué pour enregistrer, Na +, K + et Ca 2 + canaux 3-8.
Pendant l'enregistrement COVG, une membrane de l'ovocyte exprimant la protéine hétérologue est divisée en trois régions. Les données du courant ionique est enregistrée à partir de la région supérieure de l'ovocyte que lebain entourant la zone de tête est fixée à un potentiel de commande, qui peut être changé facilement et rapidement. La région du Moyen protège contre les courants de fuite par serrage au même potentiel que la région supérieure 9. La zone inférieure est l'endroit où l'ouverture de l'ovocyte (cut-open) se produit grâce à l'utilisation d'une solution de saponine ou d'une canule. Chimique ou ouverture manuelle de la membrane dans la zone de fond permet un contrôle du potentiel interne, qui est fixée à la masse, et rend l'intérieur de la cellule contiguë avec la solution de la chambre inférieure. Perfusion de solutions dans la chambre inférieure peut ajuster les propriétés de l'environnement interne, alors que l'échange de solution dans la chambre supérieure modifie l'environnement extérieur. 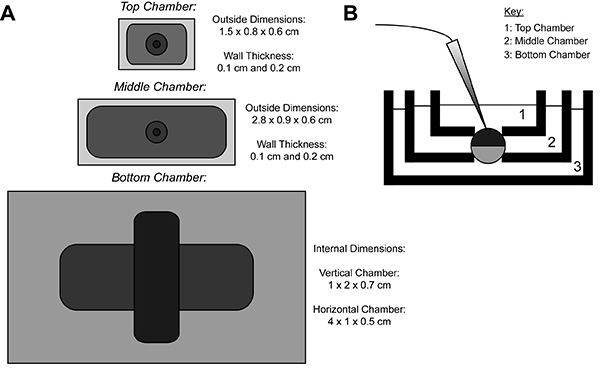
Figure 1. Ovocyte Cut-Ouvrir un diagramme de configuration Voltage-Clamp Bath. (A) Hautbas de la vue des trois salles de bains séparées les unes des autres. Les dimensions des chambres pour COVG sont affichés sur la figure. (B) Vue de côté de l'installation de salles de bains en position d'essai. Cliquez ici pour agrandir l'image .
Les avantages de la technique de COVG comprennent faible bruit actuel (1 nA à 3 kHz), le contrôle de la composition ionique des médias externes, la capacité de moduler les médias interne, la résolution de temps rapide (20-100 constante ps de temps de décroissance de la capacité transitoire), et des enregistrements stables pendant plusieurs heures 9. Les inconvénients sont que cela nécessite un équipement spécialisé et il est plus difficile à réaliser par rapport aux deux serrage de tension des électrodes (TEVC) 10.
Bien que l'approche de COVG nécessite un équipement hautement spécialisé et éléments de procédure complexes, il peut permettre l'acquisition de précieuxdonnées électrophysiologiques capables. Ces données, comme gating courants avec une cinétique rapide et courants de queue 4, peut être enregistrée sans certains des problèmes associés à d'autres protocoles tension de serrage y compris le canal délabré. Des modifications mineures à la configuration COVG peuvent permettre l'utilisation de régulateurs de température et de la tension de serrage fluorométrie (VCF). L'inclusion d'éléments de serrage fluorimétrie de tension au sein de l'assemblage COVG peut augmenter la sortie des données en conférant la capacité à surveiller les changements de conformation des protéines tout en enregistrant simultanément de courant de 11 à 13.
Protocole
Une. Installation du matériel initial
- Placer le stade et le manipulateur de micro-électrodes sur un système d'isolation de vibrations (par exemple une table d'air) avec une cage de Faraday entoure afin d'éviter le bruit électrique et mécanique.
- Soudez six pastilles Ag / AgCl à longueurs de six pouces de 24 AWG. Pour l'une de ces longueurs (pour être relié à P1), raccord dans un deuxième fil pour former un «Y». Sur les extrémités de chaque fil souder un goujon BNC de l'or, qui est inclus dans l'amplificateur.
- Connectez les cinq pastilles Ag / AgCl soudés à 24 AWG à la headstage bain / Garde (P1, P2, CC, GS1, GS2 et). Connectez le "je" Ag / AgCl culot de le «je» headstage et le second fil venant hors de P1 à la headstage V2.
- Connectez l'amplificateur à l'unité d'acquisition de données en suivant les instructions dans les manuels d'équipement.
- Placez et époxy les thermistances de contrôleur de température. Enfiler le bloc thermistance à travers un trou dans le scaffol métalliqueD directement au-dessus du centre de l'élément de chauffage / refroidissement. Placer l'époxy et la thermistance de bain dans un trou foré dans le corps de la chambre de fond thermoconducteur très près mais pas en contact de la solution.
2. Ovocytes et préparation préliminaire
- Pour enregistrer un canal hétérologue exprimé comme HNA V 1.5, la synthèse de l'ARNm (dérivé de hSCN5a) et l'injecter dans un ovocyte de Xenopus environ 4-5 jours avant d'effectuer le protocole 4. Pour hSCN5a, expression maximale est obtenue après incubation pendant 4-5 jours à 19 ° C. Reportez-vous à Richards et Dempski 14 et Cohen et al. 15 pour des instructions détaillées sur l'ovocyte, la préparation d'ARNm, et l'injection d'ovocytes.
- Chlorure fil AgCl et pastilles AgCl avant de commencer le protocole 4. Pour ce faire, placez une extrémité du fil et des pastilles dans l'eau de Javel pendant au moins 20 min et aussi longtemps que O / N. Une fois les pastilles ont été Chlorided, apposer leur collecteur en utilisant un adhésif.
Note: Le courant d'excitation à travers des fils peut également être utilisé pour le fil chlorures et des pastilles. Cette technique va augmenter la vitesse de chloruration, mais aussi besoin de plus de matériel. Voir Techniques de chloration fils d'argent pour obtenir des instructions 16.
3. Agar Pont Préparation
- Faire au moins six ponts d'agar par chauffage jusqu'à une extrémité d'un tube capillaire de borosilicate dans une flamme moyenne. Assurez-vous que l'extrémité du tube capillaire se trouve dans la partie supérieure de la flamme bleue. Faire des ponts supplémentaires en cas de dommages aux originaux.
- Une fois que le tube capillaire est chauffé, utiliser une pince pour faire un angle de pliage de 90 ° dans le tube. Objectif pour une courbe avec une courbure lisse et non un angle abrupt ou il peut réduire de façon significative le diamètre interne de la vitre, ce qui rend plus difficile le remplissage et augmente la résistance du pont.
- Faire un deuxième coude de 90 °dans la même direction 25 mm vers le bas du tube capillaire à partir du premier coude à l'aide des mêmes étapes.
Remarque: La longueur exacte de la passerelle n'a pas d'importance aussi longtemps que la taille du pont est cohérente, mais en fin de compte la longueur doit être adaptée à l'appareil de forage ils vont être utilisés sur les. Gardez à l'esprit que la résistance de pont est proportionnelle à sa longueur et doit être minimisée. - Une fois les tubes capillaires ont refroidi, utilisez un coupe-verre diamanté pour couper les "jambes" de la passerelle à environ 5 mm.
- Insérer les longueurs de fil de platine dans les tubes capillaires des trois ponts "courant-fournisseurs" pour améliorer les performances en réduisant la résistance à l'agar 17. Coupez le fil de platine en excès de sorte qu'il n'y a pas de fil exposée à l'extérieur du tube.
Remarque: En raison du coût élevé du platine, de récupérer et de réutiliser n'importe quel fil de ponts brisés. - Poussez le fil de platine plus loin dans le tube capillaire avec une pointe fine en œuvre comme une micropipette tip sorte que le fil est de 1 mm plus courte que la vitre sur les deux extrémités du tube capillaire.
- Faire 100 ml de 1 M NMDG tamponnées avec 1,2 g d'HEPES. Utiliser un appareil de mesure de pH et ajouter MES hydrate poudre jusqu'à ce qu'un pH de 7,4 est obtenue (~ 10 g). Une fois un pH de 7,4 a été atteint, retirez l'électrode de pH. Mettez de côté 40 ml de la solution pour garder comme une solution de stockage.
- Ajouter agar granulé pour produire un mélange de 2-3% de gélose. Remuer et chauffer jusqu'à ce que la solution d'agar est dissous et clair. Ne pas surchauffer ou faire bouillir la solution car il deviendra trop visqueux et remplissent les ponts seront difficiles.
- Déplacez la solution de gélose à un nouveau bécher et ajouter une petite barre d'agitation. Continuer le chauffage et l'agitation à une vitesse modérée.
- Ajouter les ponts capillaires un à la fois, les jambes vers le haut. Au fil du temps les ponts seront remplir avec de l'agar. Sinon, remplissez les ponts en poussant solution de gélose à travers une seringue attachée à un petit bout de la pipette.
- Une fois il n'y a pas de bulles dans le briGED, récupérer les ponts de la solution d'agar et placer les ponts sur une serviette en papier pour sécher. Toutes les ponts avec des bulles résiduelles peuvent être agités avec des pinces pour faciliter la sortie de la bulle.
Remarque: agar Installé avec des bulles peut être complètement enlevée par immersion des ponts dans l'eau bouillante. Une fois l'agar-agar est éliminé, utilisez une ligne de vide pour éliminer l'eau résiduelle. Les ponts peuvent ensuite être réutilisées pour le traitement de l'agar. - Retirer agar excès des ponts quand sec. Ajouter 60 ml d'eau à la solution 40 ml de réserve et de placer les ponts dans la solution de stockage.
4. Rig Préparation Coupez-ouvert
- Mettre en marche la source d'eau pour la régulation de température, puis l'interrupteur d'alimentation pour le contrôleur de température. Attendre jusqu'à ce que la température du bain atteint la température de consigne (19 ° C).
- Tirez microélectrodes de borosilicate tube capillaire avec un extracteur de microélectrodes à une résistance de 0,2-0,5 MQ.
Remarque: pip abaissementrésistance ette améliore la vitesse de serrage. Cependant, les pipettes de résistance plus faibles sont plus susceptibles d'endommager l'ovocyte. L'expérimentation est nécessaire pour déterminer la meilleure valeur de la résistance de la pipette pour chaque application. - Préparer la solution de saponine en mélangeant 0,125 g de saponine à sec avec 50 ml d'une solution interne. Cela conduira à une solution à 0,25%. Inverser doucement pour mélanger.
- Sous un microscope à dissection appliquer une petite quantité de vaseline sur le bord du trou sur la face supérieure de la chambre médiane et la partie inférieure de la chambre supérieure avec un objet très pointu.
Remarque: Le "beignet" de vaseline aidera à garder l'ovocyte en place sur le trou et va aider à la formation du joint. Cependant, trop de vaseline sera bulles de pièges et éviter les solutions d'atteindre la surface de l'ovocyte. - Ajouter 3 M KCl solution dans les fentes multiples tenant pastilles Ag / AgCl pour qu'il n'y ait pas de débordement des fentes mais les pastilles et extrémités des branches du pont sont anserouge. Nettoyer les gouttelettes de KCl supplémentaires pour empêcher les connexions électriques indésirables entre les fentes.
- Ajouter solution externe à la chambre de bain inférieures et moyennes.
- Placer les ponts d'agar dans les fentes de la pastille AgCl collecteur de sorte que la jambe par une passerelle se trouve dans chaque fente. L'autre jambe des ponts sera ensuite placé dans les chambres respectives (P1, P2, CC meilleurs; GS1, GS2 milieu (garde), je fond). Assurez-vous que les ponts de fil de platine sont dans le GS2, P2, et des fentes I.
Remarque: Veiller à ce que les ponts sont lavés avec de l'eau distillée et sécher complètement avant de l'insérer dans le bain de la chambre. - Mettre en marche le système d'acquisition de données et le PC. Démarrez le logiciel d'enregistrement.
5. Procédure de Cut-ouvert
- Installez les chambres supérieures et moyennes ovocytes sans un ovocyte. Faites glisser la chambre supérieure excentrée de sorte que les trous dans les deux chambres ne se chevauchent pas. Remplissez toutes les chambres avec une solution externe et placer toutes les électrodes dans leurs chambres respectives.
Note: Ne pas pousser la chambre supérieure tout en bas lors de l'installation des chambres. Assurez-vous d'un très petit écart demeure entre les deux chambres. La disposition décentrée augmente la résistance du système de chambre pour mieux simuler la présence d'une cellule. Ce processus, appelé «l'équilibre entre les ponts", compense les potentiels de décalage qui peuvent découler de manque d'homogénéité entre les ponts d'agar-agar.- Désactiver la commande externe et les deux pinces. Vérifiez la lecture en cours sur l'amplificateur. Réglez avec un petit tournevis P offset sur l'arrière de la salle de bain / garde la tête au stade actuel à zéro.
- Mettez l'interrupteur bain / garde sur l'amplificateur pour activer et ajuster les GS décalage pour obtenir un courant nul.
- Répétez entre «active» et «passive» jusqu'à ce que les deux sont assez proche de zéro (<100 nA).
- Retirer la chambre supérieure et transférer un ovocyte dans la chambre de bain de milieu à l'aide d'une pompe à pipette. Assurez-vous que la oocyte est positionné au-dessus du trou dans le centre du bain.
Remarque: Lors de la préparation d'un ovocyte de VCF, placez la cellule marquée dans la chambre avec le pôle animal (côté sombre) vers le haut. orientation portable n'a pas d'importance si VCF n'est pas en cours d'exécution. - Enlever l'excès de solution externe à partir du bain de fond en utilisant un aspirateur pour créer une étanchéité entre l'ovocyte et la surface du bain.
- Placer la chambre de bain supérieure sur l'ovocyte de sorte que le trou de la chambre est centrée sur le dessus de l'ovocyte. L'utilisation d'un pouce et le majeur, appliquer lentement la pression vers le bas sur la chambre jusqu'à ce qu'elle est pressée fermement contre l'ovocyte de façon à exposer seulement une petite partie de la membrane dans le bain supérieur à travers le trou.
Remarque: L'ovocyte peut gonfler sous la pression de la chambre supérieure. Ne pas appliquer une force excessive à la chambre haute, au risque de provoquer l'ovocyte à la rupture. Pince à épiler conseils placés sur les diagonales de la chambre supérieure peuvent être utilisés comme une alternative aux doigts pour applpression à la baisse y. - Ajouter solution externe pour les salles de bains haut et du bas jusqu'à ce qu'ils soient presque plein.
- Placer les jambes libres des ponts de gélose dans la solution externe de chaque bain comme on le voit sur la figure 2 (mise en place de pont). Assurez-vous que chaque pont se repose dans son emplacement de bain correcte. (I Bridge dans le bain en bas, GS1 et GS2 ponts dans le bain milieu, et P1, P2, et les ponts de CC dans le bain supérieure). Mettez l'interrupteur bain / garde de l'amplificateur à l'état actif.
Remarque: Assurez-vous il n'y a pas trois connexions M KCl entre les ponts, les puits, et les chambres d'enregistrement. En outre, s'assurer que les ponts sont façonnés de sorte qu'ils sont élevés au-dessus des solutions de la chambre d'enregistrement.
Figure 2. Endroits Agar Pont Schéma d'installation de la ville. Placement des extrémités libres des ponts d'agar-agardans les différents bains. Cliquez ici pour agrandir l'image . - Démarrer un protocole de test dans le logiciel d'enregistrement. Si l'impulsion montre le déplacement vertical de la section horizontale entre les deux pics lors de l'application d'une impulsion de 100 mV qui est supérieur à 100 nA (correspondant à 0,3 MQ avec le bain / garde en passive) puis augmenter l'étanchéité de la couverture du bain. Voir la figure 3 pour un exemple d'une impulsion d'essai idéal.
Remarque: Le protocole de test émet une impulsion de tension pour voir si le couvercle de la salle de bain est assez serré et tous les composants ont été assemblés correctement. En variante, la fonction de test de la amplificateur peut être utilisé.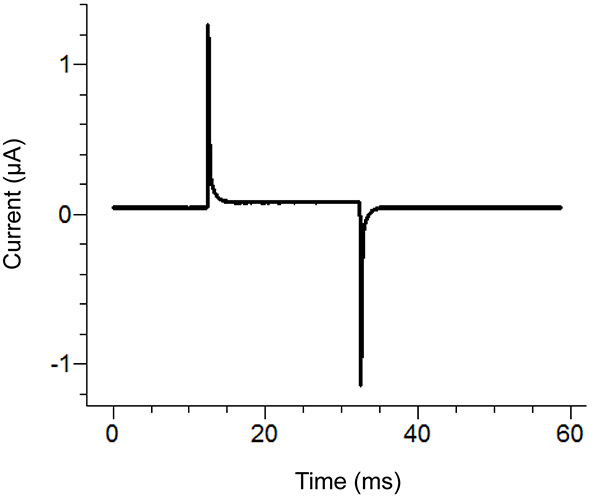
Figure 3. Idéal Impulsion d'essai du logiciel d'enregistrement. L'impulsion de testdoit ressembler à l'impulsion ci-dessus selon le protocole appliqué. Le courant de maintien (centre de référence) devrait être proche de zéro. Cliquez ici pour agrandir l'image . - Retirer la solution externe dans le bain en bas et de le remplacer par une solution de saponine. Soyez prudent pour éviter de créer des bulles tout en ajoutant la saponine. Pour assurer le remplacement maximal, appliquer une aspiration à l'extrémité opposée du fond du bain, tout en ajoutant la solution.
- Après que la solution de saponine ont été ajoutées, observer l'impulsion de test répétitif. Si le pic du protocole de test réduit ou disparaît, alors c'est un signe qu'il ya une bulle située en dessous de l'ovocyte. Dans ce cas, retirez complètement la solution de saponine et le remplacer alors.
Remarque: perméabilisation est généralement complète en 30 secondes avec une solution de saponine frais. Les solutions peuvent avoir des difficultés à atteindre la cellule si il ya des bulles emprisonnéesou si la couche folliculaire reste sur un ovocyte mal digérés. L'ovocyte a été perméabilisées (ouvert) lorsque la pente de la pointe de tension diminue (augmentation de la constante de temps de décroissance).
Figure 4. Impulsion d'essai Traces Pendant ovocytes perméabilisation. traces sélectionnées dans le protocole d'impulsions d'essai après une solution de saponine 0,25% a été introduit dans la chambre inférieure de l'ovocyte. L'augmentation de la constante de temps de décroissance vu dans les traces en évidence une augmentation de l'ovocyte perméabilisation. Cliquez ici pour agrandir l'image . - Une fois la cellule est perméabilisée, éliminer la solution de saponine et remplir la baignoire avec une solution interne. Arrêter le protocole d'essai.
Remarque: Même si la saponine permet d'accéder à laintérieur de la cellule par perméabilisation de la membrane, l'équilibrage des concentrations en ions entre le bain inférieur et le cytoplasme de l'ovocyte par diffusion est un processus très lent. Cette opération peut nécessiter plusieurs dizaines de minutes, selon les conditions (figure 5). - Vérifiez la présence de niveaux élevés de solution dans les salles de bains et cristallisé KCl entre les puits du collecteur, car ils peuvent provoquer des courts-circuits et un comportement erratique.
- Utilisez la seringue modifié pour injecter 3 M KCl dans une microélectrode. Flick la microélectrode à plusieurs reprises avec un doigt tout en s'agrippant avec les autres doigts.
Remarque: Cette étape est nécessaire pour enlever les bulles d'air emprisonnées dans la microélectrode. - Monter l'électrode remplie de KCl sur le bras de micromanipulateur par l'insertion du filament de fil dans l'extrémité ouverte de micro-électrodes. Poussez l'extrémité de la micro-électrode dans le support de filament et assurez-vous que l'électrode n'est pas lâche. Serrer la fixation de l'électrode.
Remarque: Make vous que le fil a un même AgCl revêtement pour l'électrode de fonctionner normalement. - Balancer le bras en position sur les bains d'ovocytes et serrer les colliers pour empêcher la poursuite du mouvement de bras.
- En utilisant les boutons de manipulation, marcher l'électrode vers le bas dans le bain. Assurez-vous qu'aucune impulsion d'essai est appliquée et que la fonction de test de la membrane n'est pas activé à ce moment.
Remarque: Avant la pointe de l'électrode est inséré dans le liquide, V1-V2 sur la pince de tension va lire une tension positive. Une fois que la pointe de l'électrode est inséré dans le liquide, l'appareil de mesure de tension sur la borne de tension doit passer à une valeur proche de zéro. Pour les enregistrements de VCF, l'électrode doit approcher la cellule à un angle assez faible pour laisser place à l'objectif. Empaler la cellule avec l'électrode excentrée, plus près du bord de la pièce de membrane isolée contribue également à éviter la collision de l'objectif avec l'électrode. - Arrêtez la marche de l'électrode vers le bas. Réglez le décalage électrodepotentiel à zéro en appuyant sur le bouton de V1 puis en réduisant la tension V1 à zéro en ajustant le décalage V1. En outre, effectuer le même réglage pour V2. La différence V1-V2 potentiel doit se lire 000 mV.
- Revenez à V1 et tourner Z-test pour mesurer la résistance de l'électrode. La valeur va progressivement baisser et approcher la résistance réelle. Visez une valeur de résistance de 0,2-0,5 MQ.
- Continuez à marcher l'électrode vers le bas vers le patch visible de l'ovocyte dans le bain haut. Une fois la microélectrode est très proche de l'ovocyte, regarder la lecture V1-V2 à voir lorsque l'électrode entre l'ovocyte, la tension V1-V2 deviendra négatif quand la microélectrode pénètre dans la cellule.
Remarque: La valeur affichée à cet endroit est le potentiel de membrane de la cellule et sera affectée par les canaux exprimés et des solutions utilisées. Insertion de la micro-électrode trop endommager la membrane cellulaire. - Ouvrir le protocole de collecte de données dans lelogiciel de gravure.
- Retourner sur le commutateur de serrage sur la bride de tension et ajuster le potentiel pour correspondre à la commande (par exemple -100 mV) en ajustant le bouton situé sur le "I" headstage.
- Retourner sur le commutateur de capacité et de compensation de la résistance.
- Retournez le "Test" basculer dans la région "Commandes" de la pince de tension. Utilisez l'oscilloscope pour visualiser le signal. Réglez les boutons de rémunération cm dans le segment de conditionnement de signal pour réduire les transitoires capacitifs sur l'oscilloscope. Ne pas trop compenser les pics au point où les pics inverses supplémentaires se produisent ou les sommets commencent à développer une courbure sigmoïde, qui peut introduire artefact dans l'enregistrement.
- Une fois la capacité a été réduite manuellement à un niveau satisfaisant, tournez le commutateur de test hors tension.
- Commencer le protocole d'enregistrement de données dans le logiciel d'enregistrement.
6. Nettoyage
- Lorsque les enregistrements ont abeillen terminée, mettez tous les différents commutateurs sur la pince de tension, y compris le collier et bain / commutateurs de garde.
- Utilisez une pince pour retirer les ponts d'agar des différents bains.
- Retirer du bain haut et aspirer toutes les solutions et l'ovocyte de toutes les salles de bains.
- Utilisez une bouteille d'eau déminéralisée pour rincer tous les bains, puis aspirer les bains avec un aspirateur. Répétez cette étape 3-5x.
- Essuyez cristallisé KCl hors ponts et placer les ponts dans la solution de stockage. Les ponts peuvent être réutilisés pendant plusieurs semaines aussi longtemps qu'ils sont correctement stockés.
- Aspirer la solution de KCl à partir des puits de collecteur et le collecteur rinçage à l'eau déminéralisée plusieurs fois.
- Éteignez tous les équipements divers, y compris le contrôle de la température et le logiciel d'enregistrement.
7. Ajout de la tension de serrage Fluorimétrie
- Suivez les étapes de la section 1 à 6 dans un protocole JoVE déjà publié 16 Examining la conformation dynamique de protéines membranaires in situ avec le site dirigé marquage fluorescent: Cliquez ici pour voir la page.
- Effectuez les étapes de la section 4 à 5.22 du protocole de COVG précité en utilisant un microscope VCF fixé à 4X accent.
Remarque: Les enregistrements de VCF exigent de plus grandes chambres de bain d'ovocytes que nécessaire dans les mesures de COVG. (Les dimensions des chambres de VCF personnalisé se trouvent dans la liste des matériaux.) Cette chambre VCF plus grande doit être capable d'accueillir simultanément l'objectif, microélectrodes, et les ponts d'agar-agar. En outre, le pôle animal (côté sombre de l'ovocyte) doit être orientée vers le haut dans la chambre pour les enregistrements VCF bas de fond. - Apportez la partie supérieure de l'ovocyte au point en utilisant un objectif 40x immersion dans l'eau.
Remarque: Le passage de la 4X à l'objectif 40X nécessite une ge spécifiqueometry de composants coupés-ouverte et une attention particulière afin de ne pas toucher l'électrode, les ponts, ou des chambres lors de l'abaissement de l'objectif 40X. En outre, en raison de l'augmentation du volume de la garde en haut, assurez-vous que le volume de bain de la protection supérieure n'est pas reliée à la moyenne garde lorsque l'objectif 40X est mis en place. - Concentrer sur un anneau autour du périmètre de la surface de l'ovocyte exposé, de sorte que le sommet de l'ovocyte est légèrement au-dessus du plan de focalisation.
Remarque: Le réglage dans le plan xy peut être nécessaire de sorte que le champ de vision est surtout rempli de membrane et non la chambre. Traduction XY est le plus aisément en placement du microscope sur une platine de translation. - Déplacer le cube de filtre dans le trajet optique et commuter le trajet de la lumière à partir de l'oculaire vers le détecteur (diode).
- Allumez la source de lumière de VCF.
- Éteignez les lumières du plafond, l'éclairage de lumière à fibre, et d'autres sources de lumière.
Note: Idéalement, VCFenregistrements doivent être effectués dans une pièce complètement sombre. - Exécutez un protocole de fluorescence dans le logiciel d'enregistrement.
Résultats
La figure 4 montre la variation de la perméabilité de l'ovocyte en tant que solution de saponine est appliquée à la partie inférieure de l'ovocyte. Figure 5 démontre le taux de conversion de la solution intracellulaire par diffusion suivant la perméabilisation de la saponine. 20-40 min sont nécessaires pour arriver à un état d'équilibre 2,18.
Figure 6A présentent des traces générées par le protocole d'enregistrement. La figure montre les courants ioniques (après soustraction de fuite P/-8) en réponse au protocole de tension (encart). Chaque trace sur la figure représente une tension appliquée différente. Les traces avec des cinétiques plus lentes représentent les potentiels auxquels les plus bas du canal de sodium peut ouvrir. Typiquement, en utilisant des procédés traditionnels, il est difficile de maintenir un contrôle de la tension pour ces potentiels plus faibles parce que le courant entrant dépolarise la membrane. Cette dépolarisation active à son tour plusieurs canaux de créer une boucle de réaction positive . La vitesse améliorée de serrage de la technique de découpe ouverte permet le contrôle de la tension requise pour l'enregistrement de la chaîne, même à ces potentiels difficiles.
La figure 6B représente la courbe courant / tension, qui a été généré à partir de la trace dans la figure 6A. Sans le contrôle de tension noté ci-dessus, le courant de crête au plus tôt potentiels (~ -60 mV) serait surestimée. Cela permettrait d'éviter description précise de la relation courant-tension.
La figure 7 montre un exemple de verrouillage de tension pour les résultats de la fluorimétrie un ovocyte. Les signaux de fluorescence ont été enregistrés à partir d'un ovocyte marqué avec MTS-TAMRA à une cysteine introduite en position 805 dans le domaine DII du canal sodique cardiaque humaine Na V 1.5.
_upload/51040/51040fig5.jpg "width =" 500px "/>
Figure 5. Cinétique de cytoplasmique Na + Concentration changement par diffusion. Le taux d'équilibration de la solution interne a été évaluée en appliquant 90 mM de Na + à la fois les côtés externes et internes de la cellule, puis en mesurant le potentiel d'inversion de Na + en enregistrant les relations IV toutes les 2 min. Si le milieu interne ont été parfaitement remplacé, E rev serait 0 mV. Les mesures de temps ont commencé quand saponine perméabilisées la membrane de l'ovocyte. Cliquez ici pour agrandir l'image .
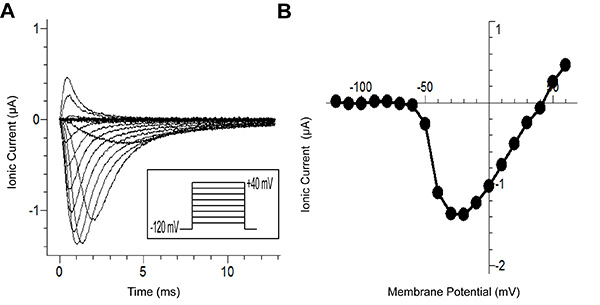
Figure 6. Type sauvage Na v 1.5Chaîne de sodium Les résultats de Cut-Ouvert Tension de serrage (A). Traces de courant enregistrée à partir de différentes tensions de stimuli à partir d'un potentiel de maintien de -80 mV jusqu'à -120 mV pendant 100 ms, l'impulsion de test (-120 mV à +40 mV dans incréments de 10 mV) pour 200 ms, et enfin à -120 mV repolarisation. (B) La courbe IV, qui représente la tension dépendance du courant de pointe dans le panneau A. Ici, le courant de crête pour des impulsions jusqu'à 60 mV est affiché. Cliquez ici pour agrandir l'image .

Figure 7. Na v 1.5 sodiques voltage canal de serrage FLUOROMETRIE Recordings. (A) ioniques courants enregistrés à partir d'un ovocytemarqué avec MTS-TAMRA à une cystéine en position 805 inséré dans le domaine DII-S4 du canal sodique cardiaque humaine Na V 1.5. des impulsions de tension allant de -170 mV à +70 mV ont été appliquées à 20 mV par incréments d'une durée de 20 ms à la suite d'une pré-impulsion à -120 mV. (B) Les signaux de fluorescence correspondants. Chaque autre trace de fluorescence est omis pour plus de clarté. AF / F représente la variation relative de l'intensité de la fluorescence induite par l'impulsion de tension. Cliquez ici pour agrandir l'image .
Discussion
L'ovocyte vaseline tension d'espace technique du clamp de coupe-ouverte permet la résolution rapide des données, à faible bruit, un contrôle accru sur la solution interne et la composition de la solution externe, et des enregistrements stables sur de relativement longues protocoles 19. Ces avantages mis cette technique en dehors de la pince de tension à deux électrodes standard et des techniques de patch-clamp. Bien que l'équipement spécialisé est nécessaire et le protocole est relativement difficile, très peu de problèmes se produisent une fois que le système a été optimisé. Cela permet des enregistrements reproductibles de sodium (HNA V 1.5) et d'autres canaux d'activation rapides.
Les étapes les plus critiques dans le protocole sont la mise en place de la chambre supérieure de l'ovocyte et l'empalement avec l'électrode de V1. L'étanchéité du joint entre la cellule et les bords des trous de la chambre a un grand impact sur la qualité de l'enregistrement. La chambre supérieure doit être poussé vers le bas sur la cellule pour atteindre le plus haut possible rerésistance sans endommager l'ovocyte. Il faudra faire le renflement de l'ovocyte, et aplatir, mais l'expérience et l'examen de la qualité des cellules est nécessaire pour déterminer la pression optimum pour éviter la rupture. Enregistrement rapide nécessite l'utilisation de la plus grande ouverture possible de la pipette qui peut être utilisée régulièrement, sans endommager la cellule. Une attention particulière devrait être accordée au cône de la pipette, ce qui devrait être assez faible de ne pas augmenter de manière significative la plaie que la pointe de la pipette est insérée. Empalement doit se faire lentement et doucement, l'arrêt immédiat électrode avancement lors de l'apparition de la membrane lecture potentiel.
Dommages à la membrane de l'ovocyte et moins parfaites joints ovocyte / chambre peuvent conduire à de forts courants de fuite. De forts courants de fuite se détériorent toujours la qualité des enregistrements. Ainsi, les enregistrements doivent toujours avoir des courants de fuite faibles (de préférence <150-200 nA). Le circuit de compensation de l'amplificateur, l'utilisation de P / N ligne de fuite coprocédures rrection, ou hors-ligne peuvent compenser pour le courant de fuite.
Dépannage devrait commencer par double contrôle que tous les composants sont correctement fixés ou ajustés, qui sera généralement résoudre la plupart des problèmes. Lors de la préparation et de l'expérience elle-même, une attention particulière doit être accordée à tous les niveaux de liquides renversés ou débordant et cristallisé KCl que ceux-ci peuvent se connecter électriquement compartiments qui sont destinés à être isolé. Si le système se comporte de manière inattendue, vérifier les connexions manquantes ou indésirables entre les ponts et les chambres. Les bulles d'air à l'intérieur des ponts d'agar-agar, au niveau des extrémités des ponts de gélose, ou piégé en dessous de la cellule peut également causer des problèmes de connectivité qui sont difficiles à détecter.
Modifications, comme décrit ci-dessus, sont tenus d'effectuer tension pince fluorimétrie (VCF) avec COVG. La principale modification consiste à utiliser un modèle de baignoire altérée. Afin de permettre l'utilisation d'un objectif 40X à immersion dans l'eausur le microscope, le bain de la chambre supérieure doit être plus grande que cela devrait être pour une configuration standard de coupure ouverte. D'autres aspects et les besoins en équipement d'enregistrement de VCF en mode COVG sont similaires à l'enregistrement de VCF à deux électrodes en mode voltage-clamp 14. Comme l'a souligné précédemment, le principal avantage de la technique de COVG est le contrôle de la tension beaucoup plus rapide et précis que TEVC dans une pièce de membrane qui exprime beaucoup plus que les canaux ioniques peuvent être atteints dans les systèmes d'expression de cellules de mammifères. Ainsi, la technique est idéale pour VCF et gating études actuelles où à la fois une haute résolution temporelle et un nombre élevé de canaux sont nécessaires pour des signaux détectables.
Bien que, en principe, les échanges de solutions à la fois extra-et intracellulaires sont possibles, leur exhaustivité et leur vitesse d'échange mis des limites sur certains types d'expériences. Comme le montre la Figure 5, le taux d'équilibration des concentrations ioniques entre le cytoplasme et la cham inférieurbre est assez lent suit saponine perméabilisation. Modification des concentrations ioniques doit donc être considérée pendant de longues expériences avant la cellule arrivant à un état d'équilibre. Les taux de change peut varier dans une large mesure en fonction des conditions. Expression élevée de canal, force motrice importante, et le résultat d'une température plus élevée des taux plus rapides. Dans notre expérience, la cellule a été refroidi à 19 ° C, l'expression de canal a été modérée, et la charge nette entraînée par les protocoles IV était minime en raison de l'orientation actuelle de changer. Dans ces contextes la technique de COVG normale est inférieure à différentes configurations de patch-clamp. Pour les applications nécessitant un remplacement rapide COVG du milieu cytoplasmique d'une canule de perfusion peut être utilisé. Dans l'avenir, les chambres COVG conçus avec des ports intégrés perfusion peuvent permettre un meilleur contrôle sur les caractéristiques d'échange de solutions extracellulaires.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Tous les membres de l'Université Washington à St. Louis cardiaque moléculaire Engineering Lab. Un Burroughs Bienvenue Fonds bourse de carrière à l'interface science - 1010299 (JS).
matériels
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Références
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , Wiley-VCH. (2006).
- Susan, G. A. Methods in enzymology. 296, Academic Press. 566-578 (1998).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Techniques for Chloriding Silver Wires. , Available from: http://www.warneronline.com/pdf/whitepapers/chloriding_wire.pdf (1999).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R. Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. Roberts, G. , Springer-Verlag Berlin Heidelberg. New York. (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon