Method Article
Quantificação da Resposta explosão respiratória como um indicador da imunitário inatas Saúde em Zebrafish
Neste Artigo
Resumo
A resposta imune inata protege os organismos contra uma infecção patogénica. Um componente crítico da resposta imune inata, a explosão respiratória de fagócitos, gera espécies reativas de oxigênio, que matam microorganismos invasores. Nós descrevemos um ensaio de explosão respiratória que quantifica as espécies reativas de oxigênio produzidas quando a resposta imune inata é induzida quimicamente.
Resumo
A explosão respiratória dos fagócitos é parte da resposta imune inata à infecção e envolve a produção de espécies reativas de oxigênio (ROS). ROS são tóxicos e funcionar para matar microorganismos fagocitados. In vivo quantificação de derivados de fagócitos ROS fornece informações sobre a capacidade de um organismo para montar uma resposta imune inata robusto. Aqui nós descrevemos um protocolo para quantificar e comparar ROS em embriões de peixe-zebra inteiros após indução química da explosão respiratória dos fagócitos. Este método faz com que a utilização de um composto não fluorescente que se torna fluorescente por oxidação por ROS. Embriões de peixes-zebra individuais são pipetadas para os poços de uma microplaca e incubadas neste substrato fluorogénico com ou sem um indutor químico da explosão respiratória. Fluorescência em cada poço é quantificada em momentos desejados utilizando um leitor de microplacas. As leituras de fluorescência são ajustados para eliminar a fluorescência de fundo e, em seguida, compared usando um teste t não pareado. Este método permite a comparação do potencial de explosão respiratória de embriões de peixes-zebra, em diferentes estágios de desenvolvimento e em resposta a manipulações experimentais, tais como o knockdown da proteína, a sobre-expressão, ou a tratamento com agentes farmacológicos. Este método também pode ser utilizado para monitorar a resposta a explosão respiratória em rins dissecados inteiros ou preparações de células de rins de peixe-zebra adultos e algumas outras espécies de peixe. Acreditamos que a relativa simplicidade e capacidade de adaptação deste protocolo irá complementar os protocolos existentes e será de interesse para os pesquisadores que procuram entender melhor a resposta imune inata.
Introdução
O sistema imunitário é constituído por duas ramificações: a imunidade inata e adaptativa. A imunidade inata é evolutivamente mais antiga do que a imunidade adaptativa. Invertebrados são atualmente pensado para ter só a imunidade inata, enquanto os vertebrados possuem ambos os ramos inata e adaptativa. Enquanto a imunidade adaptativa confere imunidade específica e de longa duração a certos patógenos, a imunidade inata é uma resposta imediata às bactérias invasoras, vírus e fungos. Um aspecto importante da resposta imune inata envolve a libertação de citocinas e quimiocinas, o que resulta em inflamação e recrutamento de fagócitos (por exemplo, macrófagos, neutrófilos) para engolir e destruir invasores estranhos.
Respostas imune inata de sucesso envolvem: (1) o reconhecimento de microorganismos invasores, (2) indução das cascatas de sinalização adequadas (por exemplo, liberação de citocinas e quimiocinas), (3) desenvolvimento adequado / número adequado de células fagocíticas, (4) Migração de fagócitos para locais de infecção; (5) imersão de patógenos, e (6) a destruição de microorganismos engoliram. Uma deficiência em qualquer uma dessas etapas pode levar ao host que está sendo oprimido por e sucumbir a, a infecção. Uma resposta imune inata robusta é vital para a saúde dos organismos, porque é a primeira linha de defesa contra agentes patogénicos, em todas as plantas e animais. Nos vertebrados, também potencia a resposta imune adaptativa 1. Portanto, é fundamental que nós somos capazes de avaliar todos os aspectos da resposta imune inata, a fim de entendê-lo melhor e para optimizar a sua função.
Muitos organismos modelo são usados para estudar a imunidade inata, que vão desde a Arabadopsis C. elegans, Drosophila a ratos para as células humanas em cultura. Uma vantagem de se utilizar o peixe-zebra (Danio rerio) sistema modelo para o estudo da imunidade inata é que o peixe-zebra é um vertebrado, com tanto inata e adaptativa imdade, mas o desenvolvimento da imunidade inata e adaptativa são temporalmente segregados. Zebrafish dependa exclusivamente de imunidade inata para a proteção contra a infecção até que a imunidade adaptativa torna-se totalmente funcional, que ocorre cerca de 4-6 semanas após a fertilização 2. Além de ferramentas para a manipulação genética, a claridade óptica e rápido desenvolvimento, externa, a imunidade inata como o modo de princípio de defesa em embriões de peixe-zebra fornece um modelo simplificado para se estudar a complexidade da resposta imune inata in vivo.
Vários protocolos têm sido desenvolvidas para avaliar diferentes facetas da resposta imune inata em embriões de peixe-zebra. Microarrays e RNAseq validaram que os perfis de citoquinas induzidas pela resposta imune inata do peixe-zebra são semelhantes aos de humanos e têm também sugerido o envolvimento de genes inesperados na imunidade inata 3,4. A transparência do embrião de peixe-zebra e fluorescente, transgénicacepas ic de patógenos e zebrafish permitir a visualização de interações patógeno-hospedeiro dinâmicos in vivo em tempo real. Embriões de peixes-zebra transgénicos que expressam a GFP sob o controlo do promotor específico de mieloperoxidase de neutrófilos 5,6 ou o MPEG1 promotor específico de macrófago 7 tornaram possível visualizar e quantificar a migração dos fagócitos para os locais de infecções localizadas 8, bem como para visualizar a fagocitose e destruição de marcada com fluorescência patógenos 8,9. Embriões de peixes-zebra também são susceptíveis à geração de ensaios de alto rendimento e telas químicos. Por conseguinte, recentemente, têm sido desenvolvidos métodos de alto rendimento de análise do transcriptoma por infecção 10 e fagócitos migração para os locais de lesão induzida quimicamente 11.
Das técnicas listadas acima, nenhum avaliar quantitativamente a fase final de destruição patógeno pelos fagócitos. Esta fase finalenvolve uma explosão respiratória (ou seja, produção de ROS e outros compostos tóxicos), que matam os patógenos engoliram. A enzima NADPH-oxidase é uma importante fonte de ROS nas células fagocíticas. Montagem das subunidades dos resultados da enzima NADPH-oxidase de transferência de electrões para o oxigénio, a geração de superóxido. Por meio de reacções enzimáticas subsequentes, superóxido pode então ser convertido em peróxido de hidrogénio e ácido hipocloroso (Figura 1A). É o colapso respiratório de fagócitos que mata organismos patogénicos e assim, a quantificação do potencial de explosão respiratória de embriões de peixes-zebra é indicativo de saúde global imune inata. Foi desenvolvido um ensaio baseado em fluorescência para quantificar a explosão respiratória em grupos de embriões de peixes-zebra individuais 12. Este ensaio utiliza a forma não-fluorescente, reduzida de um corante disponível comercialmente, de células-permeável. Este corante, 2 ', 7'-dichlorodihydrofluorescein diacetato (H2DCFDA), é convertido para o fluocomposto cento, 2 ', 7'-diclorofluoresceína (DCF), por oxidação. As diversas ROS geradas pela explosão respiratória dos fagócitos podem oxidar H2DCFDA e gerar fluorescência 24. O aparecimento de fluorescência pode ser utilizado para quantificar e comparar a resposta de explosão respiratória entre grupos de peixe-zebra. A proteína quinase C de etilo agonista de miristato de forbol (PMA) é utilizado para induzir quimicamente NADPH-oxidase para a produção de ROS e, assim, aumentar as leituras de fluorescência (Figura 1B). Aqui, nós fornecemos um protocolo detalhado de uma versão modificada e optimizada deste ensaio explosão respiratória embrião do peixe-zebra. Este ensaio pode ser utilizado para comparar a explosão respiratória entre grupos de embriões de peixes-zebra individuais ao longo do tempo e / ou em resposta a manipulações experimentais (por exemplo, proteína de knockdown morfolino-mediada). O uso deste método, em conjunto com outros ensaios de imunidade inata peixe-zebra, irá fornecer uma imagem mais completa do complexo e críticoresposta imune inata.
Protocolo
1. Cuidados e Manutenção Zebrafish
- Pecuária: desova Mass adulto zebrafish como descrito anteriormente 13. Recolhe embriões gerados como anteriormente descrito 14.
- Microinjecção (se for o caso): Microinject 1-4 estágio de células de embriões de peixes-zebra com oligonucleótidos morfolino para knockdown produtos do gene ou ARNm para sobre-expressar os produtos dos genes, como previamente descrito 15.
- Manter uma piscina adequada de falsa controles injetados (pelo menos 48 localização, simulada injetado peixes de controle e 48 de vida, o peixe experimentalmente manipulados são necessários para preencher uma microplaca de 96 poços).
- Manter os embriões: crescer embriões em placas de petri de profundidade a 28 ° C em água de ovo (60 mg / ml instantâneo Oceano sal do mar em água destilada autoclavada de água) até o estágio de desenvolvimento desejado (a resposta explosão respiratória não é detectável usando esse protocolo em embriões de peixe-zebra com menos de 2 dias após a fertilização 12). Nota: Foi observed que a prevenção da pigmentação em embriões de peixe-zebra, quer através da utilização de 1-fenil-2-tioureia (PTU) ou peixe-zebra mutante golden/slc24a5 não altera significativamente a indução de fluorescência por PMA (dados não publicados, embriões testados aos 48, 72, e 96 hpf).
- Retirar embriões mortos diariamente com uma pipeta de transferência de plástico.
- Decantar cuidadosamente água ovo velho e reabastecer com água nova ovo por dia.
- Embriões Dechorionate: No dia da experiência, os embriões dechorionate (se embriões ainda estão nas suas córions) como descrito anteriormente usando duas pinças finas 14 (este ensaio explosão respiratória também podem ser realizadas sobre os rins dissecados de peixes-zebra adultos de 12 e protocolos detalhados para rim dissecção a partir do peixe-zebra adultos foram previamente descritos 16,17).
2. Preparação de Solução
- Prepare uma solução estoque de H2DCFDA: Pesar 1 mg de H2DCFDA.
- Dissolve 1 mg de H2DCFDA em 1 ml de dimetil-sulfóxido (DMSO) para fazer uma solução estoque de 1 mg / ml.
- Faça 22 mL alíquotas desta solução estoque em 1,7 ml microtubos.
- Enrole as alíquotas de solução estoque H2DCFDA em papel alumínio e manter no escuro, sempre que possível, porque H2DCFDA é sensível à luz.
- Alíquotas loja H2DCFDA a -20 ° C por até 3 meses.
- ATENÇÃO - Prepare uma solução estoque de acetato de forbol miristato (PMA): Pesar 1 mg de PMA utilizando equipamento adequado de protecção individual (ou seja, luvas, óculos e máscara).
- Dissolve-se PMA em 1 ml de DMSO para produzir uma solução stock de 1 mg / ml.
- Faça 11 mL alíquotas de 1,7 ml microtubos.
- Armazenar aliquotas de uma solução de estoque de PMA a -80 ° C durante até 3 meses.
- Preparar uma solução de trabalho de H2DCFDA: No dia da experiência, fazer uma solução de trabalho de H2DCFDA pela adição de 1 parte de solução de estoque de um H2DCFDADMSO parte (500 mg / ml H2DCFDA concentração final). Por exemplo, adicionar 20 ml de solução estoque H2DCFDA e 20 mL de DMSO a uma folha envolto 1,7 ml tubo de microcentrífuga.
- Preparar uma solução de trabalho de PMA: No dia da experiência, fazer uma solução de trabalho de PMA por adição de 1 parte de solução de estoque de PMA a 49 partes por nucleases água livre (20 ug / ml de concentração final de PMA). Por exemplo, diluir 10 mL de solução stock PMA em 490 mL de água livre de nuclease em um tubo de 1,7 ml de microcentrífuga.
- Prepara-se uma solução de dosagem de H2DCFDA: No dia da experiência, fazer uma solução de dosagem H2DCFDA com uma concentração final de 1 ug / ml em água H2DCFDA ovo. Os volumes das soluções preparadas de dosagem pode ser modificado como desejado, mas asseguram que as concentrações finais dos reagentes são mantidos. Para rins, em vez de água do ovo, usar o mesmo volume de medium/F-12 modificado por Dulbecco Eagle (50% de DMEM, 50% de F-12, sem vermelho de fenol). Para tornar a 5 ml de H2DCFDAsolução de dosagem, use uma pipeta de 5 ml sorológico para transferir 5 ml de água ovo (ou DMEM/F-12) em um tubo de centrífuga de 15 ml cônico embrulhadas em papel alumínio e rotulados 'H'.
- Retirar 10 ml de água do ovo (ou DMEM/F-12) a partir das 15 ml tubo cônico rotulados 'H' e descartar.
- Adicionar 10 ml de solução de trabalho H2DCFDA no tubo de 15 ml rotulados 'H' e vortex para misturar (este volume é suficiente para 48 embrião ou amostras de rim (metade de um total de 96 poços de microplaca) e esses poços irá fornecer medições do nível de fluorescência de fundo).
- Prepara-se uma solução de dosagem de H2DCFDA + PMA: No dia da experiência, fazer uma solução de H2DCFDA + PMA dosagem com concentrações finais de: H2DCFDA - 1 ug / ml e PMA - 400 ng / ml. Para tornar a 5 ml de solução de dosagem H2DCFDA + PMA, utilizar uma pipeta de 5 ml serológico para transferir 5 ml de água de ovo (ou DMEM/F-12) para um novo tubo de 15 ml rotulados 'H + P'.
- Remover 110 _6; l de água do ovo (ou DMEM/F-12) a partir das 15 ml tubo cônico rotulados 'H + P' e descartar.
- Adicionar 10 ul de solução de trabalho de H2DCFDA, depois adicionar 100 mL de solução de trabalho de PMA no tubo de 15 ml rotulados 'H + P' e vortex para misturar (este volume é suficiente para 48 amostras ou a outra metade de um total de 96 poços de microplacas ).
- Manter as soluções de dosagem no gelo.
3. Programação Leitora
- Preparar instrumento: Ligue o leitor de microplacas.
- Aqueça-se a fonte de luz.
- Estabelecer um programa para ler a fluorescência: por exemplo, Excitação: 485 nm; emissão: 528 nm; Optics Posição: top 510 nm; Sensibilidade: 65, com um passo tremendo 5 segundos antes da leitura.
4. Microplaca de 96 poços Set Up (ver Figura 2)
- Reúna suprimentos: obter pratos com embriões dechorionated, preto microplaca de 96 poços, p200 pipeta edicas, balde de gelo com H2DCFDA e soluções de dosagem H2DCFDA + PMA, multicanal p200 pipeta, dois reservatórios estéreis, folha de alumínio, e uma tesoura.
- Transferência de um embrião em cada poço de uma microplaca de 96 poços: Use a tesoura para cortar uma ponteira de tal forma que os embriões ou rins passar pela abertura.
- Definir um pipetador de p200 para 100 ul e transferir um embrião, juntamente com a água do ovo (ou DMEM/F-12) em que muitos dos poços de uma microplaca de 96 poços preta como desejado (que não é necessário mudar a ponta de pipeta para cada diferente amostra do embrião dentro de uma condição experimental, mas pode ser necessário para mudar entre as pontas condições experimentais). Certifique-se de evitar a transferência de córions residuais, uma vez que estes tendem a distorcer os dados coletados. Para a transferência dos rins, uma pipeta de volume maior (definida como 100 ul) pode ser utilizado e as pontas das pipetas pode ser cortada para se obter um tamanho maior do furo, se necessário. Pode ser necessário incorporar poços sem amostras de embrião ou de rim, mas comas soluções de dosagem para controle de algumas manipulações experimentais.
- Adicionar soluções de dosagem: despeje solução de dosagem H2DCFDA em um estéril 25 ml reservatório.
- Usar uma pipeta multicanal p200 e oito pontas de pipeta, simultaneamente 100 jil de solução de dosagem H2DCFDA em uma coluna na microplaca de 96 poços (500 concentração ng / ml final H2DCFDA).
- Repita este (trocando as pontas não é necessário) para as colunas desejado (geralmente seis colunas ou 48 poços se preenchendo toda uma microplaca de 96 poços). Adicionar esta solução a metade das amostras de controlo e de embrião de metade das amostras de embrião experimentalmente manipuladas (por exemplo, de 96 poços de microplacas configuração é mostrado na Figura 2, estes poços (cor de laranja) irá fornecer dados de fluorescência de fundo em amostras não induzidas com PMA) .
- Verter a solução de dosagem H2DCFDA + PMA numa nova, estéril 25 ml de reservatório.
- Use um p200 pipeta multicanal e oito dicas para Simultaneously pipeta 100 uL da solução de dosagem H2DCFDA + PMA nas colunas restantes (cor vermelha na Figura 2) da microplaca de 96 poços (mudar as pontas não é necessário, as concentrações finais de H2DCFDA-500 ng / ml e PMA a 200 ng / ml) .
- Cobrir a microplaca com papel alumínio.
- Agitar a microplaca por aproximadamente 20 segundos a 150 rpm para homogeneizar as soluções em cada poço.
- Incubar a microplaca a 28 ° C quando não está a ser lida.
5. Fluorescência Quantificação
- Leia a microplaca no tempo = 0 horas após a adição do PMA usando os parâmetros descritos no passo 3.1.2.
- Continuar a tomar medidas a cada poucos minutos, para o intervalo de tempo desejado ou incubar a folha enrolada microplaca a 28 ° C até um ponto de tempo mais tarde e, em seguida, fazer uma medição de ponto de extremidade a um tempo desejado (por exemplo, 4 horas após a adição do PMA).
- Use um plástico transferência pipeta para recuperar os embriões a partir dos poços.
- Eutanásia os embriões de acordo com o seu cuidado com os animais e protocolo de uso, por exemplo, imersão em tricaina MS222.
- Descarte a microplaca e outros materiais descartáveis no recipiente de resíduos de risco biológico.
6. Análise de Dados
- Decidir sobre o ponto no tempo em que você gostaria de comparar os valores de fluorescência (por exemplo, 4 horas após a adição de PMA, a Tabela 1).
- Subtrair o valor de fluorescência do grupo controle média induzida por un dos valores de fluorescência do grupo controle induzido por PMA individual.
- Repita este procedimento para o grupo experimental com e sem PMA.
- Armazene esses valores de fluorescência normalizados em duas colunas, o controle + grupo PMA eo experimental + grupo PMA (Tabela 2).
- Calcular as médias e desvios-padrão para os valores de fluorescência normalizados do controle + PMA group eo grupo + PMA experimental.
- Comparar os valores de fluorescência normalizados utilizando um teste t não emparelhado para determinar a significância estatística (Tabela 2).
- Gráfico dos meios de controle + grupo + PMA eo grupo PMA experimental com barras de erro refletindo os desvios padrões apropriados.
- Registe o nível de significância no gráfico e na legenda da figura (Figura 2).
Resultados
Aqui, nós fornecemos dados comparando a resposta explosão respiratória em embriões de peixe-zebra (tipo selvagem, AB de fundo) em 48 e 72 horas pós fertilização (hpf). Os 48 embriões HPF atuou como nosso grupo controle e os 72 hpf embriões como nosso grupo experimental. O tamanho da amostra utilizada foi de 24 embriões induzida por un e 24 embriões induzidas PMA por estágio de desenvolvimento. Leituras de fluorescência em bruto (em unidades de fluorescência relativas (RFU)) foram obtidas através da leitura da microplaca 4 horas após a adição do PMA. Os valores de fluorescência primas são fornecidos na Tabela 1. Valores de fluorescência-primas foram sempre superiores nos 48 HPF embriões induzida por un do que os 72 embriões induzida por un HPF, com a exceção de um embrião 72 hpf (significa: 48 hpf = 758 RFU, 72 HPF = 230 RFU). A variabilidade dentro destas duas amostras foi aproximadamente igual (desvio padrão: 48 hpf = ± 549 RFU, 72 hpf = ± 513 RFU), mas o grupo de 72 hpf variou mais em relação à média (deviatio padrãon como uma porcentagem da média: 48 hpf = 72%, 72 hpf = 223%). Nos grupos induzidos pelo PMA, os valores de fluorescência matérias eram em sua maioria mais elevada na população hpf 72 (significa: 48 hpf PMA = 3798 RFU, 72 hpf PMA = 5825 RFU). Houve uma maior variabilidade no grupo induzida por PMA 72 hpf do que o grupo 48 hpf induzida por PMA (desvio padrão: 48 hpf PMA = 831 RFU, 72 hpf PMA = 1365 RFU), mas a variabilidade no que diz respeito à média foi aproximadamente igual (48 hpf PMA = 22%, 72 hpf PMA = 23%).
Para levar em conta a variabilidade nos níveis de fluorescência de fundo, os valores de fluorescência normalizados foram calculados (valor induzida por PMA menos a média dos valores induzidos por un do estádio de desenvolvimento apropriado). Estes valores de fluorescência normalizados são fornecidos na Tabela 2, juntamente com as médias, desvios padrão e p-valor para os 48 e 72 hpf grupos. Um gráfico de dados é fornecido na Figura 2. Os valores de fluorescência normalizados são consistentemente oigher no grupo 72 hpf que o grupo hpf 48 (significa: 48 hpf = RFU 3040, 72 hpf = 5596 RFU) e a variabilidade é semelhante em relação à média (48 hpf = 27%, 72 hpf = 24%). Este ensaio explosão respiratória revelou que os embriões 72 hpf peixe-zebra são capazes de produzir mais ROS e, portanto, montar uma resposta explosão respiratória mais robusto do que 48 hpf embriões após a indução com PMA. Esta descoberta pode ser devido a um aumento do número de células, incluindo um aumento do número de granulócitos 18, em 72 embriões hpf em comparação com 48 embriões hpf. Um teste t desemparelhados para comparar estatisticamente os dados confirmaram que a resposta de explosão respiratória é significativamente diferente em 72 embriões hpf de 48 hpf embriões (* p = 2 x 10 -9).
Num sentido mais geral, o ponto de tempo t = 0 horas, após a adição do PMA, os valores de fluorescência em bruto não deve ser estatisticamente diferente entre o PMA-induzida e os grupos induzida por un. Os valores de fluorescência matérias serão cada veze ao longo do tempo em ambos os exemplos não-induzidas e induzidas, com um aumento muito maior que ocorrem nos embriões induzidas por PMA 12. O aumento nos valores de fluorescência matérias do grupo induzida por PMA, em comparação com o grupo induzida por un, vai tornar-se estatisticamente significativo em cerca de 1-2 horas após a adição do PMA (dependendo do estádio de desenvolvimento dos embriões de peixe-zebra, com mais velhos embriões a montagem de uma resposta mais rápida explosão respiratória do que os embriões mais jovens). Valores de fluorescência normalizados (induzida por un menos induzido) deve aumentar com o aumento do estágio de desenvolvimento de embriões de peixes-zebra, com a maior diferença que ocorre entre 48 e 72 horas pós-fertilização e uma diferença menor do que ocorre entre 72 e 96 horas pós-fecundação. Números de fluorescência primas deve ser 5 a 60 vezes mais elevada no grupo induzida por PMA em relação ao grupo-induzida un, dependendo da fase de desenvolvimento dos embriões de peixes-zebra (entre 48 e 96 horas pós-fertilização). Variaçãoocorrerá entre as amostras de embriões de peixes-zebra individuais, assim, recomenda-se que cerca de 24 amostras de embriões por tratamento ser utilizado.
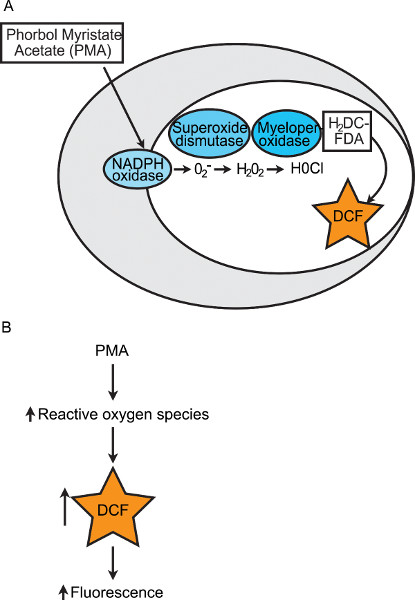
Figura 1. Diagrama da indução química da explosão respiratória dentro de um fagócito. (A) Neste ensaio a explosão respiratória, PMA é utilizado para induzir a produção de superóxido por NADPH-oxidase. Superóxido é convertido em oxigénio e peróxido de hidrogénio por superóxido dismutase. De peróxido de hidrogénio e cloreto de aniões são convertidos em ácido hipocloroso por mieloperoxidase. O corante não fluorescente, H2DCFDA, é convertido no composto fluorescente, DCF, quando oxidado por muitos diferentes ROS. (B) Esquema de como a quantificação de fluorescência é uma leitura de resposta a explosão respiratória.
lt = "Figura 2" fo: content-width = "4.5in" src = "/ files/ftp_upload/50667/50667fig2.jpg" />
Figura 2. Esquemática do desenho experimental para o ensaio de explosão respiratória. Individual dechorionated embriões de peixe-zebra são transferidas para os poços de uma microplaca de 96 poços. Os poços em branco contêm descritas embriões de controlo e os poços descritos no preto conter embriões a partir do grupo experimental. Soluções de doseamento H2DCFDA ou H2DCFDA + PMA são adicionados aos poços apropriados (coloridos de laranja ou vermelho, respectivamente). A fluorescência é quantificada utilizando um leitor de microplacas. Dados de ensaio explosão respiratória é então analisado, em comparação, e apresentados. A tabela nesta figura é um subconjunto dos valores de fluorescência normalizadas indicadas no Quadro 2. O gráfico neste valor inclui as médias, desvios-padrão e p-valor para todo o conjunto de dados apresentados neste manuscrito, que também é exibido na Tabela 2. * P = 2 X 10 - 9.
Tabela 1. Valores de fluorescência-primas de induzida por un (fundo alaranjado) e induzida (fundo vermelho) 48 ou 72 horas após a fertilização (hpf) embriões de peixe-zebra (números brancos ou pretos, respectivamente) a 4 horas após a adição de PMA. A média é calculada para as amostras induzidas un.
| 48 embriões HPF | 72 embriões HPF | ||||
| 408 | 326 | 358 | 92 | 83 | 208 |
| 276 | 381 | 1124 | 473 | 106 | 86 |
| 518 | 180 | 1085 | 110 | 93 | 109 |
| 1196 | 232 | 380 | 143 | 152 | 81 |
| 1416 | 339 | 735 | 123 | 85 | 81 |
| 489 | 390 | 347 | 110 | 98 | 118 |
| 2139 | 1183 | 1015 | 95 | 97 | 2609 |
| 1660 | 385 | 1630 | 111 | 115 | 136 |
| Significar | 758 | 230 | |||
| 48 embroys HPF + PMA | 72 embriões HPF + PMA | ||||
| 4713 | 2868 | 5144 | 3051 | 4868 | 4880 |
| 2978 | 4768 | 1998 | 5662 | 6144 | 4635 |
| 4460 | 3733 | 2984 | 7052 | 4429 | 6672 |
| 4026 | 3978 | 3311 | 4848 | 8489 | 6154 |
| 3169 | 5024 | 3543 | 5783 | 5621 | 5504 |
| 3742 | 2970 | 4628 | 6765 | 6016 | 5958 |
| 3728 | 3711 | 4637 | 5678 | 7638 | 5831 |
| 2525 | 4232 | 4288 | 3272 | 6123 | 8735 |
Tabela 2. A normalização e comparação estatística dos dados. Para obter valores de fluorescência normalizados, o cálculo da diferença entre cada valor de fluorescência induzida por PMA e o valor médio induzido por un apropriado. Estatisticamente comparar estes dois conjuntos de dados utilizando um teste t não pareado. Calcular as médias e desvios-padrão. Apresentar as médias, desvios padrão e p-valor (es) de forma gráfica (como na Figura 2).
Discussão
A principal função dos fagócitos é detectar, engolfar e destruir patógenos. A capacidade dos fagócitos para produzir uma explosão respiratória adequado é crítico para esta função. Assim, a quantificação da resposta explosão respiratória é um método para permitir a comparação de saúde imune inato geral e função entre grupos de indivíduos e / ou em resposta a manipulações experimentais. Aqui, nós descrevemos um protocolo para induzir, quantificar e comparar a resposta explosão respiratória entre grupos de embriões de peixes-zebra individuais. Em suma, PMA resulta na produção de ROS pela enzima NADPH-oxidase. Estes ROS agir sobre um corante não fluorescente e oxidam para formar um composto fluorescente. Um leitor de microplacas é usado para detectar a fluorescência relativa em cada poço. Fluorescência gerada após indução PMA é indicativo do potencial de explosão respiratória e saúde imune inato geral de embriões de peixe-zebra. A comparação do nível normalizado de fluocência entre PMA grupos induzidos usando um teste t não emparelhado pode ser utilizado para determinar se existe uma diferença significativa no potencial de explosão respiratória entre grupos de peixe-zebra. Manipulações experimentais que resultam em diferenças significativas na resposta explosão respiratória irá fornecer insights sobre os mecanismos da imunidade inata, por exemplo, produtos de genes necessários para a explosão respiratória de fagócitos, medicamentos que potencializam ou antagonizam a resposta explosão respiratória.
Protocolos de ensaio diferentes facetas da resposta imune inata no modelo peixe-zebra foram desenvolvidos (ver Introdução). Relativamente poucas dessas técnicas medir a produção de ROS. A técnica detalhado neste artigo quantifica a produção de ROS em embriões de peixes-zebra com a estimulação de uma resposta imune inata com PMA. Esta técnica é semelhante a explosão respiratória ensaios realizados em amostras de sangue total, isolado, em que a PMA é também utilizado para induce uma resposta a explosão respiratória, e em seguida, o ROS são gerados medida utilizando um substrato fluorogénico (por exemplo Phagoburst, ORPEGEN Pharma). O método descrito aqui pode ser utilizado com embriões de peixes-zebra inteiras, bem como rins dissecados de peixes-zebra adulto 13, como o rim anterior do peixe-zebra é análoga à da medula óssea humana, que é o sítio da hematopoiese adulta 19. O método aqui descrito também é suficientemente versátil para ser usado com outras espécies de peixe e de sistemas celulares, como por exemplo preparações de células de rins vairão 20.
Um método alternativo para a detecção de ROS em embriões de peixe-zebra inteiros faz uso de um in vivo do sensor de peróxido de hidrogénio. O RNA mensageiro para uma proteína fluorescente sensível ao redox é injectado em embriões de peixe-zebra e a taxa de fluorescência é monitorado ao longo do tempo a seguir a cauda da aleta ferindo 21. Este sensor redox geneticamente codificado permite a visualização do temporal edinâmica espacial da produção de peróxido de hidrogênio in vivo. A aplicação deste método revelado o resultado surpreendente de que o peróxido de hidrogénio produzido inicialmente precedida chegada das primeiras células imunitárias inatas, sugerindo que o peróxido de hidrogénio libertado por células epiteliais feridos actua como um sinal para recrutar fagócitos 21. Esta técnica, embora poderoso e informativo, envolve demorado e procedimentos embriológicos e microscopia tecnicamente difíceis. Este sensor redox também é específico para o peróxido de hidrogénio, que apenas uma das muitas ROS funcionamento durante a resposta imune inata é.
Em comparação com a abordagem acima discutido, o nosso método também mede in vivo de ROS, e ainda é tecnicamente menos exigente e usa um produto químico para induzir uma resposta imune inata em vez de uma ferida física. Em contraste com o método acima, que mede especificamente a produção de peróxido de hidrogénio, mede o nosso procedimentonível total de ROS. Uma vantagem para a detecção de um único ROS é que as funções para que o composto sozinho na imunidade inata pode ser elucidado. Semelhante ao método descrito acima, a nossa abordagem também partilha as vantagens e desvantagens inerentes de ser realizado em todo o animal. As interações entre os fagócitos e seu meio ambiente, que são eliminados quando ensaios de explosão respiratória são realizados em amostras de sangue isoladas, são preservados nestes ensaios em animais inteiros. Entretanto, o uso de todo o animal que resulta em detecção de ROS a partir de fontes não-fagócitos (por exemplo mitocondrial derivados ROS, nonphagocyte NADPH oxidase). Numa tentativa para abordar a especificidade do nosso método para a detecção de ROS derivado de fagócitos, que se refere a um estudo no qual este ensaio explosão respiratória foi realizada em embriões de peixe-zebra falta específicos de NADPH oxidase de fagócitos 9. Específicos do fagócito NADPH-oxidase foi inibida através de batida mediada por morfolino baixo de p47phox ou p91pproteínas Hox. Em embriões de peixe-zebra, no estágio de desenvolvimento ensaiadas, a expressão destas subunidades da NADPH-oxidase é restrito a um subconjunto de células sanguíneas, provavelmente macrófagos 22,23. O potencial de explosão respiratória de embriões que faltam específicos de NADPH oxidase de fagócitos é aproximadamente um terço do que controles 9 (comunicação pessoal, Dr. Robert Wheeler). Este resultado sugere que, enquanto o nosso ensaio de explosão respiratória faz detectar ROS a partir de outras fontes do que os fagócitos, a maior parte da fluorescência detectada pode ser atribuído à explosão respiratória via de NADPH-oxidase dos fagócitos. Além disso a especificidade deste ensaio foi demonstrada usando bis-indolilmaleimida I (BISI), um inibidor farmacológica da proteína quinase C, para evitar a acção de PMA, um agonista de proteína quinase C, em NADPH-oxidase. Pré-tratamento de rins de peixe-zebra induzidas por PMA ou embriões com BISI resultou em níveis semelhantes aos controlos de fluorescência induzida por un 12. Um respiratória idealensaio de ruptura seria um ensaio de elevado débito, in vivo, onde específicos de fagócitos ROS poderia ser tanto quantificadas e visualizadas ao longo do tempo. Até é possível, a natureza rápida e facilidade técnica do método descrito aqui fornece uma alternativa útil.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer os membros antigos e atuais do laboratório de Kim, Mark Nilan para o cuidado e manutenção do peixe-zebra, o Dr. Robert Wheeler para discussões úteis e compartilhamento de dados, e NIH concede 3RO1GM087308-02S1 e 1P20RR024475-01A2 eo Agrícolas e Florestais Maine Experiment Station (Publicação Número 3303) para financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Instant Ocean Sea Salt | Instant Ocean | SS15-10 | |
| H2DCFDA | Sigma Aldrich | 35845-1G | |
| PMA | Fisher | BP6851 | |
| DMSO | Sigma Aldrich | D2438-5X10ML | |
| Tricaine S MS222 | Western Chemical | 100 grams | |
| DMEM/F-12, No Phenol Red | Life Technologies | 11039-021 | |
| Deep Petri Dishes | VWR | 89107-632 | |
| Plastic Transfer Pipettes | Fisher | 13-711-7M | |
| #5 Dumont Forceps | Electron Microscopy Sciences | 72700-D | |
| 1.7 ml Micro Centrifuge Tubes | Axygen | 10011-724 | |
| 15 ml Conical Centrifuge Tubes | VWR | 21008-918 | |
| 5 ml Serological Pipettes | Greiner Bio One | 606180 | |
| Synergy 2 Multi-Mode Microplate Reader | BioTek | Contact BioTek | |
| Black 96 Well Microplate | VWR | 82050-728 | |
| 25 ml Sterile Reservoirs | VistaLab | 3054-2003 | |
| P200 Pipettor | Gilson | F123601 | |
| Multichannel Pipettor | VWR | 89079-948 | |
| Pipette Tips | VWR | 89079-478 |
Referências
- Medzhitov, R., Janeway, C. A. Jr Innate Immunity: Impact on the Adaptive Immune Response. Current Opinion in Immunology. 9, 4-9 (1997).
- Lam, S. H., Chua, H. L., et al. Development and Maturation of the Immune System in Zebrafish, Danio rerio: A Gene expression Profiling. In Situ Hybridization and Immunological. 28, 9-28 (2004).
- Stockhammer, O. W., Zakrzewska, A., et al. Transcriptome Profiling and Functional Analyses of the Zebrafish Embryonic Innate Immune Response to Salmonella Infection. J Immunol. 9. 9, 5641-5653 (2009).
- Ordas, A., Hegedus, Z., et al. Deep Sequencing of the Innate Immune Transcriptomic Response of Zebrafish Embryos to Salmonella Infection. Fish & Shellfish Immunology. 31, 716-724 (2011).
- Renshaw, S. A., Loynes, C. A., et al. A Transgenic Zebrafish Model of Neutrophilic Inflammation. Blood. 13, 3976-3978 (2006).
- Mathias, J. R., Perrin, B. J., et al. Resolution of Inflammation by Retrograde Chemotaxis of Neutrophils in Transgenic Zebrafish. J. Leukoc. Biol. 6, 1281-1288 (2006).
- Ellett, F., Pase, L., et al. mpeg1 Promoter Transgenes Direct Macrophage-Lineage Expression in Zebrafish. Blood. 4, 56-56 (2011).
- Phennicie, R. T., Sullivan, M. J., et al. Specific Resistance to Pseudomonas aeruginosa Infection in Zebrafish is Mediated by the Cystic Fibrosis Transmembrane Conductance Regulator. Infect. Immun. 11, 4542(2010).
- Brothers, K. M., Newman, Z. R., et al. Live Imaging of Disseminated Candidiasis in Zebrafish Reveals Role of Phagocyte Oxidase in Limiting Filamentous Growth. Eukaryotic Cell. 7, 932-944 (2011).
- Rotman, J., van Gils, W., et al. Rapid Screening of Innate Immune Gene Expression in Zebrafish using Reverse Transcription - Multiplex Ligation-Dependent Probe Amplification. BMC Research Notes. 4, (2011).
- d'Alencon, C. A., Pena, O. A., et al. A High-Throughput Chemically Induced Inflammation Assay in Zebrafish. BMC Biology. 8, 151(2010).
- Hermann, A. C., Millard, P. J., et al. Development of a Respiratory Burst Assay using Zebrafish Kidneys and Embryos. Journal of Immunological Methods. 292, 119-129 (2004).
- Avdesh, A., Chen, M., et al. Regular Care and Maintenance of a Zebrafish (Danio rerio) Laboratory: An Introduction. J. Vis. Exp. (69), e4196(2012).
- Brothers, K. M., Wheeler, R. T. Non-invasive Imaging of Disseminated Candidiasis in Zebrafish Larvae. J. Vis. Exp. (65), e4051(2012).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113(2009).
- Gerlach, G. F., Schrader, L. N., et al. Dissection of the Adult Zebrafish Kidney. J. Vis. Exp. (54), e2839(2011).
- Gupta, T., Mullins, M. C. Dissection of Organs from the Adult Zebrafish. J. Vis. Exp. (37), e1717(2010).
- Le Guyader, D., Redd, M. J., et al. Origins and Unconventional Behavior of Neutrophils in Developing Zebrafish. Blood. 111, 132-141 (2008).
- Davidson, A. J., Zon, L. I. The 'Definitive' (and 'Primitive') Guide to Zebrafish Hematopoiesis. Oncogene. 23, 7233-7246 (2004).
- Jovanovic, B., Goetz, F. W., et al. Immunological Stimuli Change Expression of Genes and Neutrophil Function in Fathead Minnow Pimephales promelas Rafinesque. Journal of Fish Biology. 78, 1054-1072 (2011).
- Niethammer, P., Grabher, C., et al. A Tissue-Scale Gradient of Hydrogen Peroxide Mediates Rapid Wound Detection in Zebrafish. Nature. 459, 996-1000 (2009).
- Thisse, B., Pflumio, S., et al. Expression of the zebrafish genome during embryogenesis. (NIH R01 RR15402). ZFIN Direct Data Submission. , (2001).
- Thisse, B., Thisse, C. Fast Release Clones: A High Throughput Expression Analysis. ZFIN Direct Data Submission. , (2004).
- Table 18.4. The Molecular Probes Handbook. , 11th, Forthcoming.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados