Method Article
呼吸爆发的响应为先天免疫健康的斑马鱼中的指标量化
摘要
先天免疫反应保护免受病原体感染的生物体。先天免疫反应的一个重要组成部分,吞噬细胞呼吸爆发,产生活性氧杀死入侵的微生物。我们描述了量化时所产生的先天免疫反应的化学诱导的活性氧呼吸爆发测定。
摘要
吞噬细胞呼吸爆发是对病原体感染的先天免疫应答的一部分,并涉及生产活性氧(ROS)。 ROS是有毒和功能,吞噬杀灭微生物。巨噬细胞源性活性氧在体内定量分析提供了关于生物体的挂载一个强大的先天免疫反应的能力的信息。在这里,我们描述了一个协议,在化学诱导的巨噬细胞呼吸爆发的整个斑马鱼胚胎量化和比较活性氧。这种方法使得这成为经氧化活性氧荧光无荧光化合物的用途。个人斑马鱼胚胎移入微孔板的孔中并孵育在此荧光底物有或没有呼吸爆发的化学诱导剂。荧光在各孔用酶标仪定量在期望的时间点。荧光读数调整到消除背景荧光,然后合作mpared使用非配对t检验。这种方法允许对斑马鱼胚胎在不同发育阶段以及响应于实验操作,如蛋白质敲低过表达,或与药理学药剂治疗的呼吸爆发潜力的比较。此方法也可用于监测从成年斑马鱼的肾脏和其他一些鱼类物种整个剖分肾脏或细胞制剂的呼吸爆发的反应。我们认为,这一协议的相对简单性和适应性将补充现有的协议,将感兴趣的研究人员谁寻求更好地理解先天免疫反应。
引言
免疫系统是由两个分支:先天免疫和适应性免疫。先天性免疫是进化上比适应性免疫更古老。无脊椎动物是目前认为有只先天免疫,而脊椎动物兼具先天和适应性分支。而适应性免疫赋予具体和持久的免疫力,某些病原体,先天免疫是入侵的细菌,病毒和真菌立即作出反应。先天免疫反应的一个重要方面涉及的细胞因子和趋化因子的释放,从而导致炎症的巨噬细胞( 如巨噬细胞,中性粒细胞)和招聘吞噬和破坏外来入侵者。
成功的先天免疫反应包括:(1)识别入侵微生物的;(2)感应相应的信号级联反应( 如释放细胞因子和趋化因子)的;吞噬细胞(3)适当发展/数量充足;(4)吞噬细胞对感染部位迁移;(5)吞噬病原体;和(6)破坏吞噬微生物。在这些步骤中的任何一个A缺乏可能导致被淹没由主机,并屈服于,感染。一个强大的先天免疫反应是生物体的健康是至关重要的,因为它是抵御病原体的所有植物和动物的第一道防线。在脊椎动物中,它也可加强适应性免疫应答1。因此,我们能够评估,以便更好地理解它,并优化它的功能的先天免疫反应的所有方面它是至关重要的。
许多模式生物用于研究先天免疫,从Arabadopsis为C。线虫到果蝇到小鼠培养的人类细胞。使用斑马鱼( 斑马鱼 )的模型系统来研究先天免疫系统的优点在于,斑马鱼是脊椎动物,既有先天和适应性即时通讯群落,但先天免疫和适应性免疫的发展在时间上分开。斑马鱼仅仅依靠先天免疫保护,防止感染,直到适应性免疫成为功能齐全,它发生在大约4-6周后受精2。除了 遗传操纵,光学透明性和快速,外部开发工具,先天免疫防御如在斑马鱼胚胎的原理模式提供了在其中以研究在体内的先天免疫反应的复杂性的简化模型。
多个协议已被开发,以评估在斑马鱼胚胎的先天免疫反应的不同方面。微阵列和RNAseq已经证实,通过斑马鱼先天免疫反应引起的细胞因子谱是相似于人类和也建议意想不到基因在先天免疫3,4的参与。斑马鱼胚胎和荧光灯,transgen的透明度病原体和斑马鱼集成电路菌株允许动态宿主-病原体相互作用的体内实时可视化。转基因斑马鱼胚胎中表达绿色荧光蛋白在中性粒细胞特异性髓过氧化物酶启动子5,6或巨噬细胞特异性启动子的mpeg1 7的控制使人们有可能以可视化和量化吞噬细胞迁移到局部感染8的网站以及可视化吞噬和破坏荧光标记的病原体8,9。斑马鱼的胚胎也适合进行高通量测定法和化学画面的生成。因此,最近已经开发了感染10和巨噬细胞迁移到化学诱导损伤11的位点后转录组分析的高通量方法。
上面列出的技术中,没有定量评估吞噬细胞破坏病原体的最后阶段。此最后阶段涉及呼吸爆发( 即产生的活性氧和其他有毒化合物),其中杀死吞噬病原体。酶的NADPH氧化酶是ROS在吞噬细胞的主要来源。组件的NADPH氧化酶产生的电子转移到氧亚基中,产生超氧阴离子。通过随后的酶促反应,超氧化物可以被转化成过氧化氢 和次氯酸( 图1A)。它是呼吸爆发吞噬细胞,杀死病原体,因此,斑马鱼胚胎的呼吸爆发潜力的量化指标是总体先天免疫的健康。我们开发了一种基于荧光的测定法来量化在个别斑马鱼胚胎的12个组的呼吸爆发。这个测定法利用市售的,细胞渗透性染料的非荧光,还原形式。这种染料,2',7'-二氯二乙酸酯(H2DCFDA),被转换成荧光%的化合物,2',7'-二氯荧光(DCF),在氧化时。由吞噬细胞呼吸爆发产生的活性氧多样可H2DCFDA氧化并产生荧光24。荧光的外观可以被用来量化和比较斑马鱼的组之间的呼吸爆发的反应。蛋白激酶C激动剂佛波醇肉豆蔻酸乙酸酯(PMA),用于化学诱导NADPH氧化酶产生活性氧,从而提高荧光读数( 图1B)。在此,我们提供的这个斑马鱼胚胎呼吸爆发检测的修改和优化版本的详细协议。此测定法可用于比较在一段时间和/或响应于实验操作( 例如,吗啉代-介导的蛋白敲低)个别斑马鱼胚胎的基团之间的呼吸爆发。使用这种方法时,在与其他斑马鱼先天免疫测定法结合使用,将提供复杂和关键的更完整的图象先天免疫应答。
研究方案
1。斑马鱼的维护与保养
- 畜牧业:质量产卵成年斑马鱼如前所述13。收集如前所述14衍生的胚胎。
- 显微注射(如果需要):微导1-4细胞期斑马鱼胚胎与吗啉代寡核苷酸拦截基因产物或mRNA的过表达的基因产物,如前所述15。
- 保持模拟充足池注入控制(至少48居住,模拟注入控制鱼和48的生活,实验操作的鱼来填补96孔微孔板)。
- 维持胚胎:在卵水生长在深培养皿中胚在28℃(60μg/ ml的即时海上盐在蒸馏水中,高压灭菌),直到所需的发育阶段(使用该协议在斑马鱼胚胎呼吸爆发的反应是不可检测年龄超过2天受精后12)。注意:它一直Øbserved,通过任一反应,用1 -苯基-2 -硫脲(PTU)或golden/slc24a5突变斑马鱼防止色素沉着在斑马鱼胚胎不显著改变荧光由PMA(未公布的数据,胚胎在48,72进行测试,和96的感应HPF)。
- 每天除去死胚用塑料移液管。
- 小心倒出旧鸡蛋水,每天补充新蛋水。
- Dechorionate胚胎:在实验当天,dechorionate胚胎(胚胎是否仍处于绒毛膜)如先前使用(这呼吸爆发测定也可以在从成年斑马鱼12和肾脏详细协议解剖肾脏进行2细镊子14描述从成年斑马鱼解剖先前已经描述16,17)。
2。溶液的制备
- 准备H2DCFDA的储备液:称取1毫克H2DCFDA的。
- 迪ssolve 1毫克H2DCFDA在1ml二甲基亚砜(DMSO)中,制成1毫克/毫升的储备溶液。
- 使1.7 ml离心管这种原液的22微升等分。
- 包裹的H2DCFDA原液在铝箔分装,并保持在黑暗中只要有可能,因为H2DCFDA对光敏感。
- 商店H2DCFDA分装于-20℃可保存3个月。
- 注意-准备的佛波酯(PMA)的储备液:称取1毫克的PMA使用适当的个人防护设备( 如手套,护目镜和面罩)。
- 溶解PMA在1ml的DMSO中,制成1毫克/毫升的储备溶液。
- 使1.7 ml离心管,11微升等份。
- 的PMA原液在-80℃下长达3个月店等分。
- 准备H2DCFDA的工作溶液:在实验当天,通过添加1份H2DCFDA原液1做出H2DCFDA工作溶液部分DMSO(500微克/毫升H2DCFDA最终浓度)。例如,加入20微升的H2DCFDA原液和20微升的DMSO的箔纸包裹1.7毫升离心管中。
- 制备PMA的工作溶液:在实验当天,让一个PMA工作液中加入1份的PMA原液到49份无核酸酶的水(20微克/毫升的PMA的终浓度)。例如,稀释10μLPMA原液在490μL无核酸酶的水1.7 ml离心管。
- 准备H2DCFDA的给药溶液:在实验当天,使用1微克/毫升H2DCFDA在蛋水的终浓度一H2DCFDA给药溶液。给药溶液的制备体积可以被修改为需要,但确保最终浓度试剂被保持。代替鸡蛋水为肾脏,用Dulbecco改良的Eagle氏medium/F-12相同体积(50%DMEM,50%的F-12,无酚红)。为了使5毫升H2DCFDA的给药溶液,用5毫升的血清吸管转移5毫升蛋水(或DMEM/F-12)到15毫升锥形离心管包裹在金属箔和标记“H”。
- 从15毫升锥形管标有“H”和丢弃取出10微升蛋水(或DMEM/F-12)的。
- 加入10μlH2DCFDA工作液到15毫升锥形管标记为'H'和旋涡混合(这个量是足够48胚胎或肾脏样本(半满96孔微孔板)和这些井将提供水平的测量结果的背景荧光)。
- 准备H2DCFDA + PMA的给药溶液:在实验当天,请与终浓度的H2DCFDA + PMA给药溶液:H2DCFDA - 1微克/毫升和PMA - 400毫微克/毫升。为了使加入5ml H2DCFDA + PMA给药溶液,用5毫升的血清吸管转移5毫升蛋水(或DMEM/F-12)到一个新的15毫升锥形管标有“H +的P'。
- 删除110 _6,从15毫升锥形管标有“H +的P'和丢弃升蛋水(或DMEM/F-12)的。
- 加入10μlH2DCFDA工作溶液,再加入100μl的PMA工作液进15毫升锥形管中标记为“H +的P'和涡流混合(此量是足够的48个样本或一个完整的96孔微量培养板的另一半)。
- 置于冰上计量解决方案。
3。酶标仪编程
- 准备工具:上电酶标仪。
- 热身光源。
- 建立一个程序来读取荧光: 如激励:485纳米;发射:528纳米;光学位置:顶部510纳米;灵敏度:65,与前一个读5秒摇步。
4。 96孔微孔板设置( 见图2)
- 收集物资:获取菜肴dechorionated胚胎,黑色96孔微孔板,P200移液器和提示,冰桶用H2DCFDA和H2DCFDA + PMA的给药方案,多渠道P200移液器,二无菌水库,铝箔,和剪刀。
- 转移一个胚胎到96孔微孔板的每个孔:用剪刀剪枪头,使得胚胎或肾脏适合通过开口。
- 设置P200移液器至100μl,并传送一个胚胎随着蛋水(或DMEM/F-12)插入尽可能多的黑色96孔微量培养板的孔中,作为理想的(没有必要改变移液管尖用于每个不同的内的实验条件下胚胎样品,但它可能有必要改变实验条件之间的提示)。一定要避免转移剩余绒毛膜,因为这些往往扭曲收集的数据。对于肾脏的转移,成交量较大移液器(设置为100微升)可以使用和移液器吸头可切割,以获得更大的口径大小,如果需要的话。可能有必要把井无胚胎或肾脏样本,但与给药方案来控制对某些实验操作。
- 添加配料解决方案:倾H2DCFDA给药溶液到无菌25毫升水库。
- 使用多声道的P200移液器和八个技巧,同时吸取100微升的H2DCFDA给药溶液插入96孔微孔板(H2DCFDA 500毫微克/毫升终浓度)一列。
- 作为理想的(通常是六列或48口井,如果填充整个96孔微孔板)为尽可能多的列重复这个(变化的提示是没有必要的)。此溶液加至一半的控制胚胎样品和一半的实验操纵胚胎样品的(一个例子96孔微量培养板设置显示在图2中 ,这些井(着色橙色),将提供背景荧光数据中不诱导用PMA样本) 。
- 倒入H2DCFDA + PMA给药溶液成新,无菌25毫升水库。
- 使用多声道的P200移液器和八个技巧SIMULTaneously吸取100μl的H2DCFDA + PMA给药溶液到剩余的列( 图2中显示为红色)的96孔微量培养板中(改变的提示是没有必要的,终浓度分别为H2DCFDA-500毫微克/毫升和PMA-200毫微克/毫升) 。
- 盖上铝箔微孔板。
- 摇动微孔板为约20秒,在150转均匀化的各溶液很好。
- 孵育微孔板,在28℃时,它不被读取。
5。荧光定量
- 阅读微孔板时间=使用步骤3.1.2中所述的参数加入PMA后0小时。
- 继续进行测量,每隔几分钟所需的时间间隔或孵化箔纸包裹微孔板在28°C,直到稍后的时间点,然后取一个端点测量在所需的时间( 如 4小时,加入PMA后)。
- 使用的塑料T转拨移液管来从各孔的胚胎。
- 根据你的动物护理和使用的协议, 如浸泡在三卡因MS222安乐死的胚胎。
- 出售中的生物危险废物容器的微孔板和其他一次性材料。
6。数据分析
- 决定的时间点,你会在哪个喜欢比较荧光值(加PMA, 表1后如 4小时)。
- 减去个人PMA诱导的对照组的荧光值的平均值未诱导对照组的荧光值。
- 重复此实验组与不PMA。
- 在两列,控+ PMA组和实验+ PMA组( 表2)存储这些荧光强度值。
- 计算平均值和标准偏差的控制+ PMA石斑鱼的荧光强度值p和实验+ PMA组。
- 使用非配对t检验,以( 表2)确定统计显着性比较归一化的荧光值。
- 图中控+ PMA组和实验+ PMA组与误差线反映了相应的标准偏差的方法。
- 记录的意义上的图形和在该图中说明的水平( 图2)。
结果
这里,我们提供48比较在斑马鱼胚胎的呼吸爆发反应(野生型,AB背景)数据和72小时后的受精(HPF)。 48 HPF胚胎担任我们的对照组和72 HPF胚胎作为我们的实验组。所使用的样本量为24未诱导胚胎和24%的发育阶段PMA诱导胚胎。原始荧光读数(以相对荧光单位(RFU))被读出微量的添加PMA的4小时后获得的。在表1中提供的原始荧光值。原始荧光值始终高于在48 HPF未诱导胚胎比72 HPF未诱导的胚胎,除一个72 HPF胚胎(指:48 HPF = 758 RFU,72 HPF = 230 RFU)。这两个样品中的变异性为约等于(标准偏差:48 HPF =±549 RFU,72 HPF =±513 RFU),但72 HPF组变化更相对于平均值(标准deviation作为均值的百分比:48 HPF = 72%,72 HPF = 223%)。在PMA诱导组,原始荧光值多数上涨在72 HPF人口(指:48 HPF PMA = 3798 RFU,72 HPF PMA = 5825 RFU)。有72 HPF PMA诱导组比48 HPF PMA诱导组(标准偏差:48 HPF PMA = 831 RFU,72 HPF PMA = 1365 RFU)更多的变化,但相对于平均值的变化是近似相等(48 HPF PMA = 22%,72 HPF PMA = 23%)。
考虑到变异的荧光的背景电平,归一化的荧光值进行计算(PMA诱导的值减去适当的发育阶段的未诱导的值的平均值)。在表2中提供了这些归一化的荧光值,随着均值,标准差,而对于48和72个高倍视野组的p值。此数据的曲线图在图2中提供。归一化的荧光值一直喜gher 72 HPF组比48 HPF组(指:48 HPF = 3040 RFU,72 HPF = 5596 RFU)和变异性是相对于平均值(48 HPF = 27%,72 HPF = 24%)相似。这种呼吸爆发实验结果显示,72 HPF斑马鱼胚胎能够产生更多的活性氧,因此安装感应比用PMA后48 HPF胚胎更强大的呼吸爆发的响应。此结果可能是由于细胞数目的增加,包括粒细胞18数目的增加,在较48 HPF胚胎72 HPF胚胎。未配对的t-检验进行统计比较数据证实,呼吸爆发的反应是不同的显著在72 HPF胚胎超过48个高倍视野胚胎(* p值= 2×10 -9)。
在更一般的意义上说,在时间点t = 0时加入PMA后小时后,将原始荧光值不应之间的PMA诱导和未诱导组统计学差异。原始荧光值将increasE的时间都在未诱导和诱导的样品,具有大得多的增加发生在PMA诱导胚12中。增加对PMA诱导的组中的原始荧光值,相比于未诱导组,将成为另外PMA(取决于斑马鱼胚胎的发育阶段,与较旧的后约1-2小时统计学显著安装的胚胎比年轻的胚胎更快的呼吸爆发反应)。荧光强度值(负诱导未诱导)要加强与斑马鱼胚胎的日益发展阶段,有48至72小时后受精和之间的72和96小时受精后发生的一个较小的差异发生的最大的区别。原始荧光数字应为5到60倍的PMA诱导组相对于未诱导组中,根据斑马鱼的胚胎(48至96小时后受精)的发展阶段。变异个人斑马鱼胚胎的样品,从而之间会发生,所以建议每次治疗约24胚胎样品中。
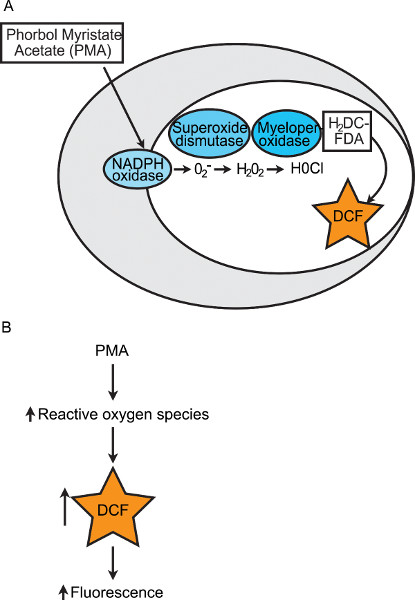
图1。图化学诱导的吞噬细胞内呼吸爆发的。 (一)在本呼吸爆发检测,物业管理公司是由NADPH氧化酶诱导产生超氧阴离子。超氧化物是由超氧化物歧化酶转化为氧气和过氧化氢。过氧化物和氢氯化物阴离子通过髓过氧化物酶转化为次氯酸。非荧光染料,H2DCFDA,被转换成荧光化合物,DCF,当由许多不同的活性氧氧化。如何荧光的定量是一个读出的呼吸爆发反应(B)的示意图。
LT =“图2”FO:内容宽度=“4.5英寸”SRC =“/ files/ftp_upload/50667/50667fig2.jpg”/>
图2。实验设计为呼吸爆发测定的示意图。个人dechorionated斑马鱼胚胎转移到96孔微量培养板的孔中。在白色中列出的水井包含控制胚胎和黑边包含从实验组胚胎的井。 H2DCFDA或H2DCFDA + PMA给药溶液加入到相应的孔中(有色橙色或红色,分别)。荧光用酶标仪定量。然后呼吸爆发实验数据进行分析,比较,并提出。在该图中的表是在表2中显示的荧光强度值的一个子集。在该图中,曲线图包括均值,标准差和对在该手稿提交的整个数据集,这也显示在表2中的p值。 * P = 2×10 - 9。
表1从未诱导原始荧光值(橙色背景)和诱导(红色背景),48或72小时受精后(HPF)的斑马鱼胚胎(白色或黑色的数字,分别)在另外的PMA后4小时。平均值计算为未诱导的样品。
| 48 HPF胚胎 | 72 HPF胚胎 | ||||
| 408 | 326 | 358 | 92 | 83 | 208 |
| 276 | 381 | 1124 | 473 | 106 | 86 |
| 518 | 180 | 1085 | 110 | 93 | 109 |
| 1196 | 232 | 380 | 143 | 152 | 81 |
| 1416 | 339 | 735 | 123 | 85 | 81 |
| 489 | 390 | 347 | 110 | 98 | 118 |
| 2139 | 1183 | 1015 | 95 | 97 | 2609 |
| 1660 | 385 | 1630 | 111 | 115 | 136 |
| 意味着 | 758 | 230 | |||
| 48 HPF embroys + PMA | 72 HPF胚胎+ PMA | ||||
| 4713 | 2868 | 5144 | 3051 | 4868 | 4880 |
| 2978 | 4768 | 1998 | 5662 | 6144 | 4635 |
| 4460 | 3733 | 2984 | 7052 | 4429 | 6672 |
| 4026 | 3978 | 3311 | 4848 | 8489 | 6154 |
| 3169 | 5024 | 3543 | 5783 | 5621 | 5504 |
| 3742 | 2970 | 4628 | 6765 | 6016 | 5958 |
| 3728 | 3711 | 4637 | 5678 | 7638 | 5831 |
| 2525 | 4232 | 4288 | 3272 | 6123 | 8735 |
表2。标准化和数据的统计比较。为了获得荧光强度值,计算每个PMA诱导荧光值及相应的未诱导平均值之间的差异。使用非配对t-检验进行统计学比较这两个数据集。计算平均值和标准偏差。显示均值,标准差,和p值(次)以图表的形式( 如图2)。
讨论
吞噬细胞的主要功能是检测,吞噬和消灭病原体。吞噬细胞,以产生足够的呼吸爆发的能力是此功能是至关重要的。因此,呼吸爆发反应的量化是一种方法,允许的个人和/或响应于实验操作的组之间的一般先天免疫系统的健康和功能的比较。在这里,我们描述了一个协议来诱导,量化,并比较各个斑马鱼胚胎的组间呼吸爆发的响应。总之,PMA导致ROS的产生的酶NADPH氧化酶。这些活性氧作用于一非荧光染料和氧化,以形成一层荧光化合物。酶标仪用于检测相对荧光每个孔中。在PMA诱导产生的荧光指示呼吸爆发潜力和斑马鱼胚胎的一般先天免疫的健康。荧光的归一化水平的比较使用非配对t检验PMA诱导组之间cence可以被用来确定是否有斑马鱼群体之间的呼吸爆发潜力的显著差异。导致呼吸爆发反应显著差异的实验操作将提供深入了解先天免疫机制, 如必要的吞噬细胞呼吸爆发的基因产物,药物,使可能或拮抗呼吸爆发的响应。
协议来测定在斑马鱼模型的先天免疫反应的不同方面已开发(参见引言)。相对较少的这些技术测定ROS的产生。在与物业管理公司的固有免疫应答刺激详情请参阅本文中的技术定量ROS的产生在斑马鱼胚胎。这种技术类似于上孤立的全血样品,其中PMA也用于INDU进行呼吸爆发测定CE侧的呼吸爆发反应,然后生成的活性氧是使用荧光底物( 例如 Phagoburst,Orpegen制药)测定。这里描述的方法可以与整个斑马鱼的胚胎,以及从成年斑马鱼13解剖肾脏被使用,如斑马鱼的头肾,类似于人的骨髓,这是成年造血19的网站。这里描述的方法也灵活,足以与其它鱼的种类和细胞系统,如从鲦肾20细胞制剂使用。
检测ROS在整个斑马鱼胚胎的另一种方法是利用体内过氧化氢 传感器。信使RNA的氧化还原敏感的荧光蛋白注射到斑马鱼胚胎的荧光比率随时间以下尾鳍伤人21监测。该基因编码的氧化还原传感器允许时间的可视化和过氧化氢 生产在体内的空间动态。这种方法的应用揭示了令人惊讶的结果,产生所述第一固有免疫细胞的最初到来之前,提示由受伤的上皮细胞中释放的过氧化氢 的过氧化氢 作为一个信号招募吞噬细胞21。这种技术,同时功能强大,内容丰富,涉及费时,技术难度和胚胎显微术方法。此氧化还原传感器也具体为过氧化氢,这是唯一的许多活性氧中的先天免疫应答中起作用的1。
相比于上述讨论的方法中,我们的方法还体内活性氧测量,但在技术上要求不高,并使用化学诱导先 天免疫反应,而不是一个物理创伤。相反,上面的方法,其特异性地测定过氧化氢的生产,我们的程序测量活性氧的总水平。于检测到一个单一的ROS的优点在于,用于在先天免疫单独用化合物的作用可以被阐明。类似于上面讨论的方法,我们的方法也分享在整个动物正在执行的固有的优点和缺点。吞噬细胞和它们的环境中,当呼吸爆试验是对离体血液样本进行的消除之间的相互作用,被保存在这些整体动物实验。然而,使用整个动物的可能导致从非吞噬细胞的来源检测的ROS( 例如线粒体的衍生ROS,nonphagocyte NADPH氧化酶)。在试图解决我们的方法的特异性检测吞噬细胞衍生的活性氧,我们提到的这是在斑马鱼胚胎进行此呼吸爆发测定吞噬细胞缺乏特异性NADPH氧化酶9的研究。吞噬细胞特异性NADPH氧化酶是通过啉介导的敲抑制p47phox的或p91p下来HOX蛋白质。在斑马鱼胚胎中,在测定的发育阶段,这些NADPH氧化酶的亚基的表达仅限于血细胞的子集,可能的巨噬细胞22,23。胚胎缺乏吞噬细胞特异性NADPH氧化酶的呼吸爆发潜力大约三分之一的控件9(个人通信,罗伯特·惠勒博士)。这一结果表明,虽然我们的呼吸爆发实验确实并非来自其他吞噬细胞活性氧检测,大部分检测到的荧光可以归结为通过吞噬细胞NADPH氧化酶的呼吸爆发。使用双 - indolylmaleimide I(BISI),蛋白激酶C的抑制剂的药理此测定法的进一步的特异性被证明,为了防止PMA,蛋白激酶C激动剂,对NADPH氧化酶的作用。治疗前PMA诱导斑马鱼的肾脏或胚胎与亮碧思导致荧光水平相似,未诱导对照12。一个理想的呼吸突发测定将是一种体内高通量测定法,其中巨噬细胞特异性的ROS可既定量和可视化一段时间。直到这是可能的,迅速性质此处描述的方法和技术方便提供了一种有用的替代方案。
披露声明
作者什么都没有透露。
致谢
作者要感谢过去和现在的金实验室,马克妮兰对斑马鱼的保养和维护,罗伯特·惠勒博士的有益讨论和数据共享的成员,和美国国立卫生研究院资助3RO1GM087308-02S1和1P20RR024475-01A2和缅因州的农业和森林试验站(公开号3303)提供资金。
材料
| Name | Company | Catalog Number | Comments |
| Instant Ocean Sea Salt | Instant Ocean | SS15-10 | |
| H2DCFDA | Sigma Aldrich | 35845-1G | |
| PMA | Fisher | BP6851 | |
| DMSO | Sigma Aldrich | D2438-5X10ML | |
| Tricaine S MS222 | Western Chemical | 100 grams | |
| DMEM/F-12, No Phenol Red | Life Technologies | 11039-021 | |
| Deep Petri Dishes | VWR | 89107-632 | |
| Plastic Transfer Pipettes | Fisher | 13-711-7M | |
| #5 Dumont Forceps | Electron Microscopy Sciences | 72700-D | |
| 1.7 ml Micro Centrifuge Tubes | Axygen | 10011-724 | |
| 15 ml Conical Centrifuge Tubes | VWR | 21008-918 | |
| 5 ml Serological Pipettes | Greiner Bio One | 606180 | |
| Synergy 2 Multi-Mode Microplate Reader | BioTek | Contact BioTek | |
| Black 96 Well Microplate | VWR | 82050-728 | |
| 25 ml Sterile Reservoirs | VistaLab | 3054-2003 | |
| P200 Pipettor | Gilson | F123601 | |
| Multichannel Pipettor | VWR | 89079-948 | |
| Pipette Tips | VWR | 89079-478 |
参考文献
- Medzhitov, R., Janeway, C. A. Jr Innate Immunity: Impact on the Adaptive Immune Response. Current Opinion in Immunology. 9, 4-9 (1997).
- Lam, S. H., Chua, H. L., et al. Development and Maturation of the Immune System in Zebrafish, Danio rerio: A Gene expression Profiling. In Situ Hybridization and Immunological. 28, 9-28 (2004).
- Stockhammer, O. W., Zakrzewska, A., et al. Transcriptome Profiling and Functional Analyses of the Zebrafish Embryonic Innate Immune Response to Salmonella Infection. J Immunol. 9. 9, 5641-5653 (2009).
- Ordas, A., Hegedus, Z., et al. Deep Sequencing of the Innate Immune Transcriptomic Response of Zebrafish Embryos to Salmonella Infection. Fish & Shellfish Immunology. 31, 716-724 (2011).
- Renshaw, S. A., Loynes, C. A., et al. A Transgenic Zebrafish Model of Neutrophilic Inflammation. Blood. 13, 3976-3978 (2006).
- Mathias, J. R., Perrin, B. J., et al. Resolution of Inflammation by Retrograde Chemotaxis of Neutrophils in Transgenic Zebrafish. J. Leukoc. Biol. 6, 1281-1288 (2006).
- Ellett, F., Pase, L., et al. mpeg1 Promoter Transgenes Direct Macrophage-Lineage Expression in Zebrafish. Blood. 4, 56-56 (2011).
- Phennicie, R. T., Sullivan, M. J., et al. Specific Resistance to Pseudomonas aeruginosa Infection in Zebrafish is Mediated by the Cystic Fibrosis Transmembrane Conductance Regulator. Infect. Immun. 11, 4542(2010).
- Brothers, K. M., Newman, Z. R., et al. Live Imaging of Disseminated Candidiasis in Zebrafish Reveals Role of Phagocyte Oxidase in Limiting Filamentous Growth. Eukaryotic Cell. 7, 932-944 (2011).
- Rotman, J., van Gils, W., et al. Rapid Screening of Innate Immune Gene Expression in Zebrafish using Reverse Transcription - Multiplex Ligation-Dependent Probe Amplification. BMC Research Notes. 4, (2011).
- d'Alencon, C. A., Pena, O. A., et al. A High-Throughput Chemically Induced Inflammation Assay in Zebrafish. BMC Biology. 8, 151(2010).
- Hermann, A. C., Millard, P. J., et al. Development of a Respiratory Burst Assay using Zebrafish Kidneys and Embryos. Journal of Immunological Methods. 292, 119-129 (2004).
- Avdesh, A., Chen, M., et al. Regular Care and Maintenance of a Zebrafish (Danio rerio) Laboratory: An Introduction. J. Vis. Exp. (69), e4196(2012).
- Brothers, K. M., Wheeler, R. T. Non-invasive Imaging of Disseminated Candidiasis in Zebrafish Larvae. J. Vis. Exp. (65), e4051(2012).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113(2009).
- Gerlach, G. F., Schrader, L. N., et al. Dissection of the Adult Zebrafish Kidney. J. Vis. Exp. (54), e2839(2011).
- Gupta, T., Mullins, M. C. Dissection of Organs from the Adult Zebrafish. J. Vis. Exp. (37), e1717(2010).
- Le Guyader, D., Redd, M. J., et al. Origins and Unconventional Behavior of Neutrophils in Developing Zebrafish. Blood. 111, 132-141 (2008).
- Davidson, A. J., Zon, L. I. The 'Definitive' (and 'Primitive') Guide to Zebrafish Hematopoiesis. Oncogene. 23, 7233-7246 (2004).
- Jovanovic, B., Goetz, F. W., et al. Immunological Stimuli Change Expression of Genes and Neutrophil Function in Fathead Minnow Pimephales promelas Rafinesque. Journal of Fish Biology. 78, 1054-1072 (2011).
- Niethammer, P., Grabher, C., et al. A Tissue-Scale Gradient of Hydrogen Peroxide Mediates Rapid Wound Detection in Zebrafish. Nature. 459, 996-1000 (2009).
- Thisse, B., Pflumio, S., et al. Expression of the zebrafish genome during embryogenesis. (NIH R01 RR15402). ZFIN Direct Data Submission. , (2001).
- Thisse, B., Thisse, C. Fast Release Clones: A High Throughput Expression Analysis. ZFIN Direct Data Submission. , (2004).
- Table 18.4. The Molecular Probes Handbook. , 11th, Forthcoming.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。