Method Article
כימות תגובת Burst נשימה כאינדיקטור של החיסון מולדת בריאות בדג הזברה
In This Article
Summary
התגובה החיסונית המולדת מגנה על אורגניזמים מפני זיהום הפתוגן. מרכיב קריטי של התגובה החיסונית המולדת, פרץ הנשימה תא בלען, מייצר מיני חמצן תגובתי שהורגים מיקרואורגניזמים פולשים. אנו מתארים assay פרץ נשימה שמכמת מיני חמצן תגובתי נוצרו כאשר התגובה החיסונית המולדת מושרה כימית.
Abstract
פרץ הנשימה תא בלען הוא חלק מהתגובה החיסונית המולדת לזיהום הפתוגן וכרוך בייצור של מיני חמצן תגובתי (ROS). ROS הם רעילים ולתפקד כדי להרוג מיקרואורגניזמים phagocytized. בvivo כימות של ROS נגזר תא בלען מספקת מידע לגבי היכולת של האורגניזם לעלות תגובה חיסונית מולדת חזקה. כאן אנו מתארים פרוטוקול לכמת ולהשוות ROS בעוברי דג הזברה שלמים על אינדוקציה כימית של פרץ הנשימה תא בלען. שיטה זו עושה שימוש במתחם שאינו ניאון שהופך ניאון על ידי חמצון ROS. עוברי דג הזברה אישיות pipetted לתוך הבארות של microplate וטופחו בfluorogenic מצע זה עם או בלי inducer כימי של הפרץ בדרכי הנשימה. הקרינה בכל אחד גם היא לכמת בנקודות זמן רצויות באמצעות קורא microplate. קריאות הקרינה מותאמות לחסל את הקרינה רקע ולאחר מכן במשותףmpared באמצעות מבחן t מזווג. שיטה זו מאפשרת השוואה של פוטנציאל פרץ הנשימה של עוברי דג הזברה בשלבי התפתחות שונים ובתגובה למניפולציות ניסיוני, כגון מציאה חלבון, ביטוי יתר, או טיפול עם סוכנים תרופתיים. גם בשיטה זו ניתן להשתמש כדי לפקח על תגובת פרץ בדרכי הנשימה בכליות שלמות גזורות או תכשירי תא מכליות של דג הזברה מבוגר וכמה מיני דגים אחרים. אנו מאמינים כי הפשטות והתאמה היחסית של פרוטוקול זה ישלימו את הפרוטוקולים קיימים ויהיו עניין לחוקרים המבקשים להבין את התגובה החיסונית המולדת טוב יותר.
Introduction
מערכת החיסון מורכבת משני סניפים: חסינות מולדת ובעלי כושר הסתגלות. החסינות מולדת היא אבולוציונית עתיקה יותר חסינות אדפטיבית. חסרי חוליות נמצאות כיום חשבו שיש רק חסינות מולדת, בעוד שבעלי חוליות יש שני הסניפים המולדים ובעלי כושר הסתגלות. בעוד חסינות אדפטיבית מקנה חסינות ספציפית וארוכת טווח לפתוגנים מסוימים, חסינות מולדת היא תגובה מיידית לחיידקים פולשים, וירוסים ופטריות. היבט חיוני של תגובת החיסון המולדת כולל את שחרורו של ציטוקינים וכמוקינים, שגורם לדלקת וגיוס phagocytes (למשל מקרופאגים, נויטרופילים) לבלוע ולהשמיד פולשים זרים.
תגובות חיסוניים מולדים מוצלחות לערב: (1) הכרה במיקרואורגניזמים פולשים, (2) אינדוקציה של המפלים המתאימים איתות (למשל שחרורו של ציטוקינים וכמוקינים); (3) התפתחות תקינה / מספרים מספקים של תאי phagocytic; (4) הגירה של phagocytes לאתרים של זיהום; (5) היבלעות של פתוגנים, וכן (6) השמדת מיקרואורגניזמים נבלעו. מחסור בכל אחד מהשלבים הבאים עלול להוביל למארח להיות המום, ונכנע ל, הזיהום. תגובה חיסונית מולדת חזקה היא חיונית לבריאותם של אורגניזמים כי זה קו הגנה הראשון מפני פתוגנים בכל הצמחים ובעלי החיים. בבעלי חוליות, זה גם מגביר את התגובה החיסונית אדפטיבית 1. לכן, זה קריטי, כי אנחנו מסוגלים להעריך את כל ההיבטים של תגובת החיסון המולדת כדי להבין את זה טוב יותר ועל מנת לייעל את תפקודו.
אורגניזמים מודל רבים משמשים ללמוד חסינות מולדת, החל Arabadopsis לג elegans לדרוזופילה לעכברים לתאי אדם בתרבית. יתרון בשימוש במערכת מודל (Danio rerio) דג הזברה ללמוד חסינות מולדת הוא שדג הזברה היא חוליות, עם im שני המולדות אדפטיביתmunity, אך הפיתוח של חסינות מולדת ובעלי כושר הסתגלות מופרד בזמן. דג הזברה להסתמך רק על חסינות מולדת להגנה מפני זיהום עד חסינות אדפטיבית הופכת מתפקד במלואה, אשר מתרחשת לאחר סביב 4-6 שבועות הפריה 2. בנוסף לכלים למניפולציה גנטית, בהירות אופטית והתפתחות מהירה, חיצונית, חסינות מולדת כמצב עיקרון ההגנה בעוברי דג הזברה מספקת מודל מופשט שבו ללמוד את המורכבות של תגובת החיסון המולדת in vivo.
פרוטוקולים מרובים פותחו כדי להעריך את ההיבטים שונים של התגובה החיסונית המולדת בעוברי דג הזברה. Microarrays וRNAseq אימתו כי פרופילי ציטוקינים שהושרו על ידי התגובה החיסונית המולדת דג הזברה הם דומים לזו של בני אדם וגם הציעו את מעורבותם של גנים בלתי צפויים בחסינות מולדת 3,4. השקיפות של עובר דג הזברה וניאון, transgenזני ic של פתוגנים ודג זברה מאפשרים ויזואליזציה של אינטראקציות בין המאכסן לפתוגן דינמיים in vivo בזמן אמת. עוברי דג הזברה מהונדסים להביע GFP תחת שליטה של אמרגן נויטרופילים הספציפיים myeloperoxidase 5,6 או אמרגן MPEG1 מקרופאג ספציפי 7 הפכו אותו ניתן לחזות ולכמת הגירת תא בלען לאתרים של זיהומים מקומיים 8, כמו גם כדי להמחיש phagocytosis והרס של כותרתו fluorescently פתוגנים 8,9. עוברי דג הזברה גם נתונים לדור של מבחני תפוקה גבוהה והמסכים כימיים. בהתאם לכך, שיטות תפוקה גבוהה של ניתוח transcriptome על זיהום 10 והגירה תא בלען לאתרים של פגיעה כימית שגרמה 11 לאחרונה פותחו.
של הטכניקות המפורטות לעיל, אף כמותית להעריך את השלב הסופי של השמדת הפתוגן ידי phagocytes. שלב סופי זהכרוך בפרץ בדרכי הנשימה (כלומר ייצור של ROS ותרכובות רעילות אחרות), אשר להרוג פתוגנים נבלעו. מונואמין NADPH האנזים הוא מקור עיקרי של ROS בתאי phagocytic. הרכבה של יחידות משנה של תוצאות אנזים מונואמין NADPH בהעברת אלקטרונים לחמצן, שהניבו אניוני סופראוקסיד. דרך תגובות אנזימטיות שלאחר מכן, סופראוקסיד אז יכול להיות מומר למי חמצן וחומצת hypochlorous (איור 1 א). זה פרץ הנשימה של phagocytes שהורג פתוגנים וכך, כימות של פוטנציאל פרץ הנשימה של עוברי דג הזברה היא מעיד על בריאות מערכת החיסון מולדת בכללותה. פיתחנו assay הקרינה מבוסס לכמת את פרץ הנשימה בקבוצות של עוברי דג הזברה בודדים 12. assay זה מנצל בצורה לא פלורסנט, מופחתת של צבע זמין באופן מסחרי, תא חדיר. צבע זה, 2 ', diacetate 7'-dichlorodihydrofluorescein (H2DCFDA), מומר לנורותמתחם הסנט, 2 ', 7'-dichlorofluorescein (DCF), על חמצון. ROS המגוון שנוצר על ידי פרץ הנשימה תא בלען יכול לחמצן H2DCFDA וליצור הקרינה 24. המראה של הקרינה יכול לשמש כדי לכמת ולהשוות את תגובת פרץ בדרכי הנשימה בין קבוצות של דג הזברה. אצטט החלבון קינאז C Myristate phorbol אגוניסט (PMA) משמש כדי לגרום כימי מונואמין NADPH כדי לייצר ROS ובכך להגדיל את קריאות הקרינה (איור 1). בזאת, אנו מספקים פרוטוקול מפורט של גרסה שונה והמותאמת של assay זה דג הזברה עובר הנשימה פרץ. assay זה יכול לשמש כדי להשוות את פרץ הנשימה בין קבוצות של עוברי דג הזברה בודדים לאורך זמן ו / או בתגובה למניפולציות ניסיוני (מציאה חלבון למשל בתיווך morpholino). השימוש בשיטה זו, בשילוב עם מבחני חסינות אחרים דג הזברה מולדים, תספק תמונה של מורכב וקריטי שלמה יותרתגובה חיסונית מולדת.
Protocol
1. טיפול ותחזוקה של דג הזברה
- בעלי: דג הזברה מבוגר שרצים המוני כפי שתוארו קודם לכן 13. איסוף עובר הוליד כמתואר 14 בעבר.
- Microinjection (אם רוצה): עוברי Microinject 1-4 שלב תא דג הזברה עם oligonucleotides morpholino למציאת מוצרי גן או mRNA לביטוי יתר מוצרי גן כפי שתוארו לעיל 15.
- לשמור על בריכה נאותה של בקרות מדומה מוזרקת (לפחות 48 חיים, מדומה הזריק דגי שליטה ו48 חיים, יש צורך בדגי מניפולציות בניסוי למלא microplate 96 היטב).
- לשמור על עוברים: לגדול עוברים בצלחות פטרי עמוקים על 28 מעלות צלזיוס במי ביצה (אוקיינוס ים המלח מיידי 60 מיקרוגרם / מ"ל במזוקק-autoclaved מים) עד לשלב ההתפתחותי הרצוי (תגובת פרץ בדרכי הנשימה היא לא ניתן לגילוי שימוש בפרוטוקול זה בעוברי דג הזברה צעיר מ2 ימים לאחר הפריה 12). הערה: זה כבר observed כי מניעת פיגמנטציה בעוברי דג הזברה או דרך השימוש של 1-2-פניל thiourea (PTU) או דג הזברה המוטציה golden/slc24a5 אינו משנה את האינדוקציה של הקרינה על ידי PMA (נתונים שלא פורסמו, עוברים שנבדקו ב48, 72, ו96 באופן משמעותי hpf).
- הסר את העוברים מתים מדי יום עם פיפטה העברה פלסטיק.
- למזוג בזהירות מים ביצה ישנות ולחדש עם מים ביצה חדשים מדי יום.
- עוברי Dechorionate: ביום של הניסוי, עובר dechorionate (אם עוברים עדיין בchorions) כפי שתוארו לעיל באמצעות שני מלקחיים בסדר 14 (assay פרץ נשימה זה יכול גם להתבצע על כליות גזורים מן דג הזברה מבוגר 12 ופרוטוקולים מפורטים לכליות נתיחה מדג הזברה מבוגר תוארו בעבר 16,17).
2. פתרון הכנה
- הכן פתרון מניות של H2DCFDA: לשקול את 1 מ"ג של H2DCFDA.
- דימ"ג ssolve 1 של H2DCFDA ב 1 מיליליטר של sulfoxide דימתיל (DMSO) כדי להפוך 1 מ"ג / מיליליטר פתרון מניות.
- הפוך 22 aliquots μl של פתרון מניות זה ב1.7 מיליליטר microcentrifuge צינורות.
- עטוף את aliquots של פתרון מניות H2DCFDA בנייר אלומיניום ולשמור בחושך בכל הזדמנות אפשרית, כי H2DCFDA הוא רגיש לאור.
- aliquots החנות H2DCFDA ב -20 ° C עד 3 חודשים.
- זהירות - הכן פתרון מניות של אצטט Myristate phorbol (PMA): לשקול את 1 מ"ג של PMA תוך שימוש בציוד מגן אישי מתאים (כלומר, כפפות, משקפי מגן ומסכה).
- ממיסים PMA ב 1 מיליליטר של DMSO לעשות 1 מ"ג / מיליליטר פתרון מניות.
- הפוך 11 aliquots μl ב1.7 מיליליטר microcentrifuge צינורות.
- aliquots חנות של פתרון מניות PMA ב -80 מעלות צלזיוס למשך עד 3 חודשים.
- הכן פתרון עבודה של H2DCFDA: ביום של הניסוי, להפוך את פתרון עובד H2DCFDA על ידי הוספת פתרון מניות H2DCFDA חלק 1 עד 1DMSO חלק (500 מיקרוגרם / מיליליטר H2DCFDA ריכוז סופי). לדוגמא, להוסיף 20 μl של פתרון מניות H2DCFDA ו20 DMSO μl לנייר כסף עטוף 1.7 מיליליטר צינור microcentrifuge.
- הכן פתרון עבודה של PMA: ביום של הניסוי, להפוך את פתרון עובד PMA על ידי הוספת פתרון מניות PMA חלק 1 ל49 חלקים nuclease מים חופשיים (20 מיקרוגרם / מיליליטר PMA ריכוז סופי). לדוגמא, לדלל 10 פתרון מניות PMA μl במי nuclease ללא μl 490 בצינור 1.7 מיליליטר microcentrifuge.
- הכן פתרון מינון של H2DCFDA: ביום של הניסוי, להפוך את פתרון מינון H2DCFDA עם ריכוז סופי של מיקרוגרם / מיליליטר H2DCFDA 1 במי ביצה. הכרכים מוכנים של פתרונות המינון ניתן לשנות כרצונכם, אך להבטיח כי הריכוזים הסופיים של חומרים כימיים נשמרים. לכליות, במקום מים ביצה, להשתמש באותו הנפח של medium/F-12 שונה Dulbecco של הנשר (50% DMEM, 50% F-12, ללא פנול אדום). כדי להפוך 5 מיליליטר של H2DCFDAמינון פתרון, להשתמש פיפטה 5 מיליליטר סרולוגיות להעביר 5 מיליליטר של מים ביצה (או DMEM/F-12) ל15 מיליליטר צינור צנטריפוגות חרוטי עטוף בנייר כסף ושכותרתו "H".
- הסר 10 μl מים ביצה (או DMEM/F-12) מהמ"ל 15 צינור חרוטי שכותרתו 'H' וזורקים.
- הוסף 10 μl של פתרון עובד H2DCFDA לתוך צינור חרוטי 15 מיליליטר שכותרתו "H" ומערבולת לערבב (נפח זה מספיק ל48 עובר או דוגמאות כליות (מחצית microplate היטב 96) ובארות אלה יספקו מדידות של הרמה של הקרינה רקע).
- הכן פתרון מינון של H2DCFDA + PMA: ביום של הניסוי, להפוך את פתרון H2DCFDA + PMA מינון עם ריכוזים סופיים של: H2DCFDA - 1 מיקרוגרם / מיליליטר ו PMA - 400 ng / ml. כדי להפוך 5 מיליליטר של תמיסת מינון H2DCFDA + PMA, השתמש פיפטה סרולוגיות 5 מיליליטר להעביר 5 מיליליטר של מים ביצה (או DMEM/F-12) לתוך צינור חרוטי חדש 15 מיליליטר שכותרתו "H + P '.
- הסר 110 _6; ליטר של מים ביצה (או DMEM/F-12) מהמ"ל 15 צינור חרוטי שכותרתו 'P + H' וזורקים.
- הוסף 10 μl של פתרון עובד H2DCFDA, ואז להוסיף לפתרון עובד PMA 100 μl לתוך צינור חרוטי 15 מיליליטר שכותרתו 'P + H' ומערבולת לערבב (נפח זה מספיק ל48 דוגמאות או את החצי השני של microplate היטב 96 ).
- שמור את פתרונות מינון על קרח.
3. תכנות Reader Microplate
- הכן את מכשיר: כוח על קורא microplate.
- לחמם את מקור האור.
- הגדר את תכנית לקריאת הקרינה: למשל עירור: 485 ננומטר; פליטה: 528 ננומטר; תפקיד אופטיקה: עליון 510 ננומטר; רגישות: 65, בצעד רועד 5 שניות לפני הקריאה.
4. 96 ובכן Microplate הגדרה (ראה איור 2)
- לאסוף מצרכים: השג מנות עם עוברי dechorionated, microplate גם שחור 96, pipettor p200 וטיפים, דלי קרח עם H2DCFDA ופתרונות מינון H2DCFDA + PMA, pipettor p200 רבת ערוצים, שני מאגרי סטרילי, רדיד אלומיניום, ומספריים.
- עובר העברה אחד לבאר כל microplate 96 גם: מספריים השתמשו כדי לחתוך קצה פיפטה כך שעוברים או כליות כושר דרך הפתח.
- הגדר pipettor p200 100 μl ולהעביר עובר אחד יחד עם מים ביצה (או DMEM/F-12) לכמה שיותר מהבארות של microplate גם שחור 96 כרצוי (אין צורך לשנות את קצה פיפטה לכל אחד שונה מדגם עובר בתוך תנאי ניסוי, אבל ייתכן שיהיה צורך לשנות את הטיפים בין תנאי ניסוי). הקפד להימנע מהעברת chorions שייר, כמו אלה נוטים להטות את הנתונים שנאספו. להעברת כליות, pipettor גדולה נפח (מוגדרת 100 μl) יכולה לשמש וניתן לחתוך טיפים פיפטה כדי להשיג גודל שעמם גדול יותר, במידת צורך. ייתכן שיהיה צורך לשלב את הבארות ללא דגימות עובר או בכליות, אבל עםפתרונות מינון כדי לשלוט על כמה מניפולציות ניסיוני.
- הוספת פתרונות מינון: יוצקים פתרון מינון H2DCFDA לתוך מאגר 25 מיליליטר סטרילי.
- השתמש pipettor p200 רבת ערוצים ושמונה טיפים לפיפטה בו זמנית מפתרון מינון H2DCFDA 100 μl לעמודה אחת בmicroplate 96 היטב (500 ריכוז ng / ml הסופי של H2DCFDA).
- חזור על פעולה זו (שינוי טיפים לא הכרחי) לעמודים רבים ככל רצוי (בדרך כלל שישה עמודים או 48 בארות אם מילוי microplate 96 גם כולו). הוספת פתרון זה למחצית מהדגימות עובר השליטה ומחצית מהדגימות עובר המניפולציה ניסויית (96 microplate גם דוגמא להגדיר מוצגת באיור 2, בארות אלה (בצבע כתום) יספק נתונים הקרינה רקע בדגימות אינן מושרה עם PMA) .
- יוצקים את פתרון מינון H2DCFDA + PMA לתוך מאגר 25 מיליליטר חדש, סטרילי.
- השתמש pipettor p200 רבת ערוצים ושמונה טיפים לsimultaneously פיפטה של פתרון מינון H2DCFDA + PMA 100 μl למדורים הנותרים (בצבע אדום באיור 2) של microplate 96 היטב (משתנה טיפים הוא לא הכרחי, ריכוזים סופיים של ng H2DCFDA-500 / מיליליטר וPMA-200 ng / ml) .
- כסה microplate ברדיד אלומיניום.
- נער את microplate כ 20 שניות ב150 סל"ד homogenize פתרונות בכל טוב.
- דגירה microplate ב28 מעלות צלזיוס כאשר הוא לא להיות לקרוא.
5. כימות הקרינה
- קרא microplate בזמן = 0 שעות לאחר התוספת של PMA באמצעות הפרמטרים שתוארו בשלב 3.1.2.
- תמשיך במדידות בכל כמה דקות למרווח הזמן הרצוי או דגירה microplate העטוף בנייר האלומיניום ב28 מעלות צלזיוס עד לנקודת זמן מאוחרת יותר, ולאחר מכן לקחת את מדידת נקודת סיום בזמן רצוי (לדוגמא: 4 שעות לאחר התוספת של PMA).
- השתמש לא פלסטיקפיפטה ransfer כדי לאחזר את העוברים מהבארות.
- להרדים את העוברים לפי הטיפול שלך בבעלי החיים ופרוטוקול שימוש, למשל הטבילה בMS222 tricaine.
- השלך את microplate וחומרים חד פעמי אחרים במכל הפסולת הביולוגי המסוכן.
6. ניתוח נתונים
- החלט על נקודת הזמן שבה אתה רוצה להשוות ערכי הקרינה (למשל 4 שעות לאחר התוספת של PMA, טבלת 1).
- לחסר ערך הקרינה של קבוצת ביקורת בלתי המושרית הממוצעת מערכי הקרינה של קבוצת הביקורת המושרית PMA הבודד.
- חזור על פעולה זו עבור קבוצת הניסוי עם ובלי PMA.
- אחסן את ערכי הקרינה מנורמלים אלה בשני טורים, השליטה + קבוצת PMA וקבוצת הניסוי + PMA (טבלת 2).
- חשב את הממוצעים וסטיות תקן לערכי הקרינה מנורמלים של השליטה + grou PMAp וקבוצת PMA + הניסיונית.
- השווה את ערכי הקרינה מנורמלים באמצעות מבחן t מזווג כדי לקבוע מובהקות סטטיסטיות (טבלה 2).
- גרף אמצעי השליטה + קבוצת PMA וקבוצת הניסוי + PMA עם ברים שגיאה המשקפים את סטיות התקן המתאימות.
- רשום את רמת המובהקות בגרף ובאגדת הדמות (איור 2).
תוצאות
כאן, אנו מספקים 72 שעות שלאחר הפריה (hpf) נתונים המשווים את תגובת דרכי הנשימה פרץ בעוברי דג הזברה (wild-type, רקע א.ב.) ב48 ו. 48 עוברי hpf שימשו כקבוצת הביקורת שלנו ו72 hpf העוברים כקבוצת הניסוי שלנו. גודל המדגם השתמש היה 24 עוברים הנגרמים האו"ם ו24 עוברים הנגרמים PMA לשלב ההתפתחותי. קריאות גלם הקרינה (ביחידות יחסית פלואורסצנטי (RFU)) התקבלו על ידי קריאת microplate 4 שעות לאחר התוספת של PMA. ערכי הקרינה גלם מסופקים בטבלה 1. ערכי הקרינה גלם היו באופן עקבי גבוהים יותר ב48 העוברים הנגרמים בלתי hpf מ 72 העוברים הנגרמים בלתי hpf, למעט עובר 72 hpf אחד (אמצעי: 48 hpf = 758 RFU, 72 hpf = 230 RFU). השונות בתוך שתי דגימות אלה היו שווים בערך (סטיות תקן: 48 hpf = ± 549 RFU, 72 hpf = ± 513 RFU), אבל קבוצת 72 hpf מגוונת יותר ביחס לממוצע (deviatio הסטנדרטיn כאחוז מהממוצע: 48 hpf = 72%, 72 hpf = 223%). בקבוצות הנגרמות PMA, ערכי הקרינה גלם היו בעיקר גבוהים יותר באוכלוסיית hpf 72 (אמצעי: 48 hpf PMA = 3798 RFU, 72 hpf PMA = 5825 RFU). היו יותר השתנות בקבוצה המושרית PMA 72 hpf מאשר הקבוצה המושרית PMA 48 hpf (סטיות תקן: 48 hpf PMA = 831 RFU, 72 hpf PMA = 1365 RFU), אבל ההשתנות ביחס לממוצע הייתה כ שווה (48 PMA = 22% hpf, 72 hpf PMA = 23%).
כדי להסביר את שונות ברמות רקע של הקרינה, ערכי הקרינה מנורמלים חושבו (ערך מושרה PMA מינוס הממוצע של הערכים-Induced בלתי של שלב התפתחותי המתאים). ערכי הקרינה מנורמלים אלה ניתנים בטבלה 2, יחד עם האמצעים, סטיות תקן, ו-p ערך עבור 48 ו72 hpf הקבוצות. גרף של נתונים זה ניתן באיור 2. ערכי הקרינה מנורמלים הם היי באופן עקבישלהן גרתי בקבוצת 72 hpf מאשר קבוצת hpf 48 (פירושו: 48 hpf = 3040 RFU, 72 hpf = 5596 RFU) וההשתנות דומה ביחס לממוצע (48 hpf = 27%, 72 hpf = 24%). assay פרץ נשימה זו גילה כי עוברי דג הזברה 72 hpf מסוגלים לייצר יותר ROS ולכן הר תגובת פרץ נשימה חזקה יותר מאשר 48 hpf עוברים לאחר אינדוקציה עם PMA. ממצא זה יכול להיות בגלל מספר גדל של תאים, כוללים מספר גדל של גרנולוציטים 18, ב72 עוברי hpf לעומת 48 עוברי hpf. מבחן t מזווג להשוות סטטיסטי את הנתונים אישר כי תגובת פרץ בדרכי הנשימה היא שונה באופן משמעותי ב72 עוברי hpf מ 48 hpf עוברים (* p = 2 X 10 -9).
במובן כללי יותר, בנקודת זמן t = 0 שעות לאחר התוספת של PMA, ערכי הקרינה גלם לא צריכים להיות שונים מבחינה סטטיסטי בין המושרה PMA והקבוצות-Induced של האו"ם. ערכי הקרינה הגלם יהיה increasדואר לאורך הזמן בשתי דגימות בלתי מושרה ומושרות, עם עלייה גדולה בהרבה המתרחשת בעוברים הנגרמים PMA 12. העלייה בערכי הקרינה גלם בקבוצה המושרית PMA, בהשוואה לקבוצה מושרה האו"ם, תהפוך משמעותית מבחינה סטטיסטית בכ 1-2 שעות לאחר התוספת של PMA (בהתאם לשלב ההתפתחותי של עוברי דג הזברה, עם מבוגר עוברי הרכבה תגובת פרץ נשימה מהר יותר מעוברים צעירים יותר). ערכי הקרינה מנורמלים (מושרה בלתי מינוס המושרה) צריכים להגדיל בשלב ההתפתחות הגובר של עוברי דג הזברה, עם ההבדל הגדול ביותר המתרחש בין 48 ו72 הודעה שעה הפריה והבדל קטן יותר המתרחש בין 72 ו96 הודעה hr הפריה. מספרי הקרינה גלם צריכים להיות 5-60 גבוהות פי ב- Induced PMA הקבוצה ביחס לקבוצה מושרה האו"ם, בהתאם לשלב ההתפתחותי של עוברי דג הזברה (בין 48 ו96 הודעה hr הפריה). וריאציהיתרחש בין דגימות בודדות דג הזברה עובר, ולכן, מומלץ שתשמשנה כ 24 דגימות עובר לכל טיפול.
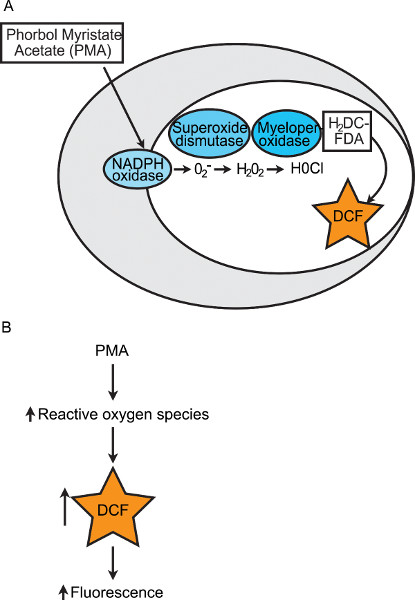
איור 1. תרשים של אינדוקציה הכימית של פרץ הנשימה בתוך תא בלען. (א) בassay פרץ הנשימה הזה, PMA משמש כדי לגרום לייצור של אניוני סופראוקסיד ידי מונואמין NADPH. Superoxide מומר מי חמצן ומימן על ידי סופראוקסיד דיסמוטאז. הם אניוני מי חמצן וכלוריד להמרה חומצת hypochlorous ידי myeloperoxidase. הצבע לא פלורסנט, H2DCFDA, הופך למתחם הניאון, DCF, כאשר חמצון על ידי ROS רבים ושונה. (ב) תרשים של איך כימות של הקרינה הוא קריאה מתוך תגובת פרץ בדרכי הנשימה.
LT = "איור 2" עבור: תוכן ברוחב = /> src "4.5in" = "/ files/ftp_upload/50667/50667fig2.jpg"
איור 2. סכמטי של עיצוב ניסיוני עבור assay פרץ הנשימה. פרט dechorionated עוברי דג הזברה מועברים לתוך הבארות של microplate 96 היטב. הבארות בקו לבן מכילות עובר בקרה והבארות שהותוו בשחור מכילים עוברים מקבוצת הניסוי. פתרונות מינון H2DCFDA או H2DCFDA + PMA מתווספים לבארות המתאימות (בצבע כתום או אדום, בהתאמה). הקרינה היא לכמת באמצעות קורא microplate. נתוני assay פרץ נשימה לאחר מכן נותח, בהשוואה, והציגו. השולחן בנתון זה הוא קבוצת משנה של ערכי הקרינה מנורמלים מוצגים בטבלה 2. הגרף בנתון זה כולל את האמצעים, סטיות תקן וערך P עבור הקבוצה כל הנתונים המוצגת בכתב היד הזה, שגם הוא מוצג בטבלה 2. * P = 2 X 10-9.
טבלה 1. ערכי הקרינה גלם מ- Induced האו"ם (רקע כתום) ו( רקע אדום מושרה) 48 או 72 הודעה hr הפריה (hpf) עוברי דג הזברה (מספרים לבנים או שחורים, בהתאמה) בשעה 4 שעות לאחר התוספת של PMA. הממוצע מחושב עבור הדגימות-Induced של האו"ם.
| 48 עוברי hpf | 72 עוברי hpf | ||||
| 408 | 326 | 358 | 92 | 83 | 208 |
| 276 | 381 | 1124 | 473 | 106 | 86 |
| 518 | 180 | 1085 | 110 | 93 | 109 |
| 1196 | 232 | 380 | 143 | 152 | 81 |
| 1416 | 339 | 735 | 123 | 85 | 81 |
| 489 | 390 | 347 | 110 | 98 | 118 |
| 2139 | 1183 | 1015 | 95 | 97 | 2609 |
| 1660 | 385 | 1630 | 111 | 115 | 136 |
| ממוצע | 758 | 230 | |||
| 48 embroys hpf + PMA | 72 עוברי hpf + PMA | ||||
| 4713 | 2868 | 5144 | 3051 | 4868 | 4880 |
| 2978 | 4768 | 1998 | 5662 | 6144 | 4635 |
| 4460 | 3733 | 2984 | 7052 | 4429 | 6672 |
| 4026 | 3978 | 3311 | 4848 | 8489 | 6154 |
| 3169 | 5024 | 3543 | 5783 | 5621 | 5504 |
| 3742 | 2970 | 4628 | 6765 | 6016 | 5958 |
| 3728 | 3711 | 4637 | 5678 | 7638 | 5831 |
| 2525 | 4232 | 4288 | 3272 | 6123 | 8735 |
טבלה 2. נורמליזציה והשוואה סטטיסטית של הנתונים. כדי להשיג ערכי הקרינה מנורמלים, לחשב את ההפרש בין כל ערך הקרינה-Induced PMA והערך הממוצע מושרה בלתי המתאים. סטטיסטית להשוות בין שתי קבוצות של נתונים אלה באמצעות מבחן t מזווג. חשב את הממוצעים וסטיות תקן. להציג את האמצעים, סטיות תקן, ו-p ערך (ים) בצורה גרפית (כמו באיור 2).
Discussion
התפקיד העיקרי של phagocytes הוא לזהות, לבלוע ולהשמיד פתוגנים. היכולת של phagocytes לייצר פרץ נשימה נאות היא קריטית עבור פונקציה זו. לפיכך, כימות של תגובת פרץ בדרכי הנשימה היא שיטה אחת כדי לאפשר השוואה של בריאות כללית מולדת חיסונית ותפקוד בין קבוצות של יחידים ו / או בתגובה למניפולציות ניסיוני. כאן אנו מתארים פרוטוקול כדי לגרום, לכמת, ולהשוות את תגובת פרץ בדרכי הנשימה בין קבוצות של עוברי דג הזברה בודדים. בקיצור, PMA תוצאות בייצור של ROS על ידי מונואמין NADPH האנזים. ROS אלה פועלים על צבע שאינו ניאון והחמצן אותו כדי ליצור תרכובת ניאון. קורא microplate משמש כדי לזהות הקרינה היחסית בכל טוב. הקרינה שנוצרה על האינדוקציה PMA מעידה על פוטנציאל פרץ בדרכי הנשימה ובריאות מערכת החיסון מולדת כללית של עוברי דג הזברה. השוואה של הרמה המנורמלת של נורותcence בין קבוצות מושרה PMA באמצעות מבחן t מזווג ניתן להשתמש בם כדי לקבוע אם יש הבדל משמעותי בפוטנציאל פרץ הנשימה בין קבוצות של דג הזברה. מניפולציות ניסיוני וכתוצאה מכך הבדלים משמעותיים בתגובת פרץ הנשימה תספק תובנות מנגנונים של חסינות מולדת, כגון מוצרי גן הכרחיים לפרץ הנשימה תא בלען, תרופות הלהגביר או להרגיז את תגובת פרץ בדרכי הנשימה.
פרוטוקולים לassay היבטים שונים של התגובה החיסונית המולדת במודל דג הזברה פותחו (ראה מבוא). מעטים יחסית של טכניקות אלה למדוד את הייצור של ROS. הטכניקה המפורטת במאמר זה מכמת ייצור של ROS בעוברי דג הזברה על גירוי של תגובת חיסון מולדת עם PMA. טכניקה זו דומה למבחני פרץ נשימה בוצעו על דגימות דם כולו מבודדות, שבו PMA משמשים גם לinduלסה"נ תגובת פרץ בדרכי הנשימה, ולאחר מכן ROS שנוצר נמדד באמצעות מצע fluorogenic (למשל Phagoburst, Orpegen פארמה). השיטה המתוארת כאן ניתן להשתמש בעוברי דג הזברה שלמים, כמו גם כליות גזורים מן דג הזברה מבוגר 13, כמו הכליות קדמי דג הזברה היא מקבילות למח עצם אנושי, המהווה את האתר של hematopoiesis המבוגר 19. השיטה המתוארת כאן היא גם תכליתית מספיק כדי לשמש עם מיני דגים אחרים ומערכות סלולריים, כגון הכנות תא מכליות דגיג פאטהד 20.
שיטה חלופית כדי לזהות ROS בעוברי דג הזברה שלמים עושה שימוש בvivo חיישן חמצן. Messenger RNA לחלבון פלואורסצנטי חיזור רגיש מוזרק לתוך עוברי דג הזברה ויחס הקרינה מנוטר לאורך הזמן הבא סנפיר זנב ופצע 21. חיישן חיזור מקודד גנטי זו מאפשר הדמיה של הזמן ושלדינמיקה המרחבית של ייצור מי חמצן בגוף חי. יישומה של שיטה זו חשף את התוצאה המפתיעה שמי חמצן המיוצר על הגעתו בתחילה קדמה של התאים חיסוניים המולדים הראשונים, טוענת כי מי חמצן שפורסם על ידי תאי האפיתל פצועים פועל כאות לגייס phagocytes 21. טכניקה זו, תוך עוצמה ואינפורמטיבי, כרוך בזמן רב ונהלים עובריים ומיקרוסקופים קשים מבחינה טכנית. חיישן חיזור זה גם ספציפי עבור מי חמצן, שהוא רק אחד מROS הרבים בתפקוד בזמן התגובה החיסונית המולדת.
בהשוואה לגישה שנדונה לעיל, השיטה שלנו מודדת גם in vivo ROS, ובכל זאת היא מבחינה טכנית תובעני פחות ומשתמשת בחומר כימי כדי לגרום לתגובה חיסונית מולדת ולא פגיעה פיזית. בניגוד לשיטה הנ"ל, אשר מודדת באופן ספציפי ייצור מי חמצן, מודד ההליך שלנורמה כוללת של ROS. יתרון לגילוי ROS יחיד הוא שיכול להיות הובהר תפקידים עבור מתחם שלבד בחסינות מולדת. בדומה לשיטה שנדונה לעיל, הגישה שלנו גם מניות את היתרונות וחסרונות הטמונים במתבצע בכל החי. האינטראקציות בין phagocytes וסביבתם, אשר בוטלו כאשר מבחני פרץ נשימה מבוצעים על דגימות דם מבודדות, נשמרות במבחנים בבעלי החיים כל אלה. עם זאת, שימוש בכל החיה סבירה תוצאות בזיהוי של ROS ממקורות שאינם תא בלען (למשל נגזר mitochondrially ROS, מונואמין NADPH nonphagocyte). בניסיון לתת מענה לייחודיות של השיטה שלנו לאיתור ROS נגזר תא בלען, התייחסנו למחקר שבו assay פרץ נשימה זה בוצע בעוברי דג הזברה חסר מונואמין NADPH תא בלען ספציפי 9. מונואמין NADPH תא בלען הספציפי היה עצור באמצעות דפיקה בתיווך morpholino למטה של p47phox או p91pחלבון Hox. בעוברי דג הזברה, בשלב התפתחותי assayed, הביטוי של תת יחידות מונואמין NADPH אלה מוגבל לקבוצת משנה של תאי דם, סביר להניח שהמקרופאגים 22,23. פוטנציאל פרץ הנשימה של עוברים חסרי מונואמין NADPH תא בלען הספציפי היה כשליש שבקרות 9 (תקשורת אישית, ד"ר רוברט ווילר). תוצאה זו מרמזת כי בעוד assay פרץ הנשימה שלנו עושה לזהות ROS ממקורות אחרים מאשר phagocytes, רוב הקרינה שזוהתה יכול להיות מיוחסת לפרץ הנשימה באמצעות מונואמין NADPH תא בלען. ייחוד נוסף של assay זה הודגם באמצעות bis-indolylmaleimide (Bisi), מעכב תרופתי של חלבון קינאז C, כדי למנוע את הפעולה של PMA, אגוניסט חלבון קינאז C, על מונואמין NADPH. טרום טיפול בכליות הנגרמות PMA דג הזברה או עוברים עם Bisi הביאו לרמות הקרינה דומות לפקדים מושרה בלתי 12. נשימה אידיאליתassay פרץ יהיה assay תפוקה גבוהה in vivo בי ROS תא בלען הספציפי יכול לכמת שני ודמיין לאורך זמן. עד שזה אפשרי, את האופי המהיר וקלות טכניים של השיטה המתוארת כאן מספק אלטרנטיבה שימושית.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
המחברים רוצים להכיר חברים בעבר ובהווה של המעבדה קים, מארק Nilan לטיפול בדג זברה ותחזוקה, ד"ר רוברט וילר לדיונים מועילים ושיתוף נתונים, ומענקי NIH 3RO1GM087308-02S1 ו1P20RR024475-01A2 וחקלאות מיין והיער להתנסות תחנה (מספר פרסום 3303) למימון.
Materials
| Name | Company | Catalog Number | Comments |
| Instant Ocean Sea Salt | Instant Ocean | SS15-10 | |
| H2DCFDA | Sigma Aldrich | 35845-1G | |
| PMA | Fisher | BP6851 | |
| DMSO | Sigma Aldrich | D2438-5X10ML | |
| Tricaine S MS222 | Western Chemical | 100 grams | |
| DMEM/F-12, No Phenol Red | Life Technologies | 11039-021 | |
| Deep Petri Dishes | VWR | 89107-632 | |
| Plastic Transfer Pipettes | Fisher | 13-711-7M | |
| #5 Dumont Forceps | Electron Microscopy Sciences | 72700-D | |
| 1.7 ml Micro Centrifuge Tubes | Axygen | 10011-724 | |
| 15 ml Conical Centrifuge Tubes | VWR | 21008-918 | |
| 5 ml Serological Pipettes | Greiner Bio One | 606180 | |
| Synergy 2 Multi-Mode Microplate Reader | BioTek | Contact BioTek | |
| Black 96 Well Microplate | VWR | 82050-728 | |
| 25 ml Sterile Reservoirs | VistaLab | 3054-2003 | |
| P200 Pipettor | Gilson | F123601 | |
| Multichannel Pipettor | VWR | 89079-948 | |
| Pipette Tips | VWR | 89079-478 |
References
- Medzhitov, R., Janeway, C. A. Innate Immunity: Impact on the Adaptive Immune Response. Current Opinion in Immunology. 9, 4-9 (1997).
- Lam, S. H., Chua, H. L., et al. Development and Maturation of the Immune System in Zebrafish, Danio rerio: A Gene expression Profiling. In Situ Hybridization and Immunological. 28, 9-28 (2004).
- Stockhammer, O. W., Zakrzewska, A., et al. Transcriptome Profiling and Functional Analyses of the Zebrafish Embryonic Innate Immune Response to Salmonella Infection. J Immunol. 9. 9, 5641-5653 (2009).
- Ordas, A., Hegedus, Z., et al. Deep Sequencing of the Innate Immune Transcriptomic Response of Zebrafish Embryos to Salmonella Infection. Fish & Shellfish Immunology. 31, 716-724 (2011).
- Renshaw, S. A., Loynes, C. A., et al. A Transgenic Zebrafish Model of Neutrophilic Inflammation. Blood. 13, 3976-3978 (2006).
- Mathias, J. R., Perrin, B. J., et al. Resolution of Inflammation by Retrograde Chemotaxis of Neutrophils in Transgenic Zebrafish. J. Leukoc. Biol. 6, 1281-1288 (2006).
- Ellett, F., Pase, L., et al. mpeg1 Promoter Transgenes Direct Macrophage-Lineage Expression in Zebrafish. Blood. 4, 56-56 (2011).
- Phennicie, R. T., Sullivan, M. J., et al. Specific Resistance to Pseudomonas aeruginosa Infection in Zebrafish is Mediated by the Cystic Fibrosis Transmembrane Conductance Regulator. Infect. Immun. 11, 4542 (2010).
- Brothers, K. M., Newman, Z. R., et al. Live Imaging of Disseminated Candidiasis in Zebrafish Reveals Role of Phagocyte Oxidase in Limiting Filamentous Growth. Eukaryotic Cell. 7, 932-944 (2011).
- Rotman, J., van Gils, W., et al. Rapid Screening of Innate Immune Gene Expression in Zebrafish using Reverse Transcription - Multiplex Ligation-Dependent Probe Amplification. BMC Research Notes. 4, (2011).
- d'Alencon, C. A., Pena, O. A., et al. A High-Throughput Chemically Induced Inflammation Assay in Zebrafish. BMC Biology. 8, 151 (2010).
- Hermann, A. C., Millard, P. J., et al. Development of a Respiratory Burst Assay using Zebrafish Kidneys and Embryos. Journal of Immunological Methods. 292, 119-129 (2004).
- Avdesh, A., Chen, M., et al. Regular Care and Maintenance of a Zebrafish (Danio rerio) Laboratory: An Introduction. J. Vis. Exp. (69), e4196 (2012).
- Brothers, K. M., Wheeler, R. T. Non-invasive Imaging of Disseminated Candidiasis in Zebrafish Larvae. J. Vis. Exp. (65), e4051 (2012).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Gerlach, G. F., Schrader, L. N., et al. Dissection of the Adult Zebrafish Kidney. J. Vis. Exp. (54), e2839 (2011).
- Gupta, T., Mullins, M. C. Dissection of Organs from the Adult Zebrafish. J. Vis. Exp. (37), e1717 (2010).
- Le Guyader, D., Redd, M. J., et al. Origins and Unconventional Behavior of Neutrophils in Developing Zebrafish. Blood. 111, 132-141 (2008).
- Davidson, A. J., Zon, L. I. The 'Definitive' (and 'Primitive') Guide to Zebrafish Hematopoiesis. Oncogene. 23, 7233-7246 (2004).
- Jovanovic, B., Goetz, F. W., et al. Immunological Stimuli Change Expression of Genes and Neutrophil Function in Fathead Minnow Pimephales promelas Rafinesque. Journal of Fish Biology. 78, 1054-1072 (2011).
- Niethammer, P., Grabher, C., et al. A Tissue-Scale Gradient of Hydrogen Peroxide Mediates Rapid Wound Detection in Zebrafish. Nature. 459, 996-1000 (2009).
- Thisse, B., Pflumio, S., et al. Expression of the zebrafish genome during embryogenesis. (NIH R01 RR15402). ZFIN Direct Data Submission. , (2001).
- Thisse, B., Thisse, C. Fast Release Clones: A High Throughput Expression Analysis. ZFIN Direct Data Submission. , (2004).
- . Table 18.4. The Molecular Probes Handbook. , .
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved