Method Article
GC baseado em detecção de ácido Aldononitrile Glucosamina e Murâmicos Acetato derivatizados à determinação do resíduo microbiana em solo
Neste Artigo
Resumo
Nós descrevemos um método para o protocolo de análise de GC-Based dos derivados aldonitrile acetato de glucosamina e ácido murâmico extraído do solo. Para elucidação do mecanismo química, também apresentar uma estratégia para confirmar a estrutura do derivado e os fragmentos de iões formados mediante ionização de electrões.
Resumo
Abordagens quantitativas dos microrganismos que caracterizam são cruciais para uma compreensão mais ampla do estado microbiana e função dentro dos ecossistemas. As estratégias actuais para análise microbiana incluem ambos os tradicionais de laboratório de cultura dependentes de técnicas e aqueles com base em extracção directa e determinação de biomarcadores determinados 1, 2. Poucos entre a diversidade de espécies microbianas que habitam o solo podem ser cultivadas, de modo a cultura dependentes de métodos de introduzir enviesamentos significativos, uma limitação ausente na análise de biomarcadores.
O ácido glucosamina, manosamina, galactosamina e murâmico têm sido bem como medidas de vivos e mortos massa microbiana, desses ácidos a glucosamina (mais abundante) e murâmico (exclusivamente a partir de células bacterianas) são componentes mais importantes nos sistemas de solo 3 , 4. No entanto, a falta de conhecimento sobre a análise restringe a ampla divulgação entre os pares científicos. Entre todas as existing métodos analíticos, derivatização para aldononitrile acetatos seguido por GC-análise baseada surgiu como uma boa opção em relação à melhor forma equilibrar precisão, sensibilidade, simplicidade, boa separação cromatográfica, e estabilidade durante o armazenamento da amostra 5.
Aqui, apresentamos um protocolo detalhado para uma análise confiável e relativamente simples de glucosamina e ácido murâmico do solo após a sua conversão para acetatos aldononitrile. O protocolo é constituída principalmente por quatro etapas: digestão ácida, a purificação da amostra, a derivatização e determinação GC. O procedimento passo-a-passo é modificada de acordo com as publicações ex 6, 7. Além disso, apresentam-se uma estratégia para estruturalmente validar o ião molecular do derivado e fragmentos seus iões formada a partir de ionização de electrões. Foram aplicados GC-EI-MS-SIM, LC-ESI-TOF-MS e os reagentes isotopicamente rotulados para determinar o peso molecular de aldononitrile acetato de glucosamina derivatizado e murácido âmico; utilizou-se o deslocamento em massa de marcada com isótopos derivados no espectro de iões para investigar fragmentos de iões de cada derivados 8. Além disso para a elucidação teórica, a validação do ião molecular do derivado e fragmentos seus iões será útil para os investigadores que utilizam δ 13 C ou fragmentos de iões destes biomarcadores em estudos biogeoquímicos 9, 10.
Protocolo
1. Preparação de amostras e extração de ácidos
- Liofilizar amostras de solo após a coleta de campo.
- Moer e homogeneizar amostras de solo, utilizando um moinho de bolas, moinho de solo, ou um almofariz e um pilão.
- Pesar amostras de solo (contendo> 0,3 mg de N) para um balão de hidrólise de 25 mL.
- Adicionar 10 mL de HCl 6M em cada frasco de hidrólise, preencher N gás 2 nos frascos, e tampa.
- Hidrolisar a 105 ° C numa incubadora durante 8 horas, utilizando um interruptor temporizador automático.
2. Purificação da amostra
- Remover os frascos da incubadora; arrefecer à temperatura ambiente.
- Adicionar 100 uL padrão interno de mio-inositol (1 mg mL -1 em água) a cada frasco e misturar por agitação.
- Configure funis de plástico de drenagem em 200 ml de pêra com balões em forma de ST / NS 24/40 articulações, definidas em copos de plástico para a estabilidade.
- Fold Whatman # 2 Círculos qualitativos (11 cm de diâmetro) em quartos e em conjunto funis.
- Redemoinho de cada frasco de hidrólise, e despeje dejetos em funil para filtrar (você pode ainda Lavar com ~ 3 mL de água).
- Seca-se o filtrado utilizando um evaporador rotativo a ~ 45 ° C sob vácuo, aplicando.
- Ressuspender o resíduo seco de cada frasco de pêra com 3 ~ 5 mL de água (utilizar banho ultra-sónico, se desejado), e verter em um tubo de Teflon 40 mL; enxaguar o balão com uma segunda alíquota de água.
- Ajustar o pH a 6,6-6,8 usando solução 1M de KOH a iões de metal precipitado e outras moléculas orgânicas.
- Remover os precipitados por centrifugação a 2000 rcf durante 10 minutos.
- Verter o sobrenadante para um tubo de vidro 40 mL, cobrir a abertura do tubo com parafilme, congelamento a -20 ° C, em seguida, criar buracos na parafilme.
- Liofilizar o sobrenadante congelado para remover todo o líquido.
- Dissolve-se o resíduo com 3 mL de metanol seco, vortex completamente (utilizar banho ultra-sónico, se desejado); tampa do tubo, e, em seguida, centrifugar a 2000 rcf durante 10 minutos para resolveros sais.
- Transferir o sobrenadante para um frasco de reacção 3 mL cónico; evaporar até à secura por máquina RapidVap a 45 ° C (ou sob uma corrente suave de azoto gasoso seco, se desejado).
- Para cada frasco, adicionar 100 uL de recuperação padrão N-metilglucamina (1 mg mL -1 em água) e 1 mL de H2O, cobrir as bocas dos frascos com parafilme, congeladas a -20 ° C, perfurar a parafilme e, em seguida seca congelar .
- Fazer padrões: adicionar 100 uL de ácido murâmico (0,5 mg mL -1 em metanol), 100 uL de glucosamina (1 mg mL -1 em água), 100 uL de mio-inositol (1 mg mL -1 em água), 100 N-uL metilglucamina (1 mg mL -1 em água), e 1 mL de H2O, parafilme cada frasco, congelamento a -20 ° C, perfurar a parafilme, em seguida, liofilizar.
3. Derivatização
- Preparar o reagente de derivatização contendo 32 mg mL -1 cloridrato de hidroxilamina e 40 mg mL -1 4-dimetilamino-pyridine em piridina-metanol (4:1 v / v).
- Adicionar 300 uL do reagente de derivatização para cada um dos reactivials, tampa firmemente, e vórtice completamente.
- Coloque os frascos em banho-maria 75-80 ° C por 35 minutos (bem selados os frascos para evitar que a água entrar nos frascos).
- Remover os frascos a partir do banho de água, e arrefecer à temperatura ambiente.
- Adicionar 1 ml de anidrido acético a cada um dos reactivials de 3 mL tampão, firmemente, e vórtice completamente, em seguida aquecer em 75-80 ° C banho de água durante 25 minutos.
- Remover os frascos a partir do banho de água, e arrefecer à temperatura ambiente.
4. Separação e Mensuração
- Adicione 1,5 mL de diclorometano a cada frasco tampa, com força, e vortex completamente.
- Adicionar 1 mL de HCl 1M para cada frasco de tampa, com firmeza e vortex cuidadosamente para permitir que as soluções para sentar-se imperturbável até as duas frases em separado, aspirar e descartar a fase (aquosa) superior usando pipetador 1000 uL.
- Na mesma fashion, extrair a fase orgânica 3 vezes, mas com 1 mL de H2O (com o passo de lavagem último, tomar cuidado especial para assegurar que toda a fase aquosa superior foi removida).
- Seca-se a solução final utilizando RapidVap a 45 ° C (ou seca utilizando azoto gasoso, se desejado).
- Dissolve-se em 300 uL de etilo acetato de etilo-hexano (1:1 v / v) e transferência para 2 mL de âmbar com tampa de rosca frascos com um volume pequeno-inserção e tampa.
- Para a quantificação, analisar por GC-FID utilizando uma coluna capilar de sílica fundida não polar: 30 m de comprimento, 0,25 mm id, 0,25 espessura de filme UM; fase estacionária 5% fenil-, 95% metil-polissiloxano (DB-5 ou equivalente) com hidrogénio ou hélio como gás transportador, em 0,5 mL de fluxo -1 min constante. A cromatografia é melhor no prêmio "inerte" fases e gás transportador de hidrogênio, mas é aceitável para as variedades mais comuns e com hélio. As configurações são detectores 300 ° C, 400 mL min -1 de ar e 30 mL min -1, tanto para o nitrogênio emaquiagem gases hidrogênio. A injecção e os parâmetros do forno são como se segue: 1 injecção de divisão uL (30:1) com a entrada de GC fixado em 250 ° C; temperatura do forno inicial, de 120 ° C; segurar 1 min; aumentar a temperatura do forno a 10 ° C min. -1 a 250 ° C; segurar 2,5 min;. rampa até 270 ° C a 20 ° C min @ 1; segurar 2 minutos; rampa para 290 ° C a 20 ° C min -1, mantenha 5 min. Ajustar o transportador taxa de fluxo de gás de modo que a eluir inositol, glucosamina e derivados de ácido Murâmicos a 250 ° C, e os elui N-metilglucamina com 270 ° C.
5. Validação Derivada
- Use ionização mole LC-ESI-TOF-MS para identificar o ião molecular e determinar o peso molecular do derivado.
- Use GC-EI-MS-SIM ou GC-EI-MSMS para aumento de sensibilidade para investigar os iões específicos do derivado.
- Use vários reagentes isotopicamente marcados para a preparação dos derivados, e depois usar o deslocamento em massados derivados isotopicamente marcados em MS para investigar ião molecular e fragmentos de iões.
6. Os resultados representativos
O protocolo do método compreende principalmente quatro etapas: digestão ácida, a purificação da amostra, a derivatização e GC determinação (Figura 1). Um exemplo da análise para a glucosamina e ácido murâmico das existências de padrão e de uma amostra de solo é mostrado na Figura 2. Além glucosamina e ácido murâmico, manosamina e galactosamina (dois isómeros de glucosamina) também pode ser determinada utilizando o método simultâneo. Com base em factores de resposta de padrões com relação ao padrão interno de mio-inositol, podemos quantificar estes biomarcadores em amostras de solo. O padrão de recuperação tem sido utilizada para monitorizar o processo qualitativamente derivatização. Os esquemas para a formação do ácido aldononitrile glucosamina e murâmico acetato derivatizado são mostrados na Figura 3 .
As estruturas propostas dos derivados foi determinada por GC-EIMS-SIM para aumento de sensibilidade, ou da ionização mole LC-ESI-TOF-MS 8; as estruturas propostas dos fragmentos de iões formados mediante ionização de electrões foram estudados por comparação dos espectros de iões do amostras preparadas com incorporações de isótopos diferentes 11. A Figura 4 mostra a mudança de massa do ião dominante m / z 187, de aldononitrile acetato de glucosamina derivatizado em três cenários, preparados com agentes não-etiquetados, D-acético anidrite, e -13 U C-glucosamina. Outras informações detalhadas e explicações podem ser encaminhados para nossas publicações mais recentes 8, 11. Esta estratégia poderia servir de modelo para estudar química derivada.
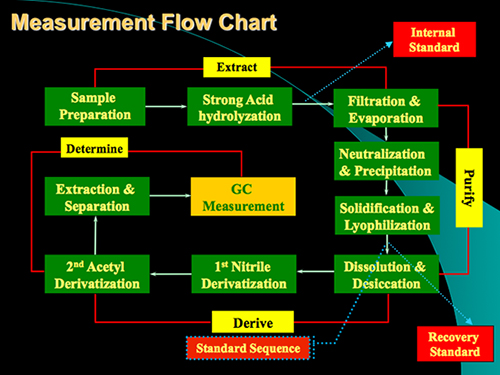
Figura 1. Fluxograma Medição do protocolo para a análise de glucosamina e ácido murâmico no soloAs amostras. O protocolo contém principalmente 4 etapas: digestão ácida, purificação, derivatização e determinação GC.
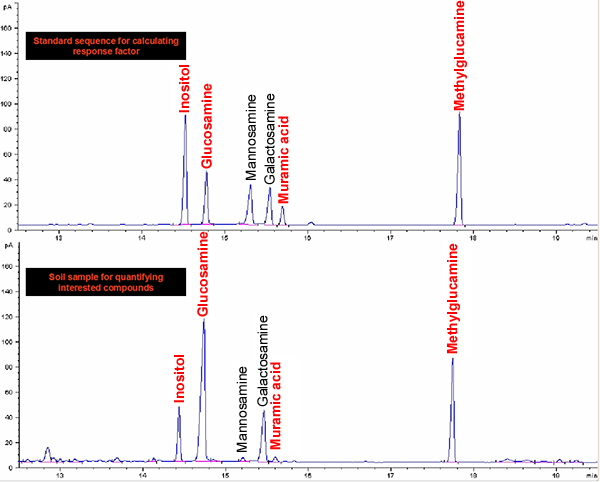
Figura 2. GC-FID cromatogramas de acetatos aldononitrile de inositol, glucosamina, ácido murâmico, manosamina, galactosamina e metilglucamina para normas e do solo.
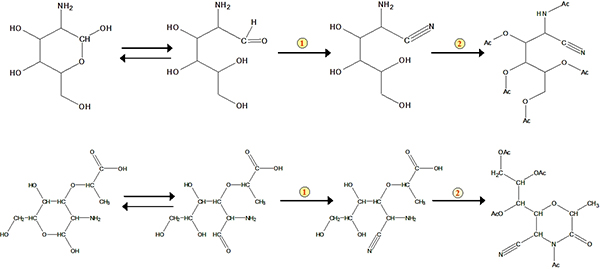
Figura 3. Esquemas para a formação do ácido aldononitrile glucosamina e murâmico acetato derivatizado. O número 1 representa reacção de nitrilo. O número 2 representa acetilação.

Figura 4. Os espectros de massa de acetato de glucosamina aldononitrile derivatizado associado com a estruturação ião dominantees sob modo EI preparado com (A) os agentes não-etiquetados, (B) D-acético anidrita, (C) U -13 C-glucosamina. Estrela representa pesado isótopo átomo ou grupo de isótopos.
Discussão
O método GC apresentou baseado para a análise de aldononitrile ácido murâmico glucosamina e acetato de derivatizado proporciona um método relativamente rápido para quantificar estes açúcares aminados, extraídos do solo. Os derivados são quimicamente estáveis, e pode ser determinada em uma análise. O método não é restrito às amostras de solo, e pode ser simplificada para amostras de solo não-matriz.
A bomba de vácuo usado neste método é construído para ser resistente a ácido. Sugerimos ainda a criação de uma armadilha de base para proteger as bombas quando evaporação 6M HCl. Cuidados devem ser tomados durante as etapas de derivatização para manter as condições rigorosamente anidras, para ambos os reagentes e vidraria. O trabalho deve ser realizada sem demora. Material de vidro deve ser escrupulosamente limpa, quer por abafamento a 550 ° C ou por lavagem com solvente. Precauções de segurança devem ser tomados para o manuseio de ácidos e vapores de ácidos fortes durante a evaporação. Aminoglicosídeos, umasérie de antibiótico produzido por solo de habitação-organismos, tem sido identificada como uma possível interferência, como co-elui com glucosamina ou ácido murâmico em DB-5 12, de modo uma segunda coluna com uma fase diferente da química estacionário é recomendado se GC-FID é o principal método utilizado para quantificar estes açúcares aminados. Recomendamos um detector de confirmação depois elui GC para análise futura. Para a identificação inequívoca do biomarcador traço em matrizes complexas, sugerimos usando instrumentação sofisticada, por exemplo GC-MSMS com monitorização de reacção múltipla; para a quantificação precisa de biomarcador na presença de interferentes, sugerimos fazendo calibração baseada em alguns iões de massa dominantes únicas para o biomarcador derivados.
Confirmação da identidade da estrutura de açúcar foi feita por substituição 15 Cloridrato de N-hidroxilamina, deuterado anidrido acético, e 13 C e biomarcadores / ou 15 N para não-etiquetado rotulado hidroxilocloridrato de amina, anidrido acético e biomarcadores na preparação dos derivados, e maior monitorização previu m / z mudança de iões característicos do rotulado versus os derivados não marcados. Em específico, uma vez que cada grupo de acetato de contém 3 deuteriums e cada grupo nitrilo contém um átomo de 15 N, pode-se prever que ião mudança de massa m / z é decidido por quantos grupos acetato e do grupo nitrilo serão apresentados nas estruturas de ião fragmentos. De modo semelhante, 13 C e / ou 15 N-marcação das células bacterianas podem ser usados para determinar quantas átomos de C nas estruturas de iões de fragmentos são originados a partir da glucosamina ou ácido murâmico, ou se glucosamina-N ou ácido murâmico-N existe no estruturas de fragmento.
GC-MS-EI-SIM é seguido por cromatografia em fase gasosa de ionização de impacto de electrões e espectrometria de massa utilizando quadropole separação de massa e de monitorização iónica seleccionada; LC-ESI-TOF-MS é a cromatografia líquida seguido por elecionização trospray e espectrometria de massa de tempo de vôo, separação de massa. Nós aqui salientar as diferenças entre estes métodos que são usados para ajudar a determinar o peso molecular e os fragmentos de iões. ESI-TOF-MS é um "mole de ionização" técnica na energia de ionização comunicado a moléculas de analito que é suficientemente baixo, de modo que não ocorre a fragmentação e do sinal produzido é uma medida altamente preciso do peso molecular da substância a analisar. Em GC-EI-MS, mais energia é transferida para o analito, ea molécula rompe produzindo um número de fragmentos carregadas. O quadropole actua como um filtro de massa de modo a que apenas os fragmentos de uma relação massa / carga específica alcançar o detector. A distribuição de fragmentos, que é característica da substância a analisar, é mostrada em um gráfico chamado um espectro de iões, na qual a intensidade ou a abundância é representada em função m / z. Para aumentar a sensibilidade, usamos monitorização de iões seleccionados (SIM), na qual se programar o MS de recolher apenas alguns específicos de m / z valores rather do que o espectro de massa inteira.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi suportado por concessões do DOE Grande Lakes Bioenergy Research Center (DOE BER escritório da Ciência DE-FC02-07ER64494). Somos gratos ao Dr. Xudong Zhang e seus membros de grupo para discussões técnicas úteis e valiosos comentários sobre a finalização do protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Murâmico | Sigma-Aldrich | M2503-25mg | |
| D-cloridrato de (+)-glucosamina | Sigma-Aldrich | G1514-100G | |
| N-metil-D-glucamina | Sigma-Aldrich | M2004-500G | |
| Mio-inositol | Fisher Scientific | A307003G025 | |
| Metanol (seco) | Acros Organics | AC326950010 | |
| 4-dimetilamino-piridina | Acros Organics | AC148270050 | |
| Acetato de etilo | VWR International | BJGC100-4 | |
| Cloridrato Hydroxlamine | Fisher Scientific | H330-100 | |
| Piridina | Fisher Scientific | P368-500 | |
| Anidrido acético | Fisher Scientific | A10-100 | |
| Diclorometano (cloreto de metileno) | Fisher Scientific | D37-500 | |
| Hexano | Fisher Scientific | H303-4 | |
| Ácido clorídrico (6M) | Fisher Scientific | S456-4 | |
| Cloridrato de hidroxilamina -15 N | Ícone serviços | IN5280 | |
| Anidrido acético -2 H (D 6 C 4 O 3) | Acros Organics | AC174670050 | |
| D-glucose-U -13 C | Cambridge isótopo laboratório | CLM-1396-1 | |
| Ammonium sufate -15 N | Cambridge isótopo laboratório | NLM-713-1 | |
| Nome do equipamento | Companhia | Tipo | |
| Rapid-Vap | Labconco | 790002 | |
| Vacum bomba | KNF Neuberger | D-79112 | |
| Frasco de hidrólise | Fisher Scientific | 06 423A | |
| Microtubo derivatização | Fisher Scientific | 06-100E | |
| GC | Hewlett-Packard | 6890 | |
| MS | Hewlett-Packard | 5972 | |
| LC-ESI-TOF-MS | Agilent | Um sistema Agilent 1200 series HPLC acoplado a um LC Agilent / MSD-TOF |
Referências
- Zelles, L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils. 29, 111-129 (1999).
- Kirk, J. L. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58, 169-188 (2004).
- Joergensen, R. G., Emmerling, C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils. Journal of Plant Nutrition and Soil Science. 169, 295-309 (2006).
- Guggenberger, G., Frey, S. D., Six, J., Paustian, K., Elliott, E. T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal. 63, 1188-1198 (1999).
- Amelung, W. Assessment Methods for Soil Carbon. Lal, R., Kimble, J. M., Follett, R. F., Stewart, B. A. , CRC/Lewis Publishers. Boca Raton, FL. 233-270 (2001).
- Guerrant, G. O., Moss, C. W. Determination of monosaccharides as aldononitrile, O-methyloxime, alditol, and cyclitol acetate derivatives by gas-chromatography. Analytical Chemistry. 56, 633-638 (1984).
- Zhang, X., Amelung, W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry. 28, 1201-1206 (1996).
- Liang, C. Investigation of the molecular ion structure for aldononitrile acetate derivatized muramic acid. Journal of Microbiological Methods. 86, 224-230 (2011).
- He, H., Xie, H., Zhang, X. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars. Soil Biology and Biochemistry. 38, 1083-1091 (2006).
- Glaser, B., Gross, S. Compound-specific delta 13C analysis of individual amino sugars - a tool to quantify timing and amount of soil microbial residue stabilization. Rapid Communications in Mass Spectrometry. 19, 1409-1416 (2005).
- Liang, C., Balser, T. C. Mass spectrometric characterization of amino sugar aldononitrile acetate derivatives used for isotope enrichment assessment of microbial residues. Soil Biology and Biochemistry. 42, 904-909 (2010).
- Liang, C., Pedersen, J. A., Balser, T. C. Aminoglycoside antibiotics may interfere with microbial amino sugar analysis. Journal of Chromatography A. 1216, 5296-5301 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.