Method Article
GC-basierte Erkennung von Aldononitrile Acetat Derivatisierte Glucosamin und Muraminsäure für Mikrobielle Rückstandsbestimmung im Boden
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren Protokoll für die GC-Analyse der aldonitrile Acetat-Derivate von Glucosamin und Muraminsäure aus dem Boden extrahiert. Für Aufklärung der chemischen Mechanismus, präsentieren wir auch eine Strategie, um die Struktur des Derivats und den Ionen-Fragmenten auf Elektronenionisation gebildet bestätigen.
Zusammenfassung
Quantitative Ansätze zur Charakterisierung von Mikroorganismen sind von entscheidender Bedeutung für ein breiteres Verständnis der mikrobiellen Status und Funktion in den Ökosystemen. Aktuelle Strategien zur mikrobiellen Analyse umfassen sowohl traditionelle Labor-Kultur-abhängigen Techniken und diese auf direkte Extraktion und die Bestimmung bestimmter Biomarker 1, 2 basiert. Wenige unter der Vielfalt der Mikroben-Spezies bewohnen Boden kann kultiviert werden, so Kultur-abhängigen Methoden einführen signifikante Verzerrungen, eine Einschränkung fehlt bei Biomarker-Analyse.
Das Glucosamin, Mannosamin, Galactosamin und Muraminsäure wurden auch Maßnahmen sowohl der lebenden und toten mikrobielle Masse diente, von diesen die Glucosamin (häufigste) und Muraminsäure (eindeutig von bakteriellen Zelle) sind die wichtigsten Bestandteile in den Boden-Systeme 3 , 4. Allerdings schränkt der Mangel an Wissen über die Analyse der breiten Popularisierung wissenschaftlicher unter Gleichaltrigen. Unter allen ExiStachel Analyseverfahren, Derivatisierung zu aldononitrile Acetaten gefolgt von GC-Analyse als eine gute Option bezüglich optimal Auswuchten Präzision entwickelt, Empfindlichkeit, der Einfachheit, gute chromatographische Trennung und Stabilität bei Lagerung 5 Probe.
Hier stellen wir Ihnen ein detailliertes Protokoll für eine zuverlässige und relativ einfachen Analyse von Glucosamin und Muraminsäure aus dem Boden nach ihrer Bekehrung zum aldononitrile Acetate. Das Protokoll umfasst im Wesentlichen vier Schritte: Säureaufschluss, Probenaufbereitung, Derivatisierung und GC-Bestimmung. Die Schritt-für-Schritt-Verfahren wird nach früheren Veröffentlichungen 6, 7 modifiziert. Darüber hinaus präsentieren wir Ihnen eine Strategie, um strukturell validiert die Molekül-Ion des Derivats und dessen Ionen-Fragmenten auf Elektronenionisation gebildet. Wir wendeten GC-EI-MS-SIM-, LC-ESI-TOF-MS und isotopisch markierten Reagenzien, um das Molekulargewicht des aldononitrile Acetat derivatisierte Glucosamin und mur zu bestimmenAmidsäure, benutzten wir die Masse Verschiebung der isotopenmarkierten Derivaten in der Ionen-Spektrum zu Ionen-Fragmenten eines jeden Derivate 8 zu untersuchen. Neben der theoretischen Aufklärung, wird die Validierung von molekularen Ionen des Derivats und dessen Ionen-Fragmenten nützlich sein, um Forscher mit δ 13 C-oder Ionen-Fragmente dieser Biomarker in biogeochemischen Studien 9, 10.
Protokoll
1. Probenvorbereitung und-Extraktion
- Freeze-Dry Bodenproben nach Feldauflistung.
- Grind und homogenisieren Bodenproben mit einer Kugelmühle, Boden-Schleifmaschine, oder einen Mörser und Stößel.
- Wiegen Bodenproben (mit> 0,3 mg N) in einen 25 ml Kolben Hydrolyse.
- Fügen Sie 10 ml 6M HCl in jeder Hydrolyse Kolben, füllen N 2-Gas in den Kolben, und fest verschließen.
- Hydrolysieren bei 105 ° C in einem Inkubator für 8 Stunden mit einem Auto-Zeitschaltuhr.
2. Reinigung der Probe
- Entfernen Sie die Flaschen aus dem Inkubator, auf Zimmertemperatur abkühlen lassen.
- Geben Sie 100 ul interner Standard myo-Inosit (1 mg mL -1 in Wasser) in jeden Kolben, durch Umschwenken mischen.
- Richten Kunststoff Trichter Entleerung in 200 ml Spitzkolben mit ST / NS 24/40 Gelenke, auf Plastikbecher für Stabilität gesetzt.
- Falten Sie Whatman Nr. 2 Qualitative Circles (11 cm Durchmesser) in Viertel-und Set in Trichtern.
- Swirl jeder Hydrolyse Kolben und gieße Schlamm in Trichter zu filtern (Sie können weiter spülen jede Flasche mit ~ 3 ml Wasser).
- Trocknen des Filtrats mit einem Rotationsverdampfer bei ~ 45 ° C, unter Vakuum.
- Resuspendieren Sie das getrocknete Rückstand aus jeder Birne Kolben mit 3 ~ 5 ml Wasser (benutzen Ultraschallbad falls gewünscht), und gießen Sie in einem 40 ml Teflon-Rohr, spülen Sie den Kolben, der mit einem zweiten Aliquot von Wasser.
- PH-Wert auf 6,6 bis 6,8 mit 1 M KOH-Lösung zu präzipitieren Metallionen und andere organische Moleküle.
- Entfernen der Niederschläge durch Zentrifugation bei 2000 xg für 10 Minuten.
- Gießen Sie den Überstand in ein 40 mL Glasröhrchen, decken Sie die Rohröffnung mit Parafilm bei -20 ° C, dann stechen Löcher in den Parafilm.
- Gefrierzutrocknen den gefrorenen Überstand, um alle Flüssigkeit zu entfernen.
- Der Rückstand wird mit 3 ml trockenem Methanol, Vortexen gründlich reinigen (Ultraschallbad verwenden, wenn gewünscht); Kappe das Rohr, und dann bei 2000 rcf zentrifugieren für 10 Minuten zu begleichenSalze aus.
- Übertragen Sie den Überstand in ein 3 ml konischen Röhrchen Reaktion, verdampft zur Trockene RapidVap Maschine bei 45 ° C (oder unter einem leichten Strom von trockenem Stickstoff falls gewünscht).
- Zu jeder Ampulle, fügen Sie 100 ul Erholung Standard N-Methyl-(1 mg mL -1 in Wasser) und 1 ml H 2 O, decken Sie die Fläschchen Münder mit Parafilm bei -20 ° C, perforieren den Parafilm, und dann einfrieren trocken .
- Machen Standards: add 100 ul Muraminsäure (0,5 mg mL -1 in Methanol) wurden 100 ul Glucosamin (1 mg mL -1 in Wasser), 100 ul myo-Inosit (1 mg mL -1 in Wasser), 100 ul N- Methylglucamin (1 mg mL -1 in Wasser), und 1 ml H 2 O, Parafilm jedes Fläschchen bei -20 ° C, perforieren den Parafilm, dann gefriergetrocknet trocken.
3. Derivatisierung
- Planen Derivatisierungsreagenz mit 32 mg L -1 Hydroxylaminhydrochlorid und 40 mg ml -1 4-Dimethylamino-pypiperidin in Pyridin-Methanol (4:1 v / v).
- Dann werden 300 ul der Derivatisierungsreagenz zu jedem der reactivials, fest verschließen und gründlich vortexen.
- Setzen Sie die Fläschchen in 75-80 ° C warmen Wasserbad für 35 Minuten (gut verschlossen die Fläschchen zu vermeiden, dass kein Wasser die Fläschchen geben).
- Entfernen Fläschchen aus dem Wasserbad, und auf Zimmertemperatur abkühlen lassen.
- 1 ml Acetanhydrid zu jedem der 3 mL reactivials, fest verschließen und gründlich vortexen, dann in 75-80 ° C warmen Wasserbad für 25 Minuten aufwärmen.
- Entfernen Fläschchen aus dem Wasserbad, und auf Zimmertemperatur abkühlen lassen.
4. Trennung und Messung
- 1,5 ml Dichlormethan zu jedem Fläschchen, fest verschließen und gründlich vortexen.
- 1 ml 1 M HCl zu jedem Fläschchen, fest verschließen und gründlich vortexen, damit die Lösungen zu sitzen, bis die zwei Sätze getrennt ungestört, absaugen und entsorgen Sie die obere (wässrige) Phase mit 1000 ul Pipette.
- Im gleichen fashion, extrahieren Sie die organische Phase 3 mal aber mit 1 ml H 2 O (mit dem letzten Waschschritt, besondere Sorgfalt walten lassen, um sicherzustellen, dass alle von der wässrigen oberen Phase wurde entfernt).
- Trocknen Sie die endgültige Lösung mit RapidVap bei 45 ° C (trocken oder mit Stickstoffgas wenn gewünscht).
- Man löst in 300 ul Ethylacetat-Hexan (1:1 v / v) und Transfer zu 2 ml Bernstein Schraubverschluss Durchstechflaschen mit einer kleinen Volumen-Einsatz und fest verschließen.
- Zur Quantifizierung mittels GC-FID analysiert unter Verwendung eines unpolaren Fused-Silica-Kapillarsäule: 30 m lang, 0,25 mm ID, 0,25 um Filmdicke; stationäre Phase 5% Phenyl-, 95% Methyl-Polysiloxan (DB-5 oder gleichwertig) mit Wasserstoff oder Helium als Trägergas, bei 0,5 ml min -1 konstanten Durchfluss. Die Chromatographie ist besser auf Premium "inert" Phasen-und Wasserstoff-Trägergas, sondern ist auf die häufigsten Sorten und mit Helium akzeptabel. Die Einstellungen sind Detektor 300 ° C, 400 ml min -1 Luft und 30 ml min -1 sowohl für den Stickstoff undWasserstoff-Make-up-Gase. Die Injektion und Backofen Parameter lauten wie folgt: 1 ul-Split-Einspritzung (30:1) mit dem GC-Einlass bei 250 ° C eingestellt; anfängliche Ofentemperatur, 120 ° C; 1 min halten, erhöhen die Ofentemperatur bei 10 ° C min. -1 bis 250 ° C; 2,5 min halten;. Rampe bis 270 ° C bei 20 ° C min -1; halten 2 Minuten; Rampe auf 290 ° C bei 20 ° C min -1, halten 5 min. Einstellen der Durchflussgeschwindigkeit des Trägergases, so dass das Inositol, Glucosamin und Muraminsäure Derivate eluieren bei 250 ° C, und die N-Methylglucamin eluiert bei 270 ° C
5. Derivative Validation
- Verwendung weicher Ionisation LC-ESI-TOF-MS, um die molekulare Ionen zu identifizieren und die molekularen Gewichts des Derivats.
- Verwenden GC-EI-MS-SIM-oder GC-EI-MSMS für Empfindlichkeitsanhebung zu gezielten Ionen des Derivats zu untersuchen.
- Verwenden Sie mehrere isotopenmarkierten Reagenzien für die Herstellung der Derivate, und verwenden Sie dann die Masse Verschiebungdieser isotopenmarkierten Derivate in MS zu untersuchen, Molekül-Ion und Fragment-Ionen.
6. Repräsentative Ergebnisse
Das Protokoll der Methode umfasst im Wesentlichen vier Schritte: Säureaufschluss, Probenaufbereitung, Derivatisierung und GC-Bestimmung (Abbildung 1). Ein Beispiel für die Analyse für Glucosamin und Muraminsäure von Standardmaterial und aus einer Bodenprobe ist in 2 gezeigt. Neben und Muraminsäure Glucosamin, Mannosamin und Galactosamin (zwei Isomeren von Glucosamin) gleichzeitig auch bestimmt werden unter Verwendung des Verfahrens. Basierend auf Response-Faktoren von Standards in Bezug auf den internen Standard myo-Inosit, können wir diese Biomarker in Bodenproben zu quantifizieren. Die Erholung Standard wurde verwendet, um qualitativ überwacht die Derivatisierung. Die Regelungen für die Bildung des aldononitrile Acetat derivatisierte Glucosamin und Muraminsäure sind in Abbildung 3 gezeigt .
Die vorgeschlagenen Strukturen der Derivate wurden durch GC-EI-MS-SIM für Empfindlichkeitsanhebung, oder weiche Ionisation LC-ESI-TOF-MS-8 bestimmt, die vorgeschlagenen Strukturen der Ionen-Fragmenten auf Elektronenionisation gebildet wurden, indem die Ionen-Spektren der untersuchten Proben mit verschiedenen Isotopen Eingemeindungen 11 hergestellt. Die Abbildung 4 zeigt die Masse Verschiebung der dominanten Ionen m / z 187 von aldononitrile Acetat derivatisierte Glucosamin in drei Szenarien, mit nicht-markierten Wirkstoffen, D-Essigsäure Anhydrit, und U -13 C-Glucosamin vorbereitet. Weitere Informationen und Erklärungen können in unseren aktuellen Publikationen 8, 11 bezeichnet werden. Diese Strategie könnte als Modell zur Ableitung dienen Chemie zu studieren.
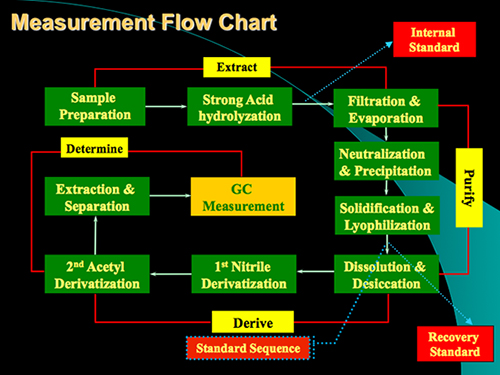
1. Messung Flußdiagramm des Protokolls für die Analyse von Glucosamin und Muraminsäure im BodenProben. Das Protokoll enthält im Wesentlichen vier Schritte: Säureaufschluss, Reinigung, Derivatisierung und GC-Bestimmung.
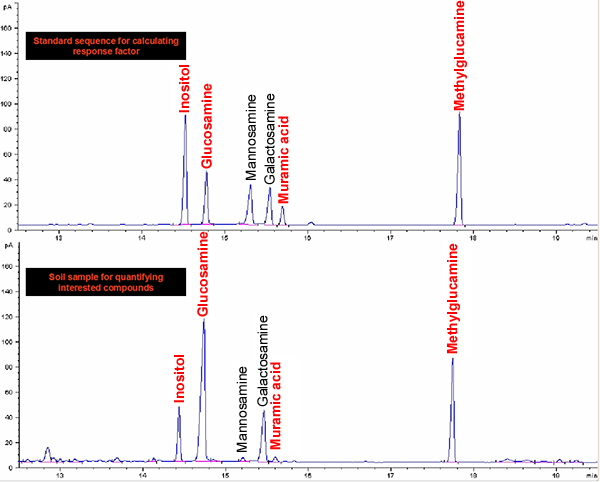
Abbildung 2. GC-FID-Chromatogramme von aldononitrile Acetate von Inosit, Glucosamin, Muraminsäure, Mannosamin, Galactosamin und Methylglucamin für Normen und Boden.
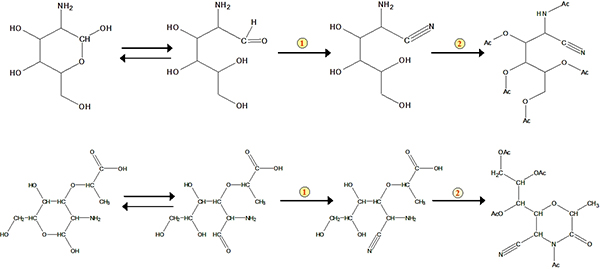
3. Schemata zur Bildung der aldononitrile Acetat derivatisierte Glucosamin und Muraminsäure. Die Zahl 1 darstellt Nitril-Reaktion. Die Zahl 2 steht für die Acetylierung.

Abbildung 4. Massenspektren von aldononitrile Acetat derivatisierte Glucosamin mit dem dominanten Ionen strukturell verbundenes unter EI-Modus mit (A) nicht-markierten Wirkstoffen hergestellt, (B) D-Essigsäure Anhydrit, (C) U -13 C-Glucosamin. Stern repräsentiert schwere Isotop Atom oder Isotop-Gruppe.
Diskussion
Die vorliegende GC-basierte Verfahren zur Analyse von aldononitrile Acetat derivatisierte Glucosamin und Muraminsäure eine relativ schnelles Verfahren, um diese Aminozucker, aus dem Boden extrahierten quantifizieren. Die Derivate sind chemisch stabil, und kann in einer Analyse bestimmt werden. Das Verfahren ist nicht auf die Bodenproben beschränkt und kann für Proben aus nicht-Bodenmatrix vereinfacht werden.
Die Vakuumpumpe in diesem Verfahren verwendet wird gebaut, dass sie resistent gegen Säure. Wir empfehlen weiter die Einrichtung einer Basis-Falle, um die Pumpen zu schützen, wenn Verdampfen 6M HCl-Lösungen. Vorsicht ist bei der Derivatisierung Schritte unternommen werden, um streng wasserfreien Bedingungen zu halten, sowohl für die Reagenzien und Glaswaren. Die Arbeiten sollten ohne Verzögerung durchgeführt werden. Glasgeräte müssen peinlich sauber sein, entweder durch Dämpfung bei 550 ° C oder durch Spülen mit Lösungsmittel. Sicherheitsmaßnahmen sollten für den Umgang mit Säuren und starken sauren Dämpfe beim Verdampfen genommen werden. Aminoglykosid, einReihe von Antibiotikum, das durch im Boden lebenden Organismen hergestellt wurden, als mögliche Störungen identifiziert, wie es koeluiert mit Glucosamin oder Muraminsäure auf DB-5 12, so dass eine zweite Spalte mit einer anderen stationären Phase Chemie wird empfohlen, wenn GC-FID ist die primäre Methode zur Quantifizierung dieser Aminozucker verwendet. Wir empfehlen eine bestätigende Detektor nach GC eluiert für künftige Analysen. Zur eindeutigen Identifizierung von Biomarker-Spur in komplexen Matrices, empfehlen wir, mit ausgefeilten Instrumenten, z. B. GC-MSMS mit Multiple Reaction Monitoring, für die präzise Quantifizierung von Biomarkern in der Gegenwart von Störstoffen, schlagen wir tun Kalibrierung basierend auf einigen dominierenden Masse Ionen einzigartig für die Biomarker Derivate.
Bestätigung der Identität Zuckerstruktur durch Substituieren 15 N-Hydroxylamin-Hydrochlorid wurde, deuteriertes Essigsäureanhydrid und 13 C und / oder 15 N markierten Biomarker für nicht-markierte HydroxyAminhydrochlorid, Essigsäureanhydrid und Biomarkern in Herstellung der Derivate, und weitere Beobachtung vorhergesagten m / z-Verschiebung der charakteristischen Ionen der gegenüber den unmarkierten Derivate bezeichnet. In bestimmten, da jede Gruppe bildet, 3-acetat deuteriums und jedes Nitril-Gruppe 1 15 N-Atom, kann man voraussagen, dass m / z Massenverschiebung, wie viele Acetatgruppen und Nitrilgruppe in den Strukturen von Ionen präsentiert wird entschieden Fragmente. Ebenso, 13 C und / oder 15 N-Markierung Bakterienzellen können beide verwendet, um festzustellen, wie viele C-Atomen in den Fragment-Ion Strukturen von der Glucosamin oder Muraminsäure entstand, oder ob Glucosamin-N oder-N Muraminsäure besteht in den Fragment Strukturen.
GC-EI-MS-SIM ist die Gaschromatographie mit Elektronenstoß-Ionisation und Massenspektrometrie mit Quadrupol Massen-Trennung und Selected Ion Monitoring gefolgt; LC-ESI-TOF-MS ist Flüssigchromatographie durch elek gefolgttrospray Ionisation und Massenspektrometrie mit Time-of-flight mass Trennung. Wir weisen darauf hin, hier die Unterschiede zwischen diesen Methoden, die verwendet werden, um festzustellen, das Molekulargewicht und die Ionen-Fragmente werden. ESI-TOF-MS ist eine "weiche Ionisation"-Technik bei der Ionisation Energie, die auf Analytmoleküle, die niedrig genug ist, so dass keine Fragmentierung auftritt, und das erzeugte Signal ist ein sehr genaues Maß für das Molekulargewicht des Analyten. In der GC-EI-MS, wird mehr Energie an den Analyten übertragen, und das Molekül zerbricht wodurch eine Reihe von geladenen Fragmente. Die Quadrupol wirkt als ein Massenfilter, so dass nur solche Fragmente einer bestimmten Masse / Ladungs-Verhältnis den Detektor erreichen. Die Verteilung der Fragmente, die charakteristisch für den Analyten ist, wird in einem Diagramm als eine Ionen-Spektrum, bei dem die Intensität oder Häufigkeit gegen m / z aufgetragen ist. Um die Empfindlichkeit zu erhöhen, verwenden wir ausgewählte Ion Monitoring (SIM), in dem wir die MS zu sammeln nur ein paar bestimmte m / z-Werte ra programmierenther als die gesamte Massenspektrum.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch Bewilligungen von DOE Großen Seen Bioenergy Research Center (DOE Office of Science BER DE-FC02-07ER64494) unterstützt. Wir danken Dr. Xudong Zhang und seine Gruppenmitglieder für hilfreiche technische Diskussionen und wertvolle Anmerkungen zur Fertigstellung des Protokolls.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Muraminsäure | Sigma-Aldrich | M2503-25mg | |
| D-(+)-Glucosamin-Hydrochlorid | Sigma-Aldrich | G1514-100G | |
| N-Methyl-D-glucamin | Sigma-Aldrich | M2004-500G | |
| Myo-Inosit | Fisher Scientific | A307003G025 | |
| Methanol (trocken) | Acros Organics | AC326950010 | |
| 4-Dimethylamino-pyridin | Acros Organics | AC148270050 | |
| Ethylacetat | VWR International | BJGC100-4 | |
| Hydroxlamine Hydrochlorid | Fisher Scientific | H330-100 | |
| Pyridin | Fisher Scientific | P368-500 | |
| Essigsäureanhydrid | Fisher Scientific | A10-100 | |
| Dichlormethan (Methylenchlorid) | Fisher Scientific | D37-500 | |
| Hexan | Fisher Scientific | H303-4 | |
| Salzsäure (6M) | Fisher Scientific | S456-4 | |
| Hydroxylaminhydrochlorid -15 N | Icon Dienstleistungen | IN5280 | |
| Essigsäureanhydrid -2 H (D 6 C 4 O 3) | Acros Organics | AC174670050 | |
| D-Glucose-U -13 C | Cambridge Isotopenlabors | CLM-1396-1 | |
| Ammonium sufate -15 N | Cambridge Isotopenlabors | NLM-713-1 | |
| Bezeichnung des Geräts | Firma | Typ | |
| Rapid-Vap | Labconco | 790002 | |
| Vacum Pumpe | KNF Neuberger | D-79112 | |
| Die Hydrolyse Kolben | Fisher Scientific | 06 423A | |
| Derivatisierung Mikroampulle | Fisher Scientific | 06-100E | |
| GC | Hewlett-Packard | 6890 | |
| MS | Hewlett-Packard | 5972 | |
| LC-ESI-TOF-MS | Agilent | Ein Agilent Serie 1200 HPLC-System zu einem Agilent LC / MSD TOF-gekoppelt |
Referenzen
- Zelles, L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils. 29, 111-129 (1999).
- Kirk, J. L. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58, 169-188 (2004).
- Joergensen, R. G., Emmerling, C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils. Journal of Plant Nutrition and Soil Science. 169, 295-309 (2006).
- Guggenberger, G., Frey, S. D., Six, J., Paustian, K., Elliott, E. T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal. 63, 1188-1198 (1999).
- Amelung, W. Assessment Methods for Soil Carbon. Lal, R., Kimble, J. M., Follett, R. F., Stewart, B. A. , CRC/Lewis Publishers. Boca Raton, FL. 233-270 (2001).
- Guerrant, G. O., Moss, C. W. Determination of monosaccharides as aldononitrile, O-methyloxime, alditol, and cyclitol acetate derivatives by gas-chromatography. Analytical Chemistry. 56, 633-638 (1984).
- Zhang, X., Amelung, W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry. 28, 1201-1206 (1996).
- Liang, C. Investigation of the molecular ion structure for aldononitrile acetate derivatized muramic acid. Journal of Microbiological Methods. 86, 224-230 (2011).
- He, H., Xie, H., Zhang, X. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars. Soil Biology and Biochemistry. 38, 1083-1091 (2006).
- Glaser, B., Gross, S. Compound-specific delta 13C analysis of individual amino sugars - a tool to quantify timing and amount of soil microbial residue stabilization. Rapid Communications in Mass Spectrometry. 19, 1409-1416 (2005).
- Liang, C., Balser, T. C. Mass spectrometric characterization of amino sugar aldononitrile acetate derivatives used for isotope enrichment assessment of microbial residues. Soil Biology and Biochemistry. 42, 904-909 (2010).
- Liang, C., Pedersen, J. A., Balser, T. C. Aminoglycoside antibiotics may interfere with microbial amino sugar analysis. Journal of Chromatography A. 1216, 5296-5301 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.