Method Article
Mapeamento de heterogeneidade de expressão da proteína em tumores usando imunofluorescência Quantitative
Neste Artigo
Resumo
Aqui nós descrevemos um método para quantificar a heterogeneidade molecular em cortes histológicos de material do tumor através de imunofluorescência quantitativos, análise de imagem, e uma medida estatística de heterogeneidade. O método é destinado ao uso no desenvolvimento de biomarcadores e análises clínicas.
Resumo
Heterogeneidade morfológica dentro de um tumor individual é bem reconhecido por histopathologists na prática cirúrgica. Enquanto isso muitas vezes assume a forma de áreas de diferenciação distintas em reconhecida subtipos histológicos, ou grau patológico diferentes, muitas vezes há diferenças mais sutis no fenótipo que desafiam classificação precisa (Figura 1). Em última análise, uma vez que a morfologia é ditada pelo fenótipo molecular subjacente, áreas com diferenças visíveis são susceptíveis de ser acompanhadas por diferenças na expressão de proteínas que orquestram a função celular e comportamento, e, portanto, a aparência. O significado do visível e invisível heterogeneidade (molecular) para o prognóstico é desconhecida, mas evidências recentes sugerem que, pelo menos no nível genético, a heterogeneidade existente no 1,2 tumor primário, e alguns desses clones sub-dar origem a metástases ( e, portanto, letal) da doença.
Além disso, algumas proteínas sãomedida como biomarcadores porque eles são os alvos da terapia (por exemplo, ER e HER2 para o tamoxifeno e trastuzumab (Herceptin), respectivamente). Se estas proteínas mostram expressão variável dentro de um tumor, em seguida, respostas terapêuticas também podem ser variáveis. O amplamente utilizados sistemas de pontuação histopatológico em imuno-histoquímica ou ignoram, ou numericamente homogeneizar a quantificação da expressão da proteína. Da mesma forma, em técnicas destrutivas, onde as amostras são homogeneizadas tumor (tais como perfil de expressão gênica), informação quantitativa pode ser elucidado, mas a informação espacial é perdido. Abordagens de mapeamento heterogeneidade genética no câncer pancreático confiaram tanto na geração de uma suspensão única célula 3, ou em 4 macrodissection. Um estudo recente tem utilizado os pontos quânticos, a fim de mapear a heterogeneidade morfológica e molecular em tecido de câncer de próstata 5, fornecendo prova de princípio que o mapeamento morfologia e molecular é viável, mas caindo short de quantificar a heterogeneidade. Desde imuno-histoquímica é, na melhor das hipóteses, apenas semi-quantitativa e sujeito a viés intra-e inter-observador, mais sensível e metodologias quantitativas são necessárias, a fim de mapear com precisão e quantificar a heterogeneidade do tecido in situ.
Temos desenvolvido e aplicado uma metodologia experimental e estatística, a fim de quantificar sistematicamente a heterogeneidade da expressão da proteína em seções do tecido inteiro de tumores, com base na análise automatizada quantitativos (AQUA) sistema 6. Secções de tecido são rotulados com anticorpos específicos dirigidos contra citoqueratinas e alvos de interesse, acoplado a fluoróforo marcado com anticorpos secundários. Slides são gravadas usando um scanner de fluorescência de todo o slide. As imagens são subdivididos em centenas de milhares de telhas, e cada azulejo é então atribuído uma pontuação AQUA que é uma medida de concentração de proteínas dentro do componente (tumor) do tecido epitelial. Heatmaps são gerados para representar expressão tecidual de proteínas e uma pontuação atribuída a heterogeneidade, usando uma medida estatística de heterogeneidade originalmente usado em ecologia, com base no índice de Simpson biodiversidade 7.
Até à data não houve tentativas de mapear sistematicamente e quantificar essa variabilidade em conjunto com a expressão da proteína, em preparações histológicas. Aqui, ilustramos o primeiro uso do método aplicado para ER e HER2 expressão de biomarcadores em câncer de ovário. Usando este método abre caminho para analisar a heterogeneidade como uma variável independente em estudos de expressão de biomarcadores em estudos de translação, a fim de estabelecer o significado da heterogeneidade no prognóstico e previsão de respostas à terapia.
Protocolo
1. Preparação dos tecidos
- Microtomia
- Parafina seção formol fixo embutido blocos de tumor de 4 mM espessura usando um micrótomo rotativo.
- Coloque as secções em lâminas com carga positiva.
- Incubar as lâminas em um forno de 37 ° C durante a noite.
- Armazenamento
- Seções em uma loja de -18 ° C a -25 ° C freezer, a fim de evitar a perda de antigenicidade.
2. Imunofluorescência de secções de tecido
- Desparafinação e Reidratação
- Dewax slides em xileno duas vezes por 5 min.
- Reidratar slides em 99%, 99%, 80%, 50% de etanol e água corrente por 2 min de cada um em ordem.
- Recuperação antigênica
- Realizar a recuperação antigênica induzida por calor, usando citrato de sódio 0,15 mM, pH 6,0 em uma panela de pressão por 5 minutos na mide microondas.
- Arrefecer slides por 20 min.
- Lavar as lâminas em PBST 0,05% por 5 min do roqueiro.
- Bloqueio de procedimento
- Tratar seções em peróxido de hidrogênio 3% por 10 min.
- Lavar as lâminas em PBST 0,05% por 5 min do roqueiro.
- Adicionar as seções a Sequenza rack de imunocoloração.
- Tratar seções no bloco de proteína de soro livre por 10 min.
- De incubação do anticorpo primário
- Incubar anticorpo primário diluído para diluição óptima em diluente de anticorpo Dako por 1 hora em temperatura ambiente.
- Enxágüe em 0,05% PBST três vezes por 5 min cada.
- Epiteliais máscara de incubação (citoqueratina)
- Incubar mouse anti-pan citoqueratina, diluído 1:50 em diluente de anticorpo Dako overnight a 4 ° C.
- Visualização máscara epiteliais
- Prepare uma diluição de 1:25 da cabra anti-rato Alexa555 santicorpo econdary no pré-diluído Envision bode coelho solução de anticorpo HRP. Incubar as lâminas no escuro por 1,5 horas em temperatura ambiente.
- Enxágüe em 0,05% PBST três vezes para cada 5min.
- Visualização alvo
- Transferir os slides da Sequenza para a câmara de umidade.
- Combine-alvo diluente amplificação de sinal (HistoRx tub E) e os tiramida Cy5 (HistoRx F tubo) em 1:50 concentração. Vortex para misturar bem. Incubar as lâminas no escuro por 10 min em temperatura ambiente.
- Enxágüe em 0,05% PBST três vezes por 5 min cada.
- Desidratar as lâminas em etanol 80% por 1 min.
- Slides ar seco no escuro.
- Contracoloração e lamínulas
- Aplicar DAPI meio de montagem na lamínulas e coloque as lamelas sobre a seções do tecido.
- Slides secar durante a noite no escuro.
- Após os slides tenham secado, segura com unhas polonês para enpreservação a longo prazo e se manter na geladeira a 4 ° C.
3. Captura de imagem de varredura seção inteira
- Carregar até cinco slides no cassete deslize do scanner de slides Aperio ScanScope FL.
- Para cada slide, selecione a região em geral para a imagem usando a interface no console ScanScope. Selecione a região para abranger todo o tecido no slide, independentemente da coloração padrão ou de outros aspectos observáveis da amostra.
- Usando o Console ScanScope, para cada canal (DAPI, Cy3 e Cy5) determinar uma melhor exposição da seguinte forma:
- Selecione uma região de tecido para interrogar - esta área deve, idealmente, estar na região do tumor de tecido para fornecer a melhor representação.
- Usando o recurso de auto-exposição ScanScope Console, avaliar o tempo de exposição sugerido para cada canal, juntamente com o foco da imagem.
- Repita mais até 05/03 regiões de cada amostra para confirm estabilidade do valor.
- Selecione uma região adicional (como mostrado por um diamante azul na imagem consola ScanScope) de distância a partir do tecido, mas ainda dentro da região lamínulas da lâmina, para definir uma área de fundo onde as imagens correcção forfetária de campo serão adquiridos para cada filtro.
- Rever essas imagens antes da aquisição da imagem. Se as imagens parecem ter elevado ruído de fundo ou artefatos outra imagem, a região da imagem deve ser movido e novas imagens adquiridas.
- Adquirido imagens de slides digitais são carregados automaticamente no banco de dados Spectrum Aperio.
4. AQUA automatizado de análise de imagem
- Ver o imagens digitais slide inteiro no banco de dados Spectrum e anotar tumor áreas de interesse no contexto de todo o tecido e padrão de coloração (s).
- Selecione o slide ao analisar usando AQUAnalysis da lista de slides digitais no banco de dados Spectrum clicando duas vezes o polegarprego de imagem (em alternativa, marque a caixa de seleção ao lado da imagem e selecione "Ver imagens" no menu no topo da lista). Este abre automaticamente o software ImageScope ea imagem de cores mescladas da amostra de tecido.
- Use este software para navegar na imagem usando as ferramentas fornecidas.
- Usando a H & E acompanha (ou deslize o físico ou uma imagem anotada), anotar a região de interesse na imagem fluorescente. Diversas regiões de interesse, individual circulou áreas, podem ser selecionados em uma única amostra. Há também uma ferramenta de "negativo" que é usada para excluir as áreas dentro de uma região selecionada (ou seja, o tecido danificado, áreas de histologia pobres, áreas não-tumorais, detritos, etc.)
- Salvar a camada de anotação (s) na imagem.
- Voltar ao menu principal Spectrum e marque a caixa de seleção ao lado a imagem que acabou de ser anotado. Selecione "Analisar" da faixa de menu na parte superior da lista.
- Na janela de Análise, que vai aparecer, select "HistoRx Análise AQUA" no menu suspenso.
- Se existem várias camadas de anotações, use as caixas de seleção para selecionar a camada adequada (s) para análise.
- Pressione o "Analisar" botão quando estiver pronto para começar.
- Neste ponto, uma janela de console irá aparecer minimizado na barra de tarefas do Windows. Isto irá exibir o andamento da transferência de imagens do banco de dados de espectro para o PC local (a "puxar" a operação).
- Uma vez que os dados são transferidos, AQUAnalysis vai lançar. O usuário pode então usar todas as funções internas do software para visualizar, navegar e analisar imagens.
- A região anotada da imagem do banco de dados de espectro é dividido em telhas de imagem 512x512 pixel - cada um dos quais vai ser marcado individualmente.
- Para este estudo, um algoritmo de pontuação unsupervised AQUA, baseado na agregação de dados, foi utilizado 8. Neste algoritmo, as pontuações AQUA são gerados da seguinte forma:
- A imagem pan-citoqueratina signal é thresholded acima fundo e os pixels são usados para definir um tumor 'máscara' que é então utilizado para cálculos posteriores. A expressão de alta pan-citoqueratina pixels também definem as regiões citoplasmáticas / não-nuclear das células tumorais.
- Pixels com sinal de alta no canal DAPI que estão dentro da máscara de tumor são identificadas como nuclear na natureza.
- O algoritmo de agrupamento também examina pixels que têm baixa intensidade para qualquer coloração DAPI ou expressão citoqueratina e tenta parcialmente atribuí-las a qualquer dos compartimentos nuclear ou citoplasmática, ou de fundo.
- Uma vez que todos os pixels são atribuídos a um dos compartimentos do tumor ou de fundo, a intensidade do sinal da proteína-alvo (ER ou HER2) é então calculada em cada um dos compartimentos e normalizadas para o tamanho dos compartimentos, produzindo pontuações AQUA.
- Imagens que não têm representação tumor suficientes não foram marcados (como definido por aqueles com less de 5% dos pixels representando tumor). Estas regiões também produzem um valor 'Resultado Final' chamada 'Fail' e podem ser retirados nas subseqüentes análises estatísticas.
- Além disso, se após a revisão, um operador identificados campos que não eram apropriados para marcar devido à amostra ou artefatos de imagem (por exemplo, o tecido dobrado detritos), os campos foram redigidas a partir de pontuação e produziu um 'Final Resultado' chamada 'Fail'.
- Os resultados da pontuação AQUA são tabelas de pontuações associadas a cada telha 512x512 pixels na região de interesse dentro de uma amostra de tecido toda seção. Esses arquivos, em formato. CSV, pode então ser usado para posterior análise estatística.
5. Análise estatística: Todas as análises estatísticas são realizadas no SPSS (IBM)
- Sempre que possível, para operações de grande porte, gerar arquivos de sintaxe SPSS código (. Sps) para realizar manipulações de dados e as etapas de análise. Sintaxe de código exemplo é fornecido como arquivos suplementares.
- Leia os arquivos de dados em SPSS. Remove variáveis não utilizadas nos dados brutos (por exemplo, parâmetros de instrumento específico, a pontuação AQUA de não-utilizados compartimentos).
- Quando as regiões têm um 'Resultado Final' de 'Fail' (veja acima), marca estes valores como SYSMIS, que remove-los a partir das análises numéricas.
- Agregar todos os dados para todos os slides para cada marcador (ER ou HER2) em um único conjunto de dados mestre em formato SPSS. Utilize este arquivo mestre para todos os cálculos subseqüentes.
- Usando um arquivo de sintaxe SPSS (uma para cada marcador: ER ou HER2 (ver arquivos de sintaxe adicionais) de dados foi ainda mais validado e índices de diversidade de Simpson calculado da seguinte forma:
- Gerar um arquivo mestre analítico, a fim de impedir a modificação dos dados mestre set gerado anteriormente.
- Validar os dados mestre set contra os dados brutos e imagens geradas.
- Produzir estatísticas de resumo para pontuação AQUA para cada amostra (contagem de campos, a média de pontuação pontuação, mediana, minimum pontuação, a pontuação máxima, e desvio padrão dos escores da amostra).
- Confira uma amostra aleatória de resultados com o original primas arquivos de dados de saída e contra os dados de imagem raw marcou.
- Para gerar as imagens mapa de calor (mostrado nas Figuras 2 e 3):
- "Bin" do Aqua Data pontuação (utilizando a função 'Binning Visual' no SPSS) em oito níveis individual. Para ER, partituras nuclear foram utilizados, para HER2, partituras citoplasmática foram usados.
- Derive caixas de forma que cada bin representa uma percentagem igual de casos disponíveis a partir do conjunto de dados inteiro.
- Use 'File Split' a função SPSS para que todos os de saída subseqüente seria em nível de uma "amostra slide / per '.
- Plot cada região (que corresponde a uma telha 512x512) pelo seu coordenadas x, y e cor com um valor correspondente ao bin em que foi alocado (ver figuras 2 e 3).
- Para gerar escores heterogeneidade, o código foi escrito para gerar um de Simpsoníndice de diversidade através de escores AQUA.
- O índice de Simpson da diversidade, como usado aqui, é definida como:
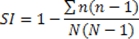
Onde N é o número total de contagens / campos utilizados para uma dada amostra e n é o número de resultados / campos em um determinado grupo de escores padronizados (produzidos conforme descrito abaixo).
- O índice de Simpson da diversidade, como usado aqui, é definida como:
- Use o arquivo mestre analítico descrito acima para fonte de dados. Nos exemplos apresentados, todos os cálculos ER utilizado o escore AQUA nuclear e HER2 cálculos utilizados a pontuação AQUA citoplasmática. Executar os cálculos abaixo para cada amostra / slide.
- Como os dados de fluorescência está sujeito à instabilidade da variância, tal magnitude que o erro se propaga com intensidade, aplicar normalização (base 2) logarítmica para todos os escores AQUA.
- Ainda transformar o normalizado (log transformado) de dados em z-(standard) pontuações.
- A transformação Z-score é calculado ums seguinte forma: Z = (pontuação AQUA - média de todas as pontuações para uma amostra) / desvio padrão das notas para a amostra. Isto traduz a distribuição dos escores em uma distribuição dos desvios em torno do valor central de desvio zero.
- Bin estes valores Z-score em seis grupos (<-2, -2 - -1, -1 - 0, 0-1, 1-2,> 2).
- Calcular o número de valores alocados em cada bin e soma para cada bin. Utilize este valor, juntamente com o número total de campos, para calcular um valor para cada um dos seis caixas usadas para o índice.
- Soma esses valores e subtrair de uma para produzir o índice de diversidade.
- O índice de diversidade fornece um indicador da dispersão dos escores em torno da média para uma amostra particular. Assim, os índices mais altos indicam uma maior propagação da pontuação, ou crescente heterogeneidade de expressão. Por outro lado, os índices mais baixos, indicam menor variação na medição de expressão e de expressão homogênea na amostra. Isso é ilustrado na Figures 2 e 3.
6. Resultados representativos:
Terapia-alvo com os agentes de toxicidade relativamente baixos, como o tamoxifeno e trastuzumab, não são padrão de atendimento para pacientes com câncer de ovário. Há boas evidências de que a platina-taxano quimioterapia de primeira linha é superior a outros regimes de quimioterapia para o câncer de ovário 9-13, e enquanto 70-80% dos pacientes respondem inicialmente, a maioria vai recaída e morrer de sua doença. Medição de biomarcadores que possam prever a resposta a terapias alternativas seria útil na seleção de terapia individualizada para cada paciente, e uma vez que a quimioterapia pressão de seleção exerce sobre um tumor, sobrevivendo as células tumorais podem possuir características diferentes e representam uma subpopulação do tumor antes da terapia; quantificar este mudança pode ser útil. Nós aplicamos nossa abordagem de mapeamento heterogeneidade de expressão ER e HER2 em amostras de câncer de ovário, antes e após a quimioterapia, em order para medir mudanças quantitativas na expressão, e avaliar a relação entre a expressão de biomarcadores antes e após a terapia. Ambos ER e HER2 demonstram grande heterogeneidade nos tumores individuais, e em alguns tumores, alterações do índice de Simpson após a terapia da heterogeneidade relativamente alta para baixa heterogeneidade, representada pela diminuição do índice de Simpson pontuações (ver Figuras 2 e 3). Isso apóia a idéia de que a seleção clonal ocorre em resposta à quimioterapia citotóxica, mais importante, isso pode ser explorada usando terapia direcionada contra a população residual, a fim de personalizar melhor terapia para pacientes com câncer.

Fotomicrografias figura 1. Hematoxilina e eosina de diferentes áreas do cancro do ovário mesmo mostrando a morfologia variável. (A) x40 fotomicrografia mostra duas áreas adjacentes de tumor com morfologia variada. Alta vê o poder (x200) revelam células com clareamento citoplasmático e um padrão de crescimento sólido na parte superior do tumor (B), enquanto a parte inferior do tecido (C) tem mais homogênea citoplasma eosinofílico e um padrão de crescimento papilar. Este tumor, no entanto, ser classificadas como subtipo papilar serosa histológicas para efeitos de gestão mais.
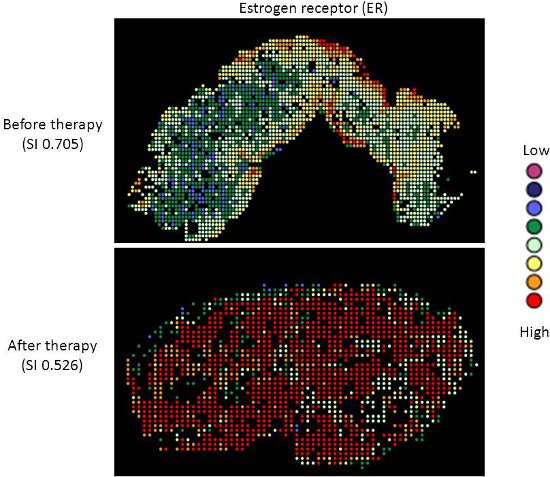
Figura 2. Heatmaps Heterogeneidade de ER expressão da proteína em citoqueratina positivas tecido de câncer de ovário, antes (painel superior) e após (painel inferior) terapia.
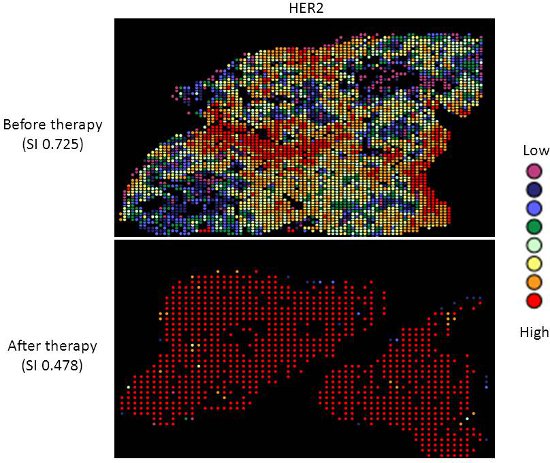
Figura 3. Heatmaps Heterogeneidade da expressão da proteína HER2-positivo em citoqueratina tecido de câncer de ovário, antes (painel superior) e terapia (painel inferior) após.
Discussão
O método descrito aqui permite a quantificação da heterogeneidade molecular na norma fixadas em formalina, incluído em parafina cortes histológicos de material de tumor. O método permite um valor a ser atribuído o grau de heterogeneidade em uma seção de tecido, de modo que este pode então ser considerados como uma variável no desenvolvimento de biomarcadores e análise. Embora, em geral, é preferível que os biomarcadores de tecido são homogêneas no que diz respeito à liberdade de expressão, de modo que o ensaio é menos suscetível a erros de amostragem ou de viés, pode em algumas circunstâncias ser útil para quantificar a heterogeneidade como um parâmetro. Por exemplo, como mostrado no exemplo ilustrativo para ER e HER2, biomarcadores comuns mostram uma considerável heterogeneidade de expressão e é atualmente desconhecido se isto representa um fator prognóstico independente ou preditiva em relação à evolução clínica ou resposta à terapia, respectivamente. Da mesma forma, como ilustrado, a terapia em si pode alterar dinamicamente apopulações constituintes das células e, portanto, medição de enriquecimento de alvo pode ser útil para orientar as decisões de tratamento.
No entanto, a técnica é limitada pelos mesmos fatores que limitam tradicionais análises histopatológicas ou biomarcadores (tais como imuno-histoquímica). O resultado é dependente do tipo, tamanho e qualidade do tecido a ser analisado, e, portanto, uma secção de tecido única pode não ser representativa de todo o tumor. De fato, o índice de Simpson pode ser indevidamente influenciada por tamanho do tecido (número de quadros capturados e dezenas AQUA medido). A imunogenicidade da epítopos que está sendo medido pode estar sujeito a incontrolável fatores pré-analíticos que artificialmente alterar sua expressão através da secção de tecido (como o tempo de isquemia fria, ou o comprimento de fixação, e artefatos de borda). Isto é particularmente um problema para fosfo-epítopos, que são notoriamente instáveis 14, 15. Portanto, a técnica poderia ser mais adequadaaos espécimes de ressecção, em vez de pequenas biópsias, e realizado em várias seções, em vez de apenas um. Em última análise, técnicas de imagem 3D pode oferecer uma oportunidade para melhor quantificar este parâmetro.
A técnica, tal como apresentado também pode ser limitada por fatores biológicos, tais como variabilidade na expressão do epítopo mascaramento citoqueratina. Isso pode ser motivo de preocupação particular nos cânceres, incluindo câncer de mama e de ovário, que se submetem epitelial-mesenquimal to-transição (EMT) ou são enriquecidas para não-epiteliais componentes ou células-tronco 16, como foi recentemente demonstrado que ocorrem em quimioterapia tratados de câncer de ovário in vitro 17, e em pacientes com câncer de mama em resposta à terapêutica 18. Esta limitação pode ser superada através de anticorpos mascaramento alternativa (ou cocktails de anticorpos), tais como citoqueratina mais vimentina, que é regulada em EMT 16. Além disso, uma vez que outros componentes do tecido (o microenvironment), como fibroblastos ou células endoteliais vasculares são também cada vez mais sendo alvo de terapias biológicas, a técnica também pode ser expandida para marcar esses componentes, usando máscaras específicas para compartimentos de interesse, tais como PECAM / CD31 a mancha de células endoteliais vasculares .
Embora a adaptação do índice de Simpson foi usado como uma medida de heterogeneidade no protocolo atual, devido à sua simplicidade, outras medidas de heterogeneidade poderia ser usado, como medidas simples de tendência central (média, mediana variância, etc). Além disso, os cálculos do índice de Simpson poderia ser modificado para melhor atender uma população de teste particular. O uso de Z-score transformações permite o placar ser mais aplicável para múltiplos marcadores desde a heterogeneidade é baseado em desvio em torno da média para um conjunto de dados. No entanto, a gama global de pontuação pode ser limitado a este tipo de transformação. Alguns projetos podem ser mais adequadossimplesmente bin as pontuações AQUA real para todas as amostras de um conjunto marcador particular. A seleção do número de caixas e cortes também é uma limitação no intervalo de valores que pode resultar e pode ser otimizado para designs alternativos experimental.
Temos usado ER e HER2 no estudo atual como candidatos a biomarcadores, uma vez que já são utilizados na clínica, ajudar a responder questões clínicas relevantes com relação à eficácia de terapias específicas, e são conhecidos por apresentar uma considerável heterogeneidade e mudança no ensino primário e distante doença 19. No entanto, o marcador ideal de heterogeneidade permanece a ser determinado. Outras possibilidades podem incluir marcadores citogenéticos de clonalidade, como os anteriormente utilizados em estudos FISH interfásico 20. A abordagem requer uma validação adicional em grande, bem anotado coortes clínicos ou clínicos, a fim de apurar a relevância deste parâmetro na biologia do câncer.
Divulgações
JC, MG, CJ, e CS são funcionários da HistoRx, Inc.
Agradecimentos
Este trabalho foi financiado em parte pelo financiamento do Conselho Escocês (Grant Número HR07005; http://www.sfc.ac.uk/ ), Medical Research Scotland ( http://www.medicalresearchscotland.org.uk/ ), o câncer Cancer Research UK Experimental Medicine Centre ( http://www.cancerresearchuk.org/ ), e Breakthrough Breast Cancer ( http://breakthrough.org.uk/ ).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| ScanScope FL | Aperio | ScanScope FL | Usado como equipada de fornecedor |
| Espectro | Aperio | Espectro | Números de configuração e catálogo irá variar de como as instituições locais criarem a sua base de dados e estrutura de TI. |
| AQUAnalysis, em conjunto com AQUAjustment | HistoRx | V2.3 | O pacote permite AQUAjustment AQUAnalysis usar imagens armazenadas no Spectrum. |
| HER2 | Dako | A0485 | 1 em 400 de diluição |
| mouse anti-pan citoqueratina | Dako | M3515 | 1 em 50 de diluição |
| Diluente de anticorpo | Dako | S0809 | |
| Envision bode coelho-HRP | Dako | K4003 | |
| Bloco de proteína | Dako | X0909 | |
| Goat anti-mouse Alexa555 | Invitrogen | A21422 | |
| DAPI meio de montagem | Invitrogen | P36931 | |
| Cy5 tiramida | HistoRx | AQ-EMR1-00001 | |
| Sequenza Centro imunocoloração | Thermo Scientific Shandon | 73300001 | Usada aqui para bancada imunofluorescência |
Referências
- Gutierrez, M. L., Sayagues, J. M., Del Mar, A. M. Cytogenetic heterogeneity of pancreatic ductal adenocarcinomas: identification of intratumoral pathways of clonal evolution. Histopathology. 58, 486-497 (2011).
- Yachida, S., Jones, S., Bozic, I. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467, 1114-1117 (2010).
- Gutierrez, M. L., Sayagues, J. M., Del Mar, A. M. Cytogenetic heterogeneity of pancreatic ductal adenocarcinomas: identification of intratumoral pathways of clonal evolution. Histopathology. 58, 486-497 (2011).
- Yachida, S., Jones, S., Bozic, I. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467, 1114-1117 (2010).
- Liu, J., Lau, S. K., Varma, V. A. Molecular mapping of tumor heterogeneity on clinical tissue specimens with multiplexed quantum dots. ACS Nano. 4, 2755-2765 (2010).
- Camp, R. L., Chung, G. G., Rimm, D. L. Automated subcellular localization and quantification of protein expression in tissue microarrays. Nat. Med. 8, 1323-1327 (2002).
- Simpson, E. H. Measurement of biodiversity. Nature. 163, 688-68 (1949).
- Gustavson, M. D., Bourke-Martin, B., Reilly, D. M. Development of an unsupervised pixel-based clustering algorithm for compartmentalization of immunohistochemical expression using Automated Quantitative Analysis. Appl. Immunohistochem. Mol. Morphol. 17, 329-337 (2009).
- . Paclitaxel plus carboplatin versus standard chemotherapy with either single-agent carboplatin or cyclophosphamide, doxorubicin, and cisplatin in women with ovarian cancer: the ICON3 randomised trial. Lancet. 360, 505-515 (2002).
- McGuire, W. P., Hoskins, W. J., Brady, M. F. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N. Engl. J. Med. 334, 1-6 (1996).
- Muggia, F. M., Braly, P. S., Brady, M. F. Phase III randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage III or IV ovarian cancer: a gynecologic oncology group study. J. Clin. Oncol. 18, 106-115 (2000).
- Piccart, M. J., Bertelsen, K., James, K. Randomized intergroup trial of cisplatin-paclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: three-year results. J. Natl. Cancer. Inst. 92, 699-708 (2000).
- Cannistra, S. A. Cancer of the ovary. N. Engl. J. Med. 351, 2519-2529 (2004).
- Baker, A. F., Dragovich, T., Ihle, N. T. Stability of phosphoprotein as a biological marker of tumor signaling. Clin. Cancer. Res. 11, 4338-4340 (2005).
- Espina, V., Edmiston, K. H., Heiby, M. A portrait of tissue phosphoprotein stability in the clinical tissue procurement process. Mol. Cell. Proteomics. 7, 1998-2018 (2008).
- Klymkowsky, M. W., Savagner, P. Epithelial-mesenchymal transition: a cancer researcher's conceptual friend and foe. Am. J. Pathol. 174, 1588-1593 (2009).
- Kurrey, N. K., Jalgaonkar, S. P., Joglekar, A. V. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells. Stem. Cells. 27, 2059-2068 (2009).
- Creighton, C. J., Li, X., Landis, M. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proc. Natl. Acad. Sci. U. S. A. 106, 13820-13825 (2009).
- Aitken, S. J., Thomas, J. S., Langdon, S. P., Harrison, D. J., Faratian, D. Quantitative analysis of changes in ER, PR and HER2 expression in primary breast cancer and paired nodal metastases. Ann. Oncol. 21, 1254-1261 (2010).
- Sayagues, J. M., Abad, M. M., Melchor, H. B. Intratumoural cytogenetic heterogeneity of sporadic colorectal carcinomas suggests several pathways to liver metastasis. J. Pathol. 221, 308-319 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados