Method Article
Heterogenität Mapping von Protein Expression in Tumoren mittels quantitativer Immunfluoreszenz
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode zur molekularen Heterogenität in histologischen Schnitten von Tumormaterial mittels quantitativer Immunfluoreszenz, Bildanalyse und ein statistisches Maß an Heterogenität quantifizieren. Die Methode ist für den Einsatz in klinischen Biomarker-Entwicklung und Analyse bestimmt.
Zusammenfassung
Morphologische Heterogenität innerhalb eines individuellen Tumors wird durch Histopathologen in der chirurgischen Praxis gut erkannt. Während dies oft in Form von Bereichen deutliche Differenzierung in anerkannten histologischen Subtypen oder anderen pathologischen Grad, oft gibt es mehr subtile Unterschiede im Phänotyp, die genaue Klassifizierung (Abbildung 1) trotzen. Letztlich, da Morphologie durch die zugrunde liegenden molekularen Phänotyp bestimmt wird, sind Bereiche mit sichtbaren Unterschiede wahrscheinlich durch Unterschiede in der Expression von Proteinen, die zelluläre Funktion und Verhalten aufeinander abstimmen und somit Erscheinungsbild begleitet werden. Die Bedeutung der sichtbaren und unsichtbaren (molekularen) Heterogenität für die Prognose ist nicht bekannt, aber die jüngsten Anzeichen dafür, dass zumindest auf der genetischen Ebene, Heterogenität in den Primärtumor 1,2 existiert, und einige dieser Sub-Klone führen zu Metastasen ( und damit tödliche) Erkrankung.
Darüber hinaus sind einige Proteinegemessen als Biomarker, weil sie die Ziele der Therapie (z. B. ER-und HER2 für Tamoxifen und Trastuzumab (Herceptin), genannt) sind. Wenn diese Proteine variable Expression zeigen innerhalb eines Tumors dann therapeutische Reaktionen können auch variabel sein. Die weit verbreitete histopathologischen Scoring Systeme für die Immunhistochemie entweder ignorieren oder numerisch homogenisieren die Quantifizierung der Proteinexpression. Auch in destruktive Techniken, bei denen der Tumor Proben homogenisiert (wie Genexpressions-Profiling), können quantitative Informationen aufgeklärt werden, aber räumliche Information ist verloren. Genetische Heterogenität Mapping Ansätze bei Bauchspeicheldrüsenkrebs haben entweder auf die Erzeugung von einer einzigen Zelle Suspension 3 verlassen, oder auf macrodissection 4. Eine aktuelle Studie hat Quantenpunkte verwendet, um morphologische und molekulare Heterogenität bei Prostatakrebs Gewebe 5 Karte und bietet proof of principle, dass die Morphologie und molekulare Zuordnung möglich ist, aber fallen short zur Quantifizierung der Heterogenität. Da Immunhistochemie ist im besten Fall nur semi-quantitative und unterliegt intra-und inter-observer bias, empfindlicher und quantitative Methoden erforderlich, um zu einer genauen Kartierung und zu quantifizieren Gewebe Heterogenität in situ.
Wir haben uns entwickelt und die Anwendung eines experimentellen und statistischen Methoden, um systematisch quantifizieren die Heterogenität der Proteinexpression in ganze Gewebeschnitte von Tumoren auf der Automated quantitative Analyse (AQUA) System 6 basiert. Gewebeschnitte werden mit spezifischen Antikörpern gegen Zytokeratine und Ziele von Interesse gerichtet ist, gekoppelt mit Fluorophor-markierten sekundären Antikörpern markiert. Slides sind abgebildet mit einem Ganzkörper-Rutsche Fluoreszenz-Scanners. Die Bilder werden in Hunderten bis Tausenden von Kacheln unterteilt und jede Fliese ist dann eine AQUA-Score, ein Maß für die Protein-Konzentration ist in den Epithelzellen (Tumor-) Komponente des Gewebes zugeordnet. Heatmaps generiert werden, um Gewebe Expression der Proteine und eine Heterogenität des Gastes zugeordnet dar, wenn ein statistisches Maß an Heterogenität ursprünglich in der Ökologie verwendet, auf der Simpson Biodiversität Index 7 basiert.
Bisher gibt es keine Versuche, systematisch Karte und quantifizieren diese Variabilität im Tandem mit Protein-Expression wurde in histologischen Präparaten. Hier zeigen wir den ersten Einsatz der Methode angewendet, um ER-und HER2-Biomarker Ausdruck bei Eierstockkrebs. Mit dieser Methode ebnet den Weg für die Analyse von Heterogenität als eine unabhängige Variable in Studien von Biomarker-Ausdruck in translationale Studien, um die Bedeutung von Heterogenität in Prognose und Vorhersage von Reaktionen auf die Therapie zu etablieren.
Protokoll
1. Tissue Vorbereitung
- Mikrotomie
- § Formalin fixiert in Paraffin eingebetteten Tumor-Blöcke bei 4 mu m Dicke mit einem Rotationsmikrotom.
- Legen Sie die Schnitte auf positiv geladene Objektträger.
- Inkubieren bei 37 ° C im Ofen über Nacht.
- Lagerung
- Shop Abschnitte in einem -18 ° C bis -25 ° C Gefrierschrank, um den Verlust der Antigenität zu verhindern.
2. Immunfluoreszenz von Gewebeschnitten
- Entwachsen und Rehydrierung
- Entparaffinieren Dias in Xylol zweimal für 5 min.
- Rehydrieren Dias in 99%, 99%, 80%, 50% Ethanol und fließendem Leitungswasser 2 min von jedem in Ordnung.
- Antigen Retrieval
- Führen Sie die Hitze induzierte Antigen-Retrieval, mit 0,15 mM Natriumcitrat, pH 6,0-Puffer in einem Dampfkochtopf für 5 min in der microwave.
- Cool down Folien für 20 min.
- Spülen Sie gleitet in 0,05% PBST für 5 min auf der Wippe.
- Blocking Verfahren
- Gönnen Abschnitte in 3% Wasserstoffperoxid für 10 min.
- Spülen Sie gleitet in 0,05% PBST für 5 min auf der Wippe.
- Fügen Sie die Abschnitte zu Sequenza Immunfärbung Rack.
- Gönnen Abschnitte in Serum freiem Protein-Block für 10 min.
- Primäre Antikörper-Inkubation
- Inkubieren Primärer Antikörper, um eine optimale Verdünnung in Dako-Antikörper Verdünnungsmittel verdünnt für 1 Stunde bei Raumtemperatur.
- Spülen in 0,05% PBST dreimal für jeweils 5 min.
- Epitheliale Maske (Cytokeratin) Inkubation
- Inkubieren Maus-anti-pan Cytokeratin, 1:50 in Dako Antikörperverdünnung Nacht bei 4 ° C.
- Epitheliale Maske Visualisierung
- Bereiten 1:25 Verdünnung der Ziege anti-Maus Alexa555 secondary Antikörper in der vorverdünnt Envision Ziege-Kaninchen-HRP-Antikörper-Lösung. Inkubieren im Dunkeln für 1,5 Stunden bei Raumtemperatur.
- Spülen in 0,05% PBST dreimal für 5min jeder.
- Target-Visualisierung
- Die Objektträger aus dem Sequenza der feuchten Kammer.
- Kombinieren Ziel Signalverstärkung Verdünnungsmittel (HistoRx Wanne E) und die Cy5 Tyramid (HistoRx Rohr F) bei 1:50 Konzentration. Vortex gründlich mischen. Inkubieren im Dunkeln für 10 min bei Raumtemperatur.
- Spülen in 0,05% PBST dreimal für jeweils 5 min.
- Entwässern Dias in 80% Ethanol für 1 min.
- Der Luft trocknen lassen gleitet in die Dunkelheit.
- Gegenfärbung und Eindecken
- Übernehmen DAPI Eindeckmedium auf den Deckgläschen und Ort der Deckgläser in den Gewebeschnitten.
- Trockene gleitet über Nacht im Dunkeln.
- Nach dem Objektträger getrocknet sind, mit Nagellack zu sichern, um ensicher, dass die langfristige Bewahrung und halten in einem 4 ° C Kühlschrank.
3. Bilderfassung mit ganzer Abschnitt Scannen
- Legen Sie bis zu fünf Folien in der Bildschirmpräsentation Kassette der Aperio ScanScope FL Dia-Scanner.
- Für jede Folie, wählen Sie die allgemeine Region Image über die Benutzeroberfläche in der ScanScope Console. Wählen Sie die Region, um alle Gewebe auf der Folie umfassen, unabhängig von Färbemuster oder anderen sichtbaren Aspekte der Probe.
- Mit dem ScanScope Console, für jeden Kanal (DAPI, Cy3 und Cy5) bestimmen eine optimale Belichtung wie folgt:
- Wählen Sie eine Region des Gewebes zu verhören - dieser Bereich sollte idealerweise in der Tumorregion von Gewebe werden, um die beste Darstellung zu liefern.
- Mit dem ScanScope Console Belichtungsautomatik Funktion, bewerten die Belichtungszeit für jeden Kanal vorgeschlagen, zusammen mit der Bildschärfe.
- Wiederholen Sie über bis zu 3-5 Regionen von jeder Probe die Zusammenarbeitnfirm Stabilität des Wertes.
- Wählen Sie eine weitere Region (wie durch einen blauen Diamanten auf dem ScanScope Konsole Bild dargestellt) vom Gewebe, aber immer noch innerhalb der eingedeckt Bereich des Schiebers, um einen Hintergrund, in dem Flat-Field-Korrektur Bilder für jeden Filter erworben haben, werden zu definieren.
- Lesen Sie diese Bilder vor der Bildaufnahme. Wenn die Bilder eine hohe Hintergrund-oder sonstigen Bildfehlern zu haben scheinen, sollte der Bildbereich verschoben und neue Bilder erworben.
- Die erworbenen digitalen Dia-Bilder werden automatisch in die Aperio Spectrum-Datenbank hochgeladen.
4. AQUA automatisierte Bildanalyse
- Sehen Sie sich die digitale gesamte Folie Bilder in der Spectrum-Datenbank und mit Anmerkungen versehen Tumor Bereiche von Interesse im Kontext des gesamten Gewebes und Färbungsmuster (s).
- Wählen Sie die Folie zu analysieren mit AQUAnalysis aus der digitalen Dia-Liste in der Spectrum-Datenbank durch einen Doppelklick auf den DaumenNagel Bild (alternativ wählen Sie das Kontrollkästchen neben dem Bild und wählen Sie dann "Bilder anzeigen" aus dem Menü am oberen Rand der Liste). Dieser öffnet automatisch den ImageScope Software und Farbe zusammengefügte Bild der Gewebeprobe.
- Mit dieser Software können Sie das Bild mit den bereitgestellten Tools navigieren.
- Mit der beiliegenden H & E (entweder der physischen Dia oder eine kommentierte Bild), kommentieren Sie die Region von Interesse auf der fluoreszierenden Bild. Multiple Region of Interest, kreiste einzelnen Bereiche können an einer einzigen Probe ausgewählt werden. Es gibt auch eine "negative" Werkzeug, das benutzt, um Bereiche innerhalb einer ausgewählten Region (dh beschädigte Gewebe, Bereichen mit schlechter Histologie, Nicht-Tumor-Bereichen, Schutt, etc.) ausgeschlossen ist.
- Speichern Sie die Annotation Layer (s) auf das Bild.
- Zurück zur Spectrum Hauptmenü und wählen Sie das Kontrollkästchen neben dem Bild, das gerade kommentierten wurde. Wählen Sie "Analysieren" aus der Menüleiste am oberen Rand der Liste.
- In der Analyse-Fenster, das wird kommen, select "HistoRx AQUA Analysis" aus dem Pull-Down-Menü.
- Wenn es mehrere Schichten von Annotationen sind, verwenden Sie die Kontrollkästchen, um die entsprechende Schicht (en) für die Analyse auszuwählen.
- Drücken Sie die "Analyze"-Taste, wenn Sie bereit zu beginnen.
- An dieser Stelle wird ein minimiertes Konsolen-Fenster in der Windows-Taskleiste angezeigt. Dadurch wird der Fortschritt der Übertragung von Bildern aus dem Spectrum-Datenbank auf dem lokalen PC ("Pull"-Betrieb).
- Sobald die Daten übertragen werden, wird AQUAnalysis starten. Der Benutzer kann dann der gesamte interne Funktionen der Software zur Ansicht, navigieren und zu analysieren, Bilder.
- Die kommentierten Bereich des Bildes aus dem Spectrum-Datenbank ist in 512x512 Pixel großes Bild Fliesen gebrochen - von denen jede einzeln gewertet.
- Für diese Studie wurde ein unbeaufsichtigt AQUA Scoring-Algorithmus, basierend auf Daten-Clustering basiert, 8 verwendet. In diesem Algorithmus werden AQUA Noten wie folgt generiert:
- Die pan-Zytokeratin image signal wird über dem Hintergrund Schwellenwert und die Pixel werden verwendet, um einen Tumor "Maske", die dann für die weiteren Berechnungen verwendet zu definieren. Die High-Expression pan-Zytokeratin Pixel definieren auch die cytoplasmatische / nicht-nuklearen Regionen der Tumorzellen.
- Pixel mit hohem Signal in der DAPI-Kanal, der innerhalb des Tumors Maske werden als atomare in der Natur identifiziert.
- Die Clustering-Algorithmus untersucht auch Pixel, die geringe Intensität entweder für DAPI-Färbung oder Cytokeratin Ausdruck und versucht, teilweise schreiben sie, die nukleare oder zytoplasmatischen Kompartimente, oder im Hintergrund entweder zu haben.
- Sobald alle Pixel eines der Tumor Fächern oder im Hintergrund, die Intensität des Signals von dem Zielprotein (ER oder HER2) zugeordnet wird dann innerhalb der einzelnen Fächer und normiert auf die Größe der Fächer berechnet, wodurch AQUA Partituren.
- Bilder, die nicht über ausreichende Tumor Darstellung wurden nicht gewertet (wie jene mit le definiertss als 5% der Pixel darstellen Tumor). Diese Regionen stellen auch ein "Endergebnis"-Wert namens 'Fail' und kann somit in der weiteren statistischen Analyse entfernt werden.
- Außerdem, wenn nach Prüfung, ein Betreiber Felder, die nicht geeignet waren für die Wertung aufgrund von Probe-oder Imaging-Artefakte (zB gefaltete Gewebe, Schutt) identifiziert wurden, wurden die Felder von Scoring redigiert und produziert ein "Endergebnis" genannt 'Fail'.
- Die Ergebnisse der AQUA Scoring sind Tabellen mit den einzelnen 512x512 Pixel Fliesen in der Region von Interesse innerhalb eines gesamten Gewebeschnitt Probe verbunden. Diese Dateien, in. CSV-Format, kann dann für die anschließende statistische Analyse verwendet werden.
5. Statistische Analyse: Alle statistischen Analysen sind in SPSS durchgeführt (IBM)
- Wo immer möglich, für große Operationen generieren SPSS Syntax-Code-Dateien (. Sps), um Daten Manipulationen und Analysen Schritte ausführen. Beispiel Syntax-Code ist als ergänzende Dateien zur Verfügung gestellt.
- Lesen Sie Dateien in SPSS. Entfernen Sie nicht verwendete Variablen in den Rohdaten (z. B. gerätespezifischen Parameter, AQUA Partituren aus nicht genutzten Fächer).
- Dort, wo Regionen ein "Endergebnis" der 'Fail' (siehe oben) haben, markieren Sie diese Werte als SYSMIS, die sie entfernt von der numerischen Analysen.
- Aggregate alle Daten für alle Folien für jeden Marker (ER oder HER2) in einem einzigen Master-Daten in SPSS-Format eingestellt. Mit diesem Master-Datei für alle nachfolgenden Berechnungen.
- Mit Hilfe eines SPSS-Syntax-Datei (eine für jeden Marker: ER oder HER2 (siehe zusätzliche Syntax-Dateien) Daten wurde weiter validiert und Simpson Indizes der Vielfalt wie folgt berechnet:
- Generieren Sie ein Master-analytischen Datei, um eine Änderung der Stammdaten gesetzt zuvor generierten verhindern.
- Überprüfen Sie die Stammdaten gegen die Rohdaten und Bilder erzeugt wird.
- Produce Auswertungsstatistiken für AQUA Noten für jede Probe (Anzahl der Felder, Mittelwert, Median Score, minimum Score, maximale Punktzahl, und die Standardabweichung der Werte für Probe).
- Überprüfen Sie eine zufällige Stichprobe der Ergebnisse gegenüber den ursprünglichen Rohdaten Output-Dateien und gegen die rohen Bilddaten erzielt.
- Um die Hitze Karte Bilder (in den Abbildungen 2 und 3) zu erzeugen:
- 'Bin' der AQUA Score-Daten (mit dem 'Visual Binning-Funktion in SPSS) in acht einzelnen Ebenen. Für ER wurden nuklearen Scores verwendet, für HER2, zytoplasmatische Scores verwendet wurden.
- Leiten Sie bins, so dass jedes Fach einen gleichen Prozentsatz der verfügbaren Fälle aus dem gesamten Datensatz repräsentiert.
- Verwenden Sie die SPSS-Funktion "Split File", so dass alle nachfolgenden Ausgaben würden auf einer "pro Folie / Probe"-Ebene sein.
- Plot jeder Region (entsprechend einer 512x512 Fliesen) durch seine x-, y-Koordinaten und die Farbe mit einem Wert in den Papierkorb, in die sie zugewiesen wurde (siehe Abbildungen 2 und 3).
- Zur Erzeugung von Heterogenität Partituren, wurde Code geschrieben, um eine Simpson zu generierenIndex der Vielfalt mit AQUA Partituren.
- Die Simpson-Index der Vielfalt, wie hier verwendet, ist definiert als:
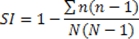
Wobei N die Gesamtzahl der Punkte / Felder für eine gegebene Probe verwendet und n die Anzahl der Punkte / Felder in einer bestimmten Gruppe von standardisierten Scores (hergestellt wie unten beschrieben).
- Die Simpson-Index der Vielfalt, wie hier verwendet, ist definiert als:
- Verwenden Sie die Master-analytischen Datei oben beschrieben für die Datenquelle. In den gezeigten Beispielen verwendet alle ER Berechnungen der nuklearen AQUA Partitur und HER2 Berechnungen der cytoplasmatischen AQUA Gäste. Führen Sie die nachfolgenden Berechnungen für jede Probe / Folie.
- Da Fluoreszenz Daten unterliegt Varianz Instabilität, so dass Fehler Größenordnung mit Intensität ausbreitet, gelten logarithmisch (Basis 2) Normierung auf alle AQUA Partituren.
- Weitere verwandeln die normierte (log transformierten) Daten in z-(Standard-) Werte.
- Der Z-Score-Transformation ist ein berechneters folgt: Z = (AQUA Partitur - Durchschnitt aller Noten für eine Probe) / Standardabweichung der Werte für die Probe. Dieser übersetzt die Verteilung der Punkte in eine Verteilung der Abweichungen um den zentralen Wert von Null Abweichung.
- Bin diese Z-score-Werte in sechs Gruppen (<-2, -2 - -1, -1 - 0, 0 bis 1, 1 bis 2,> 2).
- Berechnen Sie die Anzahl der Werte in jedem Fach und die Summe für jedes Bin zugeordnet. Verwenden Sie diesen Wert zusammen mit der Gesamtzahl der Felder, um einen Wert für jeden der sechs Behälter für den Index verwendet zu berechnen.
- Sum diese Werte und subtrahieren von einem auf den Index der Vielfalt zu erzeugen.
- Die Vielfalt Index bietet ein Indikator für die Ausbreitung des Scores um den Mittelwert für eine bestimmte Probe. So zeigen eine höhere Indizes eine breitere Verbreitung von Partituren oder zunehmende Heterogenität des Ausdrucks. Umgekehrt unteren Indizes zeigen weniger Schwankungen in der Expression-Messung und homogener Ausdruck in der Probe. Dies ist in Figur dargestelltES 2 und 3.
6. Repräsentative Ergebnisse:
Gezielte Therapie mit relativ geringen Toxizität Mittel, wie Tamoxifen und Trastuzumab, sind nicht Standard in der Therapie Patientinnen mit Ovarialkarzinom. Es gibt gute Belege dafür, dass Platin-Taxan-first-line Chemotherapie überlegen zu anderen Chemotherapien für Eierstockkrebs 9-13 ist, und während 70-80% der Patienten sprechen darauf anfangs reagieren, die meisten werden Rückfall und sterben an ihrer Krankheit. Messung von Biomarkern, die Reaktion auf alternative Therapien vorhersagen könnte, wäre nützlich sein bei der Auswahl der individuellen Therapie für jeden Patienten, und seit Chemotherapie übt Selektionsdruck auf einen Tumor, überlebende Tumorzellen können unterschiedliche Eigenschaften besitzen und stellen eine Subpopulation des Tumors vor der Therapie; Quantifizierung dieser ändern könnte daher sinnvoll sein. Wir haben unser Heterogenität Mapping Ansatz zur ER-und HER2-Expression im Ovarialkarzinom Proben vor und nach der Chemotherapie, in order zu messen quantitative Veränderungen in der Expression und Untersuchung des Zusammenhangs zwischen Biomarker Ausdruck vor und nach Therapie. Beide ER-und HER2 zeigen deutliche Heterogenität innerhalb der einzelnen Tumoren, und in einigen Tumoren, die Simpson-Index Veränderungen nach der Therapie von einem relativ hohen Heterogenität geringer Heterogenität, vertreten durch eine Verringerung der Simpson-Index Scores (siehe Abbildungen 2 und 3). Dies unterstützt die Vorstellung, dass klonale Selektion in Reaktion auf eine zytotoxische Chemotherapie auftritt, noch wichtiger ist, kann dies ausgenutzt durch gezielte Therapie gegen die restliche Bevölkerung, um besser zu personalisieren Therapie für Krebspatienten werden.

Abbildung 1. Hämatoxylin und Eosin gefärbt Aufnahmen aus verschiedenen Bereichen des gleichen Eierstockkrebs zeigen variable Morphologie. (A) x40 Mikrophotographie zeigt zwei benachbarte Bereiche des Tumors mit unterschiedlicher Morphologie. Hohe Leistung Ansichten (x200) zeigen Zellen mit zytoplasmatischen Clearing und eine solide Struktur des Wachstums in den oberen Teil des Tumors (B), während der untere Teil des Gewebes (C) hat mehr homogene eosinophile Zytoplasma und ein papilläres Wachstumsmuster. Dieser Tumor wäre jedoch, wie serösen papillären histologischen Subtyp zum Zwecke der weiteren Verwaltung eingestuft werden.
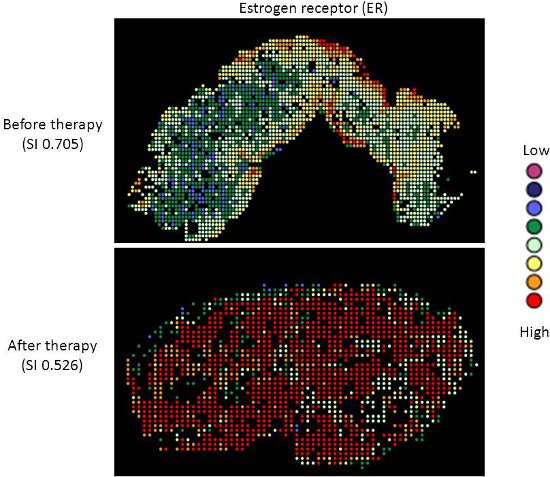
Abbildung 2. Heterogenität Heatmaps der ER-Protein-Expression in Zytokeratin-positive Eierstockkrebsgewebeproben, vor (oben) und nach (unten) Therapie.
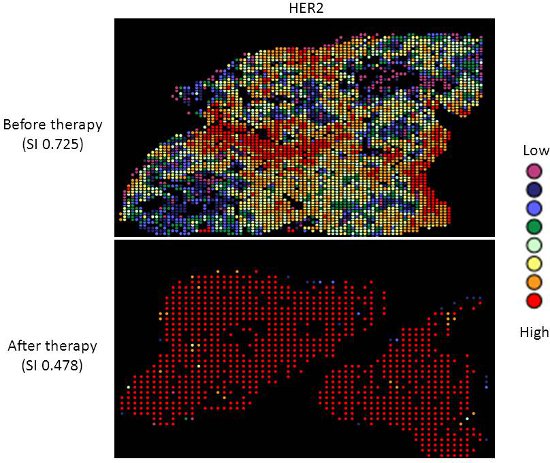
Abbildung 3. Heterogenität Heatmaps von HER2-Protein-Expression in Zytokeratin-positive Eierstockkrebsgewebeproben, vor (oben) und nach (unten) Therapie.
Diskussion
Das hier beschriebene Verfahren erlaubt die Quantifizierung molekularer Heterogenität in Standard-Formalin-fixierte, in Paraffin eingebetteten histologischen Schnitten von Tumormaterial. Das Verfahren erlaubt ein Wert, der den Grad der Heterogenität in einem Gewebeschnitt zugeordnet werden, so dass diese dann berücksichtigen kann als Variable in Biomarker Entwicklung und Analyse entnommen werden. Während im Allgemeinen ist es vorzuziehen ist, dass Gewebe Biomarker homogen sind in Bezug auf Ausdruck, so dass der Test weniger anfällig für Stichprobenfehler oder Voreingenommenheit ist, könnte es unter Umständen sinnvoll sein, Heterogenität als Parameter zu quantifizieren. Zum Beispiel, wie in der illustrativen Beispiel für ER-und HER2 gezeigt, zeigen gemeinsame Biomarker beträchtliche Heterogenität der Meinungsäußerung und es ist derzeit nicht bekannt, ob diese ein unabhängiger prognostischer oder prädiktiver Faktor in Bezug auf klinische Ergebnisse oder Ansprechen auf die Therapie bzw. darstellt. Ebenso, wie dargestellt, könnte eine Therapie sich dynamisch verändernBestandteil Populationen von Zellen und damit die Messung der Ziel-Anreicherung kann nützlich sein, in Führung Therapieentscheidungen treffen.
Allerdings ist die Technik, die von den gleichen Faktoren, die traditionellen histopathologischen oder Biomarker (z. B. immunhistochemische) analysiert Grenze begrenzt. Das Ergebnis ist abhängig von der Art, Größe und Qualität des Gewebes, die analysiert werden, und somit ein einzelnes Gewebe Abschnitt möglicherweise nicht repräsentativ für den gesamten Tumor sein. In der Tat kann die Simpson-Index über Gebühr nach der Größe des Gewebes (Anzahl der Frames erfasst und AQUA Scores gemessen) vorgespannt werden. Die Immunogenität der Epitope gemessen unterliegen können unkontrollierbare präanalytischen Faktoren, die artifactually verändern deren Ausdruck über den Gewebeschnitt (wie kalte Ischämiezeit, oder die Länge der Fixierung und Rand Artefakt). Dies ist vor allem ein Problem für phospho-Epitope, die notorisch labile 14, 15. Deshalb ist die Technik könnte besser geeignet seinzu Resektionsproben eher als kleine Biopsien und durchgeführt in mehreren Abschnitten statt nur einem. Letztlich kann 3D-Bildgebung bieten die Möglichkeit zur besseren Quantifizierung dieser Parameter.
Die Technik, wie dargestellt kann auch durch biologische Faktoren, wie Schwankungen in der Expression des Zytokeratin Maskierung Epitop beschränkt werden. Dies könnte von besonderer Bedeutung in diesen Tumoren, einschließlich Eierstock-und Brustkrebs, die epithelial-zu-mesenchymale Transition (EMT) zu unterziehen sind oder für nicht-epithelialen Komponenten oder Stammzellen Zellen 16 angereichert, wie kürzlich gezeigt wurde, treten in der Chemotherapie- behandelt Eierstockkrebs in vitro 17, und bei Patientinnen mit Brustkrebs in Ansprechen auf die Therapie 18. Diese Einschränkung kann zu überwinden Verwendung alternativer Maskierung Antikörper (oder Cocktails von Antikörpern), wie Zytokeratin und Vimentin, die in EMT 16 hochreguliert wird. Darüber hinaus, da andere Komponenten des Gewebes (der microenvironment), wie Fibroblasten oder Endothelzellen sind auch zunehmend von biologischen Therapien gezielter kann die Technik auch erweitert werden, um diese Komponenten Score, mit Masken für Fächer von Interesse, wie PECAM / CD31 für vaskuläre Endothelzellen Fleck .
Obwohl die Anpassung der Simpson-Index als ein Maß für die Heterogenität in der aktuellen Protokoll wegen ihrer Einfachheit verwendet worden, könnten auch andere Maßnahmen der Heterogenität eingesetzt werden, wie einfache Messungen der zentralen Tendenz werden (Mittelwert, Varianz, Median, etc). Darüber hinaus könnte die Simpson-Index-Berechnungen modifiziert werden, um besser an einen bestimmten Test Bevölkerung. Die Verwendung von Z-score-Transformationen ermöglicht das Punktesystem zu sein gilt für mehrere Marker, da die Heterogenität auf Abweichung um den Mittelwert für einen Datensatz beruht. Allerdings kann die gesamte Palette von Scoring in dieser Art von Transformation begrenzt werden. Einige Designs besser geeignet seineinfach bin die eigentliche AQUA Noten für alle Proben einer bestimmten Markierung zu setzen. Die Auswahl der Anzahl der Bins und Abschaltungen ist auch eine Einschränkung im Bereich der Werte, die können die Folge sein und kann für alternative experimentelle Designs optimiert werden.
Wir haben ER und HER2 in der aktuellen Studie als Biomarker-Kandidaten verwendet, da sie bereits in der Klinik eingesetzt werden, zu beantworten relevante klinische Fragen in Bezug auf die Wirksamkeit von gezielten Therapien, und sind dafür bekannt, eine beträchtliche Heterogenität und Wandel in weisen primäre und entfernte Krankheit 19. Allerdings bleibt die optimale Marker der Heterogenität zu bestimmen. Andere Möglichkeiten könnten auch zytogenetische Marker der Klonalität, wie sie zuvor in der Interphase FISH-Studien 20 verwendet. Dieser Ansatz erfordert eine weitere Validierung in großen, gut kommentierte klinischen Kohorten oder klinischen Studien, um weiter zu etablieren die Relevanz dieses Parameters in der Krebs-Biologie.
Offenlegungen
JC, MG, CJ und CS sind die Mitarbeiter der HistoRx, Inc.
Danksagungen
; Diese Arbeit wurde zum Teil durch die Scottish Funding Council (Grant Number HR07005 unterstützt http://www.sfc.ac.uk/ , Medical Research Scotland () http://www.medicalresearchscotland.org.uk/ ), die Krebs- Research UK Experimental Cancer Medicine Centre ( http://www.cancerresearchuk.org/ ) und Breakthrough Breast Cancer ( http://breakthrough.org.uk/ ).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| ScanScope FL | Aperio | ScanScope FL | Gebrauchte ab Hersteller ausgestattet |
| Spektrum | Aperio | Spektrum | Konfigurations-und Katalog-Nummern werden wie die lokalen Institutionen einzurichten ihrer Datenbank-und IT-Struktur variieren. |
| AQUAnalysis, in Verbindung mit AQUAjustment | HistoRx | V2.3 | Die AQUAjustment Paket ermöglicht AQUAnalysis Bilder in Spectrum gespeichert sind. |
| HER2 | Dako | A0485 | 1 in 400 Verdünnung |
| Maus-anti-pan Cytokeratin | Dako | M3515 | 1 in 50 Verdünnung |
| Antikörper Verdünnungsmittel | Dako | S0809 | |
| Envision Ziege-Kaninchen-HRP | Dako | K4003 | |
| Protein blockieren | Dako | X0909 | |
| Ziege anti-Maus-Alexa555 | Invitrogen | A21422 | |
| DAPI Eindeckmedium | Invitrogen | P36931 | |
| Cy5 Tyramid | HistoRx | AQ-EMR1-00001 | |
| Sequenza Immunfärbung-Center | Thermo Scientific Shandon | 73300001 | Hier für Tisch-Immunfluoreszenzfärbung verwendet |
Referenzen
- Gutierrez, M. L., Sayagues, J. M., Del Mar, A. M. Cytogenetic heterogeneity of pancreatic ductal adenocarcinomas: identification of intratumoral pathways of clonal evolution. Histopathology. 58, 486-497 (2011).
- Yachida, S., Jones, S., Bozic, I. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467, 1114-1117 (2010).
- Gutierrez, M. L., Sayagues, J. M., Del Mar, A. M. Cytogenetic heterogeneity of pancreatic ductal adenocarcinomas: identification of intratumoral pathways of clonal evolution. Histopathology. 58, 486-497 (2011).
- Yachida, S., Jones, S., Bozic, I. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467, 1114-1117 (2010).
- Liu, J., Lau, S. K., Varma, V. A. Molecular mapping of tumor heterogeneity on clinical tissue specimens with multiplexed quantum dots. ACS Nano. 4, 2755-2765 (2010).
- Camp, R. L., Chung, G. G., Rimm, D. L. Automated subcellular localization and quantification of protein expression in tissue microarrays. Nat. Med. 8, 1323-1327 (2002).
- Simpson, E. H. Measurement of biodiversity. Nature. 163, 688-68 (1949).
- Gustavson, M. D., Bourke-Martin, B., Reilly, D. M. Development of an unsupervised pixel-based clustering algorithm for compartmentalization of immunohistochemical expression using Automated Quantitative Analysis. Appl. Immunohistochem. Mol. Morphol. 17, 329-337 (2009).
- . Paclitaxel plus carboplatin versus standard chemotherapy with either single-agent carboplatin or cyclophosphamide, doxorubicin, and cisplatin in women with ovarian cancer: the ICON3 randomised trial. Lancet. 360, 505-515 (2002).
- McGuire, W. P., Hoskins, W. J., Brady, M. F. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N. Engl. J. Med. 334, 1-6 (1996).
- Muggia, F. M., Braly, P. S., Brady, M. F. Phase III randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage III or IV ovarian cancer: a gynecologic oncology group study. J. Clin. Oncol. 18, 106-115 (2000).
- Piccart, M. J., Bertelsen, K., James, K. Randomized intergroup trial of cisplatin-paclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: three-year results. J. Natl. Cancer. Inst. 92, 699-708 (2000).
- Cannistra, S. A. Cancer of the ovary. N. Engl. J. Med. 351, 2519-2529 (2004).
- Baker, A. F., Dragovich, T., Ihle, N. T. Stability of phosphoprotein as a biological marker of tumor signaling. Clin. Cancer. Res. 11, 4338-4340 (2005).
- Espina, V., Edmiston, K. H., Heiby, M. A portrait of tissue phosphoprotein stability in the clinical tissue procurement process. Mol. Cell. Proteomics. 7, 1998-2018 (2008).
- Klymkowsky, M. W., Savagner, P. Epithelial-mesenchymal transition: a cancer researcher's conceptual friend and foe. Am. J. Pathol. 174, 1588-1593 (2009).
- Kurrey, N. K., Jalgaonkar, S. P., Joglekar, A. V. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells. Stem. Cells. 27, 2059-2068 (2009).
- Creighton, C. J., Li, X., Landis, M. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proc. Natl. Acad. Sci. U. S. A. 106, 13820-13825 (2009).
- Aitken, S. J., Thomas, J. S., Langdon, S. P., Harrison, D. J., Faratian, D. Quantitative analysis of changes in ER, PR and HER2 expression in primary breast cancer and paired nodal metastases. Ann. Oncol. 21, 1254-1261 (2010).
- Sayagues, J. M., Abad, M. M., Melchor, H. B. Intratumoural cytogenetic heterogeneity of sporadic colorectal carcinomas suggests several pathways to liver metastasis. J. Pathol. 221, 308-319 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten