Method Article
Transformação e Cercarial In vitro Cultivo de Schistosoma mansoni Esquistossômulos
Neste Artigo
Resumo
Nós descrevemos um In vitro Método para esquistossômulos cultura do parasita platelminto Schistosoma mansoni, Através da colheita e transformação de cercárias infectantes do caramujo de água doce Biomphalaria glabrata hospedeiro intermediário.
Resumo
Esquistossomo parasitas são os agentes causadores da esquistossomose, uma doença crônica e debilitante que afeta mais de 200 milhões de pessoas no mundo e ocupa o segundo lugar à malária entre as doenças parasitárias em termos de saúde pública e impacto sócio-econômico (1-4). Esquistossomo parasitas são vermes trematódeos com um ciclo de vida complexo intercâmbio entre uma vida parasitária em hospedeiros mamíferos e moluscos, com intervenção de natação livre etapas. Brevemente, de natação livre cercárias infectar um hospedeiro mamífero penetrando a pele com a ajuda de proteases secretadas, durante o qual o cercárias perdem a cauda, transformando-se em esquistossômulos. Os esquistossômulos agora deve escapar do sistema imune do hospedeiro, desenvolver um intestino para a digestão das células vermelhas do sangue, e migrar embora os pulmões ea circulação portal rota para seu destino final no sistema porta hepática e, eventualmente, as veias mesentéricas (para S. mansoni) onde homens e mulheres par worms e mate, produzindo centenas de ovos por dia. Alguns dos ovos são excretados a partir do corpo em água doce, onde os ovos eclodem em nado livre miracídios (5-10). Os miracídios infectam espécies de caracóis específica e se transformar em mãe e filha esporocistos, que por sua vez, produzem cercárias infectantes, completando o ciclo de vida. Infelizmente, o ciclo de vida do S. mansoni não podem ser cultivadas in vitro, mas cercárias infectantes podem ser transformados em esquistossômulos, e os esquistossômulos podem ser cultivadas durante semanas para a análise do desenvolvimento do S. mansoni in vitro ou análise de microarray. Neste protocolo, nós fornecemos uma descrição visual de transformação cercárias e no cultivo in vitro de esquistossômulos. Nós eliminaram cercárias infecciosas da Biomphalaria glabrata caramujo hospedeiro e manualmente transformá-los em esquistossômulos, destacando suas caudas usando um emulsificante agulha dupla. A in vitro cercarial transformação e técnicas de cultura esquistossômulos descrito evitar o uso de uma série de mamíferos, o que simplifica a visualização de schistosomes e facilita a coleta do parasita para a análise experimental. Vitro na transformação e técnicas de cultivo de schistosomes ter sido feito há anos (11, 12), mas nenhum protocolo visuais têm sido desenvolvidos que estão disponíveis para toda a comunidade.
Protocolo
Medidas de segurança:
Cercárias do S. mansoni pode penetrar diretamente na pele sem a necessidade de um corte ou poros, e causar a doença crônica da esquistossomose. S. mansoni é um nível de biossegurança 2 organismo, portanto, equipamento de proteção individual e medidas de segurança apropriadas devem ser seguidas quando se trabalha com cercaria infecciosa. A maioria dos equipamentos necessários para crescer e transformar schistosomes é padrão, com uma chave poucas exceções indicado na tabela ao final do protocolo. Todo o trabalho cercarial deve ser feito em uma sala isolada. Esquistossômulos devem ser cultivadas em um estéril capa de biossegurança, aprovado. Duas camadas de borracha nitrílica ou luvas de látex devem ser usadas, bem como uma bata de laboratório, um par de sapatos impermeáveis, calças sem furos ou rasgos, e mangas de protecção impermeável para seus pulsos e braços. Em caso de derrame acidental, pulverizar imediatamente a área contaminada com etanol 70% ou água sanitária a 10%, esfregando vigorosamente se em sua pessoa. Isso vai ser suficiente para desativar o parasita, mas todas as possíveis infecções devem ser relatados e levada a sério. Embora esquistossômulos não são inatamente infecciosa, diretrizes institucionais variam, e devem ser consultadas para determinar se BSL2 precauções são necessárias durante as fases da vida não-infecciosa. Desinfectar todas as superfícies que entram em contato com qualquer substância potencialmente infecciosos após o experimento é realizado e descarte de resíduos em um recipiente aprovado biohazard.
NOTA: caixotes Cubra snail host 1 a 2 dias antes da queda e proteger da luz
1. Colheita cercárias a partir do host caracol
- Encher um copo limpo e livre de 500mL detergentes metade cheio com água destilada atingir a temperatura ambiente. Se trabalhar com caracóis hospedeiro infectado com miracídios em datas diferentes, use um copo separado para cada data de infecção (Isto é particularmente importante se os caracóis será reutilizado para futuros experimentos). O tamanho do copo também pode ser menor dependendo da experiência do usuário.
- Coletar caramujos infectados hosts que você deseja galpão e depositá-los cuidadosamente no copo com um peixe de aquário padrão net e pinças de uso geral, conforme necessário.
- Copo lugar em um derramamento de emergência bandeja de aproximadamente 8 a 12 polegadas sob uma fonte de luz incandescente. Deixe repousar por 1-2 horas sob a luz. Cercárias sair do caramujo hospedeiro quando expostos à luz brilhante.
- Cuidadosamente filtrar caracóis a partir da mistura cercárias. Tomar precauções de segurança extra, como mistura é altamente infecciosa. Lembre-se, cercárias podem penetrar diretamente da pele humana!
- Substituir mistura sob fonte de luz para cerca de 15 minutos, permitindo que qualquer questão dos resíduos de partículas para resolver.
- Transferência de cercárias em um erlenmeyer limpo usando uma pipeta, evitando os destroços no fundo do copo. Colocar o balão em aproximadamente um ângulo de 45 ° no gelo no escuro por 45-60 minutos, permitindo cercárias para resolver em um canto.
- Use uma pipeta de 50 mL para remover 75 a 90% do sobrenadante e depositá-lo no copo contendo lixívia 10% ou etanol 70%, tendo o cuidado de não deixar pingar gotas de água contendo cercárias da pipeta.
- Agitar o erlenmeyer contendo cercárias suavemente para voltar a suspender as cercárias em solução. Use uma pipeta para transferir a amostra para 50 tubos estéreis ml. Coloque os tubos novamente no gelo por 20 minutos no escuro. Cercárias vai resolver para o fundo do tubo no escuro.
2. Transformação manual de cercárias em esquistossômulos
Antes de começar: Faça RPMI 1640 completo (RPMI, 5% de soro fetal bovino, 1X Pen / Strep) e quente a 37 ° C. (É fundamental que o soro fetal bovino utilizado foi inativada pela incubação a 56 ° C durante 1 hora como schistosomes pode ser sensível para complementar).
- Em uma capa de risco biológico, remover o sobrenadante até 5 a 10 ml de solução em cada cônico de 50 ml utilizando uma pipeta ou outro dispositivo de vácuo.
- Anexar um calibre 22 double-ended, luer lok emulsificante agulha para uma seringa de tamanho adequado.
- Tirar lentamente a mistura para dentro da seringa. Coletar cercárias de todos os tubos de 50 ml em uma seringa. Esteja atento de gotejamento.
- Cuidadosamente por sua vez seringa sobre como que o fim agulha não acoplada é para cima. Anexar outra seringa para este lado da agulha emulsificante.
- Passe a mistura através da agulha de um total de 40 vezes (20 vezes ida e volta) para transformar o cercárias.
- Posição das seringas na vertical de tal forma que a mistura está contida na seringa inferior e superior é a seringa vazia. Retire a seringa top e desinfectar em etanol 70%.
- Gota a gota depósito mistura em um prato limpo alta 100 milímetros x 50 milímetros murada pirex ou prato de cristalização. Desinfectar agulha e seringa em Etanol 70%.
- Adicionar 37 ° C RPMI 1640 completo de mídia de modo que ainferior da placa de Petri é completamente coberto, como se derramando um prato de caldo Luria.
- Agite cuidadosamente para coletar esquistossômulos no centro da placa de Petri. Evitar respingos.
Nota: Pode ser útil para desligar a luz do exaustor para esta etapa a mais adequada visualizar os esquistossômulos no centro. - Imediatamente depósito esquistossômulos concentrada em uma nova placa de cultura de células de 12 bem assim usando um conta-gotas estéril.
- Repita 2.9 e 2.10 até esquistossômulos não estão mais presentes no centro do prato (cerca de 10 vezes). Depósito cada recolha subsequente em uma bem fresca.
- Encher cada poço até metade (~ 1,5 mL) pré-aquecido com a mídia RPMI completo.
- Visualize em um microscópio invertido para verificar a presença dos esquistossômulos e ausência de cercárias.
- Crescer a esquistossômulos em uma incubadora de CO 2 set a 37 ° C e 5% CO 2.
3. Resultados representativos:
Transferência pendente de esquistossômulos transformados em meios de cultura, visualização sob um microscópio de campo brilhante invertido (Ver tabela de equipamentos, por exemplo) deve render uma imagem semelhante à Figura 1, em que apenas esquistossômulos transformados estão presentes no poço. Contaminantes potenciais poderiam incluir cercárias intacta, caudas cortadas cercárias, ou outros detritos. Se nenhum microscópio invertido estiver disponível, um microscópio padrão ou mesmo um escopo dissecção será suficiente para visualizar os esquistossômulos. Note que este procedimento nem sempre transformar 100% de cercárias.
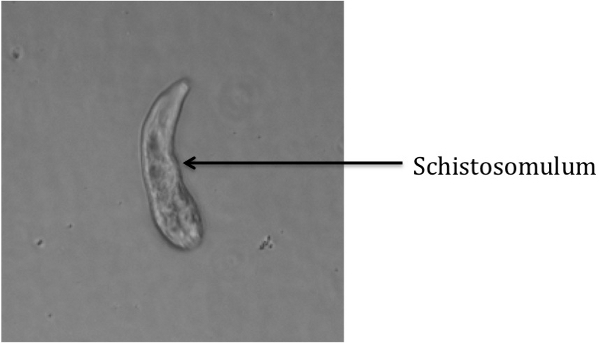
Figura 1: esquistossômulo Transformado
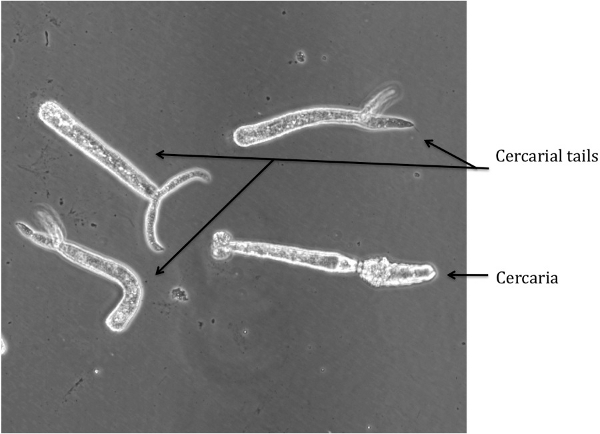
Figura 2: cercárias e Tails Severed
Discussão
Vários problemas potenciais poderiam surgir durante o processo de transformação, no entanto, este protocolo é projetado para evitar a maioria destes problemas. Um risco potencial é o entupimento da agulha de emulsificante, que geralmente surge devido aos detritos que sobraram da colheita no passo 1.3. Certifique-se de permitir que todas as partículas para resolver no passo 1.5 e transferir a cercárias cuidadosamente no passo 1.6 para evitar este problema. Além disso, como descrito anteriormente, trabalhando dentro de um armário de segurança biológica, a utilização de equipamento de proteção individual (escudos, mesmo face) e evitar a pressão excessiva sobre as seringas é aconselhável.
Moradia caudas cercarial pode ser visualizado na mídia, o que é indicativo da separação pobres durante o passo 2.9. As caudas apresentam um movimento espasmo-like e tem uma forma distinta (ver Figura 2), e desta forma são facilmente distinguíveis da esquistossômulos. As caudas podem ser removidos por lavagem a esquistossômulos em excesso de RPMI completo permitindo que os esquistossômulos para resolver. As caudas permanecerá flutuante e pode ser aspirado off.
Se cercárias intactas estão presentes na mídia, a transformação no passo 2.5 não foi executado corretamente. Uma imagem de um cercaria intacta é retratado na Figura 3b, para referência. Se esse problema ocorre, assegurar que a agulha emulsionante a ser utilizado é do tamanho adequado. Além disso, o número de vezes que a mistura cercarial é passado através da agulha pode ser aumentado, apesar de 40 vezes é tipicamente muito mais do que suficiente para chegar perto dos 100% de corte das caudas cercárias.
Transformação da cercária em esquistossômulos foi descrita pela primeira vez em 1974 por Colley e Wikel (13). Desde então, a preparação de esquistossômulos foi feito usando a estratégia do corte com uma agulha e seringa, conforme descrito neste protocolo, ou através de uma abordagem vórtex e separados por gradientes de Percoll (14, 15) ou rodando como demonstrado neste trabalho. Estas duas técnicas para preparar esquistossômulos são belamente descrito por Fred Lewis (16) e mais informações para cultura adicional de esquistossômulos de crescimento a longo prazo pode ser encontrado no NIAID esquistossomo Resource Center ( www.schisto-resource.org ).
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este projeto foi financiado pela Case Western Reserve University fundos de inicialização fornecido para E. Jolly. Caramujos infectados foram fornecidos pelo Centro de Recursos esquistossomo, NIH-NIAID (Contrato n º HHSN272201000009I NIAID). Agradecemos também a Chris King e Ronald Blanton para o apoio na obtenção de caracóis infectados esquistossomo e para discussões úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| 22g x 2-7/8 "agulha emulsionante | Fisher Scientific | 14-825-17G | |
| RPMI 1640 1X Médio (500ml) | Invitrogen | 11835030 | |
| De soro fetal bovino de calor (FBS) inativada | Invitrogen | 10082139 | |
| Penicilina estreptomicina / (100X) | Invitrogen | 15070063 | |
| Dish cristalizando (100mm) | Fisher Scientific | 08-741D | |
| Objetivo geral Tweezers | Fisher Scientific | 10-316C | |
| Petco Aquarium líquido artémia | Petco | SKU: 1190954 |
Referências
- Ross, A. G., Bartley, P. B., Sleigh, A. C., Olds, G. R., Li, Y., Williams, G. M. Schistosomiasis. N Engl J Med. 346, 1212-1220 (2002).
- Steinmann, P., Keiser, J., Bos, R., Tanner, M., Utzinger, J. Schistosomiasis and water resources development: systematic review, meta-analysis, and estimates of people at risk. Lancet Infect Dis. 6, 411-425 (2006).
- Savioli, L., Albonico, M., Engels, D., Montresor, A. Progress in the prevention and control of schistosomiasis and soil-transmitted helminthiasis. Parasitol Int. 53, 103-113 (2004).
- King, C. H., Dickman, K., Tisch, D. J. Reassessment of the cost of chronic helmintic infection: a meta-analysis of disability-related outcomes in endemic schistosomiasis. Lancet. 365, 1561-159 (2005).
- Haas, W., Grabe, K., Geis, C., Pach, T., Stoll, K., Fuchs, M. Recognition and invasion of human skin by Schistosoma mansoni cercariae: the key-role of L-arginine. Parasitology. 124, 153-167 (2002).
- Grabe, K., Haas, W. Navigation within host tissues: cercariae orientate towards dark after penetration. Parasitol Res. 93, 111-113 (2004).
- Shiff, C. J., Cmelik, S. H., Ley, H. E., Kriel, R. L. The influence of human skin lipids on the cercarial penetration responses of Schistosoma haematobium and Schistosoma mansoni. J Parasitol. 58, 476-480 (1972).
- Saladin, K. S. Schistosoma mansoni: cercarial responses to irradiance changes. J Parasitol. 68, 120-124 (1982).
- Chai, M., McManus, D. P., McInnes, R., Moertel, L., Tran, M., Loukas, A. Transcriptome profiling of lung schistosomula, in vitro cultured schistosomula and adult Schistosoma japonicum. Cell Mol Life Sci. 63, 919-929 (2006).
- Gobert, G. N., Tran, M. H., Moertel, L., Mulvenna, J., Jones, M. K., McManus, D. P. Transcriptional changes in Schistosoma mansoni during early schistosomula development and in the presence of erythrocytes. PLoS Negl Trop Dis. 4, (2011).
- Basch, P. F. Cultivation of Schistosoma mansoni in vitro. I. Establishment of cultures from cercariae and development until pairing. J Parasitol. 67, 179-185 (1981).
- Yoshino, T. P. &. a. m. p. ;. a. m. p., Laursen, J. R. Production of Schistosoma mansoni daughter sporocysts from mother sporocysts maintained in synxenic culture with Biomphalaria glabrata embryonic (Bge) cells. J Parasitol. 81, 714-722 (1995).
- Colley, D. G., Wikel, S. K. Schistosoma mansoni: simplified method for the production of schistosomules. Exp Parasitol. 35, 44-51 (1974).
- Lazdins, J. K., Stein, M. J., David, J. R., Sher, A. Schistosoma mansoni: rapid isolation and purification of schistosomula of different developmental stages by centrifugation on discontinuous density gradients of Percoll. Exp Parasitol. 53, 39-44 (1982).
- Cousin, C. E., Stirewalt, M. A., Dorsey, C. H. Schistosoma mansoni: ultrastructure of early transformation of skin- and shear-pressure-derived schistosomules. Exp Parasitol. 51, 341-365 (1981).
- Lewis, F. Schistosomiasis. Curr Protoc Immunol. Chapter 19, 1-1 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados