Method Article
Purificação de preparação, e Caracterização de Complexos de lantanídeos para uso como agentes de contraste para Imagem por Ressonância Magnética
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Demonstramos a metalation, purificação e caracterização de complexos de lantanídeos. Os complexos descrito aqui pode ser conjugado com macromoléculas para habilitar o rastreamento destas moléculas usando ressonância magnética.
Resumo
Polyaminopolycarboxylate baseado ligantes são comumente usados para quelar íons lantanídeos, e os complexos resultantes são úteis como agentes de contraste para ressonância magnética (MRI). Muitos ligantes disponíveis comercialmente são especialmente úteis porque contêm grupos funcionais que permitem rápido, de alta pureza e alto rendimento conjugação de macromoléculas e biomoléculas através de amina-reativo ésteres ativados e grupos isotiocianato ou tiol-reativa Maleimidas. Enquanto metalation desses ligantes é considerada o conhecimento comum no campo da química bioconjugation, diferenças sutis em procedimentos metalation devem ser levados em consideração na seleção de materiais metálicos de partida. Além disso, várias opções para a purificação e caracterização de existir, e seleção do procedimento mais eficaz depende em parte da seleção de matérias-primas. Essas diferenças sutis são muitas vezes negligenciados nos protocolos publicados. Aqui, nosso objetivo é demonstrar os métodos comuns para metalation, purificação e caracterização de complexos de lantanídeos que podem ser usados como agentes de contraste para ressonância magnética (Figura 1). Esperamos que esta publicação irá permitir que os cientistas biomédicos para incorporar as reações de complexação lantanídeos em seu repertório de reações comumente utilizados, facilitando a seleção de matérias-primas e métodos de purificação.
Protocolo
1. Metalation usando LnCl três sais
- Dissolver o ligante na água para produzir uma solução de 30-265 mM. O ligante 2 - (4-isothiocyanatobenzyl)-ácido dietileno pentaacetic (p-SCN Bn-DTPA) foi usado neste vídeo a uma concentração de 73 mM.
- Ajustar o pH da solução do ligante para entre 5,5 e 7,0 pela adição de 1 M NH 4 OH. Neste vídeo, 0,2 mL de NH M 1 4 OH solução foi usado.
- Dissolver 02/01 equivalentes de LnCl 3 em água para produzir uma solução com uma concentração de 5000-1000 mM. Neste vídeo, EuCl 3 e GdCl 3 foram usados em concentrações de 111 mM. Um excesso de metal é usado frequentemente para conduzir o metalation até a conclusão e, consequentemente, simplificar a purificação.
- Adicionar a solução de LnCl 3 para a solução de ligante, agitando.
- Após a adição de LnCl 3, ajustar o pH da mistura de reação resultante para entre 5,5 e 7,0 pela adição de 0,2 M NH 4 OH. Um total de 0,5 mL de NH 4 M 0,2 solução de OH foi usado neste vídeo. Se o seu ligante contém ácido-sensíveis grupos funcionais, ajustar o pH várias vezes durante esta etapa. ATENÇÃO - Se a solução torna-se demasiado básica, qualquer base sensível grupos funcionais, como o isotiocianato, serão inutilizados para a conjugação.
- Monitorar a reação via medições de pH. A reação é completa quando o pH se mantém constante.
2. Workup pH Raising (não incluído neste vídeo, mas bom para ligantes sem base sensível grupos funcionais)
- Adicionar concentrada NH 4 OH à mistura de reação para ajustar o pH a ≥ 11. Esta etapa irá precipitar os metais não complexada como o hidróxido insolúvel.
- Filtrar o sobrenadante através de um filtro M 0,2. Se a mistura de reação entope o filtro, centrifugação e decantação antes de filtragem é recomendado.
- Se a diálise não será realizada, remover solvente sob pressão reduzida (evaporação rotativa ou liofilização é recomendado).
- 2,1-2,3 passos podem ser repetidos se lantanídeos livre permanece.
3. Diálise workup
- Corte o tubo de diálise com um comprimento adequado (siga as orientações do fabricante) para manter o volume de amostra, deixando comprimento extra (aproximadamente 10% do volume da amostra). Neste vídeo, um 100-500 dalton de peso molecular de corte de membrana (MWCO) foi usado, mas maiores tubos MWCO pode ser usado como apropriado se conjugação é realizada antes da metalation. Além disso, cassetes de diálise pode ser usado como uma alternativa ao tubo de diálise, se desejar.
- Se for o caso com base em orientações do fabricante, mergulhe o tubo de diálise corte em água por 15 min à temperatura ambiente.
- Encher um reservatório de diálise (um copo de L 1 foi usado neste vídeo) com água (efluente). O volume de dialisato deve ser de aproximadamente 100 vezes a da amostra.
- Uma extremidade do tubo vezes duas vezes e garantir a porção dobrada do tubo com uma pinça de fechamento de diálise. Enrole a ponta do encerramento com um elástico para garantir que ele permanece fechado durante a diálise.
- Filtrar a mistura de reação através de um filtro 0,2 m, e carregar o filtrado para a extremidade aberta do tubo com cuidado para não rasgar o tubo. Certifique-se de deixar espaço de cabeça o suficiente para fechar a tubulação.
- Dobre a outra extremidade aberta do tubo de duas vezes, segura com um fechamento, e enrole o fechamento com um elástico como no passo 3.4.
- Anexar um frasco de vidro contendo ar, ao grampo em uma extremidade do tubo de diálise utilizando um elástico. Anexar um frasco contendo areia para a braçadeira outros. Esses frascos garantir que a tubulação fica imerso no dialisado.
- Coloque a tubulação cheia no reservatório de diálise que contém dialisado.
- Agitar o dialisado usando uma placa de agitação magnética a uma velocidade lenta (sem vórtice) à temperatura ambiente.
- Alterar o dialisato 3x ao longo de um dia (neste vídeo, o dialisato foi alterada de 2,5, 6,5 e 11,5 h), e então permitir que a diálise para continuar durante a noite (para um total de 20-28 h de diálise).
- Remova o tubo de diálise do dialisato e abra cuidadosamente um fechamento para remover a amostra. Lave o tubo de diálise 3x com água e combinam as lavagens com a amostra.
- Retire a água sob pressão reduzida. Liofilização é usada neste vídeo.
4. Avaliação da presença de metal livre
- Dissolver o complexo de metal em tampão acetato (preparação buffer: Dissolver 1,4 mL de ácido acético em 400 mL de água, ajustar o pH para 5,8 com 1 M NH 4 OH, e acrescentar água para produzir um volume total de 500 mL) e adicione o xilenol indicador de laranja (16 mM em tampão pH 5,8). Neste vídeo, 0,3 mg do complexo foi dissolvida em 0,3 mL de tampão e 3 mL da solução do indicador foi adicionado.
- Detectar a presença de metal livre através de observação de uma mudança de cor do indicador de amarelo para violeta.
- Se desejar, a quantidade de metal livre pode ser quantificado através da criação de uma curva de calibração 1. Alternativamente, o corante arsenazo III pode ser usado em vez de xilenol laranja 2. Se o metal livre permanece, a amostra deve ser purificado utilizando diálise, uma coluna de dessalinização, ou cromatografia líquida (HPLC), antes da caracterização.
5. Determinação de água coordenação-número (q)
- Prepare uma solução para o Eu-III contendo complexo (~ 1 mm), em H 2 O e outra solução de mesma concentração em D 2 O. Antes da análise, a solução de D 2 O deve ser evaporada e dissolvida em D 2 O três vezes para remover residual H 2 O.
- Adicionar a solução de água para uma cuvete limpa, e coloque a cubeta em um espectrofluorímetro.
- Realizar exames de excitação e emissão para determinar os máximos para cada (~ 395 nm e ~ 595 nm, respectivamente).
- Realizar um experimento de tempo de decaimento-fosforescência usando os seguintes parâmetros: excitação e emissão de comprimentos de onda determinado a partir do passo 5.3, de excitação e de emissão larguras de fenda (5 nm), flash count (100), atraso inicial (0,01 ms), prazo máximo (13 ms) e incremento de atraso (0,1 ms). Estas condições são apropriadas para a maioria dos complexos, mas o atraso máximo e os valores de incremento pode ser aumentada ou diminuída para espécies com tempos de decaimento muito longo ou muito curto.
- Repita o passo 5,4 com a solução D O 2 preparada no passo 5.1.
- A partir dos dados de luminescência de decaimento obtida em 5.4 e 5.5, o enredo do log natural de intensidade versus tempo. A inclinação dessas linhas são as taxas de decaimento (τ -1) (Figura 2). Neste vídeo, Microsoft Excel 2007 foi utilizado para gerar os gráficos log natural a partir dos dados brutos. Use as taxas de atenuação na equação desenvolvida por Horrocks e colegas de trabalho (eq 1) 3. Se o seu ligante contém OH ou NH grupos coordenados ao metal, então a equação deve ser modificada antes de utilizar 3.
eq 1: 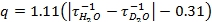
6. Medições de relaxação
- Selecione o modo de aplicação desejada no analisador tempo de relaxamento: T 1 (tempo de relaxamento longitudinal) ou T 2 (tempo de relaxamento transversal).
- Preparar uma série de amostras que contêm diferentes concentrações de D-us III contendo complexos em um solvente aquoso. Neste vídeo, a água era utilizada como solvente e soluções de 10,0, 5,00, 2,50, 1,25, 0,625 e 0 mM foram preparadas. Outros solventes aquosos ou buffers poderia ser usado, mas é importante usar o solvente como o branco. O volume final da amostra é específico para o instrumento que está sendo usado.
- Colocar a amostra no instrumento e deixe descansar por 5 min para equilibrar a temperatura do instrumento (37 ° C neste vídeo).
- Determinar o tempo de relaxamento (em unidades de s), ajustando os parâmetros do software para obter uma curva suave exponencial para T 1 ou T 2 (curvas representativas para T 1 e T 2 são mostrados na Figura 3).
- Repita os passos 6.3 e 6.4 para todas as amostras, incluindo o espaço em branco.
- Calcule o inverso da medida T 1 ou T 2 valores em unidades de s -1.
- Plotar a T 1 -1 ou T 2 -1 contra D'us valores de concentração III (em unidades de mM). Devido à natureza de D'us III higroscópico contendo complexos, confirmar a concentração de D-us III usando espectrofotometria de absorção atômica ou indutivamente acoplado a espectrometria de massa de plasma. Fit a trama com uma linha reta. Uma parcela representativa é mostrado na Figura 4.
- A inclinação da linha ajustada é a relaxação (r 1 ou r 2 para T 1 e T 2, respectivamente) e tem unidades de mM -1 s -1.
7. Resultados representante
Dados representativos para as etapas deste protocolo foram incluídos na seção de tabelas e figuras. Além de o número de coordenação de água e caracterização relaxação descrito no protocolo, é importante para caracterizar produtos finais utilizando técnicas químicas padrão. A identidade do composto pode ser obtido por espectrometria de massa, e espectros de massa representante mostrando os padrões de isótopos de diagnóstico para D'us III - Eu e III contendo complexos são mostrados na Figura 5. Além disso, para não-Gd III lantanídeos contendo complexos, espectroscopia de RMN pode ser utilizada para a identificação do produto. Para caracterizar a pureza do complexo, HPLC ou análise elementar ou ambos podem ser usados.
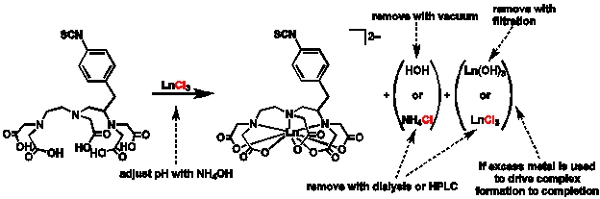
Figura 1 Esquema geral para metalation e purificação:. Esquema representando o procedimento geral para metalation e razões para escolher rotas diferentes de purificação.

Figura 2 Luminescência intensidade parcela:. Enredo Representante do log natural de intensidade versus tempo da seção 5. As inclinações das linhas geradas a partir de curvas similares adquiridos para água e soluções de D 2 O são usados com um eq para caracterizar o número de coordenação de água Eu III contendo complexos.
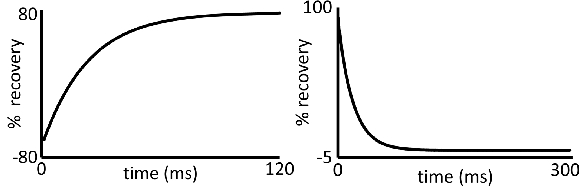
Figura 3 curvas de relaxamento deterioração do tempo:. Dados Representante para (esquerda) e T 1 (direita) T 2 de aquisição. Desvios relativamente a estas formas de curva seria produzir dados confiáveis.
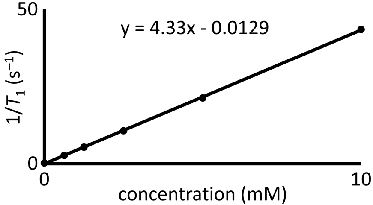
Figura 4 determinação relaxação:. A parcela representativa de 1 / T 1 versus a concentração de D-us III. A inclinação da linha é equipada relaxação e tem unidades de mM -1 s -1.
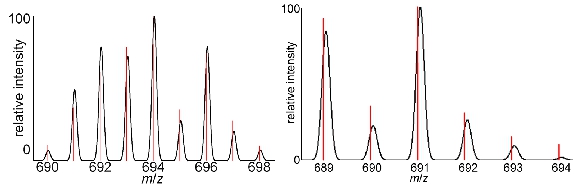
Figura 5 espectros de massa:. Espectros Representante em massa, mostrando os padrões de isótopos de diagnóstico para (esquerda) Gd III contendo complexos e (direita) Eu III contendo complexos. Os picos preto Gaussian representam a distribuição dos isótopos teóricos e as linhas vermelhas são os dados reais.
Discussão
Dado o número crescente de publicações que incluem agentes de contraste à base de lantanídeos 14/04, é importante que seja tomado cuidado na preparação, purificação e caracterização de produtos para garantir resultados reprodutíveis e comparáveis. Estes complexos são muitas vezes considerados desafiadores para purificar e caracterizar moléculas orgânicas em relação ao devido à sua natureza paramagnética ea sensibilidade de qualquer grupo funcional que pode ser usado para bioconjugation. Nós descrevemos métodos comuns para a síntese, purificação e caracterização de complexos de lantanídeos. No entanto, ao escolher um destes métodos é importante considerar o sistema específico que está sendo estudado.
Em reações de complexação, uma variedade de sais metálicos que estão comercialmente disponíveis podem ser utilizados, ea seleção de sal depende do objectivo do estudo. Por exemplo, uma vantagem de usar o cloreto de (ou triflate ou nitrato) sais é que as condições relativamente suaves são necessários com relação à temperatura. No entanto, estes métodos requerem monitoramento cuidadoso do pH e produção de sais como subprodutos. Se o sistema em estudo é particularmente sensível às mudanças no pH, em seguida, um cuidadoso monitoramento e controle do pH deve ser realizada. Além disso, se os subprodutos de sal seria prejudicial ao sistema a ser estudado, eles devem ser removidos ou uma síntese alternativa deve ser usada. Com o hidróxido de lantanídeos ou (óxido de) matérias-primas, temperaturas mais altas devem ser usados por causa da baixa solubilidade destas espécies, mas o único subproduto da metalation é a água. Este método é ideal para as reações que seria difícil para dessalinizar, mas não iria trabalhar para sistemas sensíveis à temperatura. Também é importante ressaltar que essas reações metalation são extremamente robustos no que diz respeito às concentrações de metal e ligante. A concentração intervalos listados em parte uma extensão da gama de concentrações que nós poderíamos encontrar na literatura.
Além da seleção cuidadosa de material metálico de partida, é importante ressaltar que tanto o metal e ligante provavelmente intimamente associada moléculas de água e solvente, mesmo que eles parecem estar seco. Estas moléculas adicionais são muitas vezes suficiente para distorcer muito a estequiometria de uma reação. Por isso, é útil ter bem caracterizado matérias-primas (análise elementar) para que quantidades precisas desses materiais são utilizados na reação.
Neste artigo, enfatizamos a importância de manter o pH da mistura de reação. Este controle de pH é crítico por causa das múltiplas vertentes da reação que pode falhar se o pH é permitido desviar-se perto neutro. Para a reação metalation a ocorrer, os ácidos carboxílicos sobre o ligante deve ser desprotonado (perto de pH neutro ou superior), enquanto o íon lantanídeo deve permanecer solúvel (perto de pH neutro ou inferior). Se o pH é muito alto, complexos de hidróxido insolúvel do íon lantanídeo irá precipitar e parar a reação. Alternativamente, se o pH é muito baixo, os ácidos carboxílicos protonados e continuará a ser o ligante não irá coordenar ao metal. Além disso, em valores de pH extremos, grupos funcionais reativos irá se decompor e tornar o complexo de inertes para reações bioconjugation subseqüentes. Para complicar ainda mais, como a reação metalation ocorre, o pH da mistura de reação é reduzido como ácidos carboxílicos desprotonado. Enquanto o ato de equilíbrio do pH metalation pode parecer complexo, pode ser facilmente controlada com a adição cuidadosa de base.
Há muitas estratégias para metalation com diferenças sutis. Neste artigo optou-se por descrever o uso de metais em excesso. Também é aceitável a utilização de ligante em excesso ou quantidades equivalentes de ligante e metal (com base na análise elementar de matérias-primas). Há vantagens e limitações de cada rota. A principal vantagem de usar o excesso de metal é que o ligante é muitas vezes o material mais caro de partida, e este método pode economizar dinheiro. No entanto, quando o metal é usado em excesso, a remoção do excesso de metal é de fundamental importância, pois qualquer metal livre pode influenciar dramaticamente propriedades importantes, incluindo a relaxação e toxicidade. Se a diálise contra água é insuficiente para remover o excesso de metal, diálise contra tampão citrato pode ser realizada seguida de diálise com água para remover tampão citrato. Alternativamente, uma coluna de dessalinização ou HPLC pode ser usado, desde que seja tomado cuidado para garantir que a neutralidade do pH da fase móvel é usado. Quando o ligante é usado em excesso, não há mais a necessidade crítica para remover o excesso de metal e ligante em excesso provavelmente não vai influenciar relaxação, no entanto, ligante livre permanecerá. Para reações bioconjugation subseqüentes, este ligante em excesso pode ser problemático e resultar em conjugados não homogêneo que são difíceis de separar. Para remediar esta questão, metal complexes pode ser precipitado de éter etílico anidro ou HPLC pode ser usado para separar complexo de metal do ligante em excesso. Idealmente, ligante e metal seria utilizado na proporção de 1:1, resultando em subprodutos não-metal ou ligando-based. Contudo, a análise elementar para ambos os materiais de partida é necessária antes de cada reação, e se há um ligeiro desvio a partir de uma relação de 1:1 ligante-metal, então a reação cairá tanto o ligante em excesso ou metal- em excesso de categorias, resultando na necessidade de purificação.
Nós demonstramos metalation onde o complexo resultante está pronto para bioconjugation 15-17. Uma alternativa a esta estratégia é a conjugação de ligante e biomolécula primeiro, seguido por metalation 18,19. Com esta estratégia conjugada-then-metalate, os mesmos fatores precisam ser levados em consideração ao decidir sobre uma rota metalation (pH sensibilidade e sensibilidade à temperatura da biomolécula, bem como a capacidade de purificar produto a partir de sais).
Divulgações
Agradecimentos
Agradecemos fundos de inicialização de Wayne State University (MJA), uma bolsa da Fundação Americana para Aging Research (SMV), e um Caminho para a Independência Award Transição de Carreira (R00EB007129) do Instituto Nacional de Imagem Biomédica e Bioengenharia do Instituto Nacional da Saúde (MJA).
Materiais
| Name | Company | Catalog Number | Comments |
| Reagentes e Equipamentos | Companhia | Número de catálogo | |
|---|---|---|---|
| EuCl 3 • 6H 2 O | Sigma-Aldrich | 203254-5G | |
| p SCN-Bn-DTPA | Macrocyclics | B-305 | |
| hidróxido de amônio | EMD | AX1303-3 | |
| Spectra / Por Biotech Celulose Ester (CE) Membrana de Diálise - 500 D MWCO | Fisher Scientific | 68-671-24 | |
| Millipore IC Millex-LG Unidades Filtro | Fisher Scientific | SLLG C13 NL | |
| xilenol laranja tetrasodium sal | Alfa Aesar | 41379 | |
| ácido acético | Fluka | 49199 | |
| D 2 O | Cambridge Isotope Laboratories, Inc. | DLM-4-25 | |
| depurador de água | ELGA | PURELAB Ultra | |
| cromatografia líquida de alta eficiência e espectrometria de massas | Shimadzu | LCMS-2010EV | |
| analisador de tempo de relaxamento | Bruker | mq60 minispec | |
| Espectrofotômetro UV-vis | Fisher Scientific | 20-624-00092 | |
| liofilizador | Fisher Scientific | 10-030-133 | |
| medidor de pH | Hanna Instruments | HI 221 | |
| espectrofluorímetro | HORIBA Jobin Yvon | Fluoromax-4 | |
| Versão Calculadora Peso Molecular 6,46 por Matthew Monroe, baixado 17 out, 2009 | http://ncrr.pnl.gov/software/ | Calculadora de Peso Molecular |
Referências
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- León-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- León-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados