Method Article
Préparation, la purification et la caractérisation des complexes de lanthanides pour utilisation comme agents de contraste pour imagerie par résonance magnétique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous démontrons la métallation, la purification et la caractérisation des complexes de lanthanides. Les complexes décrites ici peuvent être conjugués à des macromolécules pour permettre le suivi de ces molécules en utilisant l'imagerie par résonance magnétique.
Résumé
Polyaminopolycarboxylate basée sur les ligands sont couramment utilisés pour chélater les ions lanthanides, et les complexes qui en résultent sont utiles comme agents de contraste pour imagerie par résonance magnétique (IRM). Beaucoup de ligands disponibles dans le commerce sont particulièrement utiles car ils contiennent des groupes fonctionnels qui permettent de rapides et de haute pureté et à haut rendement conjugaison à des macromolécules et des biomolécules par des amines réactives esters activés et des groupes isothiocyanate ou thiol-réactive maléimides. Bien métallation de ces ligands est considérée comme connaissance commune dans le domaine de la chimie bioconjugaison, de subtiles différences dans les procédures de métallation doivent être prises en compte lors du choix des matériaux métalliques de départ. Par ailleurs, de multiples options pour la purification et la caractérisation existent, et la sélection de la procédure la plus efficace dépend en partie de la sélection des matières premières. Ces subtiles différences sont souvent négligés dans les protocoles publiés. Ici, notre but est de démontrer des méthodes communes de métallation, la purification et la caractérisation des complexes de lanthanides qui peuvent être utilisés comme agents de contraste pour l'IRM (figure 1). Nous espérons que cette publication permettra aux chercheurs en sciences biomédicales à intégrer les réactions de complexation de lanthanides dans leur répertoire de réactions couramment utilisé par l'assouplissement de la sélection des matières premières et des méthodes de purification.
Protocole
1. Métallation utilisant LnCl 3 sels
- Dissoudre le ligand dans l'eau pour produire une solution de 30 à 265 mM. Le ligand 2 - (4-isothiocyanatobenzyl)-diéthylènetriamine pentaacétique acide (p-SCN-Bn-DTPA) a été utilisé dans cette vidéo à une concentration de 73 mM.
- Ajuster le pH de la solution de ligand à entre 5,5 et 7,0 en ajoutant 1 M NH 4 OH. Dans cette vidéo, 0,2 mL de la 1 M solution de NH 4 OH a été utilisé.
- Dissoudre 1-2 équivalents d'LnCl 3 dans l'eau pour produire une solution avec une concentration de 5000-1000 mM. Dans cette vidéo, eucl 3 et GdCl 3 ont été utilisés dans des concentrations de 111 mM. Un excès de métal est souvent utilisé pour conduire la métallation d'achèvement et, par conséquent simplifier la purification.
- Ajouter la solution de LnCl 3 à la solution de ligand tout en remuant.
- Après l'ajout de LnCl 3, ajuster le pH du mélange réactionnel résultant à entre 5,5 et 7,0 par addition de 0,2 M NH 4 OH. Un total de 0,5 mL de l'0,2 M solution de NH 4 OH a été utilisé dans cette vidéo. Si votre ligand contient de l'acide-groupes fonctionnels sensibles, ajuster le pH de multiples reprises au cours de cette étape. ATTENTION - Si la solution devient trop basique, n'importe quelle base de groupes fonctionnels sensibles, comme l'isothiocyanate, sera rendu inutilisable pour la conjugaison.
- Surveiller la réaction via les mesures de pH. La réaction est terminée lorsque le pH reste constant.
2. Bilan pH Raising (non inclus dans cette vidéo, mais bon pour les ligands sans base-groupes fonctionnels sensibles)
- Ajouter NH4OH concentré au mélange réactionnel pour ajuster le pH à une valeur ≥ 11. Cette étape va précipiter tout métal décomplexé que l'hydroxyde insoluble.
- Filtrer le surnageant à travers un filtre de 0,2 um. Si le mélange réactionnel obstrue le filtre, la centrifugation et de décantation avant la filtration est recommandée.
- Si la dialyse ne sera pas exécutée, éliminer le solvant sous pression réduite (évaporation rotatif ou lyophilisation est recommandé).
- Étapes 2.1 à 2.3 peut être répétée si lanthanides libre reste.
3. Dialyse bilan
- Couper le tube à dialyse à une longueur appropriée (suivre les directives du fabricant) pour maintenir le volume de l'échantillon, tout en laissant une longueur supplémentaire (environ 10% du volume de l'échantillon). Dans cette vidéo, un 100-500 daltons de poids moléculaire de coupure (MWCO) membrane a été utilisée, mais plus grand tube MWCO peuvent être utilisées le cas échéant, si la conjugaison est effectuée avant métallation. Aussi, les cassettes de dialyse peut être utilisé comme une alternative au tube à dialyse, si désiré.
- Si approprié basé sur les directives du fabricant, faire tremper le tube à dialyse coupées dans l'eau pendant 15 min à température ambiante.
- Remplir un réservoir de dialyse (un bécher de 1 L a été utilisée dans cette vidéo) avec de l'eau (dialysat). Le volume de dialysat doit être approximativement 100x celle de l'échantillon.
- Pliez une extrémité du tube à deux reprises et sécuriser la partie pliée du tube avec une pince de fermeture de dialyse. Enveloppez la fin de la fermeture avec un élastique afin de s'assurer qu'il reste fermé pendant la dialyse.
- Filtrer le mélange réactionnel à travers un filtre de 0,2 um, et de charger le filtrat dans l'extrémité ouverte du tube en faisant attention à ne pas déchirer le tube. Soyez sûr de laisser un espace suffisant pour la tête près du tuyau.
- Replier l'autre extrémité ouverte du tube à deux reprises, sécurisée avec une fermeture, et envelopper la fermeture avec un élastique comme dans l'étape 3.4.
- Attacher un flacon en verre contenant de l'air à la pince à une extrémité du tube de dialyse en utilisant une bande de caoutchouc. Attacher un flacon contenant du sable à l'autre pince. Ces flacons s'assurer que le tuyau reste immergé dans le dialysat.
- Placez le tuyau dans le réservoir plein de dialyse qui contient dialysat.
- Incorporer le dialysat en utilisant une plaque d'agitation magnétique à une vitesse lente (pas de vortex) à température ambiante.
- Changer le dialysat 3x au cours d'une journée (dans cette vidéo, le dialysat a été changé à 2,5, 6,5 et 11,5 h), et ensuite permettre de poursuivre la dialyse pendant la nuit (pour un total de 20-28 h de dialyse).
- Retirez le tube de dialyse du dialysat et ouvrir avec précaution une fermeture pour retirer l'échantillon. Laver le tube à dialyse 3x avec de l'eau et de combiner les lavages avec de l'échantillon.
- Enlevez l'eau sous pression réduite. La lyophilisation est utilisée dans cette vidéo.
4. Évaluation de la présence de métal libre
- Dissoudre le complexe de métal dans du tampon acétate (préparation du tampon: dissoudre 1,4 ml d'acide acétique dans 400 ml d'eau, ajuster le pH à 5,8 avec 1 M de NH 4 OH, et ajouter de l'eau pour produire un volume total de 500 ml) et ajouter le xylénol Indicateur d'orange (16 uM dans un tampon pH 5,8). Dans cette vidéo, 0,3 mg de complexe a été dissous dans 0,3 ml de tampon et 3 ml de solution d'indicateur a été ajouté.
- Détecter la présence de métal gratuitement via l'observation d'un changement de couleur de l'indicateur du jaune au violet.
- Si désiré, la quantité de métal libre peut être quantifiée par la création d'une courbe d'étalonnage 1. Alternativement, le colorant arsenazo III peut être utilisé au lieu de xylénol orange 2. Si le métal libre reste, l'échantillon doit encore être purifié par dialyse, une colonne de dessalage, ou la chromatographie liquide haute performance (CLHP) avant de caractérisation.
5. Dosage de l'eau-de coordination nombre (q)
- Préparer une solution de l'Eu III complexe contenant (~ 1 mM) dans H 2 O et une autre solution de la même concentration dans D 2 O. Avant l'analyse, la D 2 O solution doit être évaporé et dissous dans D 2 O trois fois pour éliminer les résidus H 2 O.
- Ajouter la solution d'eau dans une cuvette propre, et placer la cuvette dans un spectrofluorimètre.
- Effectuer des analyses excitation et d'émission afin de déterminer les maxima pour chaque (~ 395 nm et 595 nm ~, respectivement).
- Effectuer une phosphorescence temps carie expérience en utilisant les paramètres suivants: excitation et d'émission de longueurs d'onde déterminée à partir de l'étape 5.3, d'excitation et d'émission des largeurs de fente (5 nm), le flash de comptage (100), le retard initial (0,01 ms), le délai maximal (13 ms) , incrément de retard et de (0,1 ms). Ces conditions sont appropriées pour la plupart des complexes, mais le délai maximum et les valeurs incrément peut être augmenté ou diminué pour les espèces à temps de décroissance extrêmement longues ou très courtes.
- Répétez l'étape 5.4 avec la solution D 2 O préparé à l'étape 5.1.
- À partir des données de luminescence désintégration obtenu en 5.4 et 5.5, tracer le logarithme naturel de l'intensité en fonction du temps. La pente de ces lignes sont les taux de désintégration (τ -1) (figure 2). Dans cette vidéo, Microsoft Excel 2007 a été utilisé pour générer les parcelles logarithme naturel à partir des données brutes. Utilisez le taux de décomposition dans l'équation développée par Horrocks et ses collaborateurs (éq 1) 3. Si votre ligand contient des groupes OH ou NH coordonnée pour le métal, l'équation doit être modifié avant utilisation 3.
EQ 1: 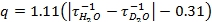
6. Mesures relaxivité
- Sélectionnez le mode d'application désirée sur l'analyseur temps de relaxation: T 1 (temps de relaxation longitudinal) ou T 2 (temps de relaxation transversale).
- Préparer une série d'échantillons qui contiennent différentes concentrations de Gd III contenant complexe dans un solvant aqueux. Dans cette vidéo, l'eau a été utilisé comme solvant et des solutions de 10,0, 5,00, 2,50, 1,25, 0,625, et 0 mm ont été préparées. Autres solvants aqueux ou des tampons peuvent être utilisés, mais il est important d'utiliser le solvant comme le vide. Le dernier volume de l'échantillon est spécifique à l'instrument qui est utilisé.
- Placer un échantillon dans l'instrument et laisser reposer pendant 5 min pour s'équilibrer à la température de l'instrument (37 ° C dans cette vidéo).
- Déterminer le temps de relaxation (en unités de s) en ajustant les paramètres du logiciel pour obtenir une courbe lisse exponentielle pour T 1 ou T 2 (courbes représentatives de T 1 et T 2 sont présentés dans la figure 3).
- Répétez les étapes 6.3 et 6.4 pour tous les échantillons, y compris le blanc.
- Calculer l'inverse de la mesure T 1 ou T 2 valeurs en unités de s -1.
- Terrain T 1 ou T 2 -1 -1 valeurs par rapport Gd III de concentration (en unités de mm). En raison de la nature hygroscopique du Gd III complexes contenant, confirme la concentration de Gd III en utilisant la spectrophotométrie d'absorption atomique ou spectrométrie de masse à couplage inductif plasma. Monter la parcelle avec une ligne droite. Un tracé représentatif est montré dans la figure 4.
- La pente de la droite d'ajustement est la relaxivité (R 1 ou R 2 pour T 1 et T 2, respectivement) et possède des unités de mm -1 s -1.
7. Les résultats représentatifs
Des données représentatives pour les étapes de ce protocole ont été inclus dans les tableaux et figures section. En plus du numéro de l'eau-de coordination et de la caractérisation relaxivité décrites dans le protocole, il est important de caractériser les produits finis en utilisant des techniques chimiques standard. L'identité du composé peut être obtenu en utilisant la spectrométrie de masse, et des spectres de masse représentatives montrant les tendances des isotopes de diagnostic pour D.ieu III - et Eu III complexes contenant sont montrés dans la Figure 5. Par ailleurs, pour les non-Gd III lanthanides complexes contenant, la spectroscopie RMN peut être utilisée pour l'identification du produit. Pour caractériser la pureté du complexe, HPLC ou analyse élémentaire ou les deux peuvent être utilisés.
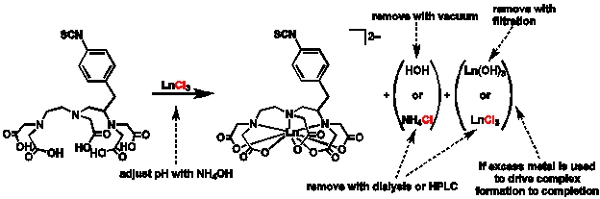
Figure 1 Schéma général d'métallation et de purification:. Schéma illustrant la procédure générale de métallation et de raisons de choisir les routes de purification différent.

Figure 2 Luminescence intensité intrigue:. Tracé représentatif de le logarithme naturel de l'intensité en fonction du temps de la section 5. Les pentes des lignes générées à partir des courbes similaires acquis pour les solutions d'eau et D 2 O sont utilisés avec une égalisation à caractériser le nombre d'eau-de coordination de l'Eu III complexes contenant.
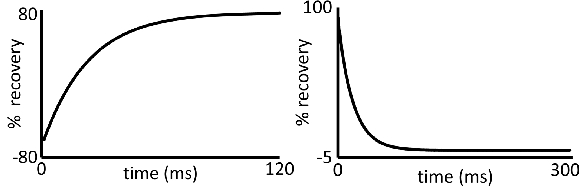
Figure 3 courbes de relaxation décroissance temporelle:. Données représentatives pour (à gauche) T 1 et (à droite) T 2 d'acquisition. Les écarts par rapport à ces formes de courbe serait de produire des données fiables.
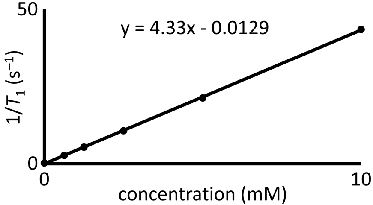
Figure 4 Détermination relaxivité:. Un tracé représentatif de 1 / T 1 versus la concentration de Gd III. La pente de la droite d'ajustement est relaxivité et possède des unités de mm -1 s -1.
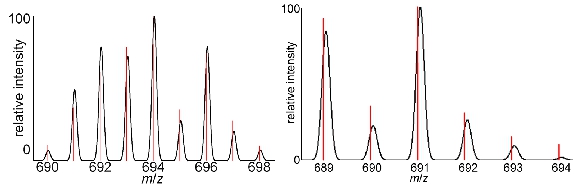
Figure 5 Les spectres de masse:. Spectres de masse représentant montrant les tendances des isotopes de diagnostic pour (à gauche) Gd III contenant les complexes et (à droite) Eu III complexes contenant. Les pics noirs représentent la répartition gaussienne isotopes théoriques et les lignes rouges sont les données réelles.
Discussion
Vu le nombre croissant de publications qui comprennent des agents de contraste à base de lanthanides 4-14, il est important que l'on prend soin dans la préparation, la purification et la caractérisation des produits pour assurer des résultats reproductibles et comparables. Ces complexes sont souvent considérés comme difficiles à purifier et de caractériser par rapport à des molécules organiques en raison de leur nature paramagnétique et la sensibilité d'un groupe fonctionnel qui peut être utilisé pour bioconjugaison. Nous avons décrit des méthodes communes pour la synthèse, la purification et la caractérisation des complexes de lanthanides. Cependant, en choisissant l'une de ces méthodes, il est important de considérer le système spécifique à l'étude.
Dans les réactions de complexation, une variété de sels de métaux qui sont disponibles dans le commerce peuvent être utilisés, et la sélection de sel dépend de la finalité de l'étude. Par exemple, un avantage de l'utilisation du chlorure de (ou triflate ou nitrate) est que les sels des conditions relativement douces sont nécessaires à l'égard de la température. Cependant, ces méthodes nécessitent un suivi attentif du pH et de produire des sels comme sous-produits. Si le système étudié est particulièrement sensible aux changements de pH, puis un suivi attentif et le contrôle du pH doit être effectuée. Aussi, si les sous-produits du sel serait préjudiciable au système étudié, ils doivent être enlevés ou une synthèse alternative doit être utilisée. Avec l'hydroxyde de lanthanides (ou oxyde) à partir des matériaux, des températures plus élevées doivent être utilisées en raison de la faible solubilité de ces espèces, mais le seul sous-produit de la métallation est l'eau. Cette méthode est idéale pour les réactions qui seraient difficiles à dessaler, mais cela ne fonctionnera pas pour les sensibles à la température des systèmes. Il est également intéressant de mentionner que ces réactions de métallation sont extrêmement robustes par rapport à la concentration du métal et du ligand. Les gammes de concentration énumérés dans la première partie couvrent la gamme de concentrations que l'on pourrait trouver dans la littérature.
En plus de la sélection réfléchie de matériel métallique de départ, il est important de souligner que les deux le métal et le ligand probablement étroitement associé molécules d'eau et de solvants, même si elles semblent être sèches. Ces molécules supplémentaires sont assez souvent considérablement fausser la stœchiométrie d'une réaction. Par conséquent, il est utile d'avoir ainsi caractérisé les matériaux de départ (analyse élémentaire) de sorte que les montants exacts de ces matériaux sont utilisés dans la réaction.
Dans cet article, nous insistons sur l'importance de maintenir le pH du mélange réactionnel. Cette régulation du pH est essentielle en raison des multiples aspects de la réaction qui peut échouer si le pH est autorisé à s'écarter de près neutre. Pour la réaction de métallation de se produire, les acides carboxyliques sur le ligand doit être déprotoné (près de pH neutre ou élevé) tandis que l'ion lanthanide doit rester solubles (près de pH neutre ou inférieur). Si le pH est trop élevé, les complexes hydroxydes insolubles de l'ion lanthanide se précipiter et d'arrêter la réaction. Alternativement, si le pH est trop faible, les acides carboxyliques restera protoné et le ligand ne sera pas de coordonnées pour le métal. En outre, à des valeurs de pH extrêmes, groupes fonctionnels réactifs se décomposent et rendre le complexe inerte vers la bioconjugaison réactions ultérieures. Pour compliquer encore les choses, comme la réaction de métallation se produit, le pH du mélange réactionnel est abaissée que les acides carboxyliques sont déprotoné. Alors que l'équilibre du pH de l'métallation peut sembler complexe, il peut être facilement contrôlé avec plus attentive de la base.
Il ya de nombreuses stratégies pour métallation avec des différences subtiles. Dans cet article, nous avons choisi de décrire l'utilisation de l'excédent de métal. Il est également acceptable d'utiliser un excès de ligand ou de montants équivalents de ligand et le métal (basé sur l'analyse élémentaire des matériaux de départ). Il ya des avantages et des limites de chaque itinéraire. Le principal avantage de l'utilisation de l'excédent de métal est que le ligand est souvent le matériau le plus cher de départ, et cette méthode peut économiser de l'argent. Toutefois, lorsque le métal est utilisé en excès, la suppression de l'excédent de métal est d'une importance capitale parce que tout métal libre peut considérablement influencer les propriétés importantes, y compris relaxivité et de toxicité. Si la dialyse contre l'eau est insuffisant pour enlever l'excédent de métal, dialyse contre un tampon citrate peut être effectuée suivie d'une dialyse à l'eau pour éliminer le tampon citrate. Alternativement, une colonne de dessalage ou HPLC peut être utilisé aussi longtemps que l'on prend soin de s'assurer que la neutralité du pH de la phase mobile est utilisée. Lorsque ligand est utilisé en excès, il n'ya plus le besoin critique pour enlever l'excédent de métal et un excès de ligand ne sera probablement pas d'influence relaxivité, mais ligand libre restera. Pour les réactions bioconjugaison ultérieures, ce ligand en excès peut être problématique et entraîner conjugués inhomogène qui sont difficiles à séparer. Pour remédier à ce problème, le métal complexes peut être précipité dans l'éther éthylique anhydre ou HPLC peuvent être utilisées pour séparer complexe métallique du ligand en excès. Idéalement, le ligand et le métal serait utilisé dans un rapport 1:1 dans aucun sous-produit résultant de métal ou ligand-fondée. Cependant, l'analyse élémentaire pour les deux matériaux de départ est nécessaire avant chaque réaction, et s'il ya une légère déviation à partir d'un ligand 01h01-métal ratio, puis la réaction va tomber dans le ligand soit en excès ou en métal- en excès de catégories, ce qui entraîne la nécessité de la purification.
Nous avons démontré métallation où le complexe résultant est prête pour bioconjugaison 15-17. Une alternative à cette stratégie est la conjugaison de ligand et de biomolécules premier, suivi par métallation 18,19. Avec cette stratégie, conjugué-alors-metalate, les mêmes facteurs doivent être pris en considération lorsqu'il s'agit de décider sur une route métallation (sensibilité au pH et de sensibilité à la température de la biomolécule, ainsi que la capacité de purifier produit à partir de sels).
Déclarations de divulgation
Remerciements
Nous remercions les fonds de démarrage de la Wayne State University (MJA), une subvention de la Fondation américaine pour la recherche sur le vieillissement (SMV), et une voie à l'attribution de transition de carrière Indépendance (R00EB007129) de l'Institut national d'imagerie biomédicale et bio-ingénierie de l'Institut national Santé des (MJA).
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs et appareillage | Société | Numéro de catalogue | |
|---|---|---|---|
| Eucl 3 • 6H 2 O | Sigma-Aldrich | 203 254-5G | |
| p-SCN-Bn-DTPA | Macrocyclics | B-305 | |
| hydroxyde d'ammonium | EMD | AX1303-3 | |
| Membrane de dialyse Spectra / Por Biotech ester de cellulose (CE) - 500 D MWCO | Fisher Scientific | 68-671-24 | |
| Millipore IC Millex-LG unités de filtration | Fisher Scientific | SLLG C13 NL | |
| xylénol orange, sel tétrasodique | Alfa Aesar | 41379 | |
| l'acide acétique | Fluka | 49199 | |
| D 2 O | Cambridge Isotope Laboratories, Inc | DLM-4-25 | |
| purificateur d'eau | ELGA | PURELAB Ultra | |
| chromatographie liquide haute performance et spectrométrie de masse | Shimadzu | LCMS-2010EV | |
| analyseur temps de relaxation | Bruker | mq60 Minispec | |
| Spectrophotomètre UV-VIS | Fisher Scientific | 20-624-00092 | |
| lyophilisateur | Fisher Scientific | 10-030-133 | |
| pH-mètre | Hanna Instruments | HI 221 | |
| spectrofluorimètre | HORIBA Jobin Yvon | Fluoromax-4 | |
| Calculateur de poids moléculaire la version 6.46 par Matthew Monroe, téléchargé 17 Octobre, 2009 | http://ncrr.pnl.gov/software/ | Calculatrice Poids Moléculaire |
Références
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- León-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- León-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon