Method Article
Um In vivo Modelo de Contração de roedores induzida por lesões e não-invasivos acompanhamento da recuperação
Neste Artigo
Resumo
Um In vivo Modelo animal de lesão é descrita. O método aproveita a posição subcutânea do nervo fibular. Tempo, velocidade da ativação muscular, e arco de movimento são todos os pré-determinada e sincronizados usando software comercial. Alterações pós-lesão são monitorados In vivo Usando RM / espectroscopia.
Resumo
Tensões musculares são uma das queixas mais comuns tratados por médicos. A lesão muscular é tipicamente diagnosticada a partir do histórico do paciente e exame físico sozinho, porém a apresentação clínica pode variar muito, dependendo da extensão da lesão, a tolerância do paciente a dor, etc Em pacientes com lesão muscular ou doença muscular, a avaliação de lesão muscular é normalmente limitada a sinais clínicos, tais como a ternura, força, amplitude de movimento e, mais recentemente estudos, de imagem. Marcadores biológicos, tais como níveis séricos de creatina quinase, são normalmente elevados com lesão muscular, mas seus níveis nem sempre se correlacionam com a perda de produção de força. Isto é mesmo verdade dos achados histológicos de animais, que fornecem uma "medida direta" de danos, mas não conta por todas as perdas de função. Alguns argumentaram que a medida mais abrangente da saúde geral do músculo da força contrátil. Porque lesão muscular é um evento aleatório que ocorre sob uma variedade de condições biomecânicas, é difícil de estudar. Aqui, descrevemos um modelo animal in vivo para medir torque e produzir uma lesão muscular confiável. Descrevemos também o nosso modelo de medição de força de um músculo isolado in situ. Além disso, descrevemos o nosso procedimento de pequenos animais de ressonância magnética.
Protocolo
1. Lesão no modelo vivo e medição de torque isométrico.
- Estes procedimentos podem ser usados para ratos ou camundongos 7,17,18. Para começar, coloque o supino animais sob anestesia inalatória (~ 4-5% isoflurano para indução em uma câmara de indução, então ~ isoflurano a 2% através de um cone de nariz para manutenção), utilizando um vaporizador de precisão (cat # 91103, Vet Equip, Inc, Pleasanton , CA). Aplicar pomada oftálmica estéril (Paralube Pomada Vet, PharmaDerm, Floham Park, NJ) para cada olho para proteger as córneas de secagem. Durante o procedimento, o animal é mantido quente pelo uso de uma lâmpada de calor colocado fora da gaiola e mantidos pelo menos 6 polegadas do animal em todos os momentos.
- Prep a pele, removendo o cabelo e com a limpeza com a alternância de scrubs de betadine e álcool 70% para evitar que bactérias da pele semear para o tecido mole ou osso. Confirmar a anestesia adequada por falta de um reflexo tendinosos profundos (sem a retirada do pé em resposta a beliscar a pé). Uma agulha é colocada manualmente através da tíbia proximal, a fim de estabilizar o membro sobre a plataforma (25G ou 27G para mouse). A agulha não deve entrar no compartimento anterior da perna.
- Bloqueio da agulha em uma posição fixa, de modo que o animal está em decúbito dorsal e os dedos estão enfrentando para cima. Um dispositivo feito sob medida é usada para proteger a agulha e, assim, estabilizar a perna.
- Coloque o pé do membro em uma platina custom-usinadas (Figura 1). O eixo da platina está ligado a um motor de passo (modelo T8904, NMB Technologies, Chatsworth, CA) e um sensor de torque (modelo QWFK-8M, Sensotec, Columbus, OH). O pé deve inicialmente ser alinhadas de modo que é ortogonal à tíbia, como na Figura 1.
- Use eletrodos transcutânea (723.742, Harvard Apparatus, Cambridge, MA) ou eletrodos subcutâneos (J05 Agulhas Needle Electrode, 36BTP, Jari Abastecimento Electrode, Gilroy, CA) para estimular o nervo fibular perto do colo da fíbula, onde o nervo encontra-se em um posição superficial. Confirmar visualmente dorsiflexão isolados realizando uma série de contrações musculares (0,1 ms de pulso para o mouse e 1 ms de pulso para o rato) antes do pé é garantido. Uma vez que o pé está garantido para a platina com fita adesiva, um aumento na amplitude contração em resposta a um aumento na tensão confirma que os músculos opostos (plantares) não estão sendo estimulados simultaneamente.
- Antes da lesão, e em pontos de tempo selecionado após uma lesão, a força máxima capacidade produtiva dos dorsiflexores é registrado como o "torque máximo isométrico" (torque sem uma mudança no comprimento do músculo). Medições de torque são executadas na plataforma mesmo que é usado para induzir a lesão. Antes de gravar torque isométrica máxima, a amplitude do pulso é ajustada para otimizar a contração e tensão a posição ideal do tornozelo é determinada dando contrações musculares em diferentes comprimentos dos dorsiflexores. Depois de obter uma curva de torque-ângulo para determinar o comprimento ideal do dorsiflexores (comprimento de repouso, também conhecido como Lo), um gráfico de freqüência torque é obtido aumentando progressivamente a freqüência de pulsos durante um trem de pulsos 200 ms. A contração tetânica máxima fundido é obtido normalmente a 90-100 Hz. Três contrações em separado e contrações tetânicas são gravadas e guardadas para posterior análise.
- Use um software comercial para (Labview versão 8.5, National Instruments, Austin, TX) para sincronizar a ativação contrátil, o início da rotação do tornozelo, e coleta de dados torque. Estimulação dos músculos dorsiflexor ocorre enquanto o motor controlado por computador ao mesmo tempo se move a platina em flexão plantar, levando a uma contração de alongamento (também chamado de contração "excêntrico", que causa lesão do músculo). O protocolo específico depende da magnitude desejada de lesão desejada pelo investigador. A magnitude da lesão ou dano ao tecido, pode ser regulada pela manipulação de variáveis como velocidade angular, tempo de ativação muscular, amplitude de movimento, eo número de contrações alongamento.
- Para induzir a lesão, sobrepor uma contração de alongamento em uma contração isométrica máxima, variando a amplitude de movimento, a velocidade de alongamento, e tempo de estimulação, conforme necessário. Por exemplo, uma contração isométrica máxima é obtida na dorsiflexores e após 200 ms são alongadas com uma velocidade selecionada para o movimento normal aproximada (900 ° / seg). Nós temos mostrado previamente que a ativação antes do movimento eo grau de alongamento são fatores importantes na obtenção de uma lesão 14. A maioria das torque produzido pelo dorsiflexores é do TA 11 e temos mostrado previamente que este modelo resulta em prejuízo para este músculo 5,13-15. O TA permanece estimulado em todo o alongamento.
- Após a lesão, o animal é retirado do aparelho. O pino é tibialremovido, a perna é limpo de novo, eo animal é devolvido para a jaula (colocados em um bloco de aquecimento com temperatura controlada a 37 ° C) e monitorado até a recuperação. Isto inclui esperando até que o animal está acordado e móveis. Os animais não sofrem dor observáveis durante o procedimento e não há alterações visíveis na marcha (manqueira, por exemplo) após a lesão induzida por contrações alongamento. No entanto, o tratamento anti-dor apropriado é administrada posteriormente (buprenorfina 0,05-0,1 mg / kg a cada 12 horas para 48 horas após a cirurgia).
2. Medição in situ de toda a tensão muscular.
- O animal é preparado e da tíbia é estabilizada como descrito acima na seção 1.1 através de 1.3. Toda a instrumentação é ligado pelo menos 30 min antes do teste para a calibração adequada e minimizar drift térmico do transdutor de força.
- Inciso anterior a pele até o tornozelo e cortar o tendão do músculo tibial anterior (TA). Cuidadosamente tie 4,0 Ethicon de seda de sutura não absorvível ao tendão e anexar a sutura vicryl à célula de carga através do gancho desde S-RI (peso = 0,1 g), modelo FT03, Instrumentos Grass, Warwick). Alternativamente, uma braçadeira personalizada (peso = 0,5 g) pode ser utilizado para fixar o tendão à sutura vicryl (Figura 2).
- A célula de carga é montado em um micromanipulador (Kite Manipulator, World Precision Instruments Inc, Sarasota, FL) para que o TA pode ser ajustado para comprimento de repouso e alinhada corretamente (uma linha reta de atração entre a origem e inserção). O TA está protegido de resfriamento por uma lâmpada de calor e da desidratação por óleo mineral. Os sinais da célula de carga (calibrado antes de cada teste) são alimentados através de um amplificador DC (modelo P122, Instrumentos Grass, Warwick, RI) para uma placa A / D a ser coletados e armazenados pelo software de aquisição (PolyView versão 2.1, Instrumentos Grama , Warwick, RI).
- Anexar o TA à célula de carga e aplicar twitches único (pulso retangular de 1 ms) em diferentes comprimentos musculares, a fim de determinar L 0. Comprimento do músculo em repouso, medidos com paquímetro, é definido como a distância entre a tuberosidade tibial ea junção miotendínea. Neste período, aumente gradualmente a amplitude de pulso e, em seguida, a freqüência de pulso para estabelecer uma relação força-freqüência. A contração máxima fundidos tetânica é obtida em cerca de 90-100Hz (300 ms duração trem composto de 0,1 ms ou ms 1 pulsos). Use 150% da intensidade máxima estimulação para ativar a TA, a fim de induzir a ativação contrátil máxima (P 0). Máxima contrações tetânicas pode ser realizada repetidamente e expresso em percentagem de P 0, fornecendo um índice de fadiga em qualquer ponto desejado no tempo.
3. In vivo ressonância magnética e / ou espectroscopia de músculos esqueléticos de roedores.
Todos os MRI e MRS é executada em um BioSpin Bruker (Billerica, MA) 7.0 Tesla sistema MR equipado com um gradiente de inserir 12 cm (660 mT / m máximo gradiente, 4570 T / m / s taxa de variação máxima) rodando software Paravision 5.0.
- O animal é anestesiado com isoflurano vaporizado, como descrito acima no ponto 1.1. Um sistema de monitoramento MR-compatível pequenos animais e gating (SA Instruments, Inc.) é usado para monitorar a taxa de respiração e temperatura corporal. Temperatura do corpo do mouse é mantida a 36-37 ° C usando um circulador de água morna. Um porta-custom-made é usado para posicionar o mouse na posição supina com as duas pernas paralelas ao furo do ímã do joelho ao pé. A quatro canais bobina de superfície receber somente é colocado dentro de um 1 º semestre de 72 milímetros linear ressonador. A bobina ressonador é sintonizado e combinados para a amostra.
- RM: Depois de localizadores, os exames são realizados seguindo MR: T1-weighted com realce aquisição rápida de relaxamento (RARE) com os seguintes parâmetros: TE = 9,52 ms, TR = 1800, comprimento do comboio echo = 4, no plano de resolução 100x100 mM e espessura de corte = 750 mM. Dual-echo PD/T2 RARE: TE = 19.0/57.1 ms, TR = 5000 ms, echo comprimento do comboio = 4, no plano mícrons de resolução 100x100, e espessura de corte = 750 mM. Spin-echo (SE) tensor de difusão de dados de imagem a partir de 12 não-colinear direções: b-valor = 350 s / mm -2, TE = 26 ms, TR = 4.500 ms, no plano de resolução 150x150 micrômetros, espessura de corte = 750 mM . Multi-slice multi-echo (MPME) T2 mapeamento de dados paramétricos utilizando TEs 16 = 11,4 ms para 182,5 ms com ΔTE = espessura 11,4 ms, TR = 10000 ms, resolução de 150x150 no plano-M, e fatia = 750 mM.
- Processamento de imagem: a reconstrução e difusão tensor tractography é realizada utilizando TrackVis (Center for Biomedical Martinos imagem; Massachusetts General Hospital, Boston, MA) para criar difusividade média (MD), anisotropia fracionada (FA) imagens, bem como mapas tractography. Mapeamento T2 é realizada utilizando software personalizado escrito em MAT LAB (The Mathworks, Natick, MA), usando não-linear de mínimos quadrados para ajustar os dados medidos em cada pixel para a equação canônica de sinal T2. Regiões de interesse medições são realizadas para avaliar os valores dos parâmetros dentro do TA.
- Espectroscopia 1H: shimming automatizada é realizada em um x 1 x 1 4 3 mm voxel no TA. Um ponto-resolved spectroscopy (PRESS) seqüência de pulsos (TR / TE = 2000/18 ms) é usado para adquirir espectros do voxel mesmo com 1024 médias. Aquisição de dados é de 34 minutos em cada perna. Dados espectrais são processados usando o pacote de 16 LCModel. 31P espectroscopia: Uma dupla afinada bobina de superfície (1H, 31P) é usado para executar não localizada (usando um experimento de pulso único) ou espectroscopia localizada usando a imagem selecionada in vivo espectroscopia (ISIS) seqüência de pulsos.
4. Colheita e armazenamento de músculos.
TAs são colhidas depois, no final dos experimentos, pesado, snap congelados em nitrogênio líquido e armazenadas a -80 ° C. Isto pode ser feito em qualquer ponto do tempo após a experimentos in vivo. Músculos são colhidas imediatamente após a experimentos in situ, já que este é um procedimento terminal. Detalhada para estudos morfológicos, o animal é fixado com paraformaldeído 4% por meio de perfusão através do ventrículo esquerdo.
5. Resultados representativos.
A Figura 3 mostra dados representativos de um rato no no aparelho O vivo em aparelhos vivo é usado para obter torque máximo gerado pelos músculos dorsiflexor;. Também é usado para induzir a lesão a estes mesmos músculos. Devido à relação comprimento-tensão do músculo, torque isométrica máxima normalmente ocorre quando a articulação do tornozelo é posicionado em aproximadamente 20 ° de flexão plantar (com o pé posicionado ortogonais à tíbia considerada 0 °). Depois de torque isométrico máximo é obtido, o pé pode ser colocado em qualquer posição para iniciar o protocolo de lesão. A Figura 3 representa um protocolo de lesão de 30 repetições com um arco de movimento de 0 ° - 70 °. Observe o constante declínio no torque gerado a partir da fase isométrica (seta cheia) e fase de alongamento (seta aberta) durante a contração induzida pelo protocolo de lesão. Torque é registrado em unidades de Nmm, mas o valor absoluto depende do tamanho do animal e sua condição (por exemplo, músculo lesionado, o músculo fatigado, ou músculo falta de uma determinada proteína, devido à recombinação homóloga).
A Figura 4 mostra dados representativos de um rato no aparelho em situ. Nosso aparato em situ não envolve contrações alongamento, mas sim, permite-nos isolar, alinhar corretamente, e medir a tensão máxima produzida por um músculo individual em um comprimento conhecido. A Figura 4 mostra a perda gradual da força que ocorre durante um teste de fadiga no músculo tibial anterior de um rato. Neste exemplo em particular, as contrações titanic foram realizadas uma vez por segundo durante 5 minutos. Tensão (força) é normalmente registrado em Newtons (ou gramas), mas como torque, o valor absoluto depende do tamanho e da condição do animal. Porque o peso muscular é obtido imediatamente após este procedimento, a força pode ser normalizada (chamados de "força específica") a área seccional muscular.
A Figura 5 mostra dados representativos de imagem in vivo de um rato, como T1 e T2 Parametric Mapping (A), tractography 3D a partir de imagens de tensor de difusão (B), espectroscopia 1 H (C), e 31 de espectroscopia P. Detalhes são fornecidos na legenda da figura.

Figura 1: em aparelhos vivo .* Para produzir a lesão, a tíbia está estabilizada e os pés ligados a uma placa de motor. O dorsiflexores do tornozelo são estimulados através do nervo fibular, enquanto a platina força o pé em flexão plantar (seta pontilhada).
* Lovering & De Deyne, Biomecânica J 2005, usada com permissão.

Figura 2: Em aparelho situ A célula de carga é montado em um micromanipulador para que o TA pode ser ajustado para comprimento de repouso e alinhados corretamente no X, Y e Z. O tendão distal do TA está ligado à célula de carga e contrações musculares são induzidas a única comprimentos musculares diferentes, a fim de determinar L 0. A contração tetânica máxima é obtida para determinar a activação contrátil máxima (P 0). Tensão tetânica máxima pode ser realizada repetidamente e expresso em percentagem de P 0, fornecendo um índice de fadiga em um ponto desejado no tempo.
782/2782fig3.jpg "alt =" Figura 3 "/>
Figura 3: Torque de dados em aparelhos vivo gravações Representante traço de torque de alongamento contrações no rato. Neste exemplo em particular, os músculos foram estimulados por 200 milissegundos para induzir uma contração isométrica máxima (seta cheia) antes de alongamento (seta aberta) por a platina através de um arco de 70 ° de movimento em uma velocidade angular de 900 ° / s.

Figura 4: Tensão de dados a partir de dados in situ Representante aparelho mostrando o declínio da tensão tetânica isométrica máxima durante a estimulação repetida do músculo tibial anterior (TA) em um rato. Neste exemplo, o TA foi isolado, ajustado ao comprimento ótimo (L 0), e então estimulados com uma contração tetânica 200 ms uma vez a cada segundo durante 5 minutos.
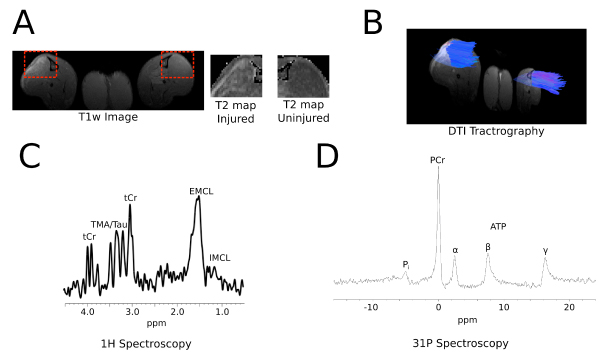
Figura 5: in vivo de imagem A: As imagens mostram transversal (axial) seções de T1 e T2 mapeamento paramétrico do músculo tibial anterior (TA). A caixa pontilhada vermelha circunda o TA para mostrar maior aumento em T2 os feridos (lado esquerdo) versus (lado direito) uninjured B:.. Tractography 3D Representante do tensor de difusão de imagem (DTI) C: O espectro de 1 H de um TA do mouse mostra várias ressonâncias lipídica detectável; diferenciação entre intramiocelular (IMCL) e lipídios extramyocellular (EMCL) picos é obtida através deste método D: O espectro de 31 P MR do TA ratos mostra fosfocreatina (PCr), fosfato inorgânico (Pi), e os três. ressonâncias (α, β, γ) da adenosina 5'-trifosfato (ATP).
Discussão
"A lesão muscular" foi definido e medido de várias maneiras. Dano estrutural é evidente em achados histológicos 6,9, mas um problema com muitos dos marcadores biológicos utilizados para avaliar lesão muscular, incluindo aqueles usados em estudos com animais, é que eles normalmente não se correlacionam com a perda de força. Lesão muscular é geralmente definido dentro do contexto do ensaio utilizado para examiná-lo e não encontrar alguém pode explicar as alterações da contratilidade após a lesão. Como a função contrátil completa pode persistir apesar da presença de marcadores de lesão, perda de força pode ser a medida mais válida de lesão 3, e provavelmente o mais relevante.
É difícil estudar lesões musculares em humanos, como a incidência é um evento aleatório que é difícil de prever ea apresentação clínica varia muito. Portanto, grande parte dos dados sobre lesões musculares foram determinados com base em estudos em animais, que fornece controle sobre muitas variáveis e capacidade para estudar mecanismos de lesão e recuperação. A lesão no aparelho vivo temos descrito fornece um método para avaliar a função contrátil, sem dissecar o músculo, e, portanto, sem a necessidade de sacrificar o animal em estudo. Nosso modelo de lesão personalizados (patente pendente) é baseado nos mesmos princípios usados por outros para estabelecer a contração induzida por lesões em animais 5,12,15,24. Apesar da disponibilidade de modelos no mercado, há pouca instrução além do uso do hardware. Nosso modelo tem especificações em termos de gama disponível de movimento e velocidade angular que são vantajosas 17, mas nosso principal objetivo é compartilhar os métodos; tentamos descrever os procedimentos do início ao fim para a produção de uma lesão. Benefícios do modelo in vivo são que o músculo, anatomia e biomecânica não são alteradas e que o procedimento não é terminal. Usamos o mesmo local na tíbia para todas as medições de torque, seguindo os procedimentos sanitários e usando uma agulha estéril para cada medição. A perna pode ser estabilizado, sem a utilização de um pino transosseus, mas temos encontrado o pino a ser superior em termos de confiabilidade e eliminando movimentos estranhos durante as contrações alongamento.
O aparelho utilizado para medições de torque em vivo tem várias vantagens adicionais. Não envolve qualquer dissecação, por isso não há necessidade de sacrificar o animal em estudo. O resultado é que se pode medir a contratilidade no mesmo animal ao longo do tempo, e / ou in vivo com imagem, como ressonância magnética. Outras vantagens são que a anatomia normal não é alterada, o nervo não é ignorada para a estimulação (como por em preparações in vitro), eo músculo permanece em seu ambiente normal, portanto, os efeitos da inflamação, hormônios ou outros fatores podem ser estudados. Porque requer o uso de menos animais, cujos músculos são submetidos a manipulações menos (por exemplo, a dissecção antes do ensaio de função), nós preferimos usar as medições de torque, sempre que possível. O braço de momento da TA do mouse é conhecido 4 e o músculo pode ser avaliado quando o animal é sacrificado. Existem algumas limitações no entanto, em comparação com o isolamento do músculo. Por exemplo, é difícil saber o tamanho exato mudanças que ocorrem durante as contrações alongamento, e da massa muscular não pode ser medido até que seja colhida (embora possa ser estimado com base no volume medido através de ressonância magnética) 8.
Para determinar a "força específica" (força por unidade de área transversal) de um músculo individual, que o músculo precisa ser isolado e posicionado corretamente, o que também evita a transmissão de força dos músculos próximos 10. O aparelho em situ foi projetado para esta finalidade. Ela fornece uma alternativa para medir a contratilidade de apenas um músculo com um comprimento conhecido e massa. No entanto, este método também tem suas limitações. Embora o aparelho em situ permite um controle mais experimental para medir a força de um músculo individual, o trade-off é que a experiência se torna menos fisiológico. Em medições de força situ exigem uma liberação cirúrgica do músculo TA, que podem alterar a anatomia e afetar transmissão de força. O experimento também é terminal, de modo que o músculo não pode ser monitorado ao longo do tempo.
Tensor de difusão de imagem (DTI) é potencialmente um marcador mais sensível e mais cedo por lesão muscular que o padrão T2-weighted MRI. As variáveis obtidas com DTI, pelo menos, em outros tecidos como o cérebro (1), mostram uma resposta forte e rápida a danos, ao passo que o sinal T2 pode ter um período prolongado de mudar. DTI é baseada na medição da difusão aparente de água nos tecidos. A técnica DTI tem sido comparado a seção longitudinal reals do TA rato e tem sido demonstrado que as direções DTI realmente representam as direções da fibra muscular local no rato TA muscular 19.
MRS fornece informações sobre a composição química do músculo não-invasiva 12. Dependendo do núcleo observado, MRS permite a observação de fosfatos de alta energia (31 P MRS) ou lipídios (1 H MRS). 31 P MRS é uma ferramenta ideal para a investigação do metabolismo muscular, pois é não-invasivo e pode ser facilmente aplicada a estudos in vivo do músculo esquelético. Abordagens alternativas para o ensaio bioquímico de metabólitos no músculo situ, como a agulha de biópsia, pode dar superestima significativas reduções de Pi e PCr aparente de 1. Um modelo animal oferece a vantagem óbvia de usar uma lesão controlada e comparando em mudanças vivo MRS aos achados da bioquímica, morfologia e função do tecido. Mudanças no metabolismo de alta energia de fosfato são encontrados em doenças levando à degeneração muscular 2,20. PH intracelular, bem como a MR relações sinal intensidade Pi / PCr (fosfato inorgânico [Pi] para fosfocreatina [PCr]), e PDE / PCr (fosfodiéster [PDE] para PCr), pode fornecer informações valiosas sobre o estágio ea gravidade da degeneração muscular.
Divulgações
Agradecimentos
Os autores gostariam de agradecer ao Dr., Robert Bloch por sua generosa doação de laboratório espacial e instalações e Rao Dr. Gullapalli e Shi Da no Núcleo for Imaging translacional em Maryland (C-TRIM) ea Ressonância Magnética Research Center (MRRC) para suporte técnico. Este trabalho foi suportado por concessões para RML do National Institutes of Health (K01AR053235 e 1R01AR059179) e da Muscular Dystrophy Association (# 4278), e por uma doação para JAR da Fundação Jain.
Materiais
(Todo o equipamento é o mesmo para camundongos e ratos, exceto para a platina)
- Valor BUD Linha gabinete (Newark, 06M4718)
- Multifunções l / O USB-6221M (National Instruments, 779808-01)
- Controlador de motor de passo (Newark, 16M4189)
- Motor de passo (Newark, 16M4198)
- Amplificador Strain Gauge (Honeywell, Sensotec, DV-05)
- Torque Sensor (Honeywell, QWLC-8M)
- Placa de pé e um dispositivo de estabilização (custom made, patente pendente)
Referências
- Aldridge, R. Muscle pain after exercise is linked with an inorganic phosphate increase as shown by 31P. NMR. Biosci. Rep. 6, 663-663 (1986).
- Argov, Z., Lofberg, M., Arnold, D. L. Insights into muscle diseases gained by phosphorus magnetic resonance spectroscopy. Muscle Nerve. 23, 1316-1316 (2000).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J. Physiol. 488, 459-459 (1995).
- Burkholder, T. J. Relationship between muscle fiber types and sizes and muscle architectural properties in the mouse hindlimb. J. Morphol. 221, 177-177 (1994).
- Hakim, M. Dexamethasone and Recovery of Contractile Tension after a Muscle Injury. Clin. Orthop. Relat Res. 439, 235-235 (2005).
- Hamer, P. W. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J. Anat. 200, 69-69 (2002).
- Hammond, J. W. Use of Autologous Platelet-rich Plasma to Treat Muscle Strain Injuries. Am. J. Sports Med. , (2009).
- Heemskerk, A. M. Determination of mouse skeletal muscle architecture using three-dimensional diffusion tensor imaging. Magn Reson. Med. 53, 1333-1333 (2005).
- Ho, K. W. Skeletal muscle fiber splitting with weight-lifting exercise in rats. Am. J. Anat. 157, 433-433 (1980).
- Huijing, P. A., Baan, G. C. Myofascial force transmission causes interaction between adjacent muscles and connective tissue: effects of blunt dissection and compartmental fasciotomy on length force characteristics of rat extensor digitorum longus muscle. Arch. Physiol Biochem. 109, 97-97 (2001).
- Ingalls, C. P. Dihydropyridine and ryanodine receptor binding after eccentric contractions in mouse skeletal muscle. J. Appl. Physiol. 96, 1619-1619 (2004).
- Lee, D., Marcinek, D. Noninvasive in vivo small animal MRI and MRS: basic experimental procedures. J. Vis. Exp. , (2009).
- Lovering, R. M., Deyne, P. G. D. e Contractile function, sarcolemma integrity, and the loss of dystrophin after skeletal muscle eccentric contraction-induced injury. Am. J. Physiol Cell Physiol. 286, C230-C238 (2004).
- Lovering, R. M. The contribution of contractile pre-activation to loss of function after a single lengthening contraction. J. Biomech. 38, 1501-1501 (2005).
- Lovering, R. M. Recovery of function in skeletal muscle following 2 different contraction-induced injuries. Arch. Phys. Med. Rehabil. 88, 617-617 (2007).
- Provencher, S. W. Automatic quantitation of localized in vivo 1H spectra with LCModel. NMR Biomed. 14, 260-260 (2001).
- Roche, J. A., Lovering, R. M., Bloch, R. J. Impaired recovery of dysferlin-null skeletal muscle after contraction-induced injury in vivo. Neuroreport. 19, 1579-1579 (2008).
- Stone, M. R. Absence of keratin 19 in mice causes skeletal myopathy with mitochondrial and sarcolemmal reorganization. J. Cell Sci. 120, 3999-3999 (2007).
- Van Donkelaar, C. C. Diffusion tensor imaging in biomechanical studies of skeletal muscle function. J. Anat. 194, 79-79 (1999).
- Vogl, T. J. The value of in-vivo 31-phosphorus spectroscopy in the diagnosis of generalized muscular diseases. The clinical results and the differential diagnostic aspects. Rofo. 162, 455-455 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados