Method Article
Une In vivo de contraction induite par des blessures et de surveillance non invasive de récupération
Dans cet article
Résumé
Une In vivo de blessure est décrite. La méthode tire parti de la position sous-cutanée du nerf fibulaire. Velocity, le calendrier de l'activation des muscles, et l'arc de mouvement sont tous pré-déterminée et synchronisée à l'aide de logiciels commerciaux. Changements après la lésion sont surveillés In vivo En utilisant l'IRM / spectroscopie.
Résumé
Souches musculaires sont l'une des plaintes les plus fréquemment traitées par les médecins. Une blessure musculaire est généralement diagnostiquée par les antécédents du patient et l'examen physique seul, cependant la présentation clinique peut varier considérablement en fonction de l'étendue de la blessure, tolérance à la douleur du patient, etc Chez les patients avec une lésion musculaire ou une maladie musculaire, l'évaluation des dommages musculaires est généralement limités à des signes cliniques, comme la tendresse, la force, l'amplitude du mouvement, et plus récemment, des études d'imagerie. Les marqueurs biologiques, tels que les taux sériques de créatine kinase, sont généralement élevée avec une lésion musculaire, mais leurs niveaux ne sont pas toujours en corrélation avec la perte de production de force. Cela est vrai même des résultats histologiques à partir d'animaux, qui fournissent une «mesure directe" de dégâts, mais ne tiennent pas compte de tous la perte de fonction. Certains ont soutenu que la mesure la plus complète de la santé globale du muscle de la force contractile. Parce blessure musculaire est un événement aléatoire qui se produit sous une variété de conditions biomécaniques, il est difficile à étudier. Ici, nous décrivons un modèle animal in vivo pour mesurer le couple et de produire une blessure musculaire fiable. Nous décrivons également notre modèle pour la mesure de la force d'un muscle isolé in situ. Par ailleurs, nous décrivons notre procédure de petit animal par IRM.
Protocole
1. Dans le modèle in vivo et des blessures de mesure de couple isométrique.
- Ces procédures peuvent être utilisées pour les rats ou les souris 7,17,18. Pour commencer, placez le dos des animaux sous anesthésie par inhalation (~ 4-5% d'isoflurane pour l'induction dans une chambre d'induction, alors ~ 2% d'isoflurane via un coiffe pour la maintenance) à l'aide d'un vaporisateur de précision (cat # 91103, Vet Equip, Inc, Pleasanton , CA). Appliquez la crème ophtalmique stérile (pommade Vet Paralube, PharmaDerm, Floham Park, NJ) pour chaque œil afin de protéger les cornées de sécher. Durant la procédure, l'animal est gardé au chaud par l'utilisation d'une lampe chauffante placée à l'extérieur de la cage et conservés au moins 6 pouces de l'animal à tout moment.
- Préparation de la peau en éliminant les cheveux et en nettoyant avec une alternance des gommages bétadine et 70% d'alcool pour empêcher les bactéries de peau d'ensemencement dans les tissus mous ou les os. Confirmer l'anesthésie adéquate par le manque d'un réflexe tendineux (pas de retrait du pied en réponse à pincer le pied). Une aiguille est placé manuellement à travers le tibia proximal afin de stabiliser la jambe sur le banc (25G ou 27G pour les souris). L'aiguille ne doit pas entrer dans la loge antérieure de la jambe.
- Verrouiller l'aiguille dans une position fixe, tels que l'animal est en position couchée et les orteils sont confrontés à la verticale. Un dispositif sur mesure est utilisé pour sécuriser l'aiguille et ainsi stabiliser la jambe.
- Placez le pied de la jambe sur un repose-pieds personnalisée-usinées (figure 1). L'axe de la platine est connectée à un moteur pas à pas (modèle T8904, NMB Technologies, Chatsworth, CA) et un capteur de couple (modèle QWFK-8M, Sensotec, Columbus, OH). Le pied doit d'abord être alignés de manière qu'il est orthogonale au tibia, comme dans la Figure 1.
- Utiliser des électrodes transcutanées (723742, Harvard Apparatus, Cambridge, MA) ou d'électrodes sous-cutanées (J05 Aiguilles électrode aiguille, 36BTP, alimentation de l'électrode Jari, Gilroy, CA) pour stimuler le nerf fibulaire près du col du péroné, où le nerf se trouve dans un la position superficielle. Confirmer visuellement la dorsiflexion isolés en effectuant une série de tics (0,1 ms d'impulsion pour la souris et 1 impulsion ms pour le rat) avant que le pied est garanti. Une fois que le pied est fixé à la platine avec du ruban adhésif, une augmentation de l'amplitude contraction en réponse à une augmentation de la tension confirme que les muscles opposés (plantaires) ne sont pas simultanément stimulés.
- Avant de blessures et à des moments choisis après une blessure, la force maximale capacité de production de l'dorsifléchisseurs est enregistré comme le «couple isométrique" (couple sans un changement dans la longueur du muscle). Mesures de couple sont réalisées sur la plate-forme même qui est utilisé pour induire des blessures. Avant l'enregistrement maximale de couple isométrique, l'amplitude d'impulsion est ajusté afin d'optimiser la tension et la contraction de la position optimale de la cheville est déterminée en donnant tics à différentes longueurs de l'dorsifléchisseurs. Après l'obtention d'une courbe de couple-angle pour déterminer la durée optimale de l'dorsifléchisseurs (longueur de repos, alias Lo), une parcelle de fréquence de couple est obtenue en augmentant progressivement la fréquence des impulsions pendant un train d'impulsions de 200 ms. Une contraction tétanique maximale est obtenue en général fondus à 90-100 Hz. Trois secousses séparées et des contractions tétaniques sont enregistrées et sauvegardées pour une analyse ultérieure.
- Utiliser un logiciel commercial d'(Labview version 8.5 de National Instruments, Austin, TX) pour synchroniser l'activation contractile, l'apparition de la rotation de la cheville, et un couple de collecte de données. La stimulation des muscles fléchisseur survient alors que le moteur commandé par ordinateur déplace simultanément la platine en flexion plantaire, conduisant ainsi à une contraction allongement (appelé aussi «excentrique» de contraction, ce qui provoque des lésions du muscle). Le protocole spécifique dépend de l'ampleur souhaitée de blessure souhaités par l'enquêteur. L'ampleur des blessures ou des dommages aux tissus, peut être régulée par la manipulation de variables telles que la vitesse angulaire, le moment de l'activation musculaire, l'amplitude du mouvement, et le nombre de contractions allongement.
- Pour induire des blessures, superposer une contraction allongement sur une contraction maximale isométrique, variant l'amplitude du mouvement, la vitesse d'allongement, et le calendrier de la stimulation nécessaire. Par exemple, une contraction isométrique maximale est obtenue dans le dorsifléchisseurs et après 200 ms, ils sont allongés à une vitesse choisie pour le mouvement normal approximative (900 ° / sec). Nous avons précédemment montré que l'activation avant que le mouvement et le degré d'allongement sont des facteurs importants dans l'obtention d'une blessure 14. La majorité du couple produit par le dorsifléchisseurs est de la TA 11 et nous avons montré précédemment que ce modèle se traduit par des blessures de ce muscle 5,13-15. Le TA reste stimulée à travers l'allongement.
- Après une blessure, l'animal est retiré de l'appareil. La broche tibiale estenlevé, la jambe est nettoyée à nouveau, et l'animal est retourné à la cage (placé sur un bloc de chauffage à température contrôlée à 37 ° C) et surveillés jusqu'à la guérison. Cela inclut d'attendre que l'animal est éveillé et mobile. Les animaux souffrent pas de douleur observable lors de la procédure et il n'ya aucun changement visible dans la démarche (boiterie par exemple) après une blessure provoquée par des contractions allongement. Toutefois, des autorités anti-douleur le traitement est administré par la suite (buprénorphine 0,05 à 0,1 mg / kg toutes les 12 heures pendant 48 h après la chirurgie).
2. Dans la mesure in situ de la tension musculaire tout entier.
- L'animal est préparé et le tibia est stabilisé tel que décrit ci-dessus dans la section 1.1 à 1.3. Tous les instruments est allumé au moins 30 min avant le test pour le calibrage correct et pour minimiser la dérive thermique du capteur de force.
- Inciser la peau la partie antérieure de la cheville et de rompre le tendon du muscle jambier antérieur (TA). Soigneusement cravate de soie 4,0 Ethicon non résorbable au tendon et attacher le fil de suture vicryl à la cellule de charge fournis via le crochet en S (poids = 0,1 g), le modèle FT03, Instruments Grass, Providence, RI). Alternativement, une pince sur mesure (poids = 0,5 g) peut être utilisé pour attacher le tendon à la suture Vicryl (figure 2).
- Le capteur est monté sur un micromanipulateur (Manipulateur Kite, World Precision Instruments Inc, Sarasota, Floride) afin que le TA pourrait être ajusté à la longueur au repos et alignés correctement (une ligne droite de la traction entre l'origine et insertion). Le TA est protégée contre le refroidissement par une lampe de chaleur et de déshydratation par l'huile minérale. Les signaux de la cellule de charge (calibré avant chaque test) sont alimentés par un amplificateur DC (modèle P122, Instruments Grass, Providence, RI) pour un A / D du conseil d'être collectées et stockées par le logiciel d'acquisition (Polyview version 2.1, Instruments Herbe , Providence, RI).
- Fixez le TA à la cellule de charge et d'appliquer tics simples (impulsion rectangulaire de 1 ms) à des longueurs musculaires différents afin de déterminer L 0. La longueur du muscle au repos, mesurée à l'aide des étriers, est définie comme la distance entre la tubérosité tibiale et de la jonction myotendineuse. Lors de cette longueur, augmenter progressivement l'amplitude d'impulsion puis la fréquence des impulsions d'établir une relation force-fréquence. Une contraction maximale est obtenue fusionné tétaniques à environ 90-100Hz (300 ms durée du train composé de 0,1 ms ou 1 ms impulsions). Utiliser 150% de l'intensité de la stimulation maximale pour activer la TA afin d'induire l'activation maximale contractiles (P 0). Maximale des contractions tétaniques peuvent être effectuées à plusieurs reprises et exprimé en pourcentage de P 0, fournissant un indice de fatigue, à tout moment souhaité.
3. In vivo par IRM et / ou spectroscopie des muscles squelettiques des rongeurs.
Toutes les IRM et SRM est effectuée sur un Bruker Biospin (Boston, MA) 7,0 Tesla système équipé d'un insert de 12 cm de gradient (660 mT / m au maximum du gradient, 4570 T / m / s vitesse de balayage maximale) fonctionnant Paravision 5.0 du logiciel.
- L'animal est anesthésié avec vaporisé isoflurane comme décrit ci-dessus en 1.1. Un système compatible avec la RM de petits animaux de surveillance et de déclenchement (SA Instruments, Inc) est utilisé pour surveiller le taux de respiration et la température corporelle. La température du corps de la souris est maintenue à 36-37 ° C en utilisant un circulateur d'eau chaude. Un titulaire de sur-mesure est utilisée pour placer la souris dans la position couchée avec les deux jambes parallèles à l'alésage de l'aimant du genou à pied. Une bobine de quatre canaux de surface de réception seule est placé dans une 1H 72 mm linéaires résonateur. La bobine résonateur est réglé et adapté à l'échantillon.
- IRM: Après localisateurs, les scans suivants MR sont effectuées: T1 acquisition rapide avec l'amélioration de relaxation (RARE) avec les paramètres suivants: TE = 9,52 ms, TR = 1800, la longueur du train d'écho = 4, dans le plan résolution 100x100 um , et l'épaisseur de coupe = 750 um. Double-écho PD/T2 RARE: TE = 19.0/57.1 ms, TR = 5000 ms, la longueur du train d'écho = 4, dans le plan résolution 100x100 um, et l'épaisseur de coupe = 750 um. Écho de spin (SE) du tenseur de diffusion des données d'image en utilisant 12 non colinéaires directions: valeur b = 350 s / mm -2, TE = 26 ms, TR = 4500 ms, dans le plan résolution 150x150 um, et l'épaisseur de coupe = 750 um . Multi-coupes multi-echo (MPME) T2 données de cartographie paramétrique en utilisant 16 TE = 11,4 ms à 182,5 ms avec ΔTE = épaisseur 11,4 ms, TR = 10000 ms, dans le plan résolution 150x150 um, et la tranche = 750 um.
- Traitement d'image: la reconstruction du tenseur de diffusion et tractographie est réalisée en utilisant TrackVis (Martinos Centre d'Imagerie Biomédicale, Massachusetts General Hospital, Boston, MA) pour créer la diffusivité moyenne (DM), fraction d'anisotropie (FA) d'images ainsi que des cartes tractographie. Cartographie T2 est réalisée en utilisant un logiciel personnalisé écrit dans MAT LAB (The Mathworks, Natick, MA) à l'aide non-linéaire des moindres carrés pour ajuster les données mesurées à chaque pixel de l'équation du signal T2 canonique. Régions de mesures d'intérêt sont effectuées pour évaluer les valeurs des paramètres au sein de l'AT.
- 1H spectroscopie: calage automatique est effectué sur un 1 x 1 x 4 mm 3 voxel dans l'AT. Un point de spectroscopie résolue (PRESSE) séquence d'impulsions (TR / TE = 2000/18 ms) est utilisé pour acquérir des spectres de la même voxel 1024 moyennes. L'acquisition des données est de 34 minutes sur chaque jambe. Les données spectrales sont traitées en utilisant le package LCModel 16. 31P spectroscopie: Une bobine double écoute de surface (1H, 31P) est utilisé pour effectuer non localisées (à l'aide d'une expérience unique d'impulsions) ou la spectroscopie localisée en utilisant l'image sélectionnée spectroscopie in vivo (ISIS) séquence d'impulsions.
4. La récolte et le stockage des muscles.
AT sont récoltés après la fin des expériences, pesé, snap congelés dans l'azote liquide, puis stockés à -80 ° C. Ceci peut être effectué à tout moment après les expériences in vivo. Les muscles sont récoltées immédiatement après la expérimentations in situ, comme il s'agit d'une procédure terminale. Pour le détail des études morphologiques, l'animal est fixé avec du paraformaldéhyde 4% par perfusion à travers le ventricule gauche.
5. Les résultats représentatifs.
La figure 3 montre des données représentatives d'un rat dans l'appareil en vivo L'appareil in vivo est utilisée pour obtenir un couple maximal généré par les muscles fléchisseur;. Il est aussi utilisé pour induire des blessures à ces mêmes muscles. En raison de la relation longueur-tension des muscles, le couple maximal isométrique se produit généralement lorsque la cheville est positionnée à environ 20 ° de flexion plantaire (avec le pied placé orthogonale au tibia considérée comme 0 °). Après maximale de couple isométrique est obtenue, le pied peut alors être placé dans n'importe quelle position pour commencer le protocole blessure. La figure 3 représente un protocole blessures de 30 répétitions avec un arc de mouvement de 0 ° - 70 °. Notez la baisse constante de couple généré par la phase isométrique (flèche pleine) et la phase de prolongation (flèche ouverte) lors de la contraction induite par le protocole blessure. Le couple est enregistrée dans les unités de NMM, mais la valeur absolue dépend de la taille de l'animal et son état (par exemple, le muscle blessé, muscle fatigué, ou musculaires manquait une certaine protéine due à la recombinaison homologue).
La figure 4 montre des données représentatives d'un rat dans l'appareil en place. Notre situ dans des appareils ne comportent pas des contractions allongement, mais plutôt nous permet d'isoler, d'aligner correctement, et de mesurer la tension maximale produite par un muscle individuel à une longueur connue. La figure 4 montre la perte progressive de la force qui survient lors d'un essai de fatigue dans un muscle tibial antérieur d'un rat. Dans cet exemple particulier, les contractions titanesques ont été effectuées une fois par seconde pendant 5 minutes. La tension (force) est généralement enregistrée en newtons (ou grammes), mais comme un couple, la valeur absolue dépend de la taille et l'état de l'animal. Parce que le poids du muscle est obtenue immédiatement après cette procédure, la force ne peut être normalisée (appelée "force spécifique») pour l'aire transversale de muscle.
La figure 5 montre les données représentatives de l'imagerie in vivo de souris, telles que la cartographie paramétrique pondérées en T1 et T2 (A), tractographie 3D à partir de Diffusion Tensor Imaging (B), 1 H spectroscopie (C), et 31 spectroscopie P. Des détails sont fournis dans la légende de la figure.

Figure 1: dans l'appareil vivo .* Pour produire la blessure, le tibia est stabilisé et le pied attaché à une plaque de moteur. Le dorsifléchisseurs cheville sont stimulés par l'intermédiaire du nerf fibulaire tandis que le platine forces du pied en flexion plantaire (flèche en pointillés).
* Lovering & De Deyne, biomécanique J 2005, utilisé avec permission.

Figure 2: Dans le dispositif in situ Le capteur est monté sur un micromanipulateur pour que le TA pourrait être ajusté à la longueur au repos et alignés correctement dans le X, Y et Z. Le tendon distal du TA est attaché à la cellule de charge et de tics simples sont induits à des longueurs musculaires différents afin de déterminer L 0. Une contraction tétanique maximale est obtenue pour déterminer l'activation maximale contractiles (P 0). Maximale de tension tétanique peuvent être effectuées à plusieurs reprises et exprimé en pourcentage de P 0, fournissant un indice de fatigue à un moment souhaité.
782/2782fig3.jpg "alt =" Figure 3 "/>
Figure 3: les données de couple à partir des enregistrements appareil vivo traces Représentant du couple de l'allongement des contractions chez le rat. Dans cet exemple particulier, les muscles ont été stimulées pendant 200 millisecondes pour induire une contraction isométrique maximale (flèche pleine) avant allongement (flèche ouverte) par la platine sur un arc de 70 ° de mouvement à une vitesse angulaire de 900 ° / s.

Figure 4: les données de tension à partir de données in situ représentant un appareil montrant la baisse de la tension maximale isométrique tétaniques pendant la stimulation répétée du muscle tibial antérieur (TA) chez un rat. Dans cet exemple, le TA a été isolé, ajustée à la longueur optimale (L 0), puis stimulées par une contraction de 200 ms tétaniques une fois par seconde pendant 5 minutes.
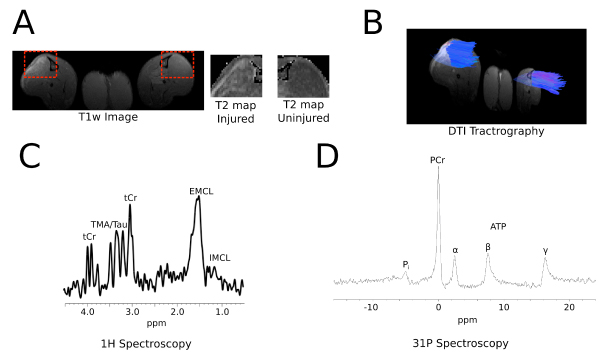
Figure 5: l'imagerie in vivo A: Les images montrent transversale (axiale) des sections de la cartographie paramétrique pondérées en T1 et T2 du muscle tibial antérieur (TA). La boîte rouge pointillée entoure le TA de montrer augmenté augmenté T2 dans la blessés (côté gauche) versus indemne (côté droit) B:.. Représentant tractographie 3D à partir de Diffusion Tensor Imaging (DTI) C: Le spectre 1 H d'un TA de souris montre plusieurs résonances lipidique détectable; différenciation entre intramyocellulaires (IMCL) et extramyocellular lipides (CELV) pics est obtenue en utilisant cette méthode D: Le P 31 MR spectre de la TA chez le rat montre phosphocréatine (PCr), le phosphate inorganique (Pi), et les trois. résonances (α, β, γ) de l'adénosine 5'-triphosphate (ATP).
Discussion
«Une atteinte musculaire» a été défini et mesuré de plusieurs façons. Les dégâts structurels est évidente dans les résultats histologiques 6,9, mais un problème avec la plupart des marqueurs biologiques utilisés pour évaluer les blessures musculaires, y compris ceux utilisés dans les études animales, c'est qu'ils ne sont généralement pas en corrélation avec la perte de la force. Une atteinte musculaire est souvent définie dans le contexte de l'analyse utilisée pour l'examiner et aucune conclusion ne peut rendre compte de l'évolution de la contractilité après une blessure. Depuis pleine fonction contractile peut persister malgré la présence de marqueurs blessure, perte de force peut être la mesure la plus valable des blessures 3, et probablement la plus pertinente.
Il est difficile d'étudier les blessures musculaires chez l'homme, que l'incidence est un événement aléatoire qui est difficile à prévoir et la présentation clinique est très variable. Par conséquent la plupart des données concernant les blessures musculaires ont été vérifiés à partir d'études sur les animaux, ce qui permet de contrôler de nombreuses variables et la possibilité d'étudier les mécanismes de blessure et de récupération. L'appareil des blessures in vivo que nous avons décrite fournit une méthode pour évaluer la fonction contractile du muscle, sans dissection, et donc sans la nécessité d'euthanasier l'animal à l'étude. Notre modèle de blessure conçu sur mesure (brevet en instance) est basé sur les mêmes principes utilisés par d'autres pour établir la contraction induite par des blessures chez les animaux 5,12,15,24. Malgré la disponibilité des modèles sur le marché, il ya peu d'instruction au-delà l'utilisation du matériel. Notre modèle a des spécifications en termes de l'amplitude du mouvement et de vitesse angulaire qui sont avantageuses 17, mais notre objectif principal est de partager les méthodes, nous avons essayé de décrire les procédures de bout en bout pour la production d'une blessure. Avantages du modèle in vivo sont que le muscle, l'anatomie et la biomécanique ne sont pas modifiées et que la procédure n'est pas terminal. Nous utilisons le même emplacement dans le tibia pour toutes les mesures de couple, en suivant les procédures sanitaires et à l'aide d'une aiguille stérile pour chaque mesure. La jambe peut être stabilisée sans l'utilisation d'une broche transosseus, mais nous avons trouvé la broche d'être supérieurs en termes de fiabilité et d'éliminer les mouvements parasites pendant les contractions allongement.
L'appareil utilisé pour les mesures in vivo couple a plusieurs autres avantages. Elle n'implique aucune dissection, il n'ya donc pas besoin d'euthanasier l'animal à l'étude. Le résultat est que l'on peut mesurer la contractilité dans le même animal au cours du temps, et / ou avec l'imagerie in vivo, comme l'IRM. D'autres avantages sont que l'anatomie normale n'est pas altérée, le nerf n'est pas contournée pour la stimulation (comme pour les préparations in vitro), et le muscle reste dans son environnement normal, donc les effets de l'inflammation, des hormones ou d'autres facteurs peuvent être étudiés. Parce qu'il nécessite l'utilisation de moins d'animaux, dont les muscles sont soumis à moins de manipulations (par exemple, la dissection avant le dosage de la fonction), nous préférons utiliser les mesures de couple dès que possible. Le bras de levier du TA de souris est connue 4 et le muscle peut être pesée lorsque l'animal est sacrifié. Il ya quelques limitations cependant, par rapport à isoler le muscle. Par exemple, il est difficile de connaître la longueur exacte des changements qui se produisent lors des contractions allongement, et la masse musculaire ne peut être mesuré jusqu'à ce qu'elle soit récoltée (même si elle peut être estimée en fonction du volume mesuré par IRM) 8.
Pour déterminer la «force spécifique" (force par unité de section transversale) d'un muscle individuel, que le muscle a besoin d'être isolés et positionnés correctement, ce qui évite aussi la transmission de la force des muscles à proximité 10. La situ dans un appareil a été conçu à cet effet. Il offre une alternative pour mesurer la contractilité d'un seul muscle avec une longueur connue et de masse. Cependant, cette méthode a trop limites. Bien que le dispositif en place permet un contrôle plus expérimentale pour mesurer la force d'un muscle individuel, le compromis est que l'expérience devient moins physiologiques. Dans les mesures in situ nécessitent une force de libération chirurgicale du muscle TA, qui peuvent modifier l'anatomie et affectent transmission de force. L'expérience est aussi terminal, de sorte que le muscle ne peut pas être contrôlée dans le temps.
Diffusion Tensor Imaging (DTI) est potentiellement un marqueur sensible et encore plus tôt pour les dommages musculaires que la norme IRM pondérées en T2. Les variables obtenues avec le DTI, au moins dans d'autres tissus comme le cerveau (1), montrent une réponse forte et rapide des dommages, alors que le signal T2 peut prendre une période prolongée de changer. DTI est basée sur la mesure de la diffusion apparente de l'eau dans les tissus. La technique de la DTI a été comparé à la section longitudinale réelles du TA chez le rat et il a été montré que les directions locales DTI représentent réellement les directions des fibres musculaires chez le rat TA musculaires 19.
MRS fournit des informations sur la composition chimique des muscles de manière non invasive 12. Selon le noyau observé, MRS permet l'observation des phosphates à haute énergie (31 P MRS) ou de lipides (1 H MRS). 31 P MRS est un outil idéal pour l'enquête sur le métabolisme musculaire, car elle est non invasive et peut être facilement appliquée à des études in vivo du muscle squelettique. Des approches alternatives à l'dosage biochimique des métabolites dans les muscles in situ, comme la biopsie, peut donner une surestimation significative de la réduction apparente de Pi et PCR 1. Un modèle animal offre l'avantage évident d'utiliser une blessure contrôlée et la comparaison des changements MRS vivo aux résultats de la biochimie, la morphologie et la fonction du tissu. Les changements dans le métabolisme du phosphate à haute énergie sont rencontrés dans les maladies conduisant à la dégénérescence musculaire, 2,20. PH intracellulaire, ainsi que les ratios d'intensité du signal MR Pi / PCr (inorganique phosphate [Pi] pour phosphocréatine [PCR]), et PDE / PCr (phosphodiester [PDE] à la PCR), peuvent fournir de précieuses informations concernant le stade et la gravité des dégénérescence musculaire.
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier le Dr Robert Bloch pour sa généreuse donation du laboratoire de l'espace et les installations et le Dr Rao Gullapalli et Da Shi dans le noyau pour l'imagerie translationnelle au Maryland (C-TRIM) et le Centre de recherche en résonance magnétique (MRRC) pour le soutien technique. Ce travail a été soutenu par des subventions pour RML des National Institutes of Health (K01AR053235 et 1R01AR059179) et de la Muscular Dystrophy Association (# 4278), et par une subvention au JAR de la Fondation Jain.
matériels
(Tout le matériel est le même pour les souris et les rats à l'exception du platine)
- BUD Value Line Cabinet (Newark, 06M4718)
- Multifonctions I / O USB-6221M (National Instruments, 779808-01)
- Contrôleur de moteur (Newark, 16M4189)
- Moteur pas à pas (Newark, 16M4198)
- Strain Gauge Amplifier (Honeywell, Sensotec, DV-05)
- Capteur de couple (Honeywell, QWLC-8M)
- Plaque de pied et de dispositif de stabilisation (sur mesure, en attente de brevet)
Références
- Aldridge, R. Muscle pain after exercise is linked with an inorganic phosphate increase as shown by 31P. NMR. Biosci. Rep. 6, 663-663 (1986).
- Argov, Z., Lofberg, M., Arnold, D. L. Insights into muscle diseases gained by phosphorus magnetic resonance spectroscopy. Muscle Nerve. 23, 1316-1316 (2000).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J. Physiol. 488, 459-459 (1995).
- Burkholder, T. J. Relationship between muscle fiber types and sizes and muscle architectural properties in the mouse hindlimb. J. Morphol. 221, 177-177 (1994).
- Hakim, M. Dexamethasone and Recovery of Contractile Tension after a Muscle Injury. Clin. Orthop. Relat Res. 439, 235-235 (2005).
- Hamer, P. W. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J. Anat. 200, 69-69 (2002).
- Hammond, J. W. Use of Autologous Platelet-rich Plasma to Treat Muscle Strain Injuries. Am. J. Sports Med. , (2009).
- Heemskerk, A. M. Determination of mouse skeletal muscle architecture using three-dimensional diffusion tensor imaging. Magn Reson. Med. 53, 1333-1333 (2005).
- Ho, K. W. Skeletal muscle fiber splitting with weight-lifting exercise in rats. Am. J. Anat. 157, 433-433 (1980).
- Huijing, P. A., Baan, G. C. Myofascial force transmission causes interaction between adjacent muscles and connective tissue: effects of blunt dissection and compartmental fasciotomy on length force characteristics of rat extensor digitorum longus muscle. Arch. Physiol Biochem. 109, 97-97 (2001).
- Ingalls, C. P. Dihydropyridine and ryanodine receptor binding after eccentric contractions in mouse skeletal muscle. J. Appl. Physiol. 96, 1619-1619 (2004).
- Lee, D., Marcinek, D. Noninvasive in vivo small animal MRI and MRS: basic experimental procedures. J. Vis. Exp. , (2009).
- Lovering, R. M., Deyne, P. G. D. e Contractile function, sarcolemma integrity, and the loss of dystrophin after skeletal muscle eccentric contraction-induced injury. Am. J. Physiol Cell Physiol. 286, C230-C238 (2004).
- Lovering, R. M. The contribution of contractile pre-activation to loss of function after a single lengthening contraction. J. Biomech. 38, 1501-1501 (2005).
- Lovering, R. M. Recovery of function in skeletal muscle following 2 different contraction-induced injuries. Arch. Phys. Med. Rehabil. 88, 617-617 (2007).
- Provencher, S. W. Automatic quantitation of localized in vivo 1H spectra with LCModel. NMR Biomed. 14, 260-260 (2001).
- Roche, J. A., Lovering, R. M., Bloch, R. J. Impaired recovery of dysferlin-null skeletal muscle after contraction-induced injury in vivo. Neuroreport. 19, 1579-1579 (2008).
- Stone, M. R. Absence of keratin 19 in mice causes skeletal myopathy with mitochondrial and sarcolemmal reorganization. J. Cell Sci. 120, 3999-3999 (2007).
- Van Donkelaar, C. C. Diffusion tensor imaging in biomechanical studies of skeletal muscle function. J. Anat. 194, 79-79 (1999).
- Vogl, T. J. The value of in-vivo 31-phosphorus spectroscopy in the diagnosis of generalized muscular diseases. The clinical results and the differential diagnostic aspects. Rofo. 162, 455-455 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon