Method Article
Ein In vivo Nager-Modell der Kontraktion-induzierte Verletzung und nicht-invasive Überwachung von Recovery
In diesem Artikel
Zusammenfassung
Ein In vivo Tiermodell der Verletzung ist beschrieben. Die Methode nutzt die subkutane Lage des N. peronaeus. Velocity, Zeitpunkt der Muskelaktivität und Bogen der Bewegung sind alle vorher festgelegten und synchronisiert mit kommerzieller Software. Beitrag Verletzungen Änderungen werden überwacht In vivo Mit der MR-Bildgebung / Spektroskopie.
Zusammenfassung
Muskelzerrungen sind eine der häufigsten Beschwerden von Ärzten behandelt. Eine Muskelverletzung in der Regel aus der Anamnese und körperliche Untersuchung allein diagnostiziert, aber die klinische Präsentation kann variieren stark je nach dem Ausmaß der Verletzung, die Schmerzen des Patienten Toleranz, etc. Bei Patienten mit Muskel-Verletzungen oder Muskelerkrankungen, die Beurteilung der Schädigung der Muskulatur ist in der Regel um die klinischen Symptome, wie Zärtlichkeit, Kraft, Beweglichkeit, und in jüngerer Zeit, bildgebende Verfahren beschränkt. Biologische Marker, wie zB Serum-Kreatin-Kinase-Ebenen werden in der Regel mit Muskelverletzungen erhöht, aber ihre Werte nicht immer mit dem Verlust von Kraft Produktion korrelieren. Dies gilt auch für histologische Befunde von Tieren, die eine "direkte Maßnahme" des Schadens, aber nicht für alle der Verlust der Funktion Konto. Manche haben argumentiert, dass das umfassendste Maß für die allgemeine Gesundheit des Muskels in kontraktilen Kraft. Da Muskelverletzung ist ein zufälliges Ereignis, dass unter einer Vielzahl von biomechanischen Bedingungen auftritt, ist es schwer zu untersuchen. Hier beschreiben wir eine In-vivo-Tiermodell, um das Drehmoment zu messen und eine zuverlässige Muskelverletzung zu produzieren. Wir beschreiben auch unser Modell zur Messung der Kraft von einem isolierten Muskel in situ. Außerdem beschreiben wir unseren Kleintiere MRT-Verfahren.
Protokoll
1. In-vivo-Modell Verletzungen und die Messung der isometrischen Drehmoment.
- Diese Verfahren können für Ratten oder Mäuse 7,17,18 verwendet werden. Um zu beginnen, statt das Tier in Rückenlage unter Inhalationsnarkose (~ 4-5% Isofluran für die Induktion in einer Induktion Kammer, dann ~ 2% Isofluran über eine Nasenkonus für Wartung) mit einer Präzisions-Verdampfer (cat # 91103, Vet Anlegen, Inc, Pleasanton , CA). Bewerben sterile ophthalmologische Creme (Paralube Vet-Salbe, PharmaDerm, Floham Park, NJ) für jedes Auge die Hornhaut vor dem Austrocknen zu schützen. Während des Verfahrens ist das Tier warm gehalten und durch die Verwendung einer Wärmelampe außerhalb des Käfigs platziert gehalten mindestens 6 cm von dem Tier zu allen Zeiten.
- Prep die Haut durch Entfernen von Haaren und durch die Reinigung mit wechselnden scrubs von betadine und 70% Alkohol Aussaat Haut Bakterien in die Weichgewebe oder Knochen zu verhindern. Überprüfen Sie die Narkose durch den Mangel an einer tiefen Sehnenreflexe (kein Fuß Rückzug als Reaktion auf das Einklemmen des Fußes). Eine Nadel wird manuell durch den proximalen Tibia platziert, um das Bein auf den Prüfstand (25G oder 27G für Maus) zu stabilisieren. Die Nadel sollte nicht in das vordere Kompartiment des Beines.
- Verriegeln Sie die Nadel in einer festen Position, so dass das Tier in Rückenlage und die Zehen sind gerade nach oben konfrontiert ist. Ein maßgeschneidertes Gerät verwendet wird, um die Nadel zu sichern und stabilisieren dadurch das Bein.
- Setzen Sie den Fuß des Beins auf einem speziell bearbeiteten Fußplatte (Abbildung 1). Die Achse der Fußplatte ist mit einem Schrittmotor (Modell T8904, NMB Technologies, Chatsworth, CA) und ein Drehmoment-Sensor angeschlossen (Modell QWFK-8M, Sensotec, Columbus, OH). Der Fuß sollte zunächst so, dass sie senkrecht auf die Tibia ausgerichtet werden, wie in Abbildung 1.
- Verwenden Sie transkutane Elektroden (723.742, Harvard Apparatus, Cambridge, MA) oder subkutane Elektroden (J05 Nadelelektrode Needles, 36BTP, Jari Electrode Supply, Gilroy, CA), um den N. peronaeus in der Nähe des Halses der Fibula, wo der Nerv liegt in einem regen oberflächliche Lage. Optisch bestätigen isolierten Dorsalflexion, indem Sie eine Reihe von Zuckungen (0,1 ms Impuls für die Maus und 1 ms Impuls für die Ratte), bevor der Fuß befestigt ist. Sobald der Fuß auf der Fußplatte mit Klebeband gesichert, bestätigt eine Zunahme der twitch Amplitude in Reaktion auf eine Erhöhung der Spannung, die entgegengesetzten Muskeln (Plantarflexoren) sind nicht gleichzeitig stimuliert.
- Vor Verletzungen und an ausgewählten Zeitpunkten nach einer Verletzung, ist die maximale Kraft, die Kapazität der Dorsalflexoren als "maximale isometrische Drehmoment" (Drehmoment ohne eine Änderung der Muskellänge) zu verzeichnen. Drehmoment-Messungen basieren auf der gleichen rig, die verwendet werden, um Verletzungen zu induzieren durchgeführt wird. Vor der Aufnahme maximale isometrische Drehmoment, die Pulsamplitude eingestellt zu zucken Spannung und die optimale Position des Sprunggelenks optimieren, indem sie zuckt bei verschiedenen Längen der Dorsalflexoren bestimmt. Nach Erhalt eines Drehmoment-Winkel-Kurve auf die optimale Länge der Dorsalflexoren (Ruhelänge, aka Lo) zu bestimmen, wird ein Drehmoment Frequenz Grundstück durch die schrittweise Erhöhung der Frequenz der Impulse während eines 200 ms Impulsfolge erhalten. Eine maximale verschmolzen tetanische Kontraktion ist in der Regel bei 90-100 Hz erhalten. Drei separate Zuckungen und tetanische Kontraktionen werden aufgezeichnet und gespeichert für weitere Analysen.
- Verwenden Sie kommerzielle Software, um (Labview Version 8.5, National Instruments, Austin, TX) zu kontraktilen Aktivierung Beginn der Knöchel Rotation und Drehmoment Datensammlung zu synchronisieren. Die Stimulation der Dorsalextensoren auftritt, während der Computer-gesteuerten Motor bewegt sich gleichzeitig der Fußplatte in Plantarflexion, was zu einer Verlängerung Kontraktion (auch als "exzentrisch" Kontraktion, die Verletzung des Muskels verursacht). Die spezifische Protokoll hängt von der gewünschten Größenordnung von Verletzungen durch den Prüfarzt gewünscht. Das Ausmaß der Verletzungen oder Gewebeschäden können durch Manipulation von Variablen wie Winkelgeschwindigkeit, Zeitpunkt der Muskelaktivität, Beweglichkeit, und die Zahl der Verlängerung Kontraktionen geregelt werden.
- Zur Induktion Verletzungen, überlagern eine Verlängerung Kontraktion auf eine maximale isometrische Kontraktion, die Variation der Bewegungsumfang, Geschwindigkeit der Verlängerung, und den Zeitpunkt der Stimulation, wie gebraucht. Zum Beispiel wird eine maximale isometrische Kontraktion in der Dorsalflexoren erhalten und nach 200 ms sind sie an einem ausgewählten Geschwindigkeit zur Angleichung der normalen Bewegung (900 ° / sec) verlängert. Wir haben bereits gezeigt, dass die Aktivierung vor der Bewegung und der Grad der Verlängerung wichtige Faktoren bei der Beschaffung einer Verletzung 14 sind. Die Mehrheit der Drehmoment durch die Dorsalflexoren produziert wird von der TA 11 und wir haben bereits gezeigt, dass dieses Modell zu einer Schädigung dieser Muskel 5,13-15. Der TA bleibt während Verlängerung angeregt.
- Nach einer Verletzung wird das Tier aus dem Gerät entfernt werden. Die Tibia-Pin istentfernt wird, wird das Bein wieder gereinigt und das Tier in den Käfig zurück (platziert auf einem temperierten Heizblock bei 37 ° C) und überwacht bis zur Genesung. Dazu gehören zu warten, bis das Tier ist wach und mobil. Die Tiere leiden keine beobachtbaren Schmerzen während der Behandlung, und es gibt keine sichtbaren Veränderungen in Gang (zB Lahmheit) nach einer Verletzung durch eine Verlängerung Kontraktionen induziert. Allerdings ist eine entsprechende Anti-Schmerz-Behandlung später (- 0,1 mg / kg alle 12 Stunden für 48 Stunden nach der Operation Buprenorphin 0,05) verabreicht werden.
2. In situ-Messung der gesamten Muskelspannung.
- Das Tier ist vorbereitet und das Schienbein stabilisiert, wie oben in Abschnitt 1.1 bis 1.3 beschrieben. Alle Instrumentierung ist auf mindestens 30 min vor dem Test für die richtige Kalibrierung eingeschaltet und der thermischen Drift des Kraftaufnehmers minimieren.
- Inzision der Haut vorderen bis zum Knöchel und sever der Sehne des M. tibialis anterior (TA). Sorgfältig binden 4,0 Ethicon Seide nicht-resorbierbares Nahtmaterial, um die Sehne und befestigen Sie die Vicryl Naht an der Wägezelle über das mitgelieferte S-Haken (Gewicht = 0,1 g), Modell FT03, Grass Instruments, Warwick, RI). Alternativ können Sie eine benutzerdefinierte Klemme (Gewicht = 0,5 g) verwendet, um die Sehne am Vicryl Naht (Abb. 2) befestigen.
- Die Wägezelle ist mit einem Mikromanipulator (Kite Manipulator, World Precision Instruments Inc., Sarasota, FL), so dass die TA zu Ruhelänge angepasst werden kann und korrekt ausgerichtet (eine gerade Linie von Pull zwischen Ursprung und Ansatz) montiert. Die TA ist von der Kühlung durch eine Wärmelampe und vor Austrocknung durch Mineralöl geschützt. Die Signale der Wägezelle (kalibriert vor jedem Test) werden über einen DC-Verstärker (Modell P122, Grass Instruments, Warwick, RI) an einen A / D-Karte gesammelt und durch den Erwerb Software (PolyView Version 2.1, Grass Instruments gespeichert werden gefüttert , Warwick, RI).
- Befestigen Sie den TA auf die Wägezelle und gelten einzelne Zuckungen (Rechteckimpuls von 1 ms) bei verschiedenen Muskel-Längen, um L 0 zu bestimmen. Muscle Ruhelänge, gemessen mit Messschieber, ist wie der Abstand zwischen der Tuberositas und der Muskel-Sehnen-Übergang definiert. Bei dieser Länge, schrittweise Erhöhung der Pulsamplitude und dann die Pulsfrequenz, um eine Kraft-Frequenz-Beziehung aufzubauen. Eine maximal abgesichert tetanische Kontraktion wird auf etwa 90-100Hz (300 ms Zug Dauer von 0,1 ms bzw. 1 ms Pulse besteht) erhalten. Verwenden Sie 150% der maximalen Intensität der Stimulation der TA aktivieren, um eine maximale kontraktile Aktivierung (P 0) induzieren. Maximale tetanische Kontraktionen können wiederholt durchgeführt werden und als Prozentsatz der P 0 ausgedrückt, einen Index von Müdigkeit zu jedem gewünschten Zeitpunkt.
3. In vivo MR-Bildgebung und / oder-Spektroskopie von Nagetier Skelettmuskeln.
Alle MRI und MRS befindet sich auf einem Bruker Biospin (Billerica, MA) 7,0 Tesla MR-System mit einem 12 cm Steigung einfügen (660 mT / m maximale Steigung, 4570 T / m / s maximale Anstiegsgeschwindigkeit) läuft Paravision 5.0 Software ausgestattet ist.
- Das Tier ist betäubt mit verdampft Isofluran wie oben in 1.1 beschrieben. Eine MR-kompatible Kleintier-Überwachung und-Gating-System (SA Instruments, Inc.) wird verwendet, um Atemfrequenz und Körpertemperatur überwacht. Maus Körpertemperatur ist bei 36-37 ° C mit Hilfe eines warmen Wasser Thermostaten gehalten. Eine maßgeschneiderte Halterung verwendet wird, um die Maus in Rückenlage mit beiden Beinen parallel zur Bohrung des Magneten vom Knie bis zum Fuß positionieren. Ein Vier-Kanal empfangen nur Oberflächenspule ist in einem 72 mm linear 1H Resonators platziert. Der Resonator Spule abgestimmt ist und abgestimmt auf die Probe.
- MR Imaging: Nach Lokalisierer, die folgenden MR-Scans werden durchgeführt: T1-gewichteten schnellen Erfassung mit Relaxationserhöhung (RARE) mit folgenden Parametern: TE = 9,52 ms, TR = 1800, Echo Zuglänge = 4, in-plane-Auflösung 100x100 um und Schichtdicke = 750 um. Dual-Echo PD/T2 RARE: TE = 19.0/57.1 ms, TR = 5000 ms, Echo Zuglänge = 4, in-plane-Auflösung 100x100 um, und Schichtdicke = 750 um. Spin-Echo (SE) Diffusions-Tensor-Bilddaten mit 12 nicht-kollineare Richtungen: b-Wert = 350 s / mm -2, TE = 26 ms, TR = 4500 ms, in-plane-Auflösung 150x150 um, und Schichtdicke = 750 um . Multi-Slice-Multi-Echo (KKMU) T2 parametrische Mapping-Daten unter Verwendung von 16 TEs = 11,4 ms auf 182,5 ms mit ΔTE = 11,4 ms, TR = 10000 ms, in-plane-Auflösung 150x150 um, und Schichtdicke = 750 um.
- Bildverarbeitung: Diffusion Tensor Wiederaufbau und Traktographie erfolgt über TrackVis (Martinos Center for Biomedical Imaging, Massachusetts General Hospital, Boston, MA) zu bedeuten Diffusivität (MD), fraktionierte Anisotropie (FA) Bilder sowie Traktographie Karten zu erstellen. T2-Mapping erfolgt mit Hilfe eigener Software in MAT geschrieben LAB (The Mathworks, Natick, MA) unter Verwendung von nicht-linearen kleinsten Quadrate, um die gemessenen Daten an jedem Pixel passen auf die kanonische T2-Signal Gleichung. Regionen von Interesse Messungen durchgeführt werden, um Parameterwerte innerhalb der TA beurteilen.
- 1H-Spektroskopie: Automatisierte shimming befindet sich auf einem 1 x 1 x 4 mm 3 Voxel in der TA durchgeführt. Eine Punkt-zeitaufgelösten Spektroskopie (PRESS) Pulssequenz (TR / TE = 2000/18 ms) wird verwendet, um Spektren aus dem gleichen Voxel mit 1024 im Durchschnitt zu erwerben. Die Datenerfassung erfolgt 34 Minuten auf jedem Bein. Spektrale Daten verarbeitet werden, mit dem LCModel Paket 16. 31P-Spektroskopie: Ein Dual-gestimmt (1H, 31P) Oberflächenspule wird verwendet, um nicht-lokalisierten durchführen (unter Verwendung eines Single-Puls-Experiment) oder lokalisierte Spektroskopie mit dem Bild in vivo-Spektroskopie (ISIS) Pulssequenz ausgewählt.
4. Ernte und Lagerung Muskeln.
Reisebüros sind nach Ende der Experimente geerntet, gewogen, in flüssigem Stickstoff eingefroren und anschließend bei -80 ° C gelagert Dies kann zu jedem Zeitpunkt nach der in-vivo-Experimente durchgeführt werden. Muskeln sind unmittelbar nach der in-situ-Experimente geerntet, da dies ein Terminal Verfahren ist. Für detaillierte morphologische Studien, wird das Tier mit 4% Paraformaldehyd über Perfusion durch die linke Herzkammer behoben.
5. Repräsentative Ergebnisse.
Abbildung 3 zeigt repräsentative Daten von einer Ratte in der in vivo Apparat Die in vivo Apparat benutzt wird, um maximale Drehmoment von der Dorsalextensoren generiert erhalten;. Es wird auch benutzt, um eine Verletzung dieser selben Muskeln hervorzurufen. Aufgrund der Länge und Spannung Verhältnis von Muskel-, maximalen isometrischen Drehmoments der Regel tritt ein, wenn das Sprunggelenk bei ca. 20 ° Plantarflexion (mit dem Fuß senkrecht positioniert, um die Tibia als 0 °) positioniert ist. Nach maximale isometrische Drehmoment erhalten wird, kann der Fuß dann in jeder beliebigen Position auf der Verletzung Protokoll beginnen platziert werden. Abbildung 3 stellt eine Verletzung des Protokolls 30 Wiederholungen mit einem Bogen der Bewegung von 0 ° - 70 °. Notieren Sie sich die stetige Abnahme des Drehmoments aus der isometrischen Phase (gefüllte Pfeil) und die Verlängerung Phase (offener Pfeil) während der Kontraktion-induzierten Verletzungen Protokoll generiert. Das Drehmoment wird in Einheiten von Nmm aufgenommen, aber der absolute Wert hängt von der Größe des Tieres und dessen Zustand (zB verletzten Muskels, müde Muskeln oder Muskel fehlt ein bestimmtes Protein durch homologe Rekombination).
Abbildung 4 zeigt repräsentative Daten von einer Ratte in der in situ Apparat. Unsere in situ Apparat nicht um Verlängerung Kontraktionen, sondern erlaubt es uns, zu isolieren, richtig auszurichten und zu messen maximale Spannung von einem einzelnen Muskel an einer bekannten Länge produziert. Abbildung 4 zeigt die allmähliche Verlust der Kraft, die beim Dauertest in einem tibialis anterior der Ratte auftritt. In diesem Beispiel wurden titanic Kontraktionen einmal pro Sekunde für 5 Minuten durchgeführt. Tension (Kraft) ist in der Regel in Newton (oder Gramm) aufgezeichnet, aber wie Drehmoment, hängt der Betrag von der Größe und dem Zustand des Tieres. Da Muskelmasse sofort nach diesem Verfahren erhalten wird, kann die Kraft normiert (so genannte "spezifische Kraft"), um Muskeln Querschnittsbereich werden.
Abbildung 5 zeigt repräsentative Daten aus in vivo-Bildgebung von einer Maus, wie T1-gewichteten und T2 Parametric Mapping (A), 3D-Traktographien von Diffusions-Tensor-Bildgebung (B), 1 H-Spektroskopie (C) und 31 P-Spektroskopie. Einzelheiten sind in der Legende zur Verfügung gestellt.

Abbildung 1: In-vivo-Apparat .* Um die Verletzungsgefahr zu produzieren, die Tibia stabilisiert und den Fuß auf einem motorbetriebenen Platte befestigt. Der Knöchel Dorsalflexoren werden über den N. peronaeus stimuliert, während die Fußplatte zwingt den Fuß in Plantarflexion (gepunkteter Pfeil).
* Lovering & De Deyne, J Biomechanik 2005, mit freundlicher Genehmigung verwendet.

Abbildung 2: In situ Apparat Die Wägezelle ist mit einem Mikromanipulator montiert, so dass die TA zu Ruhelänge angepasst werden kann und richtig in die X, Y, und Z-Richtung ausgerichtet. Die distale Sehne des TA ist es, die Wägezelle befestigt und einzelne Zuckungen an verschiedenen Muskeln Längen induziert, um L 0 zu bestimmen. Eine maximale tetanische Kontraktion erhalten wird, um maximalen kontraktilen Aktivierung (P 0) zu bestimmen. Maximale tetanische Spannung kann mehrfach durchgeführt werden und als Prozentsatz der P 0 ausgedrückt, einen Index von Müdigkeit zu einem gewünschten Zeitpunkt.
782/2782fig3.jpg "alt =" Bild 3 "/>
Abbildung 3: Drehmoment-Daten aus in vivo Apparat Vertreter Spur-Aufnahmen von Drehmoment von Verlängerung Kontraktionen in der Ratte. In diesem Beispiel wurden die Muskeln für 200 Millisekunden angeregt, einen Höhepunkt isometrische Kontraktion (gefüllte Pfeil) vor Verlängerung (offener Pfeil) von der Fußplatte durch eine 70 °-Bogen der Bewegung mit einer Winkelgeschwindigkeit von 900 induzieren ° / s.

Abbildung 4: Tension Daten aus in situ Apparat Repräsentative Daten zeigen den Rückgang der maximalen isometrischen tetanischen Spannung bei wiederholter Stimulation des M. tibialis anterior (TA) in eine Ratte. In diesem Beispiel wurde die TA isoliert, angepasst, um optimale Länge (L 0), und dann mit einem 200 ms tetanische Kontraktion einmal pro Sekunde für 5 Minuten stimuliert.
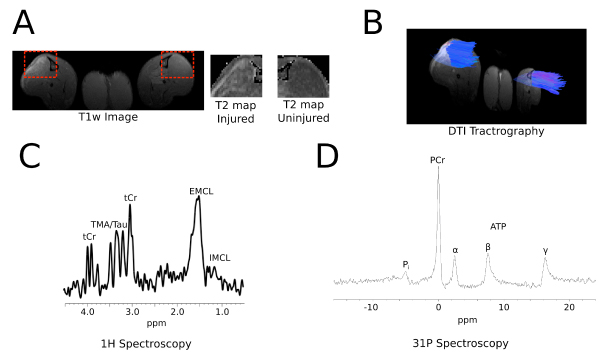
Abbildung 5: In-vivo-Bildgebung A: Die Bilder zeigen quer (axial) Teile der T1-gewichteten und T2 parametrische Mapping aus dem M. tibialis anterior (TA). Die gestrichelte rote Feld umgibt die TA zu zeigen erhöhte erhöhte T2 in den verletzten (links) versus unverletzt (rechte Seite) B:.. Vertreter 3D-Traktographien von Diffusion Tensor Imaging (DTI) C: Die 1 H-Spektrum einer Maus TA zeigt mehrere nachweisbar Lipid Resonanzen; Differenzierung zwischen intramyozellulären (IMCL) und extramyocellular Lipid (EMCL) Peaks erhält man mit dieser Methode D: Die 31 P NMR-Spektrum der Ratte TA zeigt Phosphokreatin (PCr), anorganischem Phosphat (Pi), und die drei. Resonanzen (α, β, γ) von Adenosin-5'-Triphosphat (ATP).
Diskussion
"Muscle Schaden" wurde definiert und gemessen in vielerlei Hinsicht. Bauschäden ist in histologischen Befunden 6,9 evident, aber ein Problem mit vielen der biologischen Marker verwendet werden, um Muskelverletzungen, einschließlich derjenigen in tierexperimentellen Studien verwendet zu bewerten, ist, dass sie in der Regel nicht mit dem Verlust der Kraft korrelieren. Muscle Schaden ist oft im Rahmen des Tests verwendet werden, um es zu untersuchen definiert und niemand finden kann, damit die Änderungen in Kontraktilität nach der Verletzung Konto. Da die volle kontraktile Funktion trotz der Anwesenheit von Verletzungen Marker bestehen kann, kann zum Verlust der Kraft der gültiges Maß von Verletzungen 3, und der wohl relevant.
Es ist schwierig, Muskelverletzungen in Menschen zu untersuchen, wie die Inzidenz ist ein zufälliges Ereignis, die schwierig vorherzusagen ist, und das klinische Erscheinungsbild variiert stark. Deshalb sind viele der Daten in Bezug auf Muskel-Verletzungen festgestellt worden sind aus Untersuchungen an Tieren, die Kontrolle über viele Variablen und die Fähigkeit, Mechanismen der Schädigung und Erholung Studie liefert. Die in vivo Verletzungen Apparat wir beschrieben haben, stellt eine Methode zur Beurteilung der kontraktilen Funktion ohne Zerlegung der Muskulatur und damit ohne die Notwendigkeit, das Tier zu untersuchenden einschläfern. Unsere maßgeschneiderten Verletzungen Modell (patent pending) ist auf den gleichen Prinzipien von anderen verwendet werden, um Kontraktion-induzierten Verletzungen bei Tieren 5,12,15,24 etablieren basiert. Trotz der Verfügbarkeit von Modellen auf dem Markt, gibt es wenig Belehrung über Nutzung der Hardware. Unser Modell hat die Spezifikationen in Bezug auf das verfügbare Angebot an Bewegungs-und Winkelgeschwindigkeit, die vorteilhaft 17 sind, aber unser Hauptziel ist es, die Methoden zu teilen; haben wir versucht, Verfahren von Anfang beschreiben, die zur Herstellung einer Verletzung beenden. Die Vorteile der in-vivo-Modell, dass der Muskel, Anatomie und Biomechanik nicht verändert werden und dass das Verfahren nicht Terminal. Wir verwenden die gleiche Lage in der Tibia für alle Drehmoment-Messungen folgende sanitäre Verfahren und mit einer sterilen Nadel für jede Messung. Das Bein kann ohne die Verwendung eines transosseus Pin stabilisiert werden, aber wir haben den Stift festgestellt, dass in Bezug auf Zuverlässigkeit und die Beseitigung der fremden Bewegung während der Verlängerung Kontraktionen überlegen.
Die Vorrichtung zur In-vivo-Drehmoment-Messungen verwendet hat mehrere zusätzliche Vorteile. Es beinhaltet keine Zerlegung, so ist es nicht erforderlich, um das Tier zu untersuchenden einschläfern. Das Ergebnis ist, dass man Kontraktilität im gleichen Tier im Laufe der Zeit zu messen, und / oder mit in-vivo-Bildgebung wie MRT. Weitere Vorteile sind, dass normale Anatomie nicht verändert wird, ist der Nerv nicht zur Stimulation umgangen (wie in vitro Zubereitungen), und der Muskel bleibt in seiner gewohnten Umgebung, so dass die Wirkungen der Entzündung, Hormonen oder anderen Faktoren untersucht werden können. Weil es die Verwendung von weniger Tieren, deren Muskeln sind weniger Manipulationen (zB Dissektion vor dem Test der Funktion) unterzogen verlangt, bevorzugen wir, um das Drehmoment-Messungen verwenden, wenn möglich. Der Hebelarm der Maus TA ist 4 bekannt und der Muskel kann gewogen, wenn das Tier getötet werden. Es gibt einige Einschränkungen jedoch im Vergleich zum Isolieren des Muskels. Zum Beispiel ist es schwierig, die genaue Länge Veränderungen, die während der Verlängerung Kontraktionen auftreten erkennen, und die Muskelmasse lässt sich nicht messen, bis sie geerntet werden (obwohl es kann abgeschätzt werden auf Lautstärke über MRI gemessenen) 8.
Um zu bestimmen, die "spezifische Kraft" (Kraft pro Querschnittsfläche) eines einzelnen Muskels, Bedürfnisse, die Muskeln zu isolieren und richtig positioniert werden, dies vermeidet auch die Kraftübertragung von den nahe gelegenen Muskeln 10. Die in situ Apparat wurde für diesen Zweck konzipiert. Es bietet eine Alternative zur Messung der Kontraktilität der nur ein Muskel mit einer bekannten Länge und Masse. Doch auch diese Methode hat ihre Grenzen. Obwohl die in situ Gerät bietet mehr experimentelle Kontrolle bei der Messung der Kraft eines einzelnen Muskels ist der trade-off, dass das Experiment unter physiologischen wird. In situ Kraft Messungen erfordern eine chirurgische Freigabe der TA Muskel, der die Anatomie verändern kann und beeinträchtigen Kraftübertragung. Das Experiment ist auch Terminal, so dass der Muskel nicht über längere Zeit beobachtet werden.
Diffusion Tensor Imaging (DTI) ist potentiell ein noch empfindlicher und früher Marker für Muskelschäden als Standard-T2-gewichteten MRT. Die Variablen mit DTI erhalten, zumindest in anderen Geweben wie dem Gehirn (1), zeigen eine starke und schnelle Reaktion auf Schäden, während die T2-Signal über einen längeren Zeitraum zu ändern nehmen kann. DTI beruht auf der Messung der scheinbaren Diffusion von Wasser im Gewebe basiert. Die DTI-Technik hat den tatsächlichen Längsschnitt verglichens der Ratte TA und es hat sich gezeigt, dass DTI Richtungen tatsächlich repräsentieren lokale Muskelfaser Richtungen in der Ratte TA Muskel 19.
MRS liefert Informationen über die chemische Zusammensetzung des Muskels nicht-invasiv 12. Je nach den beobachteten Kern ermöglicht MRS Beobachtung von hochenergetischen Phosphate (31 P MRS) oder Lipide (1 H MRS). 31 P MRS ist ein ideales Werkzeug für die Untersuchung von Muskel-Stoffwechsel, weil sie nicht-invasiv ist und sich leicht angewendet, um in-vivo-Studien der Skelettmuskulatur. Alternative Ansätze für die biochemische Assays von in situ Muskel Metaboliten, wie zum Beispiel Nadelbiopsie, geben können signifikante Überbewertung von Pi und scheinbare Reduktion der PCR 1. Ein Tier-Modell bietet den offensichtlichen Vorteil der Verwendung einer kontrollierten Verletzungen und zum Vergleich in vivo MRS Änderungen Erkenntnisse in der Biochemie, Morphologie und Funktion der Gewebe. Änderungen in der Hochenergie-Phosphat-Stoffwechsel bei Erkrankungen, die zu Muskel-Degeneration 2,20 gestoßen. Intrazelluläre pH-Wert, sowie die MR-Signal Intensitätsverhältnisse Pi / PCr (anorganisches Phosphat [Pi], um Phosphokreatin [PCr]) und PDE / PCr (Phosphodiester [PDE], um PCR), liefern kann wertvolle Informationen über die Bühne und die Schwere der Muskelabbau.
Offenlegungen
Danksagungen
Die Autoren bedanken sich bei Dr. Robert Bloch für seine großzügige Spende an Laborfläche und Einrichtungen und Dr. Rao Gullapalli und Da Shi danken in die Core for Translational Imaging bei Maryland (C-TRIM) und der Magnet-Resonanz-Forschungszentrum (MRRC) für den technischen Support. Diese Arbeit wurde durch Zuschüsse unterstützt, um von den National Institutes of Health (K01AR053235 und 1R01AR059179) und von der Gesellschaft für Muskeldystrophie (# 4278), und durch einen Zuschuss RML aus der Jain Foundation JAR.
Materialien
(Alle Geräte sind die gleichen für Mäuse und Ratten mit Ausnahme der Fußplatte)
- BUD Value Line Cabinet (Newark, 06M4718)
- Multifunktions-l / O USB-6221M (National Instruments, 779808-01)
- Schrittmotor-Controller (Newark, 16M4189)
- Stepper Motor (Newark, 16M4198)
- DMS-Verstärker (Honeywell, Sensotec, DV-05)
- Torque Sensor (Honeywell, QWLC-8M)
- Fußplatte und Stabilisierung Gerät (custom made, Patent angemeldet)
Referenzen
- Aldridge, R. Muscle pain after exercise is linked with an inorganic phosphate increase as shown by 31P. NMR. Biosci. Rep. 6, 663-663 (1986).
- Argov, Z., Lofberg, M., Arnold, D. L. Insights into muscle diseases gained by phosphorus magnetic resonance spectroscopy. Muscle Nerve. 23, 1316-1316 (2000).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J. Physiol. 488, 459-459 (1995).
- Burkholder, T. J. Relationship between muscle fiber types and sizes and muscle architectural properties in the mouse hindlimb. J. Morphol. 221, 177-177 (1994).
- Hakim, M. Dexamethasone and Recovery of Contractile Tension after a Muscle Injury. Clin. Orthop. Relat Res. 439, 235-235 (2005).
- Hamer, P. W. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J. Anat. 200, 69-69 (2002).
- Hammond, J. W. Use of Autologous Platelet-rich Plasma to Treat Muscle Strain Injuries. Am. J. Sports Med. , (2009).
- Heemskerk, A. M. Determination of mouse skeletal muscle architecture using three-dimensional diffusion tensor imaging. Magn Reson. Med. 53, 1333-1333 (2005).
- Ho, K. W. Skeletal muscle fiber splitting with weight-lifting exercise in rats. Am. J. Anat. 157, 433-433 (1980).
- Huijing, P. A., Baan, G. C. Myofascial force transmission causes interaction between adjacent muscles and connective tissue: effects of blunt dissection and compartmental fasciotomy on length force characteristics of rat extensor digitorum longus muscle. Arch. Physiol Biochem. 109, 97-97 (2001).
- Ingalls, C. P. Dihydropyridine and ryanodine receptor binding after eccentric contractions in mouse skeletal muscle. J. Appl. Physiol. 96, 1619-1619 (2004).
- Lee, D., Marcinek, D. Noninvasive in vivo small animal MRI and MRS: basic experimental procedures. J. Vis. Exp. , (2009).
- Lovering, R. M., Deyne, P. G. D. e Contractile function, sarcolemma integrity, and the loss of dystrophin after skeletal muscle eccentric contraction-induced injury. Am. J. Physiol Cell Physiol. 286, C230-C238 (2004).
- Lovering, R. M. The contribution of contractile pre-activation to loss of function after a single lengthening contraction. J. Biomech. 38, 1501-1501 (2005).
- Lovering, R. M. Recovery of function in skeletal muscle following 2 different contraction-induced injuries. Arch. Phys. Med. Rehabil. 88, 617-617 (2007).
- Provencher, S. W. Automatic quantitation of localized in vivo 1H spectra with LCModel. NMR Biomed. 14, 260-260 (2001).
- Roche, J. A., Lovering, R. M., Bloch, R. J. Impaired recovery of dysferlin-null skeletal muscle after contraction-induced injury in vivo. Neuroreport. 19, 1579-1579 (2008).
- Stone, M. R. Absence of keratin 19 in mice causes skeletal myopathy with mitochondrial and sarcolemmal reorganization. J. Cell Sci. 120, 3999-3999 (2007).
- Van Donkelaar, C. C. Diffusion tensor imaging in biomechanical studies of skeletal muscle function. J. Anat. 194, 79-79 (1999).
- Vogl, T. J. The value of in-vivo 31-phosphorus spectroscopy in the diagnosis of generalized muscular diseases. The clinical results and the differential diagnostic aspects. Rofo. 162, 455-455 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten