Method Article
Exocitose imagem em células da retina com Bipolar Microscopia TIRF
Resumo
Neste vídeo, demonstramos como rotular e visualizar exocitose das vesículas sinápticas única e tráfico de células da retina goldfish bipolar usando reflexão interna total de fluorescência microscopia (TIRF).
Resumo
Refletância interna total de fluorescência microscopia (TIRF) é uma técnica que permite o estudo dos eventos que acontecem na membrana celular, pela imagem seletiva de moléculas fluorescentes que são mais próximos a uma substância de alto índice de refração, como vidro
Protocolo
Parte 1: Dissecção e isolamento de células Bipolar
- Preparar soluções listadas na Tabela 2; O pH de toques "(externa) de soluções deve ser ajustado para 7,4 com NaOH e do pH da solução interna deve ser ajustado para 7,2 com CsOH. Proteger a solução interna da luz com papel alumínio e mantenha-o a 4 ° C até o uso;
- Dark-se adaptar um peixinho dourado, pelo menos, 30 minutos antes da dissecção;
- Enquanto o animal se adapta-escuro, preparar 5 mL de hialuronidase (V tipo hialuronidase, 1100 unidades / mL em baixo Ca 2 + Ringer; Sigma, St. Louis, MO) e 10 mL de L-cisteína (0,5 mg / mL em Ca 2 + baixo) da campainha as soluções e pesar os papaína (pó liofilizado, 40 unidades / mL; Sigma, St. Louis, MO) por 5 mL da solução de digestão;
- Euthanize o goldfish por decapitação rápida com uma tesoura cirúrgica e destruir o cérebro ea medula espinhal com uma lâmina de bisturi # 11;
- Remove os olhos, destruindo os músculos extra-oculares com a ajuda de uma pinça # 7 curvas Dumont e cortar o nervo óptico com tesoura de íris;
- Lugar lâmpada um olho em um pedaço de papel de filtro e punção do limbo escleral com a ponta de uma lâmina de bisturi # 11;
- Introduzir a lâmina de uma tesoura Vannas dentro do todo perfurado e cortar todo o segmento anterior de distância;
- Coloque um pequeno pedaço de papel de filtro em cima do copo restante óptica e exercer alguma pressão, a fim de ter o papel de absorver com humor vítreo;
- Levante o papel de filtro com a retina ligado a ele e cortar o nervo óptico com um par de tesouras Vannas;
- Coloque o papel de filtro contendo a retina em um prato de 35 milímetros de plástico cultura com solução de hialuronidase e descolar a retina do papel de filtro com a ajuda de uma pinça # 7 Dumont;
- Cortar a retina em 4-6 pedaços com metade de uma lâmina de aço carbono industrial único gumes e deixe descansar na solução de hialuronidase por 20 minutos;
- Enquanto espera por hialuronidase para entrar em vigor, adicionar 5 mL da solução de L-cisteína ao papaína e deixe descansar até que o líquido se torna transparente (aproximadamente 5-10 minutos);
- Lave os pedaços de retina 3x de baixa Ca 2 + Ringer e deixá-los sentar-se na solução de papaína por 30-35 minutos;
- Lave os pedaços de retina 3x de baixa Ca 2 + Ringer e armazená-los até o uso a 4 ° C em um prato de cultura 35 milímetros de plástico contendo Ca 2 + baixo de Ringer;
- Dissociar as células, coloque um pedaço de retina em um tubo de microcentrífuga contendo 500 mL de baixo Ca 2 + Ringer e lentamente triturar a retina pipetando cima e para baixo com uma dissociação de vidro pipeta, cuidadosamente para não produzir quaisquer bolhas de ar. Pipetas dissociação são fabricados por aquecimento até a ponta de uma pipeta Pasteur de vidro com um bico de Bunsen e ligeiramente dobrá-la com a ajuda de uma pinça anatômica;
- A placa de células isoladas, adicionando uma gota da suspensão da retina a um home-made câmara de gravação previamente preenchidos com 2 mL de Ca 2 + baixo Ringer. A câmara consiste na metade inferior de uma placa de cultura de 35 mm de plástico com um todo circular no meio e uma lamela de vidro circular de 1,78 do índice de refração (PlanOptik, Alemanha), colado ao fundo com um elastômero de silicone (Sylgard 184; Dow Corning , Midland, MI).
Parte 2: Bipolar Carregando Celular e Wash Out
TIRF imagens das vesículas sinápticas é melhor realizado através de um microscópio TIRFM objetivo do tipo com um objetivo NA muito alta e uma câmera sensível. Para nossos experimentos, optamos por usar um 1,65 NA objetivo (x100 Apo O HR, NA 1,65, Olympus, Japão) com um EMCCD (Cascade 512B, Roper Scientific, Tucson, AZ). O uso do objectivo NA muito elevado exige a utilização de lamínulas de vidro de alta refração e fluido de imersão (di iodometano com enxofre). Nas nossas condições, luz de excitação está limitado a um campo de decaimento exponencial com um comprimento constante de aproximadamente 50 nm.
- Adicionar uma gota de líquido de alta índice de refração (série M, índice de refração = 1,7800, Cargille Labs, Cedar Grove, NJ) para a objetiva do microscópio;
- Coloque a câmara de gravação cuidadosamente em cima da objetiva do microscópio e cuidadosamente montagem eletrodo terra e tubo de saída para superfusão câmara;
- Deixe câmara de sentar-se no microscópio por 10-20 minutos para permitir que as células a afundar e aderir ao fundo;
- Nesse meio tempo, preparar 5 mL de uma trolox 1mM ® ácido ((±)- 6-hidroxi-2 ,5,7,8-tetramethylchromane-2-carboxílico; Sigma, St. Louis, MO solução) em alta K + Ringer . Sonicate até à dissolução;
- Prepare 15 mL de solução ADVASEP-7 lavagem: 1 mM ADVASEP-7 (Sigma, St. Louis, MO) em baixo Ca 2 + Ringer. Note-se que ADVASEP-7 uso é opcional e pode ser omitido, se desejar;
- Purgar o li superfusãones e adicione solução ADVASEP-7 de lavar roupa, Ca 2 + baixo toque e controle de campainha para o sistema superfusão;
- Puxar carga pipetas de paredes finas de vidro de borosilicato (Kwik-Fil ® TW150-3; WPI, Sarasota, FL). Resistências Puffer pipeta estão na faixa de 1,5-2,5 mohms;
- Prepare o FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutylamino) styryl) pyridinium dibrometo ", embalagens especiais"; Invitrogen, Carlsbad, CA) soluções. Primeiro, faça um estoque de 1 mm, adicionando 160 mL de água destilada para um frasco (100 mg) de FM1-43 ®. Este estoque pode ser mantido a 4 ° C por até uma semana. Em seguida, adicionar 5 mL de FM1-43 ® a 1 mL de alto K + + Ringer 1mM trolox ®. Proteger a solução da luz com papel alumínio e mantenha-o a 4 ° C até o uso;
- Ligue o microscópio de luz brilhante em campo e procurar células intactas bipolar. Ligeiramente toque no microscópio para se certificar de que os neurônios estão firmemente ligado ao fundo da câmara;
- Posição da caneta superfusão próximo à célula de interesse e de forma contínua perfundir a preparação com baixo Ca 2 + Ringer;
- Desligue as luzes da sala e adicionar um longo vermelho filtro passa (isto é, RG630, Schott, Alemanha) para o caminho óptico para minimizar a excitação do corante FM;
- Preencha uma pipeta de carga com 10 mL da solução corante FM, montar a pipeta na micromanipulador e inferior da pipeta sobre o preparo, sem sobrepressão até que esteja no mesmo plano focal como a célula bipolar você deseja carregar. Certifique-se de ter pelo menos dois titulares eletrodo: o utilizado para o corante FM não pode ser usado para patch clamping, ou então ele pode contaminar a solução intracelular;
- Posição da abertura do soprador a uma distância de cerca de 10 mM do terminal axônio, por sua vez o sistema superfusão off e puff a solução corante por 10 segundos girando a sobrepressão pipeta sobre;
- Vire a sobrepressão fora e, sem mover a pipeta, aguarde 30 segundos;
- Vire o superfusão e tomar banho na câmara em ADVASEP-7 solução por 5 minutos. Nesse meio tempo, retire a pipeta puffer do banho;
- Depois de cinco minutos, mude para baixo Ca 2 + campainha e perfundir a câmara por 25-30 minutos para permitir a remoção de corante em excesso.
Parte 3: Patch de fixação e TIRFM Imagem
- Enquanto a preparação é lavar para fora, puxe pipetas patch da espessura de paredes de vidro de borosilicato (B150-86-10; Sutter Instrument Company, Novato, CA). Resistências remendo pipeta estão na faixa de 80-10 mohms;
- Depois de lavar estiver concluída, coloque o axônio terminal no centro do campo de visão;
- Preencha uma pipeta patch com 7μL de solução interna, toque a pipeta para se livrar de bolhas de ar, revestimento da pipeta com cera dental fundido (cera pegajosa; Kerr Corporation, Orange, CA) e montá-la na micromanipulador;
- Vire a sobrepressão pipeta sobre e inferior a pipeta lentamente sobre a preparação. Verifique a resistência da pipeta no amplificador e deslocamentos pipeta correto e capacitância com os controles do amplificador respectivos;
- Mudar o superfusão para controlar Ringer. Para criar um gigaseal entre a pipeta ea célula, ligeiramente tocar a ponta do eletrodo contra o corpo da célula e ligue a sobrepressão pipeta off, enquanto gentilmente a aplicação de pressão negativa para o eletrodo;
- Enquanto fechado, escolha "toda célula" modo no amplificador e definir a cela potencial de -60 mV;
- Escolha uma região de interesse com o software de imagem que engloba o axônio terminal inteiro, ligar a luz de campo claro off e, por breves instantes, expondo (30 ms) do terminal para o laser nm 488, encontrar o plano certo para TIRF focal de imagem;
- Invadir a célula usando o "zap" comando do amplificador ao aplicar pressão ligeiramente negativa para a pipeta;
- Correto para capacitância da célula e resistência em série, e depois aplicar o protocolo de tensão de interesse, enquanto movimento de imagens de vesículas sinápticas. É nesta fase importante ter o protocolo de tensão sincronizada com a taxa de quadros da câmera. No nosso caso, cada quadro é de 30 ms de comprimento, de modo a variações de tensão ocorrem em múltiplos desse valor (ou seja, a cada 300 ms ou 10 quadros);
- Espere pelo menos 40 segundos entre ensaios para permitir a recuperação;
- Para verificar a posição de fitas sinápticas, tirar fotos ao girar o laser nm em 561.
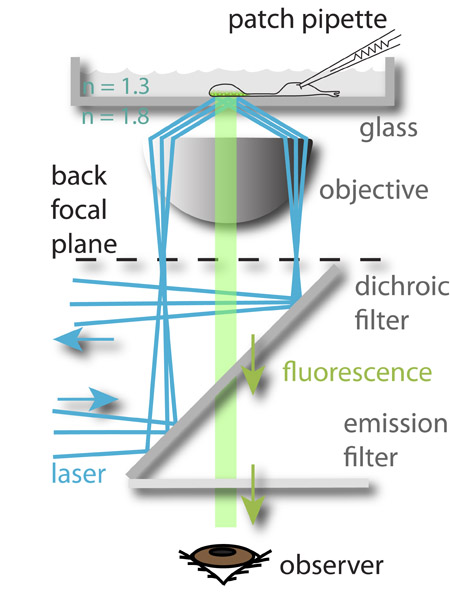
Figura 1: A configuração experimental. Um laser de 488 nm (azul) é voltado para a periferia do plano focal posterior da objetiva e sofre reflexão interna total quando ele atinge o vidro aquoso interface de médio porte. O campo eletromagnético gerado pelo feixe refletido excita o fluoróforo carregado no vesículas sinápticas mais próximo do bottom da câmara de vidro, que então fluorescência (verde). A luz fluorescente é então guiado ao olho do observador (representado) ou a uma câmera CCD. O potencial de membrana das células imaged é controlado simultaneamente por patch-aperto-los. Esta abordagem permite o estudo da relação entre os sinais de entrada (a tensão de membrana) ea saída neuronal (exocitose).
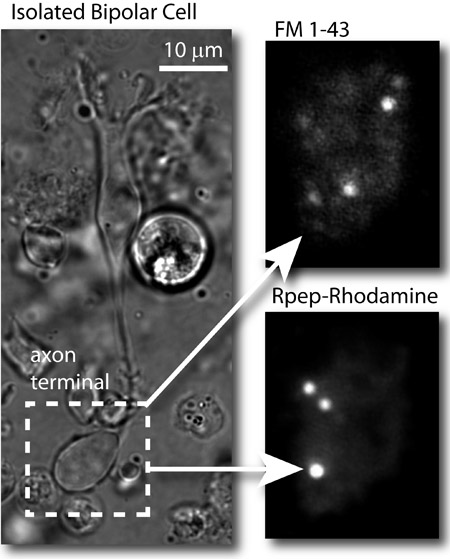
Figura 2: Resultados típicos. Esquerda: Imagem de campo claro de uma célula isolada goldfish bipolar. Superior direito: image TIRF das vesículas sinápticas no terminal axonal célula bipolar carregado com FM 1-43 ® e fotografada com o laser de 488 nm (FM corante). Parte inferior direita: imagem do terminal mesmo depois remendar o celular e as imagens do terminal axonal com o laser nm 561. Fitas sinápticas são rotulados pela rodamina baseado em peptídeo de ligação de olho de lombo (Rpep_rhod).
Tabela 1: Reagentes e equipamentos específicos.
Nome | Tipo | Fabricante | Catálogo | Comentário |
| - | Air Tabela | Newport Corporation | - | - |
| IX70 | Microscópio invertido | Olimpo | - | Equipado com uma lâmpada de tungstênio para campo claro e uma porta de abertura lateral para TIRF |
| TH4-100 | Fonte de energia da lâmpada | Olimpo | - | - |
| FF498_581-DI01 | Dichroic Filtro | Semrock | - | - |
| NF01-405_488_568 | Filtro de emissão | Semrock | - | - |
| X100 Apo O HR | Objetivo | Olimpo | - | NA 1,65 |
| RG630 | Red Filtro de Vidro | Schott | - | - |
| - | Laser 488 nm | Coerente | - | Use o mínimo de energia |
| - | Obturador | Uniblitz | - | - |
| VMM-D1 | Driver de obturador | Uniblitz | - | - |
| - | Laser 561 nm | Melles Griot | - | - |
| - | Obturador | Uniblitz | - | - |
| VMM-D3 | Driver de obturador | Uniblitz | - | - |
| Kit de pressão de perfusão | Sistema superfusão | Automatizar Scientific | 04/09 | - |
| Pen perfusão | Sistema superfusão | Automatizar Scientific | - | - |
| ValveLink 8 | Controlador do Sistema superfusão | Automatizar Scientific | - | - |
| Cascade 512B | EM CCD Camera | Roper Scientific | - | - |
| Metamorph 7,1 | Software de imagem | Os dispositivos moleculares | - | - |
| EPC-9 | Amplificador de patch clamp | Heka Elektronik | - | - |
| Pulso | Software amplificador | Heka Elektronik | - | - |
| MP-285 | Micromanipulador | Instrumento Sutter | - | - |
| - | Titular eletrodo | Heka Elektronik | - | Por 1,5 mm de diâmetro externo de vidro, 2 unidades |
| Kwik-Fil ® TW150-3 | Capilar de vidro de borosilicato | WPI | - | Sem filamento |
| B150-86-10 | Capilar de vidro de borosilicato | Instrumento Sutter | - | Com filamento |
| P-97 | Puller microeletrodo | Instrumento Sutter | - | Equipado com filamento caixa 3x3 e câmara ambiental |
| - | Pressão da bomba de ar de vácuo | Thomas Scientific | 7893B05 | Cria vácuo para remover líquidos de câmara e sobrepressão para pipetas |
| MatLab R2008a | Software de análise | MathWorks | - | - |
| 353001 | 35 milímetros de plástico Pratos Cultura | Falcão | - | - |
| - | Vidro alto índice de refração | PlanOptik | - | Índice de refração 488 nm = 1,78 |
| Série M | Líquido de elevado índice de refração | Cargille Labs | - | Índice de refração = 1,78 |
| Sylgard 184 | Kit de silicone elastômero | Dow Corning | - | - |
| Glutationa | Tripeptídeo | Merck Química | Radica livrescavenger l | |
| Hialuronidase | Enzima | Sigma | H6254 | Tipo V |
| L-cisteína | Aminoácidos | Fluka | 30090 | Ativa papaína |
| Papaína | Enzima | Fluka | 76220 | De Carica papaya |
| Trolox ® | Vitamina E solúvel | Sigma | 56510 | Scavenger de radicais livres |
| ADVASEP-7 | Sulfonado B-Ciclodextrina Derivativos | Sigma | A3723 | Reduz FM 1-43 ® fluorescência de fundo |
| FM 1-43 ® | Corante fluorescente | Invitrogen | T35356 | "Embalagem Especial" |
| Cera pegajosa | Pipeta agente de revestimento | Kerr Corporação | - | Diminui a capacitância pipeta |
Tabela 2: soluções fisiológicas utilizadas neste estudo.
Substância | Ca 2 + baixo Ringer | Controle de Ringer | Alto K + Ringer | Solução interna |
| NaCl | 120 mM | 120 mM | 97,5 mM | - |
| KCl | 2,5 mM | 2,5 mM | 25 mM | - |
| MgCl 2 | 1 mM | 1 mM | 1 mM | 4 mM |
| CaCl 2 | 0,5 mM | 2,5 mM | 2,5 mM | - |
| HEPES | 10 mM | 10 mM | 10 mM | 10 mM |
| EGTA | 0,75 mM | - | - | 0,5 mM |
| Glicose | 10 mM | 10 mM | - | - |
| Glutationa | 2 mM | 2 mM | - | 1 mM |
| * CH 3 CSO 3 S | - | - | - | 100 mM |
| TEACl | - | - | - | 10 mM |
| ATP-Mg | - | - | - | 10 mM |
| GTP-Li | - | - | - | 1 mM |
| Rpep-Rhod ** | - | - | - | 5 mM |
| Volume | 200 mL | 100 mL | 5 mL | 100 L |
* Metanossulfonato Césio.
** Peptídeo de olho de lombo de ligação: rodamina + EQTVPVDLSVARDR-COOH (mw 1.997,75).
Discussão
As vantagens do objectivo do tipo de microscopia TIRF são que 1) ele fornece seccionamento óptico excelente restringindo luz de excitação a uma estreita região dentro do plano focal da objetiva, minimizando assim o fora-de-foco de luz, 2) já que a luz cai exponencialmente com a distância , o movimento em uma direção vertical pode ser monitorado como uma mudança na intensidade de fluorescência, 3) a coleta de luz eficiente através do objectivo de alta abertura numérica 1,5.
A principal desvantagem da técnica é que ela está limitada a eventos imagem acontecendo dentro de 100 nm e da superfície celular, que é aproximadamente equivalente a uma seção ultrafina em microscopia eletrônica. Portanto, a visualização destes eventos depende criticamente sobre as células sendo firmemente aderido ao vidro, na presença de fitas sinápticas perto do remendo da membrana aderida ao vidro e sobre o carregamento de sucesso de vesículas. Nosso protocolo permite o carregamento de apenas 1-2% do número total de vesículas dentro da célula terminal bipolar sináptica 2,6. Com isso dito, é claro que existem muito mais eventos acontecendo na superfície da célula do que os que são capazes de imagem.
Agradecimentos
Este trabalho foi financiado pelo NIH Grant EY 14.990.
Referências
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados