Method Article
Esocitosi imaging in cellule bipolari della retina con microscopia TIRF
In questo articolo
Riepilogo
In questo video ci dimostra come etichettare e visualizzare singole esocitosi delle vescicole sinaptiche e la tratta di pesci rossi cellule bipolari della retina mediante fluorescenza di riflessione interna totale (TIRF) microscopia.
Abstract
Fluorescenza di riflessione interna totale (TIRF) microscopia è una tecnica che permette lo studio di eventi che accadono a livello della membrana cellulare, con immagini selettivo di molecole fluorescenti che sono più vicini ad una sostanza alto indice di rifrazione come il vetro
Protocollo
Parte 1: Dissection e cella di isolamento bipolare
- Preparare le soluzioni di cui alla tabella 2; Il pH delle suonerie '(esterni) le soluzioni devono essere regolato a 7,4 con NaOH e il pH della soluzione interna deve essere regolato a 7,2 con CsOH. Proteggere la soluzione dalla luce interna con foglio di alluminio e conservarlo a 4 ° C fino all'utilizzo;
- Dark-adattare un pesce rosso per almeno 30 minuti prima della dissezione;
- Mentre l'animale scuro si adatta, preparare 5 ml di ialuronidasi (ialuronidasi tipo V, 1100 unità / mL in basso Ca 2 + Ringer, Sigma, St. Louis, MO) e 10 mL di L-cisteina (0,5 mg / mL in basso Ca 2 + Ringer) soluzioni e pesare la papaina (polvere liofilizzata, 40 unità / ml; Sigma, St. Louis, MO) per 5 ml di soluzione digestione;
- Euthanize il pesce rosso per decapitazione veloce con le forbici chirurgiche e distruggere il cervello e il midollo spinale con una lama di bisturi # 11;
- Rimuovere gli occhi distruggendo i muscoli extraoculari con l'aiuto di una pinza # 7 curve Dumont e il taglio del nervo ottico con le forbici iris;
- Mettere una lampadina occhio su un pezzo di carta da filtro e forare il limbo sclerale con la punta della lama di un bisturi # 11;
- Introdurre la lama di un paio di forbici Vännäs all'interno del tutto forato e tagliato l'intero segmento anteriore lontano;
- Posizionare un piccolo pezzo di carta da filtro in cima alla coppa rimanenti ottica ed esercitare una certa pressione al fine di avere la carta bagnare con vitreo;
- Sollevare la carta da filtro con la retina ad esso e tagliare il nervo ottico con un par di forbici Vännäs;
- Trasferire il filtro contenente la retina in un piatto di plastica 35 millimetri con soluzione cultura ialuronidasi e staccare la retina dalla carta da filtro con l'aiuto di pinzette Dumont # 7;
- Tagliare la retina in 4-6 pezzi con metà di un industriale in acciaio al carbonio singolo taglio della lama e lasciare riposare nella soluzione ialuronidasi per 20 minuti;
- In attesa di ialuronidasi abbiano effetto, aggiungere 5 ml di L-cisteina soluzione alla papaina e lasciare riposare fino a quando il liquido diventa trasparente (circa 5-10 minuti);
- Lavate i pezzi di retina 3x a basso Ca 2 + Ringer e farli sedere nella soluzione di papaina per 30-35 minuti;
- Lavate i pezzi di retina 3x a basso Ca 2 + Ringer e conservarli fino al momento dell'uso a 4 ° C in un piatto da 35 millimetri cultura di plastica contenente basso Ca 2 + di Ringer;
- Dissociare le cellule, mettere un pezzo di retina in una provetta contenente 500 ml di basso Ca 2 + Ringer e lentamente triturare la retina pipettando su e giù con una dissociazione pipetta di vetro, con attenzione per non produrre eventuali bolle d'aria. Pipette dissociazione sono fabbricati con il riscaldamento fino alla punta di una pipetta Pasteur di vetro con un becco Bunsen e piegando leggermente con l'aiuto di pinze anatomiche;
- Piastra le cellule isolate aggiungendo una goccia di sospensione della retina ad un fatto in casa da camera di registrazione precedentemente riempiti con 2 ml di basso Ca 2 + Ringer. La camera è costituito dalla metà inferiore di un 35 mm, piatto di plastica con la cultura nel suo complesso circolare nel mezzo e un coprioggetto circolare in vetro di 1,78 indice di rifrazione (PlanOptik, Germania) incollati al fondo con un elastomero di silicone (Sylgard 184; Dow Corning , Midland, MI).
Parte 2: cella di carico bipolare e Wash Out
TIRF immagini delle vescicole sinaptiche è meglio effettuato con un obiettivo di tipo TIRFM microscopio con un obiettivo molto alto NA e una macchina fotografica sensibile. Per i nostri esperimenti, abbiamo scelto di usare un obiettivo NA 1,65 (Apo x100 O HR, NA 1.65, Olympus, Giappone) con un EMCCD (Cascade 512B, Roper Scientific, Tucson, AZ). L'uso del obiettivo molto alto NA richiede l'uso di coprioggetto di vetro ad alta rifrazione e fluido ad immersione (di-iodomethane con lo zolfo). Nelle nostre condizioni, luce di eccitazione è limitato a un campo diminuisce in modo esponenziale con una lunghezza costante di circa 50 nm.
- Aggiungere una goccia di liquido ad alto indice di rifrazione (serie M, indice di rifrazione = 1,7800, Cargille Labs, Cedar Grove, NJ) con l'obiettivo microscopio;
- Posizionare la camera di registrazione con attenzione sulla parte superiore del microscopio e l'obiettivo con cura il montaggio dell'elettrodo di massa e l'uscita del tubo superfusione alla camera;
- Lasciate camera di sedersi sul microscopio per 10-20 minuti per consentire alle cellule di affondare e di aderire al fondo;
- Nel frattempo, preparare 5 ml di una Trolox 1mM ® ((±)- 6-idrossi-2 ,5,7,8-tetramethylchromane-2-carbossilico, Sigma, St. Louis, MO) una soluzione di alta K + Ringer . Sonicare fino a completa dissoluzione;
- Preparare 15 mL di ADVASEP-7 soluzione di lavaggio: 1 mM ADVASEP-7 (Sigma, St. Louis, MO) a basso Ca 2 + Ringer. Si noti che ADVASEP-7 uso è facoltativo e può essere omesso se lo si desidera;
- Spurgare il li superfusionesoluzione NES e aggiungere ADVASEP-7 di lavaggio, basso Ca 2 + suoneria e il controllo della suoneria al sistema superfusione;
- Tirare carico pipette da pareti sottili in vetro borosilicato (Kwik-Fil ® TW150-3; WPI, Sarasota, FL). Puffer resistenze pipetta sono nella gamma 1,5-2,5 MΩ;
- Preparare la FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutylamino) styryl) piridinio dibromuro "confezione speciale"; Invitrogen, Carlsbad, CA) soluzioni. In primo luogo, fare un 1 mM magazzino con l'aggiunta di 160 microlitri di acqua distillata per un flaconcino (100 mg) di FM1-43 ®. Questo stock può essere conservato a 4 ° C per un massimo di una settimana. Poi, aggiungere 5 ml di FM1-43 ® a 1 ml di alta K + suoneria + di 1 mM Trolox ®. Proteggere la soluzione dalla luce con un foglio di alluminio e conservarlo a 4 ° C fino all'utilizzo;
- Girare la brillante luce campo ottico e la ricerca delle cellule bipolari intatto. Leggermente toccare il microscopio per fare in modo che i neuroni sono saldamente attaccato al fondo della camera;
- Posizionare la penna superfusione vicino alla cella di interesse e profumato continua la preparazione con un basso Ca 2 + Ringer;
- Spegnere le luci della stanza e aggiungere un filtro passa lunghe rosso (cioè RG630, Schott, Germania) per il percorso ottico per ridurre al minimo l'eccitazione del colorante FM;
- Riempire una pipetta di carico con 10 microlitri della soluzione colorante FM, montare la pipetta nel micromanipolatore e abbassare la pipetta sulla preparazione senza sovrapressione fino a quando non è sullo stesso piano focale, come la cellula bipolare che si desidera caricare. Assicurarsi di avere almeno due portaelettrodi: quello usato per la tintura FM non può essere utilizzato per la patch di bloccaggio, altrimenti potrebbero contaminare la soluzione intracellulare;
- Posizionare l'apertura palla a una distanza di circa 10 micron dal terminale dell'assone, spegnere il sistema superfusione off e sfoglia la soluzione colorante per 10 secondi, girando la sovrapressione pipetta sulla;
- Girare la sovrapressione off e, senza muovere la pipetta, attendere per 30 secondi;
- Girare il superfusione su e fare il bagno della camera in ADVASEP-7 soluzione per 5 minuti. Nel frattempo, togliere la pipetta palla dal bagno;
- Dopo 5 minuti, passare al basso Ca 2 + suoneria e profumato della camera per 25-30 minuti per permettere la rimozione del colorante in eccesso.
Parte 3: Patch di serraggio e TIRFM Imaging
- Mentre la preparazione sta lavando fuori, tirare pipette patch da pareti spesse in vetro borosilicato (B150-86-10; Instrument Company Sutter, Novato, CA). Patch resistenze pipetta sono MΩ 8-10 gamma;
- Dopo wash out è completa, posizionare il terminale assone al centro del campo di vista;
- Riempire una pipetta di patch con 7μL di soluzione interna, toccare la pipetta per liberarsi di bolle d'aria, cappotto la pipetta con fuso impronte dentarie (Sticky Cera; Kerr Corporation, Orange, CA) e montarlo nel micromanipolatore;
- Girare la sovrapressione pipetta sulla e abbassare la pipetta lentamente sulla preparazione. Controllare la resistenza pipetta in dell'amplificatore e offset pipetta corretta e capacità con i controlli amplificatore rispettive;
- Accendere il superfusione per controllare la suoneria. Per creare un gigaseal tra la pipetta e la cellula, un po 'toccare la punta dell'elettrodo contro il corpo cellulare e girare la sovrapressione pipetta off mentre delicatamente applicando una pressione negativa per l'elettrodo;
- Mentre sigillato, scegliere "a cellula intera" modalità dell'amplificatore e impostare la cella di detenzione potenziale a -60 mV;
- Scegli una regione di interesse con il software di imaging che comprende tutto il terminal assone, spegnere la luce campo e fuori, con una breve esposizione (30 ms) il terminale al laser 488 nm, trovare il giusto piano focale per TIRF per immagini;
- Pausa nella cella utilizzando il comando "zap" dell'amplificatore, mentre applicando una pressione leggermente negativa per la pipetta;
- Corretto per capacità delle cellule e la resistenza serie, e quindi applicare il protocollo di tensione di interesse, mentre l'imaging del movimento delle vescicole sinaptiche. E 'in questa fase importante avere il protocollo di tensione sincronizzato con il frame rate della telecamera. Nel nostro caso, ogni fotogramma è di 30 ms lunga, quindi i cambiamenti di tensione si verificano in multipli di questo valore (cioè ogni 300 ms o 10 fotogrammi);
- Attendere almeno 40 secondi tra le prove per consentire il recupero;
- Per controllare la posizione dei nastri sinaptici, scattare foto mentre si accende il laser a 561 nm.
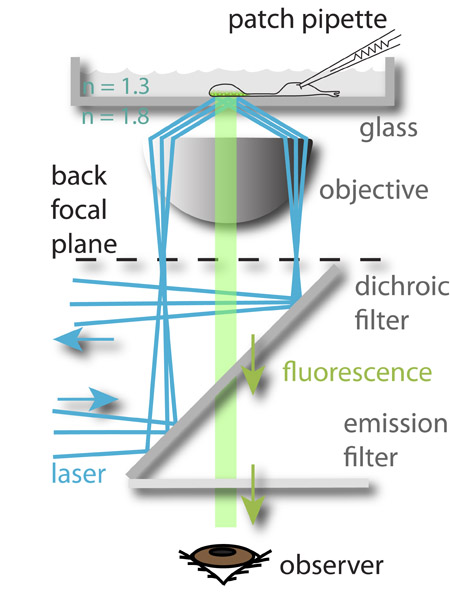
Figura 1: Il setup sperimentale. Un laser a 488 nm (blu) è focalizzata alla periferia del piano focale posteriore dell'obiettivo e soffre riflessione interna totale quando raggiunge il vetro acquoso interfaccia media. Il campo elettromagnetico generato dal raggio riflesso eccita il fluoroforo caricato nel vescicole sinaptiche più vicino al bottom della camera di vetro, che poi fluorescenti (verde). La luce fluorescente viene poi guidato all'occhio dell'osservatore (raffigurato) o di una telecamera CCD. Il potenziale di membrana delle cellule è controllata ripreso contemporaneamente da loro patch-bloccaggio. Questo approccio permette lo studio del rapporto tra i segnali in arrivo (la tensione di membrana) e l'uscita neuronale (esocitosi).
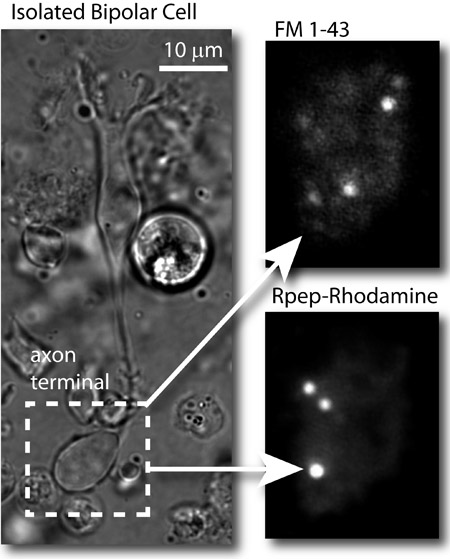
Figura 2: I risultati tipici. Sinistra: immagine in campo chiaro di una cellula isolata bipolare pesci rossi. In alto a destra: immagine TIRF delle vescicole sinaptiche nel terminale assone delle cellule bipolari caricato con FM 1-43 ® e ripreso con il nm laser 488 (FM colorante). In basso a destra: l'immagine del terminale stesso dopo aver patchato la cellula e di imaging il terminale assone con il laser a 561 nm. Nastri sinaptici sono etichettati dalla rodamina-based Ribeye di legame peptidico (Rpep_rhod).
Tabella 1: Reagenti e attrezzature specifiche.
Nome | Tipo | Fabbricante | Catalogo | Commento |
| - | Air Tabella | Newport Corporation | - | - |
| IX70 | Microscopio invertito | Olimpo | - | Dotato di una lampada al tungsteno per campo chiaro e una porta laterale per l'apertura TIRF |
| TH4-100 | Alimentazione lampada | Olimpo | - | - |
| FF498_581-DI01 | Dicroico Filtro | Semrock | - | - |
| NF01-405_488_568 | Emissione Filtro | Semrock | - | - |
| Apo x100 O HR | Obiettivo | Olimpo | - | NA 1,65 |
| RG630 | Red Glass Filter | Schott | - | - |
| - | 488 nm laser | Coerente | - | Uso alla minima potenza |
| - | Otturatore | Uniblitz | - | - |
| VMM-D1 | Shutter driver | Uniblitz | - | - |
| - | 561 nm laser | Melles Griot | - | - |
| - | Otturatore | Uniblitz | - | - |
| VMM-D3 | Shutter driver | Uniblitz | - | - |
| Perfusione pressione Kit | Superfusione sistema | Automatizzare scientifico | 09-04 | - |
| Perfusione Penna | Superfusione sistema | Automatizzare scientifico | - | - |
| ValveLink 8 | Superfusione System Controller | Automatizzare scientifico | - | - |
| Cascade 512B | EM CCD | Roper Scientific | - | - |
| Metamorph 7,1 | Imaging Software | Molecular Devices | - | - |
| EPC-9 | Patch Morsetto Amplificatore | HEKA Elektronik | - | - |
| Impulso | Amplificatore Software | HEKA Elektronik | - | - |
| MP-285 | Micromanipolatore | Sutter strumento | - | - |
| - | Porta elettrodo | HEKA Elektronik | - | Per 1,5 mm di diametro in vetro, 2 unità |
| Kwik-Fil ® TW150-3 | Capillare di vetro borosilicato | WPI | - | Senza filamento |
| B150-86-10 | Capillare di vetro borosilicato | Sutter strumento | - | Con filamento |
| P-97 | Microelettrodo Puller | Sutter strumento | - | Dotato di filamento box 3x3 e camera ambientale |
| - | Pressione pompa a vuoto d'aria | Thomas scientifico | 7893B05 | Crea vuoto per rimuovere i liquidi da camera e sovrapressione per pipette |
| MatLab R2008a | Software per l'analisi | The MathWorks | - | - |
| 353001 | Piatti 35 millimetri Cultura Plastica | Falco | - | - |
| - | Alto indice di rifrazione di vetro | PlanOptik | - | Indice di rifrazione 488 nm = 1,78 |
| Serie M | Alto indice di rifrazione liquido | Cargille Labs | - | Indice di rifrazione = 1.78 |
| Sylgard 184 | Silicone elastomero Kit | Dow Corning | - | - |
| Glutatione | Tripeptide | EMD chimici | Libero radical scavenger | |
| Ialuronidasi | Enzima | Sigma | H6254 | Tipo V |
| L-cisteina | Amino Acid | Fluka | 30090 | Attiva la papaina |
| Papaina | Enzima | Fluka | 76220 | Dalla Carica papaya |
| Trolox ® | Solubile vitamina E | Sigma | 56510 | Scavenger radicali liberi |
| ADVASEP-7 | Solfonati B-ciclodestrina derivati | Sigma | A3723 | Riduce FM 1-43 ® fluorescenza di fondo |
| FM 1-43 ® | Colorante fluorescente | Invitrogen | T35356 | "Confezione speciale" |
| Cera appiccicoso | Pipetta di rivestimento agente | Kerr Corporation | - | Diminuisce la capacità pipetta |
Tabella 2: soluzioni fisiologiche utilizzate in questo studio.
Sostanza | Basso Ca 2 + Ringer | Controllo di Ringer | Alta K + Ringer | Soluzione interna |
| NaCl | 120 mm | 120 mm | 97,5 mm | - |
| KCl | 2,5 mM | 2,5 mM | 25 mM | - |
| MgCl 2 | 1 mM | 1 mM | 1 mM | 4 mM |
| CaCl 2 | 0,5 mM | 2,5 mM | 2,5 mM | - |
| HEPES | 10 mM | 10 mM | 10 mM | 10 mM |
| EGTA | 0,75 mm | - | - | 0,5 mM |
| Glucosio | 10 mM | 10 mM | - | - |
| Glutatione | 2 mM | 2 mM | - | 1 mM |
| * CH 3 CSO 3 S | - | - | - | 100 mM |
| TEACl | - | - | - | 10 mM |
| ATP-Mg | - | - | - | 10 mM |
| GTP-Li | - | - | - | 1 mM |
| Rpep-Rhod ** | - | - | - | 5 mM |
| Volume | 200 mL | 100 ml | 5 microlitri | 100 ul |
* Metanosolfonato cesio.
** Ribeye vincolante peptide: rodamina + EQTVPVDLSVARDR-COOH (mw 1.997,75).
Discussione
I vantaggi di tipo oggettivo-microscopia TIRF sono che: 1) fornisce un'eccellente sezionamento ottico limitando luce di eccitazione ad una regione ristretta all'interno del piano focale dell'obiettivo, minimizzando così out-of-focus luce, 2) in quanto la luce diminuisce esponenzialmente con la distanza , il movimento in direzione verticale può essere monitorato come un cambiamento di intensità di fluorescenza, 3) la raccolta efficiente luce attraverso l'obiettivo ad alta apertura numerica 1,5.
Il principale svantaggio di questa tecnica è che è limitato agli eventi di imaging accadendo nel raggio di 100 nm e della superficie cellulare, che è grosso modo equivalente a una sezione ultrasottile in microscopia elettronica. Pertanto, la visualizzazione di questi eventi dipende in modo critico sulle cellule di essere saldamente aderito al vetro, alla presenza di nastri sinaptica nei pressi del patch di membrana aderito al vetro e sul carico di successo di vescicole. Il nostro protocollo permette il caricamento di solo 1-2% del numero totale di vescicole all'interno della cellula bipolare terminale sinaptico 2,6. Detto questo, è chiaro che ci sono eventi molto di più accade sulla superficie cellulare di quelli che sono in grado di immagine.
Riconoscimenti
Questo lavoro è stato sostenuto da NIH di Grant EY 14990.
Riferimenti
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon