Method Article
L'exocytose imagerie dans les cellules bipolaires rétine par microscopie TIRF
Dans cet article
Résumé
Dans cette vidéo, nous démontrons comment étiqueter et de visualiser seule exocytose des vésicules synaptiques et la traite des cellules rétiniennes bipolaires poissons rouges en utilisant la fluorescence totale internes réflectance (FRBR) microscopie.
Résumé
Réflectance interne totale de fluorescence (FRBR) microscopie est une technique qui permet l'étude des événements qui se déroulent à la membrane cellulaire, l'imagerie par sélectif des molécules fluorescentes qui sont proches d'une substance indice de réfraction élevé, comme le verre
Protocole
Partie 1: Dissection et isolement des cellules bipolaires
- Préparer des solutions énumérées dans le tableau 2; Le pH de sonneries '(extérieurs) des solutions devraient être ajusté à 7,4 avec NaOH et le pH de la solution interne devrait être ajusté à 7,2 avec CsOH. Protéger la solution interne de la lumière avec du papier aluminium et gardez à 4 ° C jusqu'à leur utilisation;
- Dark-adapter un poisson rouge pendant au moins 30 minutes avant la dissection;
- Alors que l'animal s'adapte sombre, préparer 5 ml de hyaluronidase (V hyaluronidase type, 1100 unités / ml à faible Ca 2 + de Ringer; Sigma, St. Louis, MO) et 10 mL de la L-cystéine (0,5 mg / ml à faible Ca 2 + de Ringer) et peser les solutions papaïne (poudre lyophilisée, 40 unités / ml; Sigma, St. Louis, MO) pour 5 mL de la solution de digestion;
- Euthanasier les poissons rouges par décapitation rapide avec des ciseaux chirurgicaux et détruire le cerveau et la moelle épinière avec une lame de bistouri n ° 11;
- Retirer les yeux en détruisant les muscles extra-oculaires à l'aide d'une pince Dumont # 7 courbes et couper le nerf optique avec des ciseaux iris;
- Ampoule oeil seul endroit sur un morceau de papier filtre et perforer le limbe scléral avec la pointe d'une lame de bistouri n ° 11;
- Introduire la lame d'une paire de ciseaux Vannas l'intérieur de la totalité percé et coupé l'ensemble du segment antérieur de suite;
- Placer un petit morceau de papier filtre sur le dessus de la tasse restante optique et exercer une certaine pression afin d'avoir le papier tremper avec humeur vitrée;
- Soulevez le papier filtre avec la rétine attachée à lui et couper le nerf optique d'une valeur nominale de ciseaux Vannas;
- Placez le papier filtre contenant de la rétine dans un plat de culture en plastique de 35 mm avec une solution de hyaluronidase et de décoller la rétine du papier filtre à l'aide d'une pince à épiler Dumont n ° 7;
- Couper la rétine en 4-6 morceaux avec la moitié d'un acier au carbone industrielles seul tranchant de lame et laisser reposer dans la solution de hyaluronidase pendant 20 minutes;
- En attendant la hyaluronidase pour prendre effet, ajouter 5 ml de la solution de L-cystéine à la papaïne et laisser reposer jusqu'à ce que le liquide devient transparent (environ 5-10 minutes);
- Lavez les morceaux de la rétine 3x à faible Ca 2 + de Ringer et laissez-les reposer dans la solution papaïne pendant 30-35 minutes;
- Lavez les morceaux de la rétine 3x à faible Ca 2 + de Ringer et de les stocker jusqu'à utilisation à 4 ° C dans une boîte de culture en plastique de 35 mm contenant une faible Ca 2 + de Ringer;
- Pour dissocier les cellules, mettre un morceau de la rétine dans un microtube contenant 500 ml de faible teneur en Ca 2 + de Ringer et lentement triturer la rétine par l'aspiration et refoulement avec une pipette en verre de dissociation, soigneusement pour ne pas produire les bulles d'air. Pipettes de dissociation sont fabriqués par chauffage jusqu'à la pointe d'une pipette Pasteur en verre avec un bec Bunsen et légèrement plier à l'aide d'une pince anatomique;
- Assiette des cellules isolées en ajoutant une goutte de la suspension rétiniennes à un home-made chambre d'enregistrement préalablement remplie avec 2 ml de faible teneur en Ca 2 + de Ringer. La chambre se compose de la moitié inférieure d'un plat de 35 mm de culture en plastique avec un ensemble de circulaires au milieu et une lamelle de verre circulaire de 1,78 indice de réfraction (PlanOptik, Allemagne) collé au fond d'un élastomère de silicone (Sylgard 184; Dow Corning , Midland, MI).
Partie 2: Chargement cellule bipolaire et Wash Out
FRBR imagerie des vésicules synaptiques est mieux réalisée à l'aide d'un microscope TIRFM objectif de type avec un objectif très élevé NA et une caméra sensible. Pour nos expériences, nous avons choisi d'utiliser un objectif de 1,65 NA (Apo O x100 RH, NA 1,65, Olympus, Japon) avec une EMCCD (Cascade 512B, Roper Scientific, Tucson, AZ). L'utilisation de l'objectif très élevé NA nécessite l'utilisation de lamelles de verre de haute réfraction et liquide d'immersion (di-iodométhane avec du soufre). Dans nos conditions, la lumière d'excitation est limitée à un champ de décroissance exponentielle avec une longueur constante d'environ 50 nm.
- Ajouter une goutte de liquide à indice de réfraction élevé (série M, l'indice de réfraction = 1,7800, Cargille Labs, Cedar Grove, New Jersey) à l'objectif du microscope;
- Placez la chambre d'enregistrement attentivement sur le dessus de l'objectif du microscope et soigneusement monter électrode de terre et le tuyau de sortie à la chambre de surfusion;
- Laissez-chambre de s'asseoir sur microscope pour 10-20 minutes pour permettre aux cellules de l'évier et adhérer au fond;
- En attendant, préparer 5 ml d'une trolox 1mM ® ((±)- 6-hydroxy-2 ,5,7,8-tetramethylchromane-2-carboxylique; Sigma, St. Louis, MO) solution dans K + haute Ringer . Soniquer jusqu'à dissolution;
- Préparer 15 ml de solution ADVASEP-7 à laver: 1 mM ADVASEP-7 (Sigma, St. Louis, MO) à faible Ca 2 + de Ringer. Notez que ADVASEP-7 l'utilisation est facultative et peut être omise si désiré;
- Purger la li surfusionsolution de NDA et ajouter ADVASEP-7 à laver, faible teneur en Ca 2 + de la sonnerie et le contrôle de la sonnerie au système de surfusion;
- Tirez de chargement pipettes de parois minces en verre borosilicate (Kwik-FIL ® TW150-3; WPI, Sarasota, Floride). Puffer résistances pipette sont dans la gamme de 1.5 à 2.5 MQ;
- Préparer le FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutylamino) styryle) pyridinium dibromure, "emballage spécial"; Invitrogen, Carlsbad, CA) des solutions. Tout d'abord, faire un bouillon de 1 mM en ajoutant 160 uL d'eau distillée dans un flacon (100 mg) de FM1-43 ®. Ce stock peut être conservé à 4 ° C pendant jusqu'à une semaine. Ensuite, ajoutez 5 pi de FM1-43 ® à 1 mL de haute K + + ® Ringer 1mM trolox. Protéger la solution de la lumière avec du papier aluminium et gardez à 4 ° C jusqu'à leur utilisation;
- Tournez la lumière microscope en champ lumineux et rechercher des cellules bipolaires intacte. Légèrement appuyez sur le microscope pour s'assurer que les neurones sont fermement attachés à la partie inférieure de la chambre;
- Position du stylo surfusion proche de la cellule d'intérêt et de permanence perfuser la préparation avec faible teneur en Ca 2 + de Ringer;
- Éteignez les lumières ambiante et ajouter un rouge longue passe de filtre (c'est à dire RG630; Schott, Allemagne) pour le chemin optique de minimiser l'excitation du colorant FM;
- Remplir une pipette de chargement avec 10 ul de la solution de colorant FM, monter la pipette dans le micromanipulateur et inférieure de la pipette sur la préparation sans surpression jusqu'à ce qu'il soit au même plan focal que la cellule bipolaire que vous voulez charger. Assurez-vous d'avoir au moins deux porte-électrodes: celui utilisé pour la teinture FM ne peut pas être utilisé pour patch clamp, ou bien elle peut contaminer la solution intracellulaire;
- Position de l'ouverture pompe à une distance d'environ 10 um de la terminaison axonale, mettez le système hors tension et surfusion feuilletée la solution de colorant pendant 10 secondes en tournant la pipette sur la surpression;
- Tournez la surpression off et, sans déplacer la pipette, attendre 30 secondes;
- Tourner la surfusion et se baigner sur la chambre en ADVASEP-7 solution pendant 5 minutes. En attendant, retirer la pipette pompe de la baignoire;
- Après 5 minutes, passez à faible teneur en Ca 2 + de la sonnerie et perfuser la chambre pendant 25-30 minutes pour permettre le retrait d'un excès de colorant.
Partie 3: patch clamp et imagerie TIRFM
- Alors que la préparation est lavage, tirez les pipettes de patch de parois épaisses en verre borosilicate (B150-86-10; Sutter Instrument Company, Novato, CA). Patch résistances pipette dans les 8-10 MQ large;
- Après laver est terminée, placer le terminal de l'axone dans le centre du champ de vue;
- Remplir une pipette de patch avec 7μL de solution interne, appuyez sur la pipette pour se débarrasser des bulles d'air, le manteau de la pipette avec de la cire fondue dentaires (cire collante; Kerr Corporation, Orange, CA) et le monter dans le micromanipulateur;
- Tournez la surpression pipette sur la pipette et inférieur lentement sur la préparation. Vérifiez la résistance pipette dans l'amplificateur et les décalages pipette correct et la capacité avec les commandes amplificateur respectif;
- Mettez la surfusion de contrôler Ringer. Pour créer un gigaseal entre la pipette et la cellule, légèrement toucher la pointe de l'électrode contre le corps cellulaire et tourner la surpression pipette hors tout doucement appliquant une pression négative à l'électrode;
- Bien scellés, choisissez "cellule entière" mode de l'amplificateur et mis au cachot potentiel de -60 mV;
- Choisissez une région d'intérêt avec le logiciel d'imagerie qui englobe toute la terminaison axonale, allumer la lumière hors champ clair et, par un bref exposé (30 ms), le terminal pour le laser à 488 nm, de trouver le bon plan de convergence pour la FRBR imagerie;
- Pause dans la cellule en utilisant le «zapper» le commandement de l'amplificateur tout en appliquant une pression légèrement négative à la pipette;
- Correct pour la capacité des cellules et la résistance série, puis appliquer le protocole de tension d'intérêt tout en imagerie du mouvement des vésicules synaptiques. Il est à ce stade important d'avoir le protocole de tension synchrone à la cadence caméra. Dans notre cas, chaque image est de 30 ms de temps, donc les changements de tension se produisent dans des multiples de cette valeur (c'est à dire, 300 ms ou 10 images);
- Attendre au moins 40 secondes entre les essais pour permettre la récupération;
- Pour vérifier la position des rubans synaptiques, prendre des photos tout en tournant le laser 561 nm sur.
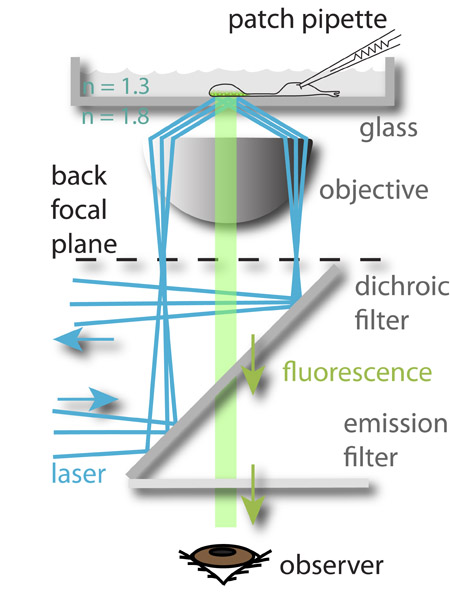
Figure 1: Le montage expérimental. A 488 nm (bleu) laser est focalisé à la périphérie du plan focal arrière de l'objectif et souffre réflexion interne totale quand il atteint le verre aqueuse d'interface moyenne. Le champ électromagnétique généré par le faisceau réfléchi excite le fluorophore chargé dans les vésicules synaptiques plus proche de l'Bottom de la chambre de verre, qui a ensuite fluorescence (vert). La lumière fluorescente est alors guidé vers l'œil de l'observateur (représenté) ou à une caméra CCD. Le potentiel de membrane des cellules imagée est contrôlée simultanément par les patch-clamp. Cette approche permet l'étude de la relation entre les signaux entrants (la tension de membrane) et la sortie des neurones (exocytose).
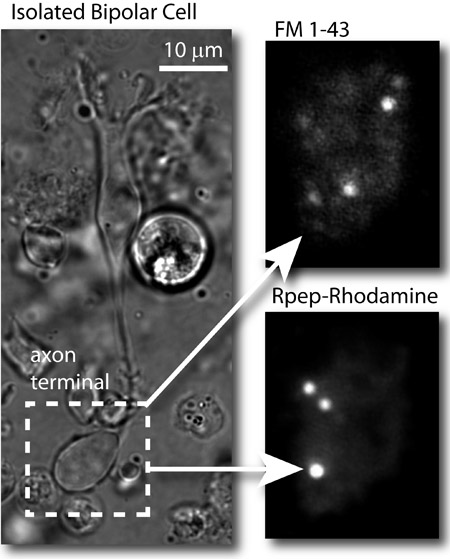
Figure 2: Résultats typiques. A gauche: l'image en champ clair d'une cellule bipolaire poissons rouges isolés. En haut à droite: image TIRF des vésicules synaptiques dans le terminal bipolaires axone des cellules chargées avec FM 1-43 ® et imagés avec le 488 nm (FM colorant) au laser. En bas à droite: image d'un même terminal, après patcher la cellule et l'imagerie de la terminaison axonale avec le laser 561 nm. Rubans synaptiques sont étiquetés par la rhodamine basé RIBEYE peptide de liaison (Rpep_rhod).
Tableau 1: Réactifs et équipements spécifiques.
Nom | Tapez | Fabricant | Catalogue | Commentaire |
| - | Air Table | Newport Corporation | - | - |
| IX70 | Microscope inversé | Olympus | - | Equipé d'une lampe au tungstène pour le champ lumineux et un port ouverture latérale de la FRBR |
| TH4-100 | Source d'alimentation de la lampe | Olympus | - | - |
| FF498_581-DI01 | Filtre dichroïque | Semrock | - | - |
| NF01-405_488_568 | Filtre d'émission | Semrock | - | - |
| Apo x100 O RH | Objectif | Olympus | - | NA 1.65 |
| RG630 | Red Glass Filter | Schott | - | - |
| - | 488 nm Laser | Cohérente | - | Utilisez à la puissance minimale |
| - | Obturateur | Uniblitz | - | - |
| VMM-D1 | Pilote d'obturation | Uniblitz | - | - |
| - | 561 nm Laser | Melles Griot | - | - |
| - | Obturateur | Uniblitz | - | - |
| VMM-D3 | Pilote d'obturation | Uniblitz | - | - |
| Kit de pression de perfusion | Système superfusion | Automatiser scientifique | 09-04 | - |
| Pen perfusion | Système superfusion | Automatiser scientifique | - | - |
| ValveLink 8 | System Controller superfusion | Automatiser scientifique | - | - |
| Cascade 512B | EM caméra CCD | Roper Scientific | - | - |
| Metamorph 7.1 | Logiciel d'imagerie | Molecular Devices | - | - |
| EPC-9 | Amplificateur Patch Clamp | HEKA Elektronik | - | - |
| Pulse | Logiciel Amplificateur | HEKA Elektronik | - | - |
| MP-285 | Micromanipulateur | Instrument Sutter | - | - |
| - | Titulaire d'électrode | HEKA Elektronik | - | Pour en verre 1,5 mm de diamètre extérieur, 2 unités |
| Kwik-FIL ® TW150-3 | Borosilicate capillaire en verre | WPI | - | Sans fil |
| B150-86-10 | Borosilicate capillaire en verre | Instrument Sutter | - | Avec filaments |
| P-97 | Extracteur de microélectrodes | Instrument Sutter | - | Equipé de filaments boîte 3x3 et de la chambre de l'environnement |
| - | Pompe de pression d'air à vide | Thomas scientifique | 7893B05 | Crée à vide pour éliminer les liquides de la chambre et de surpression pour les pipettes |
| MatLab R2008a | Logiciel d'analyse | The MathWorks | - | - |
| 353001 | 35 mm en plastique des boîtes de culture | Falcon | - | - |
| - | Haute de verre à indice de réfraction | PlanOptik | - | Indice de réfraction à 488 nm = 1,78 |
| Série M | Liquide à haute indice de réfraction | Labs Cargille | - | Indice de réfraction = 1,78 |
| Sylgard 184 | Kit élastomère de silicone | Dow Corning | - | - |
| Le glutathion | Tripeptide | EMD Chemicals | Radica gratuitL trésor | |
| Hyaluronidase | L'enzyme | Sigma | H6254 | Type V |
| L-cystéine | Amino Acid | Fluka | 30090 | Active la papaïne |
| La papaïne | L'enzyme | Fluka | 76220 | De Carica papaya |
| Trolox ® | Soluble vitamine E | Sigma | 56510 | Gratuit capteur de radicaux |
| ADVASEP-7 | Sulfonés B-cyclodextrine | Sigma | A3723 | Réduit FM 1-43 ® fond de fluorescence |
| FM 1-43 ® | Colorant fluorescent | Invitrogen | T35356 | "Un emballage spécial" |
| Cire collante | Agent d'enrobage pipette | Kerr Corporation | - | Diminue la capacité pipette |
Tableau 2: des solutions physiologiques utilisées dans cette étude.
Substance | Faible Ca 2 + de Ringer | Contrôle de Ringer | High K + Ringer | Solution interne |
| NaCl | 120 mM | 120 mM | 97,5 mm | - |
| KCl | 2,5 mM | 2,5 mM | 25mM | - |
| MgCl 2 | 1 mM | 1 mM | 1 mM | 4 mM |
| CaCl 2 | 0,5 mM | 2,5 mM | 2,5 mM | - |
| HEPES | 10 mM | 10 mM | 10 mM | 10 mM |
| EGTA | 0,75 mM | - | - | 0,5 mM |
| Le glucose | 10 mM | 10 mM | - | - |
| Le glutathion | 2 mM | 2 mM | - | 1 mM |
| CH 3 CsO 3 S * | - | - | - | 100 mM |
| TEACl | - | - | - | 10 mM |
| ATP-Mg | - | - | - | 10 mM |
| GTP-Li | - | - | - | 1 mM |
| RPEP-Rhod ** | - | - | - | 5 mM |
| Volume | 200 ml | 100 ml | 5 ul | 100 uL |
* Méthanesulfonate de césium.
** RIBEYE peptide de liaison: la rhodamine + EQTVPVDLSVARDR-COOH (MW 1997,75).
Discussion
Les avantages de l'objectif de type microscopie TIRF sont que 1) il fournit une excellente sectionnement optique en limitant la lumière d'excitation à une région étroite dans le plan focal de l'objectif, minimisant ainsi les focus-du-léger; 2) car la lumière tombe exponentiellement avec la distance , le mouvement dans une direction verticale peut être surveillé comme un changement dans l'intensité de fluorescence; 3) la collecte efficace de la lumière à travers l'objectif d'ouverture numérique élevée 1,5.
Le principal inconvénient de cette technique est qu'elle est limitée à des événements d'imagerie passe au sein de 100 nm et de la surface cellulaire, ce qui équivaut grosso modo à une section ultra en microscopie électronique. Par conséquent, la visualisation de ces événements dépend de façon critique sur les cellules étant fermement adhéré à la vitre, sur la présence de rubans synaptiques à proximité du patch de membrane adhéré au verre et sur le chargement réussi de vésicules. Notre protocole permet le chargement de seulement 1-2% du nombre total de vésicules au sein du terminal de cellules bipolaires synaptique 2,6. Cela dit, il est clair qu'il ya des événements beaucoup plus passe à la surface cellulaire que celles que nous sommes en mesure de l'image.
Remerciements
Ce travail a été soutenu par des subventions du NIH EY 14990.
Références
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon