Method Article
Imágenes de exocitosis en las células bipolares de retina con microscopía TIRF
Resumen
En este video, que muestra cómo la etiqueta y visualizar solo exocitosis de vesículas sinápticas y el tráfico en las células de la retina con peces de colores bipolar total de fluorescencia de reflexión interna (TIRF) microscopía.
Resumen
Total de reflexión interna de fluorescencia (TIRF) microscopía es una técnica que permite el estudio de los acontecimientos que suceden en la membrana celular, por la imagen selectiva de moléculas fluorescentes que están más cerca de una sustancia alto índice de refracción, como el vidrio
Protocolo
Parte 1: La disección y aislamiento de células bipolares
- Preparar las soluciones en la Tabla 2, el pH de timbres "(externo) de soluciones debe ajustarse a 7,4 con NaOH y el pH de la solución interna debe ser ajustado a 7,2 con CsOH. Proteja la solución interna de la luz con papel de aluminio y conservar a 4 ° C hasta su uso;
- Dark-un pez de colores para adaptarse al menos 30 minutos antes de la disección;
- Mientras que el animal se adapta oscuro, preparar 5 ml de la hialuronidasa (tipo hialuronidasa V, 1100 unidades / ml de bajo Ca 2 + de Ringer, Sigma, St. Louis, MO) y 10 ml de la L-cisteína (0,5 mg / ml en el bajo Ca 2 +) del timbre de soluciones y sopesar la papaína (polvo liofilizado, 40 unidades / ml, Sigma, St. Louis, MO) de 5 ml de la solución de digestión;
- La eutanasia de los peces de colores por decapitación rápida con tijeras quirúrgicas y destruir el cerebro y la médula espinal con una hoja de bisturí # 11;
- Quitar los ojos por la destrucción de los músculos extraoculares con la ayuda de unas pinzas Dumont # 7 curvas y el corte del nervio óptico con tijera iris;
- Colocar un ojo bulbo en un pedazo de papel de filtro y perforar el limbo escleral con la punta de una hoja de bisturí # 11;
- Introducir la hoja de un par de tijeras Vannas en el conjunto del pinchado y cortado el segmento anterior conjunto de distancia;
- Coloque un pedazo pequeño de papel de filtro en la parte superior de la copa óptica restantes y ejercer presión a fin de que el papel empape con humor vítreo;
- Levante el papel de filtro con la retina que se le atribuye y cortar el nervio óptico con un par de tijeras Vannas;
- Coloque el papel de filtro que contiene la retina en un plato de plástico cultura 35 mm con una solución de hialuronidasa y se desprenda la retina del papel de filtro con la ayuda de unas pinzas Dumont # 7;
- Corte de la retina en 4-6 piezas con la mitad de un acero industrial de carbono de un solo filo hoja y dejar que repose en la solución de hialuronidasa durante 20 minutos;
- A la espera de hialuronidasa a surtir efecto, añadir 5 ml de la solución de L-cisteína a la papaína y dejar reposar hasta que el líquido se vuelve transparente (aproximadamente 5-10 minutos);
- Lave las piezas de la retina 3x de bajo Ca 2 + de Ringer y dejar que repose en la solución de papaína durante 30-35 minutos;
- Lave las piezas de la retina 3x de bajo Ca 2 + de Ringer y almacenarlos hasta su uso a 4 ° C en una placa de cultivo de 35 mm de plástico con bajo Ca 2 + de Ringer;
- Para disociar las células, poner un pedazo de retina en un tubo de microcentrífuga que contiene 500 ml de bajo Ca 2 + de timbre y lentamente se tritura la retina con la pipeta hacia arriba y hacia abajo con una pipeta de vidrio de disociación, con cuidado de no producir burbujas de aire. Pipetas de disociación se fabrican mediante el calentamiento de la punta de una pipeta Pasteur de vidrio con un mechero de Bunsen y ligeramente curvado, con la ayuda de unas pinzas anatómicas;
- Placa de las células aisladas mediante la adición de una gota de la suspensión de la retina a un casero de grabación de cámara previamente llenada con 2 mL de bajo Ca 2 + de Ringer. La cámara se compone de la mitad inferior de una placa de cultivo de 35 mm de plástico con un conjunto circular en el centro y un cubreobjetos circular de cristal de 1,78 de índice de refracción (PlanOptik, Alemania), pegado a la parte inferior con un elastómero de silicona (Sylgard 184, Dow Corning , Midland, MI).
Parte 2: Carga de la célula bipolar y lavar
TIRF imágenes de las vesículas sinápticas se realiza mejor con un microscopio TIRFM objetivo de tipo con un objetivo muy alto NA y una cámara sensible. Para nuestros experimentos, hemos optado por utilizar un 1.65 NA objetivo (Apo x100 O HR, NA 1.65, Olympus, Japón) con un EMCCD (Cascade 512B, la Ciencia Roper, Tucson, AZ). El uso de la NA objetivo muy alto hace necesario el uso de alta refracción cubreobjetos de vidrio y el líquido de inmersión (di-yodometano con azufre). Bajo nuestras condiciones, la luz de excitación se limita a un campo decae de manera exponencial, con una longitud constante de aproximadamente 50 nm.
- Añadir una gota de líquido de alto índice de refracción (serie M, el índice de refracción = 1,7800, Laboratorios Cargille, Cedar Grove, Nueva Jersey) con el objetivo del microscopio;
- Coloque la cámara de registro con cuidado en la parte superior del objetivo de microscopio y cuidado montaje de electrodos de tierra y el tubo de salida a la cámara de superfusión;
- Vamos a sentarse en la cámara de microscopio de 10-20 minutos para permitir que las células se hunda y se adhieren a la parte inferior;
- Mientras tanto, preparar 5 ml de una Trolox ® 1mM ((±)- 6-hidroxi-2 ,5,7,8-tetramethylchromane-2-carboxílico; Sigma, St. Louis, MO) en una solución de alta de K + del timbre . Sonicar hasta que se disuelva;
- Prepare 15 ml de ADVASEP-7 Solución de lavado: 1 mM ADVASEP-7 (Sigma, St. Louis, MO) en el bajo Ca 2 + de Ringer. Tenga en cuenta que ADVASEP-7 uso es opcional y puede omitirse si se desea;
- Purgar la li superfusiónsolución nes y añadir ADVASEP-7 lavado, bajo Ca 2 + del timbre y el control del timbre para el sistema de superfusión;
- Tire de la carga de pipetas de paredes delgadas de vidrio de borosilicato (Kwik-Fil ® TW150-3; WPI, Sarasota, FL). Puffer pipeta resistencias se encuentran en el rango de 1.5 a 2.5 mW;
- Preparar el FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutilamino) estirilo) piridinio dibromuro, "un embalaje especial", Invitrogen, Carlsbad, CA) soluciones. En primer lugar, hacer una acción mediante la adición de 1 mM de 160 l de agua destilada a un vial (100 mg) de FM1-43 ®. Esta población puede mantenerse a 4 ° C durante un máximo de una semana. A continuación, añadir 5 L de FM1-43 ® a 1 ml de alto K + + ® timbre de 1 mM Trolox. Proteja la solución de la luz con papel de aluminio y conservar a 4 ° C hasta su uso;
- A su vez la luz del microscopio de campo claro y buscar para intactas las células bipolares. Ligeramente toque en el microscopio para asegurarse de que las neuronas están firmemente pegados a la parte inferior de la cámara;
- Posición de la pluma de superfusión cerca de la célula de interés y continuamente perfundir la preparación con bajo Ca 2 + de Ringer;
- Apague las luces de la habitación y añadir un filtro de pase largo de color rojo (es decir, RG630, Schott, Alemania) para que el camino óptico para reducir al mínimo la excitación del colorante FM;
- Llenar una pipeta de carga con 10 l de la solución de colorante FM, montaje de la pipeta en el micromanipulador e inferior de la pipeta sobre la preparación, sin exceso de presión hasta que esté en el mismo plano focal como la célula bipolar que desea cargar. Asegúrese de tener al menos dos pinzas de soldadura: la utilizada para el tinte de FM no se puede utilizar para patch clamp, o de lo contrario pueden contaminar la solución intracelular;
- La posición de la apertura de globo a una distancia de unos 10 m de la terminal del axón, a su vez el sistema de superfusión de hojaldre y la solución de colorante durante 10 segundos girando la sobrepresión en la pipeta;
- A su vez el exceso de presión fuera y, sin moverse de la pipeta, espere 30 segundos;
- A su vez la superfusión y se bañan en la cámara en la solución de ADVASEP-7 durante 5 minutos. Al mismo tiempo, eliminar la pipeta de soplado del baño;
- Después de 5 minutos, cambie a la baja de Ca 2 + del timbre y la cámara de perfusión durante 25-30 minutos para permitir la remoción del exceso de tinte.
Parte 3: Revisión de sujeción e Imagen TIRFM
- Mientras que la preparación es lavado, tire pipetas parche de pared gruesa de vidrio de borosilicato (B150-86-10, la compañía de Sutter Instrument, Novato, CA). Parche pipeta resistencias se encuentran en el rango de 8.10 mW;
- Después de lavar se ha completado, coloque el terminal del axón en el centro del campo de visión;
- Llenar una pipeta de parche con 7μL de solución interna, pulse la pipeta para eliminar las burbujas de aire, capa de la pipeta con cera fundida dental (Cera pegajosa, Kerr Corporation, Orange, CA) y montarlo en el micromanipulador;
- A su vez el exceso de presión en la pipeta y baja lentamente la pipeta en la preparación. Compruebe la resistencia de la pipeta en el amplificador y las compensaciones correcta pipeta y capacidad con los controles del amplificador respectivos;
- Cambiar la superfusión para controlar Ringer. Para crear un gigaseal entre la pipeta y la célula, apenas tocar la punta del electrodo contra el cuerpo de la célula y su vez el exceso de presión fuera de la pipeta, mientras que ejerciendo una suave presión negativa al electrodo;
- Mientras sellado, seleccione "célula entera" en el modo de amplificador y ajuste de la célula con un potencial de -60 mV;
- Elija una región de interés con el software de imagen que abarca toda la terminal del axón, a su vez a la luz de campo claro y fuera, con la exposición breve (30 ms) de la terminal con el láser de 488 nm, encontrar el plano focal de la derecha TIRF imágenes;
- Entrar en la célula mediante el "zapping" de comandos del amplificador, mientras que la aplicación de presión ligeramente negativa en la pipeta;
- Correcto para la capacitancia celular y la resistencia en serie, y luego aplicar el protocolo de tensión de interés, mientras que imágenes del movimiento de las vesículas sinápticas. Es en esta etapa tan importante que el protocolo de voltaje sincronizado con la velocidad de fotogramas de la cámara. En nuestro caso, cada cuadro es de 30 ms de largo, por lo que los cambios de tensión se presentan en múltiplos de este valor (es decir, cada 300 ms o marcos 10);
- Espere al menos 40 segundos entre los ensayos para permitir la recuperación;
- Para comprobar la posición de las cintas sinápticas, tomar fotografías mientras se gira el láser de 561 nm en.
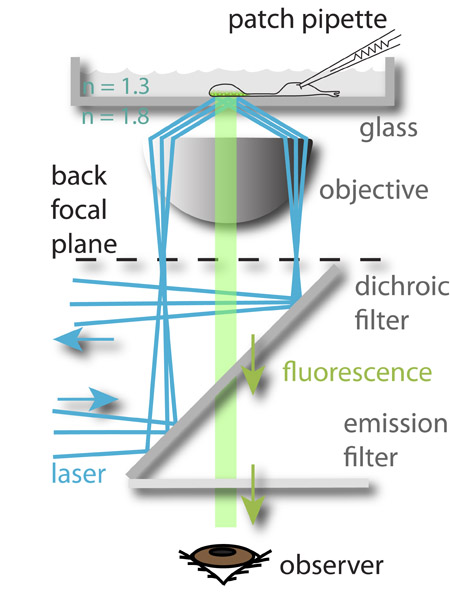
Figura 1: El montaje del experimento. A 488 nm láser (azul) se centra en la periferia del plano focal posterior del objetivo y sufre una reflexión interna total cuando se llega a la copa-acuosa interfaz de mediano plazo. El campo electromagnético generado por el rayo reflejado excita al fluoróforo carga en las vesículas sinápticas más cercano a la bottom de la cámara de vidrio, que luego fluorescente (verde). La luz fluorescente se guía a los ojos del observador (representados) o una cámara CCD. El potencial de membrana de las células de imágenes se controla de forma simultánea por ellos de patch-clamp. Este enfoque permite el estudio de la relación entre las señales de entrada (el voltaje de la membrana) y la salida neuronal (exocitosis).
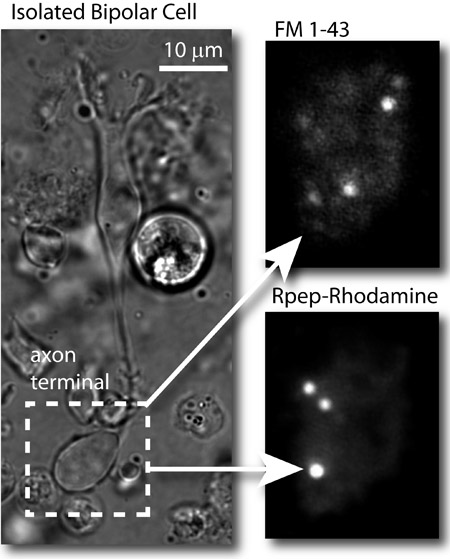
Figura 2: Los resultados típicos. Izquierda: imagen de campo claro de una célula de peces de colores bipolar aislado. Arriba a la derecha: imagen TIRF de las vesículas sinápticas en el terminal del axón bipolar celular cargado con FM 1-43 ® y la imagen con el láser de 488 nm (FM tinte). Abajo a la derecha: imagen de la misma terminal después de un parche en el celular y la imagen de la terminal del axón con el láser de 561 nm. Cintas sinápticas son etiquetados por la rodamina basado RIBEYE de unión de péptidos (Rpep_rhod).
Tabla 1: Reactivos y equipos específicos.
Nombre | Tipo | Fabricante | Catálogo | Comentario |
| - | Tabla de aire | Newport Corporation | - | - |
| IX70 | Microscopio invertido | Olimpo | - | Equipado con una lámpara de tungsteno para campo claro y un puerto de apertura lateral para TIRF |
| TH4-100 | Fuente de alimentación de la lámpara | Olimpo | - | - |
| FF498_581-DI01 | Filtro dicroico | Semrock | - | - |
| NF01-405_488_568 | Filtro de emisiones | Semrock | - | - |
| Apo x100 O HR | Objetivo | Olimpo | - | NA 1,65 |
| RG630 | Red de filtro de vidrio | Schott | - | - |
| - | 488 nm láser | Coherente | - | Utilice la potencia mínima |
| - | Obturador | Uniblitz | - | - |
| VMM-D1 | Conductor del obturador | Uniblitz | - | - |
| - | 561 nm láser | Melles Griot | - | - |
| - | Obturador | Uniblitz | - | - |
| VMM-D3 | Conductor del obturador | Uniblitz | - | - |
| Kit de presión de perfusión | Superfusión sistema | Automatizar la Ciencia | 09-04 | - |
| Perfusión de la pluma | Superfusión sistema | Automatizar la Ciencia | - | - |
| ValveLink 8 | Superfusión controlador del sistema | Automatizar la Ciencia | - | - |
| Cascada 512B | EM cámara CCD | Roper Científico | - | - |
| Metamorph 7.1 | Software de imágenes | Molecular Devices | - | - |
| EPC-9 | Parche amplificador Clamp | HEKA Elektronik | - | - |
| Pulso | Amplificador de Software | HEKA Elektronik | - | - |
| MP-285 | Micromanipulador | Sutter Instrumento | - | - |
| - | Portaelectrodos | HEKA Elektronik | - | De 1,5 mm de diámetro exterior de vidrio, 2 unidades |
| Kwik-Fil ® TW150-3 | Capilar de vidrio de borosilicato | WPI | - | Sin filamento |
| B150-86-10 | Capilar de vidrio de borosilicato | Sutter Instrumento | - | Con filamento |
| P-97 | Microelectrodo Extractor | Sutter Instrumento | - | Equipado con caja de 3x3 y filamento cámara ambiental |
| - | Vacío presión del aire de la bomba | Thomas Scientific | 7893B05 | Crea un vacío para extraer líquidos de la cámara y el exceso de presión para pipetas |
| MatLab R2008a | Análisis de Software | The MathWorks | - | - |
| 353001 | Placas de 35 mm de Cultura de plástico | Halcón | - | - |
| - | De vidrio de alta refracción Índice | PlanOptik | - | Índice de refracción 488 nm = 1,78 |
| Serie M | Refracción de líquidos de alta Índice | Cargille Laboratorios | - | Índice de refracción = 1,78 |
| Sylgard 184 | Kit de elastómero de silicona | Dow Corning | - | - |
| Glutatión | Tripéptido | EMD Chemicals | Libre radical tesoro | |
| Hialuronidasa | Enzima | Sigma | H6254 | Tipo V |
| L-cisteína | Aminoácido | Fluka | 30090 | Activa la papaína |
| Papaína | Enzima | Fluka | 76220 | De Carica papaya |
| Trolox ® | Solubles de vitamina E | Sigma | 56510 | Depurador de radicales libres |
| ADVASEP-7 | Sulfonados B-ciclodextrina | Sigma | A3723 | Reduce el FM 1-43 ® fluorescencia de fondo |
| FM 1-43 ® | Colorante fluorescente | Invitrogen | T35356 | "Embalaje especial" |
| Cera pegajosa | Pipeta agente de recubrimiento | Kerr Corporation | - | Disminuye la capacidad de pipeta |
Tabla 2: Soluciones fisiológicas utilizadas en este estudio.
Sustancia | Bajo Ca 2 + de Ringer | Control del timbre de | Alto contenido de K + de Ringer | Solución interna |
| NaCl | 120 mM | 120 mM | 97,5 mM | - |
| KCl | 2,5 mM | 2,5 mM | 25 mM | - |
| MgCl2 | 1 mM | 1 mM | 1 mM | 4 mM |
| CaCl2 | 0,5 mM | 2,5 mM | 2,5 mM | - |
| HEPES | 10 mM | 10 mM | 10 mM | 10 mM |
| EGTA | 0,75 mM | - | - | 0,5 mM |
| Glucosa | 10 mM | 10 mM | - | - |
| Glutatión | 2 mM | 2 mM | - | 1 mM |
| * CH 3 CsO 3 S | - | - | - | 100 mM |
| TEACl | - | - | - | 10 mM |
| ATP-Mg | - | - | - | 10 mM |
| GTP-Li | - | - | - | 1 mM |
| Rpep Rhod-** | - | - | - | 5 mM |
| Volumen | 200 ml | 100 ml | 5 l | 100 L |
* Metanosulfonato de cesio.
** RIBEYE de unión a péptido: rodamina + EQTVPVDLSVARDR-COOH (mw 1.997,75).
Discusión
Las ventajas de los objetivos de tipo de microscopía TIRF son: 1) que proporciona seccionamiento óptico excelente mediante la restricción de la luz de excitación a una región estrecha en el plano focal del objetivo, minimizando de esta manera fuera del foco de luz, 2) ya que la luz disminuye exponencialmente con la distancia , el movimiento en sentido vertical se puede controlar con un cambio en la intensidad de la fluorescencia, 3) la colección de bajo consumo a través del objetivo de gran apertura numérica de 1,5.
El principal inconveniente de esta técnica es que se limita a los eventos de imágenes pasando a 100 nm y de la superficie celular, lo que equivale aproximadamente a una sección ultrafina de microscopía electrónica. Por lo tanto, la visualización de estos eventos depende fundamentalmente de las células estar firmemente adheridas al vidrio, con la presencia de cintas sinápticas cerca del parche de membrana adherida al vidrio y en la carga de éxito de las vesículas. El protocolo permite la carga de sólo el 1-2% del número total de vesículas dentro de la terminal sináptica 2,6 célula bipolar. Con esto dicho, es claro que hay mucho más sucediendo los acontecimientos en la superficie celular que los que son capaces de imagen.
Agradecimientos
Este trabajo fue apoyado por el NIH subvención EY 14990.
Referencias
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados