세포주기 분석: 세포주기 CFSE 염색 및 유세포 분석을 사용한 자극 후 CD4 및 CD8 T 세포 증식 평가
Overview
출처: 퍼셰 티보1,2,3,뮤니에 실뱅1,2,3,소피 노볼트4,레이첼 골럽1,2,3
1 림프포에이시스 단위, 면역학학과, 파스퇴르 연구소, 파리, 프랑스
2 INSERM U1223, 파리, 프랑스
3 유니버시테 파리 디드로, 소르본 파리 시테, 셀룰레 파스퇴르, 파리, 프랑스
4 흐름 세포측정플리트에서, 세포측정및 바이오마커 UtechS, 번역 과학 센터, 파스퇴르 연구소, 파리, 프랑스
세포 주기는 생활의 보편적인 과정입니다. 세포 주기 도중, 세포는 2개의 딸 세포로 분할하기 위하여 몇몇 수정을 겪습니다. 이 기계장치는 그것의 필요에 응하여 유기체의 생활 내내 생깁니다. 세포 분열과 배아 발달은 단세포 zygote에서 완전한 유기체를 생성합니다. 성인기 동안 세포 주기는 조직 수리와 같은 많은 중요한 생물학적 과정의 중심입니다.
세포 분열의 메커니즘은 세포가 최종 분열 전에 단계별 수정을 겪는 엄격하게 통제된 사건입니다. 사이클에 아직 없는 세포는 갭 0(G0)상에 있는 것으로 설명된다. 이 단계에서 세포는 정지로 간주됩니다. 세포가 순환하기 시작하면 갭 1 (G1),합성 (S), 갭 2 (G2)및 미토시스 (M)의 네 가지 뚜렷한 단계가 인식됩니다. G1 단계는 DNA 합성을 위한 세포에 의해 필요한 자원에 대 한 체크 포인트. 그런 다음, S 상이 발생하고 DNA 복제가 시작되고,G2 interphase, 세포가 분할하는 데 필요한 모든 요소를 제어하는 또 다른 검사점. 마지막으로, 세포는 미토시스에 들어가 두 개의 딸 세포로 나눕니다.
세포 분열은 많은 다른 생물학적 시스템에서 매우 유익한 매개 변수입니다. 면역학 분야에서 백혈구 증식의 분석은 면역 반응의 메커니즘을 나타낼 수 있습니다. 조사의 다른 도메인은 또한 세포 주기 분석에 의존합니다. 예를 들면, 종양 발달 도중 세포 주기의 분석은 암의 우리의 이해를 향상했습니다.
많은 형광염료는 이제 세포 증식을 추적할 수 있습니다. 이러한 염료는 화학 적 특성과 스펙트럼 특성에 다릅니다. 염료의 두 가지 종류가 존재: 단백질 염료 영구적으로 공유 결합을 형성 하 여 단백질과 결합, 그리고 막 염료 안정적으로 강력한 소수성 협회를 통해 세포 막 내에서 상호 작용. 체세포세포에 의한 면역세포 증식의 체외 및 생체 내 연구는 세포 추적 염료(1, 2)의 두 클래스의 가장 일반적인 응용 분야 중 하나이다.
CFSE (Carboxyfluorescein succinimidyl 에스테르)는 세포를 나누는 것을 표시하는 형광 염료입니다. 처음에, 모든 세포는 염료의 동일한 양을 수신; 세포를 나누는 것은 그들의 두 딸 세포 사이에서 수신한 염료를 균등하게 분할합니다. 따라서, 세포 주기는 세포에서 염료 강도의 점진적인 감소에 선행될 수 있다. CFSE 염색은 CFSE 염색 정도(3)에 따라 세포의 현상과 기능적 특성화를 허용하는 고처리량, 형광계 기술인 기존의 다중 파라메트릭 흐름 세포측정법(3)에 선행된다.
다음 실험에서, 우리는 CFSE 염색 및 흐름 세포측정을 사용하여 CD3 자극에 따라 CD4+ 및 CD8+ T 세포의확산을 평가합니다.
Procedure
1. 준비
- 시작하기 전에 실험실 장갑과 적절한 보호 복을 착용하십시오.
- 먼저 세제로 모든 해부 도구를 살균한 다음 70%의 에탄올로 닦은 다음 철저히 닦아냅니다.
- 2% 태아 종아리 혈청(FCS)을 함유한 행크의 균형 잡힌 소금 용액(HBSS)을 50mL준비한다.
2. 해부
- 이산화탄소 전달 시스템을 사용하여 저산소증으로 마우스를 안락사시합니다. supine 위치에 있는 해부 판에 안락사 마우스를 고정하고 가위와 집게를 사용하여 세로 복강경을 수행합니다.
- 집게를 사용하여 복부 오른쪽에 내장과 위를 움직여 위와 비장을 노출시십시오. 비장은 위장에 부착됩니다.
- 집게를 사용하여 조심스럽게 위에서 비장을 분리하고 HBSS 2 % FCS의 5 mL가 들어있는 페트리 접시에 놓습니다.
3. 면역 세포 격리
- 같은 페트리 접시 위에 40 μm 세포 여과기에 비장을 놓습니다. 비장을 플런저로 분쇄하여 해리합니다.
- 해리된 비장과 유체를 15mL 원심분리기 튜브로 옮기.
- 10°C에서 7분 동안 370 x g의 튜브를 원심 분리하고 펠릿을 피하는 상퍼를 폐기하십시오.
- 적혈구를 lyse 칼륨 아세테이트 의 2 mL에 펠릿을 다시 중단. 2 분 기다린 다음 HBSS 2 % FCS를 사용하여 최대 15 mL의 볼륨을 구성하십시오.
- 10°C에서 7분 동안 370 x g로 튜브를 다시 원심 분리합니다. 슈퍼네티드를 버리고 5mL의 HBSS 2% FCS로 펠릿을 다시 놓습니다.
- 트라이판 블루 염색 분석기를 사용하여 세포를 계산하고 HBSS 2% FCS의 적절한 부피를 사용하여 최종 세포 농도를 107 세포/mL로 조정합니다.
4. CFSE 염색 및 T 세포 자극
- 4개의 관에107개의 격리된 비장 세포/튜브를 분배합니다 (15mL 튜브, 1-4로 표시)
- 각 튜브에 3mL HBSS 2% FCS를 추가합니다.
- 각 튜브에 CSFE 1 μL을 추가합니다(최종 농도- 5 μM).
- 튜브를 37°C에서 5% CO2 인큐베이터로 10분 동안 배양합니다.
- 튜브 3 및 4에서는 2.5 μg/mL의 최종 농도에서 HBSS 2% FCS + 안티 CD3 항체의 12mL을 추가합니다. 튜브 3 과 4항 CD3 항체를 사용하여 자극되고, 세포 주기에 미치는 영향을 관찰한다.
- 튜브 1과 2에서 HBSS 2 % FCS의 12 mL을 추가합니다. 튜브 1과 2의 세포는 자극되지 않습니다.
- 원심 분리기는 10 °C에서 7 분 동안 370 x g의 모든 튜브를 합니다. 초월체를 폐기합니다.
- HBSS 2% FCS의 2mL에서 펠릿을 재중단합니다.
- 결과 용액을 6웰 플레이트의 별도의 우물로 옮기.
- 37°C에서 세포를 배양하고 3일 동안 5% CO2를 배양합니다.
5. 셀 염색
- 3일째에는 1, 3번면 2mL HBSS 2%FCS를 추가합니다.
- 적극적으로 파이프와 5 mL FACS 튜브로 샘플을 전송합니다.
- 37°C에서 나머지 세포를 우물 2-4, 5% CO2에서계속 배양한다. 그(것)들은 세포 주기에 자극의 장기 효력을 조사하기 위하여 5일에 분석될 것입니다.
- 10°C에서 7분 동안 370 x g의 튜브원심분리기. 초월체를 폐기합니다.
- 각 튜브에 항체 믹스 100 μL을 추가합니다(표 1참조).
| 항체 | 플루오로크롬 | 희석 |
| CD3 | 퍼시픽 블루 | 1/100 |
| CD4 | BV786 | 1/1600 |
| CD8 | PE | 1/400 |
| Thy1.2 | BV605 | 1/400 |
표 1: 항체 혼합 조성물. 농축 항체 형광 접합및 HBSS를 사용하여 4개의 항체 칵테일 제제.
- 어둠 속에서 얼음에 20 분 동안 튜브를 배양.
- HBSS 2%FCS 1mL을 추가하고 10°C에서 7분 동안 370 x g의 튜브원심분리기를 추가합니다.
- 상체를 버리고 200 μL의 HBSS 2 % FCS에서 펠릿을 다시 중단하십시오.
- 재일시 중단된 펠릿을 새 FACS 튜브로 전송합니다.
- FACS를 사용하여 T 세포 증식을 평가합니다.
- 5일째에, 6웰 플레이트의 나머지 2개의 우물에서 세포로 세포 염색 과정을 반복한다.
6. 데이터 분석
- "FlowJo"소프트웨어를 열고 파일을"모든 샘플"창으로 드래그합니다.
- 3일째에 수집된 자극되지 않은 셀에 대한 파일을 두 번 클릭하여 Y 축에 전방 분산이 있는 점 플롯과 X 축의 측면 분산을 표시합니다.
- "다각형"을클릭하고 림프구 세포, Thy1.2+ CD3+ 세포를 선택하고 CD4+ 및 CD8+ 셀을 구별하는 게이팅 전략을 만듭니다 (그림 1참조).

그림 1: 게이팅 전략. 세포는 그들의 형태에 따라 먼저 문이 됩니다 (왼쪽: FSC-A, SSC-A). T 셀은 게이트(중간: CD3, Thy1.2) CD4+ T 셀(주황색) 및 CD8+ T 셀(파란색) (오른쪽: CD4, CD8)에 더 나뉜다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 다른 파일로 단계를 반복합니다.
- 분할 및 비분할 셀의 주파수를 확인하려면 먼저"레이아웃 편집기"를클릭하여 셀 모집단을 시각화합니다.
- CD4 T 셀 및 CD8 T 셀을 각각 4개의 튜브에서"모든 샘플 창"으로드래그합니다.
- 각 인구를 나타내는 그래프가 나타납니다.
- 히스토그램을 사용하여 결과를 시각화하고"CFSE"를다른 튜브및 다른 집단의 비교를 위한 매개 변수로 선택합니다.
- 비 분할 세포는 CFSE의 상부를 유지, 확산 세포는 세포를 분할CFSE의 내용을 분할하는 반면
- 분할되지 않은 셀에 게이트를 만들고 모든 튜브에 적용합니다.
- 셀 분할에 게이트를 만들고 모든 튜브에 적용합니다.
- CD3+ 셀 분할 빈도를 검사하려면"테이블 편집기"를클릭합니다.
- CD8 T 셀을 나누고 CD4 T 셀을 나누는 관심 있는 인구를"표"로드래그합니다.
- "통계"메뉴에서"T 셀 의 주파수"를선택한 다음"테이블 만들기"를클릭하여 새 테이블에서 빈도를 표시합니다.
- "테이블만들기"를클릭합니다. 주파수 값을 표시하려면 새 테이블에 나타납니다.
Results
이 실험에서, 우리는 시험관 내 배양에서 비장 CD4+ 및 CD8+ T 세포의 증식을 따랐습니다. 3 일 후, 우리는 자극의 유무에 관계없이 CD4+ 및 CD8+ T 세포 모두에서 강한 증식을 볼 수 없었습니다. 이는 CSFE의 피크가 감소하지 않는 그림 2의 상단 패널에서 볼 수 있습니다. 그러나 5 일 후에, 우리는 CSFE 봉우리 (하단 패널, 그림 2)의감소에서 분명 하는 두 인구에서 확산을 보기 시작 했습니다. CFSE 염색은 CD4+와 CD8+ T 세포가 자극 후 더 많이 분할되었다는 것을 명확하게 보여줍니다. 또한,CD8+ T 세포는 5일간의 자극 후CD4+ T 세포보다 약간 더 증식하는 것으로 보였다.
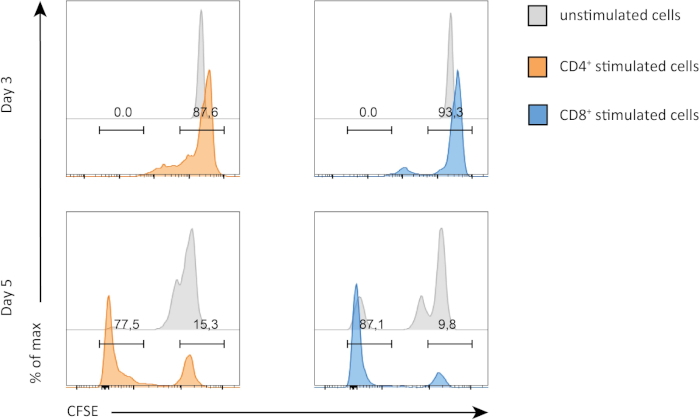
그림 2: CD4 대 CD8 T 세포 증식. 3일째(상단 패널) 및 5일째(하단 패널)에서 T 셀의 증식. 세포 주기는 2개의 다른 일에 자극의 유무에 관계없이 CD4와 CD8 T 세포 사이 비교됩니다. CD4 및 CD8 T 세포는 자극할 때 더 많이 증식합니다. CD8 자극 T 세포는 5일째에 CD4 자극 T 세포보다 더 많이 증식한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Application and Summary
증식 분석은 세포의 활성화 정도를 결정하기 위해 면역학과 같은 다른 분야에서 자주 사용됩니다. 그것은 또한 환자에 있는 종양 공격성을 결정하기 위하여 종양학 진단에서 수행됩니다. CFSE 염색은 시간이 지남에 따라 면역 세포 인구의 증식을 따르는 유용한 기술입니다. 다른 방법은 세포 주기의 특성화를 허용합니다. BrdU는, CFSE의 동등한 것은 셀 분할에만 통합됩니다. 최근 Fucci 마우스 모델은 추가 염색없이 세포 주기 위상을 감지할 수도 있습니다.
References
- Lyons, A. B. and Parish, C. R. Determination of lymphocyte division by flow cytometry. Journal of Immunological Methods. 171 (1): 131-37, (1994).
- Lyons, A. B. Analyzing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. Journal of Immunological Methods. 243 (1-2), 147-154, (2000).
- Quah, B. J., Warren H. S., and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nature Protocols. 2 (9): 2049-56, (2007).
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
세포주기 분석: 세포주기 CFSE 염색 및 유세포 분석을 사용한 자극 후 CD4 및 CD8 T 세포 증식 평가
Immunology
24.2K Views

유세포 분석 및 형광 활성화 세포 분류 (FACS): 비장 B 림프구의 분리
Immunology
92.9K Views

자기 활성화 세포 분류 (MACS): 흉선 T 림프구 분리
Immunology
22.8K Views

ELISA 분석: 간접, 샌드위치 및 길항
Immunology
237.9K Views

ELISPOT 분석: IFN-γ 분비 비장세포 검출
Immunology
28.4K Views

면역 조직 화학 및 면역 세포 화학: 광학 현미경을 통한 조직 이미징
Immunology
78.8K Views

항체 생성: 융합 세포를 사용한 단일 클론 항체 생성
Immunology
43.5K Views

면역 형광 현미경 검사법: 파라핀이 내장 된 조직 절편의 면역 형광 염색
Immunology
53.8K Views

공 초점 형광 현미경: 쥐 섬유 아세포에서 단백질의 국소화를 결정하는 기술
Immunology
43.1K Views

면역침전반응 기반 기술: 아가로스 비즈를 사용한 내인성 단백질의 정제
Immunology
87.6K Views

입양 세포 전송: 기증자 쥐 비장 세포를 숙주 쥐에 도입 후 FACS를 통한 성공 평가
Immunology
22.3K Views

세포 사멸 분석: 세포 독성 능력의 크롬 방출 분석
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유