ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Overview
מקור: פרצ'טתיבו 1,2,3, מונירסילבן 1,2,3, סופי נובאלט4, רחל גולוב1,2,3
יחידה אחת ללימפוזיס, המחלקה לאימונולוגיה, מכון פסטר, פריז, צרפת
2 INSERM U1223, פריז, צרפת
3 100é Paris Diderot, סורבון פריז סיטה, צ'רול פסטר, פריז, צרפת
4 פלטפרום ציטומטריה זרימה, ציטומטריה וסמנים ביולוגיים UtechS, המרכז למדע תרגום, מכון פסטר, פריז, צרפת
מחזור התא הוא תהליך חיים אוניברסלי. במהלך מחזור התא, תא עובר מספר שינויים כדי לחלק לשני תאי בת. מנגנון זה מתרחש לאורך כל חייו של אורגניזם בתגובה לצרכיו. חלוקות תאים והתפתחות עוברית מייצרות אורגניזם מלא מזיגוטה חד-תאית. במהלך הבגרות, מחזור התא הוא מרכזי בתהליכים ביולוגיים קריטיים רבים, כגון תיקוני רקמות.
מנגנונים של חלוקת תאים הם אירועים מבוקרים היטב שבהם התא עובר שינויים צעד לפני החלוקה הסופית. תאים שעדיין לא נמצאים במחזור מתוארים כשם הם בשלב Gap 0 (G0). בשלב זה התא נחשב לתקופתון. כאשר התא מתחיל מחזור, ארבעה שלבים נפרדים מזוהים: פער 1 (G1), סינתזה(S), פער 2 (G2) ומיטוזה (M). שלב G1 הוא נקודת ביקורת למשאבים הדרושים על ידי התא לסינתזת DNA. לאחר מכן, שלב S מתרחש, ושכפול DNA מתחיל, ואחריו אינטרפאזה G2, נקודת ביקורת נוספת השולטת בכל האלמנטים הדרושים כדי שהתא יתחלק. לבסוף, התא נכנס מיטוזה ומתחלק לשני תאי בת.
חלוקת תאים היא פרמטר אינפורמטיבי ביותר במערכות ביולוגיות רבות ושונות. בתחום החיסונים, ניתוח של התפשטות לויקוציטים יכול להצביע על מנגנון התגובה החיסונית. תחומי חקירה אחרים מסתמכים גם הם על ניתוח מחזור תאים. לדוגמה, ניתוח מחזור התא במהלך התפתחות הגידול שיפר את הבנתנו את הסרטן.
צבעים פלואורסצנטיים רבים זמינים כעת למעקב אחר התפשטות תאים. צבעים אלה שונים בתכונות הכימיות והספקטרליות שלהם. קיימים שני סוגים שונים של צבעים: צבעי חלבון משתלבים לצמיתות עם חלבון על ידי יצירת קשר קוולנטי, וצבעי ממברנה מתערבבים ביציבות בתוך קרום התא באמצעות אסוציאציות הידרופוביות חזקות. אין ויטרו ומחקרים in vivo של התפשטות תאי מערכת החיסון על ידי cytometry זרימה הם בין היישומים הנפוצים ביותר של שני סוגים של צבעי מעקב אחר תאים (1, 2).
CFSE (Carboxyfluorescein succinimidyl אסתר) הוא צבע פלואורסצנטי המסמן חלוקת תאים. בתחילה, כל התאים מקבלים את אותה כמות צבע; חלוקת תאים באופן שווה לפצל את הצבע שהם קיבלו בין שני תאי הבת שלהם. כתוצאה מכך, מחזור התא יכול להיות ואחריו ירידה הדרגתית של עוצמת הצבע בתאים. כתמי CFSE מלווה בציטומטריית זרימה רב-פרמטרית קונבנציונלית, טכנולוגיה מבוססת פלואורסצנטיות בעלת תפוקה גבוהה המאפשרת אפיון פנוטיפי ותפקודי של תאים בהתבסס על מידת הכתמת CFSE שלהם (3).
בניסוי הבא, אנו מעריכים את ההתפשטות של CD4+ ו CD8+ תאי T במבחנה, בעקבות גירוי CD3, באמצעות כתמי CFSE וציטומטריית זרימה.
Procedure
1. הכנה
- לפני שתתחילו, לבשו כפפות מעבדה וביגוד מגן מתאים.
- לחטא את כל כלי הניתוח, תחילה עם חומר ניקוי ולאחר מכן עם 70% אתנול ולאחר מכן לנגב אותם יבש ביסודיות.
- הכן 50 מ"ל מתמיסת המלח המאוזנת של האנק (HBSS) המכילה סרום עגל עוברי 2% (FCS).
2. ניתוח
- באמצעות מערכת אספקת פחמן דו חמצני, להרדים את העכבר על ידי היפוקסיה. אבטחו את העכבר המתת חסד על צלחת ניתוח בתנוחת העפרוניזציה ובצעו לפרוסטומיה אורך באמצעות מספריים ומלקחיים.
- באמצעות מלקחיים, להזיז את המעיים ואת הבטן בצד ימין של הבטן כדי לחשוף את הבטן ואת הטחול. הטחול מחובר לקיבה.
- באמצעות מלקחיים בזהירות לנתק את הטחול מן הבטן ומניחים אותו בצלחת פטרי המכיל 5 מ"ל של HBSS 2% FCS.
3. בידוד תאי מערכת החיסון
- מניחים את הטחול על מסננת תא 40 מיקרומטר על אותה צלחת פטרי. למחוץ את הטחול עם בוכנה כדי לנתק אותו.
- מעבירים את הטחול והמנותק לצינור צנטריפוגה של 15 מ"ל.
- צנטריפוגות הצינור ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס ולהשליך את supernatant הימנעות הכדור.
- resuspend הכדור ב 2 מ"ל של אשלגן אצטט ליזה אריתרוציטים. המתן 2 דקות ולאחר מכן האיפור את עוצמת הקול עד 15 מ"ל באמצעות HBSS 2% FCS.
- צנטריפוגות הצינור שוב ב 370 x גרם במשך 7 דקות ב 10 מעלות צלזיוס. להשליך את supernatant ו resuspend הכדור ב 5 מ"ל של HBSS 2% FCS.
- ספירת התאים באמצעות בדיקות כתמים כחולות טריפן ולהתאים את ריכוז התא הסופי ל 107 תאים / מ"ל באמצעות נפח מתאים של HBSS 2% FCS.
4. כתמי CFSE וגירוי תאי T
- להפיץ 107 תאי טחול מבודדים / צינור ב 4 צינורות (15 צינורות מ"ל, שכותרתו 1 עד 4)
- הוסף 3 מ"ל HBSS 2%FCS לכל צינור.
- הוסף 1 μL של CSFE בכל צינור (ריכוז סופי - 5 מיקרומטר).
- לדגור על הצינורות ב 37 °C בחממה 5% CO2 במשך 10 דקות.
- בצינורות 3 ו -4, להוסיף 12 מ"ל של HBSS 2% FCS + נוגדן נגד CD3 בריכוז סופי של 2.5 מיקרוגרם / מ"ל. צינורות 3 ו -4 להיות מגורה באמצעות נוגדן אנטי CD3, כדי לבחון את ההשפעה על מחזור התא.
- בצינורות 1 ו 2 להוסיף 12 מ"ל של HBSS 2% FCS. התאים בצינורות 1 ו -2 לא יהיו מגורה.
- צנטריפוגה כל הצינורות ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס. זרוק את אנטנטי העל.
- resuspend הכדורים ב 2 מ"ל של HBSS 2%FCS.
- מעבירים את הפתרונות המתקבלים לבארות נפרדות על צלחת של 6 בארות.
- לדגור על התאים ב 37°C, 5% CO2 במשך 3 ימים.
5. כתמי תאים
- ביום 3, הוסף 2 מ"ל HBSS 2%FCS בבאר 1 ו-3.
- Pipet במרץ ולהעביר את הדגימות לתוך 5 mL FACS צינורות.
- המשך לדגורת התאים הנותרים מבארות 2-4 ב 37 °C, 5% CO2. הם ינותחו ביום 5 כדי לחקור את ההשפעות ארוכות הטווח של גירוי על מחזור התא.
- צנטריפוגות הצינורות ב 370 x g במשך 7 דקות ב 10 °C. זרוק את אנטנטי העל.
- הוסף 100 μL של תערובת נוגדנים (ראה טבלה 1) לכל צינור.
| נוגדן | פלואורוכרום | דילול |
| CD3 | פסיפיק בלו | 1/100 |
| CD4 | BV786 | 1/1600 |
| CD8 | PE | 1/400 |
| 1.2 שלך | BV605 | 1/400 |
טבלה 1: הרכב תערובת נוגדנים. ארבע תכשירי קוקטייל נוגדנים באמצעות מצומדים נוגדנים-פלואורסצנטיים מרוכזים ו- HBSS.
- לדגור על הצינורות במשך 20 דקות על קרח בחושך.
- הוסף 1 מ"ל של HBSS 2%FCS וצנטריפוגות הצינורות ב 370 x g במשך 7 דקות ב 10 °C.
- להשליך את supernatant ו resuspend הכדורים ב 200 μL של HBSS 2% FCS.
- העבר את הכדורים המותנים מחדש לצינורות FACS חדשים ומסומנים.
- הערך התפשטות תאי T באמצעות FACS.
- ביום 5, חזור על תהליך הכתמת התא עם התאים משתי בארות הנותרות של צלחת 6-well.
6. ניתוח נתונים
- פתח את תוכנת "FlowJo" וגרור את הקבצים לחלון "כל הדוגמה".
- לחץ פעמיים על הקובץ עבור תאים לא מגויים שנאספו ביום 3 כדי להציג התוויית נקודה עם פיזור קדימה על ציר Y ופיזור צד על ציר X.
- לחץ על "מצולע" וליצור אסטרטגיית gating כדי לבחור תאי לימפה, Thy1.2+ CD3+ תאים ולהבדיל CD4+ ו CD8+ תאים (ראה איור 1).

איור 1: אסטרטגיית גטינג. התאים מגודרים תחילה על סמך המורפולוגיה שלהם (משמאל: FSC-A, SSC-A). תאי T מגודרים לאחר מכן (אמצע: CD3, Thy1.2) ומחולקים עוד יותר בתאי CD4+ T (כתומים) ובתאי CD8+ T (כחול) (מימין: CD4, CD8). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- חזור על השלבים עם קבצים אחרים.
- כדי לקבוע את התדרים של חלוקת תאים שאינם מתחלקים, תחילה דמיין את אוכלוסיות התאים על-ידי לחיצה על"עורך הפריסה".
- גרור את תאי CD4 T ותאי CD8 T מכל אחד מארבעת הצינורות אל "כל חלון הדגימה"
- גרפים המייצגים כל אוכלוסייה יופיעו.
- השתמש בהיסטוגרמה כדי לדמיין את התוצאות ולבחור "CFSE" כפרמטר להשוואה של הצינורות השונים והאוכלוסיות השונות.
- תאים שאינם מתחלקים שומרים על רמות גבוהות יותר של CFSE, בעוד שתאים מתרבים מפצלים את התוכן של CFSE לחלק תאים
- צור שער על תאים שאינם מתחלקים וליישם אותו בכל הצינורות.
- צור שער על תאים מתחלקים וליישם אותו בכל הצינורות.
- כדי לבחון את התדירות של חלוקת תאי CD3+ , לחץ על"עורך טבלאות."
- גרור את האוכלוסיות של עניין - חלוקת תאי T CD8 וחלוקת תאי T CD4 - לתוך"טבלה."
- בתפריט "סטטיסטיקה", בחר "תדירות תאי T"ולאחר מכן לחץ על " צורטבלה" כדי לחשוף את התדירות בטבלה חדשה.
- לחץ על"צור טבלה." כדי לחשוף את ערכי התדירות, מופיעים בטבלה חדשה.
Results
בניסוי זה, עקבנו אחר התפשטות של תאי CD4וטחול + ו- CD8+ T בתרבית במבחנה. לאחר 3 ימים, לא ראינו התפשטות חזקה הן CD4+ ו CD8+ T תאים עם או בלי גירוי. ניתן לראות זאת בחלונית העליונה של איור 2, שבו הפסגות של CSFE אינן יורדות. עם זאת, לאחר 5 ימים התחלנו לראות התפשטות בשתי האוכלוסיות, מה שניכר מירידה בפסגות ה-CSFE (לוחות תחתוניים, איור 2). כתמי CFSE, מדגים בבירור כי הן CD4+ ו CD8+ T תאים היו מתחלקים יותר לאחר גירוי. בנוסף, תאי CD8+ T נראה קצת יותר מרבה מאשר CD4+ תאי T לאחר 5 ימים של גירוי.
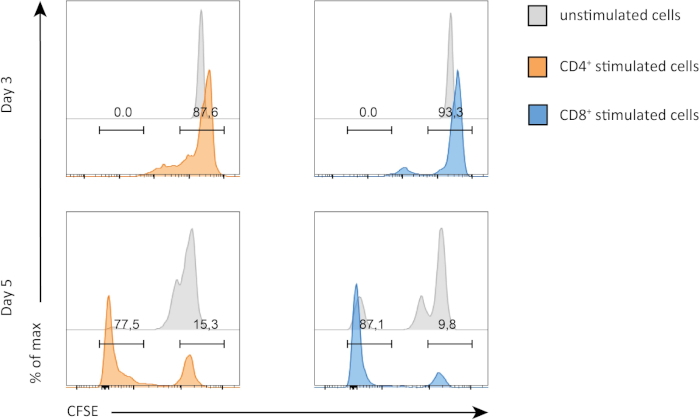
איור 2: התפשטות תאי CD4 לעומת CD8 T. התפשטות תאי T ביום 3 (פאנל עליון) וביום 5 (החלונית התחתונה). מחזור התא מושווה בין תאי CD4 ו- CD8 T עם או בלי גירוי ביומיים שונים. תאי CD4 ו- CD8 T מתרבים יותר כאשר הם מגורים. תאי T מגורה CD8 מתרבים יותר מתאי T מגורה CD4 ביום 5. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Application and Summary
התקפות התפשטות משמשות לעתים קרובות בתחומים שונים כגון אימונולוגיה כדי לקבוע את מידת ההפעלה של תאים. זה מבוצע גם באבחון אונקולוגי כדי לקבוע תוקפנות הגידול בחולים. כתמי CFSE היא טכניקה שימושית כדי לעקוב אחר התפשטות אוכלוסיות תאי החיסון לאורך זמן. שיטות אחרות מאפשרות אפיון של מחזור התא. BrdU, שווה ערך של CFSE משולב רק בחלוקת תאים. מודל העכבר האחרון של Fucci אפילו מאפשר זיהוי של שלבי מחזור התא, ללא כתמים נוספים.
References
- Lyons, A. B. and Parish, C. R. Determination of lymphocyte division by flow cytometry. Journal of Immunological Methods. 171 (1): 131-37, (1994).
- Lyons, A. B. Analyzing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. Journal of Immunological Methods. 243 (1-2), 147-154, (2000).
- Quah, B. J., Warren H. S., and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nature Protocols. 2 (9): 2049-56, (2007).
Tags
Skip to...
Videos from this collection:

Now Playing
ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.1K Views

ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
92.6K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
22.7K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
237.0K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.3K Views

אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
78.5K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.4K Views

מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.6K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.0K Views

טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.4K Views

העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.1K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved