Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Überblick
Quelle: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Abteilung für Lymphpoiesis, Institut für Immunologie, Pasteur Institute, Paris, Frankreich
2 INSERM U1223, Paris, Frankreich
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, Frankreich
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, Frankreich
Der Zellzyklus ist ein universeller Prozess des Lebens. Während des Zellzyklus erfährt eine Zelle mehrere Modifikationen, um sich in zwei Tochterzellen zu teilen. Dieser Mechanismus tritt im gesamten Leben eines Organismus als Reaktion auf seine Bedürfnisse auf. Zellteilungen und embryonale Entwicklung produzieren einen vollständigen Organismus aus einer einzelligen Zygote. Im Erwachsenenalter ist der Zellzyklus für viele kritische biologische Prozesse, wie Gewebereparaturen, von zentraler Bedeutung.
Mechanismen der Zellteilung sind streng kontrollierte Ereignisse, bei denen die Zelle vor der endgültigen Teilung schrittweise modifikationen. Zellen, die sich noch nicht im Zyklus befinden,werden als in der Phase "Lücke 0". In dieser Phase gilt die Zelle als ruhend. Wenn die Zelle zu zyklieren beginnt, werden vier verschiedene Phasen erkannt: Lücke 1 (G1), Synthese (S), Lücke 2 (G2) und Mitosis (M). G1 Phase ist ein Checkpoint für Ressourcen, die von der Zelle für die DNA-Synthese benötigt werden. Dann tritt die S-Phase auf, und die DNA-Replikation beginnt, gefolgt von der G 2-Interphase, einem weiteren Prüfpunkt, der alle Elemente steuert, die erforderlich sind, damit die Zelle geteilt werden kann. Schließlich tritt die Zelle in die Mitose ein und teilt sich in zwei Tochterzellen.
Die Zellteilung ist ein sehr informativer Parameter in vielen verschiedenen biologischen Systemen. Im Bereich der Immunologie kann die Analyse der Leukozytenproliferation auf den Mechanismus der Immunantwort hinweisen. Andere Untersuchungsbereiche stützen sich ebenfalls auf die Zellzyklusanalyse. Zum Beispiel hat die Analyse des Zellzyklus während der Tumorentwicklung unser Verständnis von Krebs verbessert.
Viele Fluoreszenzfarbstoffe sind jetzt für die Verfolgung der Zellproliferation verfügbar. Diese Farbstoffe unterscheiden sich in ihren chemischen und spektralen Eigenschaften. Es gibt zwei verschiedene Klassen von Farbstoffen: Proteinfarbstoffe verbinden sich dauerhaft mit Protein, indem sie eine kovalente Bindung bilden, und Membranfarbstoffe, die über starke hydrophobe Assoziationen stabil in Zellmembranen intercalate. In-vitro- und In-vivo-Studien zur Proliferation von Immunzellen durch Durchflusszytometrie gehören zu den häufigsten Anwendungen beider Klassen von Zelltracking-Farbstoffen (1, 2).
CFSE (Carboxyfluorescein succinimidylester) ist ein fluoreszierender Farbstoff, der teilende Zellen markiert. Zunächst erhalten alle Zellen die gleiche Menge an Farbstoff; Die teilenden Zellen teilen den Farbstoff, den sie erhielten, gleichmäßig zwischen ihren beiden Tochterzellen auf. Folglich kann dem Zellzyklus die fortschreitende Abnahme der Farbstoffintensität in den Zellen folgen. Auf cfSE-Färbung folgt die herkömmliche multiparametrische Durchflusszytometrie, eine technologiebasierter Technologie mit hohem Durchsatz, die eine phänotypische und funktionelle Charakterisierung von Zellen auf der Grundlage ihres CFSE-Färbegrades ermöglicht (3).
Im folgenden Experiment bewerten wir die Proliferation von CD4+ und CD8+ T-Zellen in-vitronach CD3-Stimulation mit CFSE-Färbung und Durchflusszytometrie.
Verfahren
1. Vorbereitung
- Vor Beginn Laborhandschuhe und die entsprechende Schutzkleidung anziehen.
- Sterilisieren Sie alle Sezierwerkzeuge, zuerst mit einem Reinigungsmittel und dann mit 70% Ethanol und wischen Sie sie dann gründlich trocken.
- Bereiten Sie 50 ml von Hanks ausgewogener Salzlösung (HBSS) vor, die 2% fetales Kalbsserum (FCS) enthält.
2. Dissektion
- Mit einem Kohlendioxid-Zufuhrsystem, euthanisieren Sie die Maus durch Hypoxie. Sichern Sie die eingeschläferte Maus auf einer Sezierplatte in der Supine-Position und führen Sie eine Längs-Laparotomie mit Schere und Zange durch.
- Mit Zange, bewegen Sie den Darm und Magen auf der rechten Seite des Bauches, um den Magen und Milz auszusetzen. Die Milz ist am Magen befestigt.
- Mit Zangen die Milz vorsichtig vom Magen lösen und in die Petrischale legen, die 5 ml HBSS 2% FCS enthält.
3. Immunzellisolierung
- Legen Sie die Milz auf ein 40 m Zellsieb über die gleiche Petrischale. Crush die Milz mit einem Kolben, um es zu dissoziieren.
- Übertragen Sie die dissoziierte Milz und die Flüssigkeit in ein 15 ml Zentrifugenrohr.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 10°C und entsorgen Sie den Überstand, um das Pellet zu vermeiden.
- Das Pellet in 2 ml Kaliumacetat wieder aufsetzen, um die Erythrozyten zu lysieren. Warten Sie 2 min und machen Sie dann das Volumen bis zu 15 ml mit HBSS 2% FCS.
- Zentrifugieren Sie das Rohr wieder bei 370 x g für 7 min bei 10°C. Entsorgen Sie den Überstand und setzen Sie das Pellet in 5 ml HBSS 2% FCS wieder aus.
- Zählen Sie die Zellen mit einem Trypan-Blau-Färbe-Assay und passen Sie die endgültige Zellkonzentration auf 107 Zellen/ml mit einem entsprechenden Volumen von HBSS 2% FCS an.
4. CFSE Färbung und T-Zell-Stimulation
- 107 isolierte Milzzellen/Rohr in 4 Röhren verteilen (15 ml-Rohre, beschriftet 1 bis 4)
- Fügen Sie 3 ml HBSS 2%FCS zu jeder Röhre hinzu.
- Fügen Sie in jedem Rohr 1 L CSFE hinzu (Endkonzentration - 5 m).
- Inkubieren Sie die Rohre bei 37°C in einem 5%CO2-Inkubator für 10 min.
- In den Röhren 3 und 4 12 ml HBSS 2% FCS + Anti-CD3-Antikörper mit einer Endkonzentration von 2,5 g/ml hinzufügen. Die Tuben 3 und 4 werden mit Anti-CD3-Antikörpern stimuliert, um die Wirkung auf den Zellzyklus zu beobachten.
- In den Rohren 1 und 2 12 ml HBSS 2% FCS hinzufügen. Die Zellen in den Röhren 1 und 2 werden nicht stimuliert.
- Zentrifugieren Sie alle Rohre bei 370 x g für 7 min bei 10°C. Entsorgen Sie die Überräube.
- Setzen Sie die Pellets in 2 ml HBSS 2%FCS wieder aus.
- Übertragen Sie die resultierenden Lösungen in separate Brunnen auf einer 6-Well-Platte.
- Inkubieren Sie die Zellen bei 37°C, 5%CO2 für 3 Tage.
5. Zellfärbung
- Fügen Sie am 3. Tag 2 mL HBSS 2%FCS in gut 1 und 3 hinzu.
- Pipetten Sie kräftig und übertragen Sie die Proben in 5 ml FACS-Rohre.
- Die verbleibenden Zellen aus den Brunnen 2-4 bei 37°C, 5%CO2weiter inkubieren. Sie werden am 5. Tag analysiert, um die langfristigen Auswirkungen der Stimulation auf den Zellzyklus zu untersuchen.
- Zentrifugieren Sie die Rohre bei 370 x g für 7 min bei 10°C. Entsorgen Sie die Überräube.
- Fügen Sie jedem Rohr 100 L Antikörpermischung (siehe Tabelle 1) hinzu.
| antikörper | Fluorochrom | verdünnung |
| CD3 | Pacific Blue | 1/100 |
| CD4 | BV786 | 1/1600 |
| CD8 | Pe | 1/400 |
| Thy1.2 | BV605 | 1/400 |
Tabelle 1: Antikörper-Mix-Zusammensetzung. Vier Antikörper-Cocktail-Präparate mit konzentrierten Antikörper-fluoreszierenden Konjugaten und HBSS.
- Inkubieren Sie die Rohre für 20 min auf Eis im Dunkeln.
- 1 ml HBSS 2%FCS hinzufügen und die Rohre bei 370 x g zentrieren für 7 min bei 10°C.
- Entsorgen Sie den Überstand und setzen Sie die Pellets in 200 l HBSS 2% FCS wieder aus.
- Übertragen Sie die resuspendierten Pellets in neue, markierte FACS-Rohre.
- Bewerten Sie die T-Zell-Proliferation mit FACS.
- Wiederholen Sie am 5. Tag den Zellfärbungsprozess mit den Zellen aus den verbleibenden zwei Brunnen der 6-Well-Platte.
6. Datenanalyse
- Öffnen Sie die "FlowJo" Software und ziehen Sie die Dateien in das Fenster "Alle Beispiele".
- Doppelklicken Sie auf die Datei für nicht stimulierte Zellen, die am 3. Tag gesammelt wurden, um ein Punktdiagramm mit Vorwärtsstreuung auf der Y-Achse und Seitenstreuung auf der X-Achse anzuzeigen.
- Klicken Sie auf "Polygon" und erstellen Sie eine Gating-Strategie, um Lymphzellen, Thy1.2+ CD3+ Zellen auszuwählen und CD4+ und CD8+ Zellen zu unterscheiden (siehe Abbildung 1).

Abbildung 1: Gating-Strategie. Zellen werden zuerst basierend auf ihrer Morphologie abgegrenzt (links: FSC-A, SSC-A). T-Zellen werden dann abgezäutt (Mitte: CD3, Thy1.2) und weiter auf CD4+ T-Zellen (orange) und CD8+ T-Zellen (blau) (rechts: CD4, CD8) aufgeteilt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Wiederholen Sie die Schritte mit anderen Dateien.
- Um die Häufigkeiten von teilenden und nicht dividierenden Zellen zu bestimmen, visualisieren Sie zuerst die Zellpopulationen, indem Sie auf"Layout-Editor"klicken.
- Ziehen Sie die CD4-T-Zellen und CD8-T-Zellen von jeder der vier Röhren in das "Alle Beispielfenster"
- Diagramme, die jede Grundgesamtheit darstellen, werden angezeigt.
- Verwenden Sie Histogramm, um die Ergebnisse zu visualisieren und wählen Sie "CFSE" als Parameter für den Vergleich der verschiedenen Röhren und der verschiedenen Populationen.
- Nicht trennende Zellen halten ein höheres CFSE-Niveau aufrecht, während sich vermehrende Zellen den Gehalt von CFSE auf teilende Zellen verteilen.
- Erstellen Sie ein Tor auf nicht teilenden Zellen und wenden Sie es in allen Rohren an.
- Erstellen Sie ein Tor auf teilenden Zellen und wenden Sie es in allen Rohren an.
- Um die Häufigkeit der Teilung von CD3+-Zellen zu untersuchen, klicken Sie auf"Tabelleneditor".
- Ziehen Sie die Voninteresseen - CD8-T-Zellen und CD4-T-Zellen - in"Tabelle".
- Wählen Sie im Menü"Statistik""Frequenz der T-Zellen"aus, und klicken Sie dann auf"Tabelle erstellen",um die Frequenz in einer neuen Tabelle anzuzeigen.
- Klicken Sie auf"Tabelle erstellen". Um die Frequenzwerte anzuzeigen, wird in einer neuen Tabelle angezeigt.
Ergebnisse
In diesem Experiment verfolgten wir die Proliferation von Splenic CD4+ und CD8+ T-Zellen in der In-vitro-Kultur. Nach 3 Tagen haben wir keine starke Proliferation sowohl in CD4+ als auch in CD8+ T-Zellen mit oder ohne Stimulation gesehen. Dies ist auf dem oberen Panel von Abbildung 2 zu sehen, wo die Spitzen von CSFE nicht abnehmen. Nach 5 Tagen begannen wir jedoch, eine Proliferation in beiden Populationen zu beobachten, was sich am Rückgang der CSFE-Spitzen zeigt (untere Panels, Abbildung 2). CFSE-Färbung zeigt deutlich, dass sich sowohl CD4+ als auch CD8+ T-Zellen nach der Stimulation mehr teilten. Darüber hinaus schienen CD8+ T-Zellen nach 5 Tagen Stimulation etwas proliferativer zu sein als CD4+ T-Zellen.
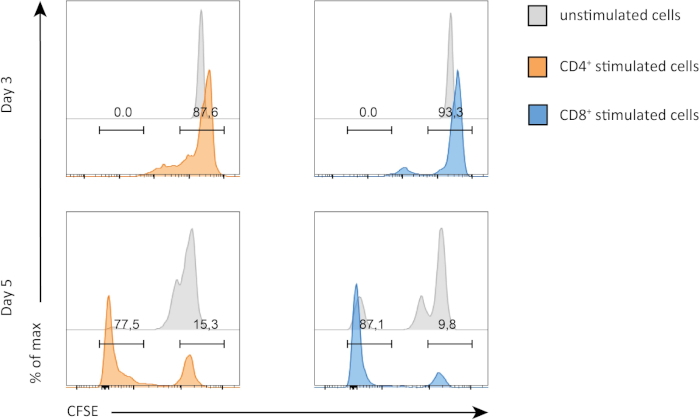
Abbildung 2: CD4 versus CD8 T-Zellen Proliferation. Proliferation von T-Zellen an Tag 3 (obere Platte) und Tag 5 (untere Platte). Der Zellzyklus wird zwischen CD4- und CD8-T-Zellen mit oder ohne Stimulation an zwei verschiedenen Tagen verglichen. CD4- und CD8-T-Zellen vermehren sich stärker, wenn sie stimuliert werden. CD8 stimulierte T-Zellen vermehren sich an Tag 5 mehr als CD4 stimulierte T-Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Anwendung und Zusammenfassung
Proliferations-Assays werden häufig in verschiedenen Bereichen wie der Immunologie verwendet, um den Grad der Aktivierung von Zellen zu bestimmen. Es wird auch in der onkologischen Diagnostik durchgeführt, um Die Tumoraggressivität bei Patienten zu bestimmen. CFSE-Färbung ist eine nützliche Technik, um die Proliferation von Immunzellpopulationen im Laufe der Zeit zu verfolgen. Andere Methoden ermöglichen die Charakterisierung des Zellzyklus. BrdU, ein Äquivalent von CFSE, wird nur in teilenden Zellen eingebaut. Jüngstes Fucci-Mausmodell ermöglicht sogar die Erkennung von Zellzyklusphasen ohne zusätzliche Färbung.
Referenzen
- Lyons, A. B. and Parish, C. R. Determination of lymphocyte division by flow cytometry. Journal of Immunological Methods. 171 (1): 131-37, (1994).
- Lyons, A. B. Analyzing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. Journal of Immunological Methods. 243 (1-2), 147-154, (2000).
- Quah, B. J., Warren H. S., and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nature Protocols. 2 (9): 2049-56, (2007).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Immunology
24.1K Ansichten

Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): Isolierung von B-Lymphozyten
Immunology
92.5K Ansichten

Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Immunology
22.7K Ansichten

ELISA-Test: Indirekt, Sandwich und kompetitiv
Immunology
236.8K Ansichten

ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Immunology
28.3K Ansichten

Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Immunology
78.5K Ansichten

Antikörper-Generierung: Herstellung monoklonaler Antikörper mit Hybridomen
Immunology
43.3K Ansichten

Immunfluoreszenzmikroskopie: Immunfluoreszenzfärbung paraffin-embedded Tissue Sections
Immunology
53.5K Ansichten

Konfokale Fluoreszenzmikroskopie: Eine Technik zur Bestimmung der Lokalisierung von Proteinen in Maus-Fibroblasten
Immunology
43.0K Ansichten

Immunprecipitation-basierte Techniken: Reinigung endogener Proteine mit Agarose-Perlen
Immunology
87.3K Ansichten

Adoptivzelltransfer: Spendermaus-Splenozyten einer Host-Maus einführen und Erfolg über FACS bewerten
Immunology
22.1K Ansichten

Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Immunology
151.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten