Analyse du cycle cellulaire : utilisation de la coloration CFSE et de la cytométrie de flux pour évaluer la prolifération des lymphocytes T CD4 et CD8 après stimulation
Vue d'ensemble
Source: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unité de lymphpoiesis, Département d'immunologie, Institut Pasteur, Paris, France
2 INSERM U1223, Paris, France
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, France
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Institut Pasteur, Paris, France
Le cycle cellulaire est un processus universel de vie. Pendant le cycle cellulaire, une cellule subit plusieurs modifications pour se diviser en deux cellules filles. Ce mécanisme se produit tout au long de la vie d'un organisme en réponse à ses besoins. Les divisions cellulaires et le développement embryonnaire produisent un organisme complet à partir d'un zygote unicellulaire. À l'âge adulte, le cycle cellulaire est au cœur de nombreux processus biologiques critiques, tels que la réparation des tissus.
Les mécanismes de division cellulaire sont des événements étroitement contrôlés où la cellule subit des modifications progressives avant la division finale. Les cellules qui ne sont pas encore dans le cycle sont décrites comme étant dans la phase gap 0 (G0). Pendant cette étape, la cellule est considérée comme quiescente. Lorsque la cellule commence à cycle, quatre phases distinctes sont reconnues: Gap 1 (G1), Synthèse (S), Gap 2 (G2) et Mitose (M). La phase G1 est un point de contrôle des ressources nécessaires à la synthèse de l'ADN par la cellule. Ensuite, la phase S se produit, et la réplication de l'ADN commence, suivie par l'interphase G2, un autre point de contrôle qui contrôle tous les éléments nécessaires pour que la cellule se divise. Enfin, la cellule entre dans la mitose et se divise en deux cellules filles.
La division cellulaire est un paramètre très instructif dans de nombreux systèmes biologiques différents. Dans le domaine de l'immunologie, l'analyse de la prolifération des leucocytes peut indiquer le mécanisme de la réponse immunitaire. D'autres domaines d'investigation reposent également sur l'analyse du cycle cellulaire. Par exemple, l'analyse du cycle cellulaire pendant le développement de tumeur a amélioré notre compréhension du cancer.
De nombreux colorants fluorescents sont maintenant disponibles pour suivre la prolifération cellulaire. Ces colorants diffèrent dans leurs propriétés chimiques et spectrales. Deux classes différentes de colorants existent : les colorants protéiques se combinent en permanence avec les protéines en formant un lien covalent, et les colorants membranaires s'intercalent de façon stable dans les membranes cellulaires par l'intermédiaire de fortes associations hydrophobes. Les études in vitro et in vivo de la prolifération des cellules immunitaires par cytométrie du flux sont parmi les applications les plus courantes des deux classes de colorants de suivi cellulaire (1, 2).
CFSE (Carboxyfluorescein succinimidyl ester) est un colorant fluorescent qui marque les cellules qui divisent. Au départ, toutes les cellules reçoivent la même quantité de colorant; les cellules de division divisent uniformément le colorant qu'elles ont reçu entre leurs deux cellules de fille. Par conséquent, le cycle cellulaire peut être suivi par la diminution progressive de l'intensité des colorants dans les cellules. La coloration CFSE est suivie d'une cytométrie multiparamétrique conventionnelle, une technologie à haut débit à base de fluorescence qui permet une caractérisation phénotypique et fonctionnelle des cellules en fonction de leur degré de coloration CFSE (3).
Dans l'expérience suivante, nous évaluons la prolifération des cellules CD4et CD8et T in vitro,après stimulation CD3, en utilisant la cytométrie de coloration et de flux de cfSE.
Procédure
1. Préparation
- Avant de commencer, enfilez des gants de laboratoire et les vêtements de protection appropriés.
- Stériliser tous les outils de dissection, d'abord avec un détergent, puis avec 70% d'éthanol, puis les essuyer soigneusement.
- Préparer 50 ml de la solution de sel équilibrée de Hank (HBSS) contenant 2 % de sérum fœtal de veau (FCS).
2. Dissection
- À l'aide d'un système de distribution de dioxyde de carbone, euthanasiez la souris par hypoxie. Fixez la souris euthanasiée sur une plaque de dissection en position de supine et effectuez une laparotomie longitudinale à l'aide de ciseaux et de forceps.
- À l'aide de forceps, déplacez les intestins et l'estomac sur le côté droit de l'abdomen pour exposer l'estomac et la rate. La rate est attachée à l'estomac.
- À l'aide de forceps, détachez soigneusement la rate de l'estomac et placez-la dans le plat Petri contenant 5 ml de HBSS 2% FCS.
3. Isolement des cellules immunitaires
- Déposer la rate sur une passoire cellulaire de 40 m sur le même plat Petri. Écraser la rate avec un piston pour la dissocier.
- Transférer la rate dissociée et le liquide dans un tube centrifugeuse de 15 ml.
- Centrifuger le tube à 370 x g pendant 7 min à 10oC et jeter le supernatant en évitant la pastille.
- Resuspendre la pastille dans 2 ml d'acétate de potassium pour lyser les érythrocytes. Attendez 2 min, puis faites le volume jusqu'à 15 ml à l'aide de HBSS 2% FCS.
- Centrifuger le tube à nouveau à 370 x g pendant 7 min à 10oC. Jeter le supernatant et resuspendre la pastille dans 5 ml de HBSS 2% FCS.
- Comptez les cellules à l'aide d'un test de coloration bleu trypan et ajuster la concentration cellulaire finale à 107 cellules/mL en utilisant un volume approprié de HBSS 2% FCS.
4. Staining CFSE et stimulation des lymphocytes T
- Distribuer 107 cellules de rate isolées/tube dans 4 tubes (tubes de 15 ml, étiquetés 1 à 4)
- Ajouter 3 mL HBSS 2%FCS à chaque tube.
- Ajouter 1 oL de CSFE dans chaque tube (concentration finale - 5 M).
- Incuber les tubes à 37oC dans un incubateur de CO2 de 5% pendant 10 min.
- Dans les tubes 3 et 4, ajouter 12 ml d'anticorps HBSS 2% FCS et anti-CD3 à une concentration finale de 2,5 g/mL. Les tubes 3 et 4 sont stimulés à l'aide d'anticorps anti-CD3, afin d'observer l'effet sur le cycle cellulaire.
- Dans les tubes 1 et 2 ajouter 12 ml de HBSS 2% FCS. Les cellules des tubes 1 et 2 ne seront pas stimulées.
- Centrifugetous les tubes à 370 x g pendant 7 min à 10oC. Jetez les supernatants.
- Resuspendre les granulés dans 2 ml de HBSS 2%FCS.
- Transférer les solutions résultantes dans des puits séparés sur une plaque de 6 puits.
- Incuber les cellules à 37oC, 5% de CO2 pendant 3 jours.
5. Staining cellulaire
- Le jour 3, ajouter 2 mL HBSS 2%FCS en puits 1 et 3.
- Pipet vigoureusement et transférer les échantillons dans 5 mL de tubes FACS.
- Continuer à couver les cellules restantes des puits 2-4 à 37oC, 5% CO2. Ils seront analysés le jour 5 pour étudier les effets à long terme de la stimulation sur le cycle cellulaire.
- Centrifuger les tubes à 370 x g pendant 7 min à 10oC. Jetez les supernatants.
- Ajouter 100 l de mélange d'anticorps (voir tableau 1) à chaque tube.
| anticorps | Fluorochrome | dilution |
| CD3 (en) | Bleu du Pacifique | 1/100 |
| CD4 (en) | BV786 (en anglais seulement) | 1/1600 |
| CD8 (en) | Pe | 1/400 |
| Thy1.2 (en) | BV605 (en anglais seulement) | 1/400 |
Tableau 1 : Composition du mélange d'anticorps. Quatre préparations de cocktail d'anticorps utilisant les conjugates concentrés d'anticorps-fluorescents et HBSS.
- Incuber les tubes pendant 20 min sur glace dans l'obscurité.
- Ajouter 1 ml de HBSS 2%FCS et centrifuger les tubes à 370 x g pendant 7 min à 10oC.
- Jetez le supernatant et suspendez les granulés dans 200 L de HBSS 2% FCS.
- Transférer les granulés resuspendus dans de nouveaux tubes FACS étiquetés.
- Évaluer la prolifération des lymphocytes T à l'aide de FACS.
- Le jour 5, répétez le processus de coloration cellulaire avec les cellules des deux puits restants de la plaque de 6 puits.
6. Analyse des données
- Ouvrez le logiciel "FlowJo" et faites glisser les fichiers dans la fenêtre "All sample".
- Double clic sur le fichier pour les cellules non stimulées recueillies le jour 3 pour afficher une parcelle de point avec la diffusion vers l'avant sur l'axe Y et la diffusion latérale sur l'axe X.
- Cliquez sur "Polygone" et créez une stratégie de gating pour sélectionner les cellules lymphoïdes, Thy1.2et CD3et distinguer lescellules CD4 et CD8 (voir Figure 1).

Figure 1 : Stratégie de gating. Les cellules sont d'abord fermées en fonction de leur morphologie (à gauche : FSC-A, SSC-A). Les lymphocytes T sont ensuite fermés (au milieu : CD3, Thy1.2) et ensuite divisés sur les lymphocytes CD4et T (orange) et CD8et T (bleu) (à droite : CD4, CD8). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
- Répétez les étapes avec d'autres fichiers.
- Pour déterminer les fréquences de division et de non-division des cellules, visualisez d'abord les populations cellulaires en cliquant sur «Rédacteur en chef».
- Faites glisser les lymphocytes T CD4 et les lymphocytes T CD8 de chacun des quatre tubes à la «fenêtre de l'échantillon»
- Des graphiques représentant chaque population apparaîtront.
- Utilisez l'histogramme pour visualiser les résultats et sélectionnez «CFSE» comme paramètre pour la comparaison des différents tubes et des différentes populations.
- Les cellules non-divisantes maintiennent des niveaux plus élevés de CFSE, tandis que les cellules proliférantes divisent le contenu de CFSE en cellules de division
- Créez une porte sur les cellules non-divisantes et appliquez-la dans tous les tubes.
- Créez une porte sur les cellules de division et appliquez-la dans tous les tubes.
- Pour examiner la fréquence de la division des cellules CD3, cliquez sur «Editeurde table ».
- Faites glisser les populations d'intérêt - en divisant les lymphocytes T CD8 et en divisant les lymphocytes T CD4 - en «Tableau».
- Sur le menu "Statistique", sélectionnez "fréquence des lymphocytes T", puis cliquez sur " Createtable" pour révéler la fréquence dans une nouvelle table.
- Cliquez sur "Créer la table". Pour révéler les valeurs de fréquence, affichez-vous sur une nouvelle table.
Résultats
Dans cette expérience, nous avons suivi la prolifération des cellules Splénic CD4et CD8t dans la culture in vitro. Après 3 jours, nous n'avons pas vu la prolifération forte dans les deux CD4et CD8- cellules T avec ou sans stimulation. C'est ce que l'on peut voir sur le panneau supérieur de la figure 2 où les pics de CSFE ne diminuent pas. Cependant, après 5 jours, nous avons commencé à voir une prolifération dans les deux populations, ce qui est évident à la suite de la diminution des pics Du CSFE (panneaux de fond, figure 2). La coloration de CFSE, démontre clairement que les deux cD4et CD8- lymphocytes T se divisait plus après stimulation. En outre, les lymphocytesT CD8 semblaient être légèrement plus proliférants que les lymphocytesT CD4 après 5 jours de stimulation.
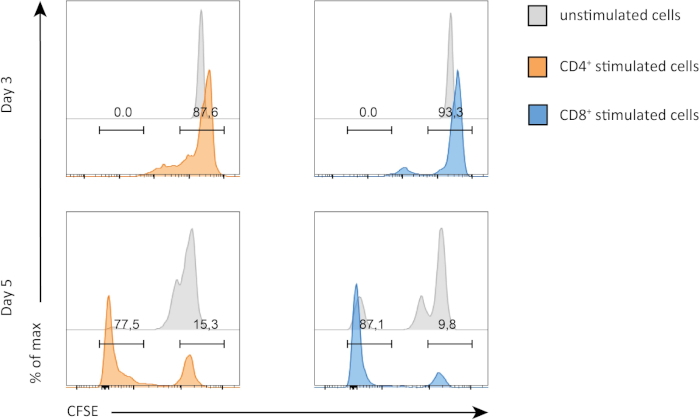
Figure 2 : prolifération des lymphocytes T CD4 par rapport à la prolifération des lymphocytes T CD8. Prolifération des lymphocytes T au jour 3 (panneau supérieur) et au jour 5 (panneau inférieur). Le cycle cellulaire est comparé entre les lymphocytes T CD4 et CD8 avec ou sans stimulation à deux jours différents. Les lymphocytes T CD4 et CD8 prolifèrent davantage lorsqu'ils sont stimulés. Les lymphocytes T stimulés Par le CD8 prolifèrent plus que les lymphocytes T stimulés par le CD4 au jour 5. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Applications et Résumé
Les tests de prolifération sont souvent utilisés dans différents domaines tels que l'immunologie pour déterminer le degré d'activation des cellules. Il est également effectué dans le diagnostic d'oncologie pour déterminer l'agressivité de tumeur dans les patients. La coloration CFSE est une technique utile pour suivre la prolifération des populations de cellules immunitaires au fil du temps. D'autres méthodes permettent la caractérisation du cycle cellulaire. BrdU, un équivalent de CFSE est incorporé seulement dans les cellules de division. Le modèle récent de souris Fucci permet même la détection des phases de cycle cellulaire, sans coloration supplémentaire.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Analyse du cycle cellulaire : utilisation de la coloration CFSE et de la cytométrie de flux pour évaluer la prolifération des lymphocytes T CD4 et CD8 après stimulation
Immunology
24.3K Vues

Cytométrie en flux et tri cellulaire activé par fluorescence (FACS) : isolement des lymphocytes B spléniques
Immunology
93.3K Vues

Tri cellulaire magnétique (MACS) : isolement des lymphocytes T thymiques
Immunology
23.1K Vues

Tests ELISA : Indirect, en sandwich et par compétition
Immunology
239.5K Vues

Test ELISPOT : Détection des splénocytes sécrétants l'IFNgamma
Immunology
28.8K Vues

Immunohistochimie et immunocytochimie : Imagerie tissulaire par microscopie optique
Immunology
79.2K Vues

Génération d'anticorps monoclonaux à l'aide d'hybridomes
Immunology
43.7K Vues

Microscopie à fluorescence : coloration par immunofluorescence des sections de tissus inclus en paraffine
Immunology
54.0K Vues

Microscopie confocale à fluorescence : une technique pour localiser les protéines dans les fibroblastes de souris
Immunology
43.4K Vues

Techniques basées sur l'immunoprécipitation : purification des protéines endogènes à l'aide de billes d'agarose
Immunology
87.9K Vues

Transfert adoptif de cellules : introduction de splénocytes d'une souris donneuse vers une souris hôte et évaluation du taux de succès au FACS
Immunology
22.6K Vues

Test de mort cellulaire : libération du chromium pour mesurer la cytotoxicité
Immunology
151.5K Vues