UV-VIS 분광기를 이용한 자동차 배기 가스의 NOx 측정
Overview
출처: 마가렛 노동자와 킴벌리 프라이의 실험실 - 데폴 대학
대구권에서는 햇빛이 이산화질소를 분할할 때 오존이 자연스럽게 형성됩니다(NO2):
NO2 + 햇빛 → NO + O
O + O2 → O3
오존(O3)은 산화질소(NO)와 반응하여 이산화질소(NO2)및 산소를 형성할 수 있습니다.
NO + O3 → NO2 + O2
이로 인해 오존(O3)의순이익이 없습니다. 그러나, 화석 연료의 연소를 통해 오존 형성 전구체(NO, NO2및 휘발성 유기 화합물)의 인위적인 생산과 함께, 대류권에서 오존의 높은 수준이 발견되었다. 자동차 배기는 전구체를 형성하는 이러한 오존의 중요한 공급원입니다 : NO, NO2및 휘발성 유기 화합물 (VOC). 예를 들어 모바일 소스는 NO + NO2 배출량의 거의 60%를 차지합니다.
자동차의 연소실에서 발견되는 고온에서 공기 중의 질소와 산소는 산화질소(NO) 및 이산화질소(NO2)를형성하기 위해 반응합니다.
N2 (g) + O2(g)→ 2 NO(g)
2 NO(g) + O2 (g)→ 2 NO2 (g)
자동차 배기에서 방출되는 산화질소(NO)는 주변 공기 에서 이산화질소(NO2)로점차 산화된다. NO와 NO2의 이 혼합물을 종종 NOx라고합니다. NOx가 햇빛이 있는 대기 중의 휘발성 유기 화합물과 반응하면, 이 단순화된 화학 반응에서 볼 수 있듯이 열대성 오존 형태:
NOx + VOC + 햇빛 → O3 + 기타 제품
알데히드, 퍼옥사세틸 질산염, 오존, VOC 및 NOx를포함할 수 있는 대기 오염의 유해 혼합물은 광화학 스모그라고 합니다. 오존은 광화학 스모그의 가장 큰 성분이다. 이 스모그는 모든 현대 도시에서 발견되지만, 특히 맑고 따뜻하며 건조한 기후와 많은 수의 자동차가있는 도시에서 발견됩니다. 공기 중의 스모그의 황갈색 색은 이산화질소가 존재하는 것으로 인해 400nm(도1)에가까운 가시광선을 흡수하기 때문이다.
단기 NO2 노출 (30 분 에서 1 일) 건강한 사람들에 있는 불리한 호흡 효력 및 천식을 가진 사람들에 있는 증가한 호흡 현상으로 이끌어 냅니다. NOx는 암모니아 및 기타 화합물과 반응하여 미립자를 형성합니다. 이 작은 입자는 폐를 관통하고 폐기종과 기관지염을 포함하여 호흡 문제를 일으키는 원인이 될 수 있습니다. 도로에서 많은 시간을 보내거나 도로 근처에 사는 개인은 NO2에상당히 높은 노출을 경험합니다.
미국 환경보호국(EPA)은 인간의 건강과 환경에 미치는 영향으로NO 2를 기준 오염물질로 분류하고 100ppb(1-h 일일 최대 농도의 98번째 백분위수, 평균 3년 이상)와 53ppb(연평균 평균)로 1차 표준을 설정했습니다. 미국 내 경우 차량 배출량이 약 1/3을 차지한다는 점을 감안할 때, 자동차 배기가스 배출은 청정공기법을 통해 규제됩니다. 현재 Tier 2 배출 표준은 제조업체가 0.07 g/mile 이하의 차량 평균 NOx 배출을 가져야 한다고 규정하고 있습니다.
제조업체가 이 표준을 충족하는 한 가지 방법은 자동차에 촉매 변환기를 사용하는 것입니다. 이 장치는 엔진과 단부 파이프 사이에 배치됩니다. 배기 스트림은 촉매 변환기를 통과하고 촉매에 노출됩니다. 백금 및 로듐의 환량 촉매는 배기에서 NOx 농도를 감소시키는 데 사용된다. 배기 가스내의 NO 또는 NO2 분자가 촉매에 닿으면, 질소 원자는 분자를 잡아 촉매에 의해 붙들게 된다. 산소가 풀려나 O2를형성합니다. 촉매의 질소 원자는 N2를형성하기 위해 촉매에 보유된 다른 질소 원자와 결합한다.
촉매 변환기는 제대로 수행 할 때 자동차 배기에서 NOx의 배출을 크게 감소 - 최대 80 % 감소. 그러나, 그들은 상당히 높은 온도에 도달 했을 때만 작동 합니다. 따라서 자동차의 차가운 시작을 할 때 촉매 변환기가 사실상 NOx를제거하지 않습니다. 촉매 변환기가 더 높은 온도에 도달할 때까지 배기 스트림에서 NOx를 효과적으로 제거합니다. 촉매 변환기는 그들이 운영하는 린 조건으로 인해 디젤 승용차에서 작동하지 않습니다. 또한, 디젤 연료의 유황도 촉매를 비활성화합니다. 디젤 엔진의 NOx는 연소 가스의 온도를 냉각시키는 배기가스 재순환(EGR) 밸브를 통해 주로 감소됩니다. 그 결과, 디젤 자동차는 일반적으로 가솔린 자동차보다 더 많은X를 방출합니다.

그림 1. 골든 게이트 브리지 뒤에 베이지 색 구름 은행에서 캘리포니아에서 스모그에 대한 특징적인 착색. 갈색 착색은 광화학 스모그에서 NOx 때문입니다.
Principles
이 실험에서는 다양한 브랜드의 자동차 배기 스트림에서 NOx의 농도가 두 번(시동 시 및 10분 후) 배기에서 NOx를 제거하는 자동차의 촉매 변환기 의 능력을 연구합니다. 촉매 변환기는 효과가 높은 온도가 필요합니다. 따라서, 자동차의 시동 시 배기의 측정은 촉매 변환기가 작동하지 않고 배기에서 NOx의 양을 나타낸다. 10분 후 배기의 측정은 촉매 변환기가 효과가 있는 후 배기시 NOx의 양을 나타낸다.
NOx 농도는 황자닐산의 다이아호화와 N-(1-naphthyl)-에틸렌디아민과 반응하여 색으로 결정되며, 550nm에서 설정된 UV-VIS 분광계를 사용하여 생성된 아조 염료 분자의 색 강도를 측정한다.
용액에서 NO 및 NO2는 NO2를형성하기 위해 다음과 같은 반응을 겪습니다.
2 NO2 (g) + H2O(l) → 2H+(aq) + NO2-(aq) + NO3-(aq)
4NO(g) + O2 (g) + 2 H2O(l) → 4 NO2-(aq) + 4 H+(aq)
NO2와 NO2사이의 예상 비율은 이전에 나열된 첫 번째 방정식에 따라 2:1이지만 경험적으로 1.39:1로 결정되었습니다.
황파닐산과 N-(1-나프틸)-에틸렌디아민이 용액에 첨가되면 분홍색 색 분자가개발(도 2).
이 분홍색 색 분자의 농도는 용액에서 NOx의 농도에 직접 비례합니다. 아조 염료 분자의 농도는 550 nm에서 설정된 UV-VIS 분광계를 사용하여 측정된다.
UV-VIS 분광법은 폭 b(cm)의 투명한 용기에 보관된 용액의 흡광도(A)를 측정한 것입니다. 흡수 종의 농도는 다음 방정식에서 볼 수 있듯이 흡수도에 직접 비례합니다.
A =  b c
b c
 어금니 의욕이 있는 곳은 어디입니다. 이 방정식은 맥주의 법칙이라고합니다. 어금니 흡수성은 물질이 주어진 파장에서 빛을 흡수하고 주어진 물질에 대한 일정얼마나 강하게 측정합니다.
어금니 의욕이 있는 곳은 어디입니다. 이 방정식은 맥주의 법칙이라고합니다. 어금니 흡수성은 물질이 주어진 파장에서 빛을 흡수하고 주어진 물질에 대한 일정얼마나 강하게 측정합니다.
용액의 흡광도를 측정하기 위해, 강도Io를 가진 빛의 광선은 큐벳(도3)의용액을 목표로 한다. 진입 빔(Io)과신흥 빔(I)의 강도는 측정되고 흡광도는 다음과 같습니다.


그림 2. 황파닐산과 N-(1-나프틸)-에틸렌디아민이 용액에 첨가될 때 발생하는 분홍색 분자.

그림 3. 큐벳의 용액을 겨냥한 강도 이오와 빛의 광선.
Procedure
1. 아질산염 준비 (NO2-) 주식 솔루션
- NaNO2의 무게는 1.500g으로 1L 볼륨 플라스크에 추가합니다.
- 나노 퓨어 워터를 사용하여 마크에 희석하십시오. (수돗물에서 증류수를 확인하십시오 - 측정을 방해하기에 충분한 아질산염이 포함될 수 있습니다.) 이것은 1,000 μg NO2-/mL 스톡 솔루션을 생성합니다.
- 5.0 μg NO2-/mL 용액을 만들려면 1,000 μg NO2-/mL 용액의 1 mL을 가져 와서 체적 플라스크에서 200 mL로 희석하십시오.
2. NOx 표시기 솔루션 준비
- 5.0 g의 무수성 설파눌산의 무게를 측정하고 1 L 체피 플라스크에 추가합니다.
- 나노 퓨어 워터 500mL를 추가합니다.
- 빙하 아세트산 140mL를 추가합니다.
- 교반바를 사용하여 설파일산이 녹을 때까지 용액을 저어줍니다. 이 소요 약 30 분.
- N-(1-나프틸)-에틸렌디아민 디하이드로클로리드의 0.020 g를 계량하고 체피 플라스크에 추가합니다.
- 나노 퓨어 워터를 사용하여 마크에 희석하십시오.
- 어두운 병으로 옮기고 (광분해를 방지하기 위해) 단단히 스토퍼 (공기와의 반응을 방지하기 위해).
3. 교정 표준 의 준비
- 5.0 μg NO2-/mL용액의 1.0mL를 25mL 체피 플라스크에 넣고 NOx 표시기 용액으로 희석하여 마크에 희석한다. 이렇게 하면 0.2 μg NO2-/mL 표준 솔루션이 됩니다.
- 5.0 μg NO2-/mL용액의 2.0mL를 25mL 체피 플라스크에 넣고 NOx 표시기 용액으로 희석하여 마크에 희석한다. 이렇게 하면 0.4 μg NO2-/mL 표준 솔루션이 됩니다.
- 5.0 μg NO2-/mL용액의 3.0mL을 25mL 체피 플라스크에 넣고 NOx 표시기 용액으로 희석하여 마크에 희석한다. 이렇게 하면 0.6 μg NO2-/mL 표준 솔루션이 됩니다.
- 5.0 μg NO2-/mL용액의 4.0mL을 25mL 체피 플라스크에 넣고 NOx 표시기 용액으로 희석하여 마크에 희석한다. 이렇게 하면 0.8 μg NO2-/mL 표준 솔루션이 됩니다.
- 5.0 μg NO2-/mL용액의 5.0mL를 25mL 체피 플라스크에 넣고 NOx 표시기 용액으로 희석하여 마크에 희석한다. 이렇게 하면 1.0 μg NO2-/mL 표준 솔루션이 됩니다.
4. 표준 곡선의 창조
- UV-VIS 분광계를 사용하여 흡광도를 읽을 수 있는 계측기를 설정합니다.
- 분광계에서 파장을 550 nm로 설정합니다.
- NOx 표시기 용액을 사용하여 분광계를 0으로 설정합니다.
- 5가지 표준 솔루션의 흡광도를 측정합니다. 데이터 테이블에 값을 기록합니다(표1).
5. 자동차 배기 샘플 측정
- 디젤 구동 자동차를 시작합니다.
- 60mL 가스가 단단한 주사기를 사용하여 몇 인치를 단부 파이프에 삽입합니다. 화상을 피하고 연기에 숨을 쉬지 마십시오. 주사기를 조절하기 위해 배기를 두 번 끌어들이고 추방합니다.
- NOX 표시기 용액의 25mL을 주사기에 그립니다. 표시기 용액을 흘리지 않고 주사기에서 공기를 배출합니다.
- 35mL의 배기를 주사기에 넣고 플런저를 60mL 마크로 당깁니다.
- 주사기를 캡. 주사기에서 2분 동안 용액을 흔들어 주세요. 알루미늄 호일로 주사기를 덮습니다.
- 샘플을 수집할 때 단부 파이프의 공기 온도를 측정합니다.
- 가솔린 구동 자동차를 사용하여 5.1 - 5.6 단계를 반복합니다. 이러한 단계는 다양한 자동차 모델을 사용하여 원하는 만큼 여러 번 반복할 수 있습니다.
- 자동차가 최소 10분 동안 운행된 후 5.1 - 5.6 단계를 반복하십시오.
- 용액의 흡광도를 측정하기 전에 색상이 발생할 수 있도록 45 분 기다립니다.
- 45분이 올라간 후, 주사기에서 가스를 배출하고, 용액을 큐벳에 넣고, 550nm에 설정된 분광계를 사용하여 흡광도를 측정한다. 데이터 테이블에 값을 기록합니다(표1).
| 견본 | 흡 광도 |
| 0.2 μg NO2-/mL 표준 | |
| 0.4 μg NO2-/mL 표준 | |
| 0.6 μg NO2-/mL 표준 | |
| 0.8 μg NO2-/mL 표준 | |
| 1.0 μg NO2-/mL 표준 | |
| 디젤 자동차 배기 (시동 시) | |
| 디젤 자동차 배기 (10 분 실행 후) | |
| 가솔린 자동차 배기 (시동 시) | |
| 가솔린 자동차 배기 (10 분 실행 후) |
표 1. 빈 데이터 테이블을 사용하여 흡수 값을 기록합니다.
Results
표 2는 적절한 결과의 예를 제공합니다. 표준 용액의 흡광도 측정을 사용하여, 흡광도 대2의농도의플롯을 만들 수 있습니다(그림 4). 그런 다음 데이터의 가장 적합한 라인을 결정할 수 있습니다. 표준 곡선의 가장 적합한 라인을 사용하여 NO2의농도- 각 알 수없는 용액 (μg /mL)에서 계산 할 수 있습니다. 이 값은 다음 방정식을 사용하여 배기 기체 샘플에서 NO2의 농도로 변환할 수 있습니다.
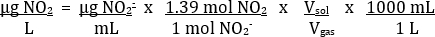
이전에 본 H 2 O에서 NO2의 균형 잡힌 방정식을 기반으로 2 mol NO2/1 mol NO2- 비율이 예상됩니다. 경험적 실험에서, 그것은 1.39:1 비율에 가까운 것으로 밝혀졌다. 사용된 용액의 부피는 25mL였다. 가스 샘플의 부피는 35mL이었다.
계산된 NO2의 농도는 실제로 배기샘플(표 3)의모든 NOX를 나타낸다. ppmV와 μg/L 간의 변환 방정식은 샘플이 수집된 온도와 압력에 따라 달라집니다. 변환 방정식은 다음과 같다.

어디 R = 범용 가스 상수 = 0.08206 atm· L/몰· K, P = 대기압 Atm, T = K의 온도 및 MW = 분자량 NOx (NO2)= 46.01 g/mol. 그러므로
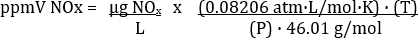
Atm에 K와 P에 T를 입력하는 것이 중요합니다.
| 견본 | 흡 광도 |
| 0.2 μg NO2-/mL 표준 | 0.22 |
| 0.4 μg NO2-/mL 표준 | 0.43 |
| 0.6 μg NO2-/mL 표준 | 0.60 |
| 0.8 μg NO2-/mL 표준 | 0.79 |
| 1.0 μg NO2-/mL 표준 | 1.05 |
| 디젤 자동차 배기 (시동 시) | 1.03 |
| 디젤 자동차 배기 (10 분 실행 후) | 1.03 |
| 가솔린 자동차 배기 (시동 시) | 0.10 |
| 가솔린 자동차 배기 (10 분 실행 후) | 0.04 |
표 2. 흡수의 대표적인 결과와 데이터 테이블.

그림 4. 흡광도 의 표준 곡선 플롯 vs. NO2의농도-.
| 차 | NOx 농도 (ppm) |
| 디젤 자동차 (시동 시) | 500 |
| 디젤 자동차 (10 분 실행 후) | 500 |
| 가솔린 자동차 (시동 시) | 48 |
| 가솔린 자동차 (10 분 실행 후) | 21 |
표 3. 차량당NO x 농도(ppm).
Application and Summary
수정된 Saltzman 반응을 사용하여 아질산염의 측정은 많은 다른 분야에서 매우 일반적이고 유용합니다. 설명한 바와 같이, 이 방법은 자동차 배기, 실험실 실, 도시의 공기 질 등 공기 샘플에서 NOx 농도를 측정하는 데 사용할 수 있습니다. 또한,이 방법은 담배 연기에서 NOx를 모니터링하는 데 사용할 수 있습니다. 시술은 주사기에 자동차 배기가스를 그리는 대신 담배 연기가 그려지는 것을 제외하고는이 실험과 매우 유사할 것입니다. 종종 많은 사람들에게 놀라운 경향이 자동차의 단부 파이프에서 나오는 것보다 담배 연기에 NOx의 높은 농도가있다. 담배 연기에서 NOx의 일반적인 값은 500-800 ppm범위입니다.
이 방법은 또한 질화 박테리아의 존재에서 생성 된 질산염의 수준을 테스트하는 데 사용할 수 있습니다. 질화 박테리아는 토양과 물에서 찾아내고 질소 주기에서 중요한 역할을 합니다 - 암모니아를 질산염으로 산화한 다음 질산염. 샘플내의 질산염은 먼저 효소 질산염 환원효소에 의해 질산염으로 변환된다. 그런 다음 아질산염은 수정된 솔츠만 반응을 사용하여 측정됩니다. 마지막으로, 이 방법은 식품에서 질산염과 아질산염의 농도를 결정하는 데 사용될 수 있다. 아질산염과 질산염은 주로 육류와 육류 제품을 보존하기 위해 식품에 첨가됩니다. 경화 육류의 아질산염의 일반적인 값은 약 125 μg/mL입니다.
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
UV-VIS 분광기를 이용한 자동차 배기 가스의 NOx 측정
Environmental Science
30.3K Views

나무 식별: 이분법적 열쇠를 사용하는 방법
Environmental Science
81.4K Views

나무 조사: 점 중심 쿼터 샘플링 방법
Environmental Science
49.5K Views

GIS를 사용한 도시 임업 조사
Environmental Science
12.7K Views

양성자 교환막 연료 전지
Environmental Science
22.2K Views

바이오 연료: 셀룰로오스 물질에서 에탄올 생산
Environmental Science
53.5K Views

유전자 변형 식품 검사
Environmental Science
90.1K Views

표층수의 탁도 및 총 고형분
Environmental Science
35.9K Views

표층수의 용존 산소
Environmental Science
56.0K Views

수생 생태계의 영양소
Environmental Science
39.0K Views

대류권 오존 측정
Environmental Science
26.5K Views

원자 흡수 분광법을 사용한 토양의 납 분석
Environmental Science
126.1K Views

환경 검체의 탄소 및 질소 분석
Environmental Science
29.6K Views

토양 영양소 분석: 질소, 인 및 칼륨
Environmental Science
216.2K Views

토양의 지렁이 개체군 분석
Environmental Science
16.6K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유