Method Article
인간 아데노신 데아미나제 1 효소의 혈청 안정성 측정
요약
이 기사에서는 인간 혈청에서 37°C에서 배양할 때 효소의 기능을 유지하는 능력(혈청 안정성이라고 하는 약리학적 특성)을 특성화하는 방법에 대해 자세히 설명합니다. 이 능력은 효소의 약동학 프로필과 치료 사용에 대한 적합성을 예측하는 데 중요한 요소가 될 수 있습니다.
초록
효소 안정성의 개념은 일반적으로 효소의 열 안정성, 즉 온도가 증가함에 따라 구조와 활성을 유지하는 능력을 나타내는 데 사용됩니다. 치료용 효소의 경우 다른 안정성 측정도 중요할 수 있으며, 특히 37°C에서 인간 혈청에서 기능을 유지하는 능력(혈청 안정성이라고 함)도 중요합니다. 여기에서는 흡광도 기반 마이크로플레이트 절차를 사용하여 야생형 Homo sapiens adenosine deaminase I(HsADA1) 효소의 혈청 안정성을 평가하기 위한 in vitro assay에 대해 설명합니다. 구체적으로, 이 원고는 완충액 및 시약의 준비, 혈청 내 HsADA1의 코인배양을 준비하는 방법, 마이크로플레이트 리더를 사용하여 테스트 샘플을 분석하는 방법, HsADA1 효소가 시간의 함수로 혈청에 유지하는 활성률을 결정하기 위한 동반 분석을 설명합니다. 또한 호모 사피엔스 키누레니나아제 효소의 예를 들어 이 프로토콜을 다른 효소에 적용하기 위한 고려 사항에 대해 논의하여 혈청 안정성이 중요한 다른 효소에 대한 프로토콜의 적응을 돕습니다.
서문
다음 방법을 통해 사용자는 정맥 주사 후 발생할 상황을 모방한 조건에 노출될 때 효소의 활성을 유지하는 효소의 능력을 정량적으로 평가할 수 있습니다. in vitro 분석법은 이러한 in vivo 조건을 모방하며 37°C에서 통합된 인간 혈청에서 효소를 배양하고 효소 활성의 머무름에 대한 시간 경과 분석으로 구성됩니다. 이러한 조건에서 활성을 유지하는 효소의 능력을 혈청 안정성이라고 하며, 효소 활성에 대한 분석 방법은 효소의 기질과 결과 산물 간의 흡광도 차이를 이용합니다. 혈청 안정성의 개념은 효소 특이적일 뿐만 아니라 여러 다른 치료 방식에도 적용되었습니다. 예를 들어, COVID 스파이크 단백질을 표적으로 하는 RNA 압타머의 혈청 안정성은 이전에 태아 송아지 혈청1로 배양 후 분해를 모니터링하여 평가되었습니다. 항균 펩타이드는 또한 풀링된 인간 혈청을 사용하여 배양 후 박테리아 성장을 억제하는 능력에 대해 평가되었습니다2.
HsADA1은 아데노신 또는 2-데옥시아데노신이 각각 이노신 또는 2-데옥시이노신으로 전환되는 것을 촉매하는 효소입니다3. 아데노신은 260nm의 흡수 피크를 갖는 반면, 이노신은 250nm에서 가장 강하게 흡수합니다4. 이러한 흡수 피크의 변화는 HsADA1이 아데노신에 추가될 때 260nm에서 흡수 강도의 감소에 의해 마이크로플레이트 리더에서 감지될 수 있습니다. HsADA1 효소는 인체에 중요한 영향을 미치며, 결핍은 심각한 복합 면역결핍(ADA-SCID)을 유발합니다5. HsADA1의 소 상동체인 BtADA1은 ADA-SCID의 치료를 위한 효소 대체 치료제로 활용될 수 있으며, 이전에 야생형 HsADA1이 풀링된 인간 혈청과 함께 배양될 때 활성을 잃어 치료제로서의 사용을 방해할 수 있음을 보여주었습니다6. 따라서 효소의 혈청 안정성을 측정하는 절차를 시연하기 위해 야생형 HsADA1 효소를 선택했습니다. HsADA1에 대한 자세한 정제 방법은 앞서설명하였다 6.
다음 프로토콜( 그림 1에 자세히 설명)에서는 37°C에서 통합된 인간 혈청에서 야생형 HsADA1을 공동 배양하는 방법을 보여줍니다. 이 기간 동안 테스트 샘플은 정의된 시점에서 채취되고 향후 분석을 위해 급속 동결됩니다. 모든 시료를 채취한 후에는 각 시료를 기질과 결합하는 마이크로플레이트 분석을 실행하며, 그 결과 흡광도 감소는 효소의 잔류 활성에 대한 상관 관계가 됩니다. HsADA1의 혈청 안정성을 보여주는 대표적인 결과가 제시되어 있으며, 이 지표는 다른 효소의 잠재적 치료 가치를 결정하는 데 관련이 있을 수 있기 때문에 이 프로토콜을 조작된 Homo sapiens kynureninase 효소(HsKYNase) 및 보다 일반적으로 모든 효소에 적용하기 위한 고려 사항도 논의합니다. HsKYNase는 트립토판의 대사에 관여하는 효소로 트립토판 부산물인 키누레닌과 하이드록시키누레닌(OH-Kyn)을 각각 안트라닐산과 하이드록시-안트라닐산(OH-AA)으로 분해할 수 있습니다. 트립토판 대사의 효소 매개 조절은 치료적 타당성이 있을 수 있다7.
프로토콜
1. 혈청 배양
- 최종 농도 10μM에서 1x PBS pH 7.4(1x PBS)로 HsADA1 10x 스톡을 준비합니다. 풀링된 인간 혈청 15mL 분취액을 해동하고 37°C로 사전 데웁니다. 1x PBS의 50mL 부분 표본을 37°C로 예열합니다.
- 효소 + 혈청 혼합물이라고 하는 저결합 미세 원심분리 튜브에 10x HsADA1 스톡 100μL를 900μL의 합동 인간 혈청에 첨가하여 효소-혈청 배양 혼합물을 준비합니다. 별도의 저결합 마이크로 원심분리기 튜브에 10x HsADA1 스톡 100μL를 1x PBS 900μL에 추가하여 효소 + 1x PBS 혼합물이라고 하는 비혈청 대조군과 비교합니다. 각 혼합물에서 HsADA1의 최종 농도는 1μM입니다.
- 100μL의 1x PBS와 900μL의 풀링된 인간 혈청으로 구성된 저결합 마이크로 원심분리기 튜브에 추가 대조군을 준비합니다. 이것은 효소 + 혈청 혼합물에 대한 비효소 조절 역할을 합니다. 또한 1mL의 1x PBS로 구성된 대조군을 만드십시오. 이것은 효소 + 1x PBS 혼합물에 대한 비효소 제어 역할을 합니다.
- 1.2단계에서 각 혼합물 100μL를 별도의 저결합 튜브에 분취하고 1x PBS에서 30%(v/v) 글리세롤 100μL로 1:1로 희석합니다. 액체 질소로 급속 냉동하고 -80 °C에서 보관합니다. 이 샘플은 Day 0 시점이 되며 해당 샘플의 HsADA1 농도는 500nM입니다. 1.3의 비효소 제어 혼합물에 대해 이 단계를 반복합니다. 모든 효소와 대조군 혼합물을 투명 필름으로 밀봉하고 37°C 인큐베이터에 넣습니다.
- 24시간 후, 배양된 각 샘플의 100μL를 분취액하고 1x PBS에서 30%(v/v) 글리세롤 100μL로 1:1로 희석합니다. 액체 질소로 급속 냉동하고 -80 °C에서 보관합니다. 이 샘플은 1일차 시점입니다. 모든 효소 및 대조군 혼합물을 37°C 인큐베이터로 되돌립니다. 72시간 및 120시간에서 이 단계를 반복합니다.
참고: Aliquoted 샘플이 반드시 급속 동결될 필요는 없습니다. 또는 사용자는 각 샘플을 채취한 직후 마이크로플레이트 기반 분석을 수행할 수 있지만, 샘플을 테스트할 때마다 새로운 표준 곡선과 아데노신 기질 스톡을 준비해야 합니다.
2. 마이크로플레이트 기반 분석
- kinetic read 프로토콜(그림 2)을 설정하여 마이크로플레이트 리더를 준비하여 30분 동안 가장 짧은 판독 간격으로 260nm에서 흡광도를 측정하고 리더를 37°C의 설정값으로 예열합니다.
- 수집된 모든 샘플을 얼음에서 해동합니다. 37°C로 사전 예열된 1x PBS를 저결합 마이크로 원심분리 튜브에서 희석제로 사용하여 해동된 각 샘플을 1:10으로 희석합니다. 이 샘플의 새로운 HsADA1 농도는 50nM입니다.
- 비효소 혈청 대조군 샘플에서도 10x PBS로 희석합니다. 또한 50mL의 1x PBS에 66.8mg의 아데노신을 추가하여 5mM 아데노신 스톡을 준비합니다. 1x PBS 7,600 μL에 아데노신 스톡 400 μL를 첨가하여 아데노신 250 μM 희석액을 준비하고 인큐베이터에서 37 °C로 예열합니다.
- 96웰 UV 호환 마이크로플레이트에 250μM 아데노신 희석액 160μL와 각 희석된 단백질 시료 40μL를 삼중으로 추가하여 총 부피 200μL를 만듭니다. 이것은 200 μM의 최종 아데노신 농도와 10 nM의 최종 효소 농도를 생성합니다.
- 희석된 혈청 또는 1x PBS 대조군 40μL와 250μM 아데노신 희석액 160μL를 삼중으로 추가하여 대조군 샘플에 대한 희석을 반복합니다. 이것은 또한 200 μM의 최종 아데노신 농도를 생성하지만 효소는 없습니다.
참고: 먼저 모든 희석된 효소 및 대조군 샘플을 마이크로플레이트에 개별적으로 추가한 다음 12채널 마이크로피펫으로 아데노신 기질을 추가하여 총 로딩 시간을 줄이는 것이 도움이 될 수 있습니다. 또한 이 단계에서는 플레이트 자체가 측정된 흡광도 신호를 혼동하지 않도록 UV 투명 플레이트를 사용해야 합니다. - 37°C에서 30분 동안 260nm에서 각 웰의 흡광도를 측정합니다. 완료되면 추가 분석을 위해 데이터를 스프레드시트로 내보냅니다.
3. 마이크로플레이트 리더 데이터 분석
- 흡광도 데이터의 선형 영역의 기울기를 마이크로플레이트 데이터의 처음 몇 분 동안의 시간 함수로 결정합니다. 혈청으로 희석된 샘플의 경우, 이는 처음 ~120초에 해당합니다. 1x PBS 희석 샘플의 경우 이는 처음 ~ 270 초에 해당합니다. 이 흡광도 값 감소의 기울기는 음의 숫자 값을 가지며 초당 흡광도 단위(ΔA260/s)의 변화 단위를 갖습니다.
- 효소 + 혈청 데이터의 기울기에서 풀링된 인간 혈청으로 구성된 음성 대조군의 기울기를 뺍니다. 1x PBS 대조군의 기울기를 빼서 효소 + 1x PBS 혼합물에 대해 동일한 작업을 수행합니다.
- 수식 1을 사용하여 조정된 모든 기울기를 t=0h의 원래 기울기로 정규화하여 남아 있는 활동의 비율을 구합니다.
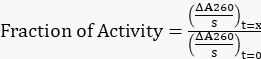 방정식 1
방정식 1 - 시간 대비 남은 활동의 비율을 표시합니다.
결과
그림은 야생형 HsADA1로 수행했을 때 실행된 분석 결과를 보여줍니다. 그림 3A,B는 아데노신 첨가 후 야생형 HsADA1에 대한 1x PBS/혈청-효소 혼합물에서 유래한 샘플의 260nm에서 흡광도 감소 곡선을 보여줍니다. 시간 데이터의 함수로 인한 이러한 흡광도 감소는 사용자가 마이크로플레이트 기반 분석을 성공적으로 완료했을 때 예상할 수 있는 것이며, 아데노신에 충분한 양의 기능성 HsADA1을 첨가한 후 발생하는 흡광도 데이터와 유사합니다. 그림 3C,D는 아데노신 첨가 후 효소를 포함하지 않는 테스트된 음성 대조군의 흡광도 곡선을 보여줍니다. 실제 효소 샘플과 비교했을 때, 이러한 음성 대조군의 흡광도 변화는 거의 무시할 수 있는 수준입니다. 그림 3에서 효소 곡선의 기울기가 배양 시간의 함수로 변하는 것을 볼 수 있습니다. 예를 들어 0일 시점의 기울기는 5일 시점보다 매우 가파릅니다.
그림 4는 37°C에서 1x PBS 또는 풀링된 인간 혈청에서 배양할 때 야생형 HsADA1에 의해 유지되는 활성의 비율을 시간 함수로 보여줍니다. 구체적으로, 그림 3A,B의 모든 흡광도 저하 곡선의 기울기는 해당 그룹의 Day 0 기울기로 정규화됩니다. 그림 4에서 볼 수 있듯이, 1x PBS와 풀링된 인간 혈청에서 야생형 HsADA1에 대해 유지된 활성에는 차이가 있습니다. 특히, 효소는 풀링된 인간 혈청에서 활성을 더 빨리 잃으며, 효소는 5일째에 원래 활성의 약 10%를 유지합니다. 효소가 활성의 약 75%를 유지하지만 HsADA1이 1x PBS에서 배양될 때 활성 손실은 여전히 감지할 수 있습니다. 이것은 Jennings et al.의 결과와 일치하며, 37 ° C에서 혈청으로 배양 한 후 48 시간6 후에 거의 40 % 활성이 감소했다고보고했습니다. Lu et al.은 또한 주변 온도(25°C)에서 흉막, 복막 및 뇌척수 체액에서 HsADA1 활성이 감소한다는 것을 보여주었습니다8.
이 프로토콜의 유연성을 입증하기 위해 우리는 이 프로토콜을 사용하여 이전에 HsKYNase66-W102H-T333N7이라고 불렸던 인간 기원의 또 다른 효소인 조작된 인간 키누레니나제 변이체의 혈청 안정성을 테스트했습니다. HsKYNase66_W102H-T333N은 야생형 HsKYNase 효소와 유사하게 OH-Kyn을 OH-AA로 전환하는 것을 효율적으로 촉매하지만, 실제로는 기질 특이성이 변경된 조작된 인간 키누레니나제 변이체의 2개 아미노산 복귀 돌연변이체, 즉 키누레닌을 안트라닐산으로 효율적으로 분해하는돌연변이입니다 7. OH-Kyn은 379nm에서 강하게 흡수하는 반면 OH-AA는 흡수하지 않으므로 OH-kyn 9,10에 엔지니어링된 HsKYNase 변형체를 추가하면 측정 가능한 흡광도 감소가 발생합니다. 그림 5A,B는 OH-Kyn을 첨가한 후 HsKYNase에 대한 1x PBS/혈청-효소 혼합물에서 유래한 샘플의 379nm에서 흡광도 감소 곡선을 보여줍니다. 그림 5C,D는 효소를 포함하지 않는 테스트된 대조군의 흡광도 곡선을 보여줍니다. HsADA1에서 볼 수 있듯이 시료 전반에 걸쳐 흡광도 곡선의 기울기에는 분명한 차이가 있습니다. 이는 그림 5A에서 특히 두드러지는데, 0시간 시점 기울기가 3시간 및 24시간 시점보다 훨씬 가파르기 때문입니다. 그림 6은 테스트된 HsKYNase에 대해 유지된 활성의 해당 비율을 시간 함수로 보여줍니다. HsADA1과 마찬가지로 HsKYNase66-W102H-T333N은 PBS보다 혈청에서 더 빨리 활성을 잃습니다(~85% 활성 손실 대 24시간 동안 ~40%). 이 효소 변이체의 혈청 안정성은 이전에 테스트되지 않았지만, 다른 HsKYNase 변이체와 마찬가지로 일반적인 경향을 따르며, 역시 37°C의 혈청에서 24시간 이내에 대부분의 활성을 잃었다7.
일반적으로 효소는 pH, 염 농도, 온도 등을 포함한 다양한 요인으로 인해 시간이 지남에 따라 활성을 잃을 수 있습니다11. 따라서 이러한 추세를 따르지 않는 결과는 비정상으로 간주될 수 있습니다. 예를 들어, 효소 활성이 시간이 지남에 따라 급격히 증가하면 결과가 유효하지 않음을 나타낼 수 있습니다. 이것은 효소 조건이 변하지 않는다고 가정한 것이며, 우리는 엄격하게 시간 의미에서 말하고 있습니다.

그림 1: HsADA1에 대한 프로토콜 단계를 자세히 설명하는 순서도. 그림은 이 프로토콜에서 수행된 단계를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Microplate 리더 kinetic read 설정. 최소 간격으로 37°C에서 30분 동안 260nm에서 흡광도를 측정하기 위해 kinetic read 프로토콜이 만들어졌습니다. 그림은 이 프로토콜을 설정하기 위해 선택한 설정을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 200μM 아데노신 첨가 후 HsADA1의 흡광도 대 시간 곡선. (A) 200μM 아데노신 첨가 후 혈청 배양 HsADA1의 흡광도 대 시간 곡선. (B) PBS 배양 HsADA1 1개. (C) 혈청 음성 대조군. (D) 1x PBS 네거티브 컨트롤(n =3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
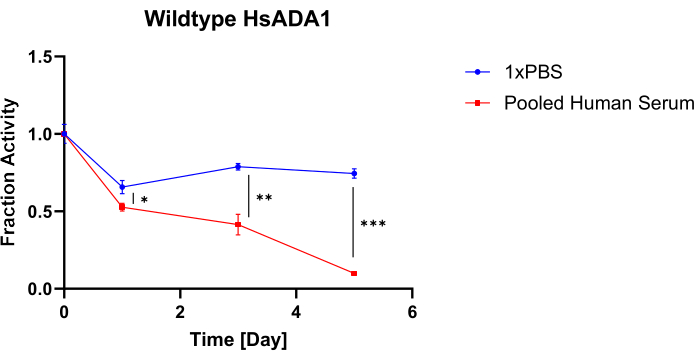
그림 4: HsADA1 활동 보존. 활성은 37°C에서 1x PBS 대 통합 인간 혈청으로 평가됩니다. 1x PBS에서 배양된 HsADA1에 대해 유지된 원래 활성의 비율과 5일 동안 통합된 인간 혈청을 측정했습니다(막대 = 평균 ± SD, n=3). 쌍을 이루지 않은 양측 t-검정은 *p<0.05, **p < 0.01 및 ***p < 0.001을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
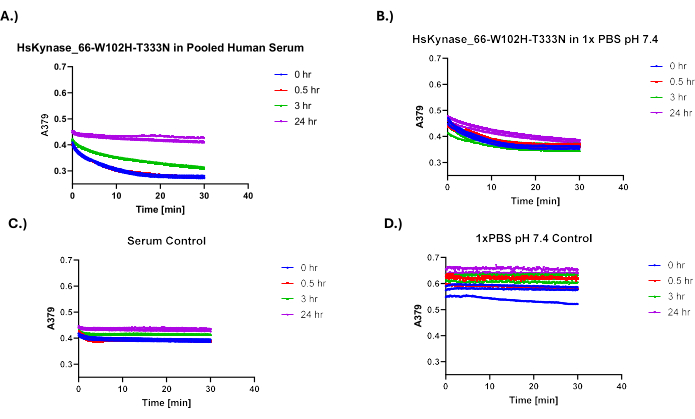
그림 5: 400μM OH-Kyn 첨가 후 HsKYNase66-W102H-T333N의 흡광도 대 시간 곡선. (A) 400μM OH-Kyn 첨가 후 혈청 배양 HsKYNase의 흡광도 대 시간 곡선. (B) PBS 배양 HsKYNase 1개. (C) 혈청 음성 대조군. (D) 1x PBS 네거티브 컨트롤(n=3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
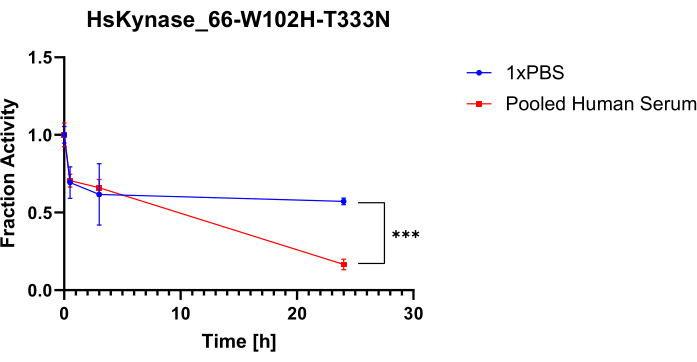
그림 6: HsKYNase66-W102H-T333N 활동 보존. 활성은 37°C에서 1x PBS 대 통합 인간 혈청으로 평가됩니다. 1x PBS에서 배양된 HsKYNase66-W102H-T333N과 24시간 동안 통합된 인간 혈청에 대해 유지된 원래 활성의 비율을 측정했습니다(막대 = 평균 ± SD, n=3). 쌍을 이루지 않은 양측 t-검정을 사용했습니다. P < 0.001입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 아데노신과 이노신의 표준 곡선. 플롯은 0-200 μM에 대해 그려졌으며, 아데노신 또는 이노신을 언급된 농도의 1x PBS에 첨가한 다음 260nm에서 흡광도를 측정했습니다. (n=3)입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: OH-Kyn의 표준 곡선. 플롯은 0-400 μM에 대해 그려졌으며, OH-Kyn을 언급된 농도의 1x PBS에 첨가한 다음 379nm에서 흡광도를 측정했습니다. (n=3)입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 200μM 아데노신 첨가 후 HsADA1 농도 증가에 따른 260nm에서의 흡광도 대 시간 곡선. (A) 다양한 농도의 HsADA1에 대한 반응 곡선. (B) 1x PBS 컨트롤과 관련하여 흡광도 곡선의 선형 영역 기울기의 폴드 변화(막대 = 평균 ± SD, n=3). 쌍을 이루지 않은 양측 t-검정은 **p < 0.01 및 ****p < 0.0001을 사용했습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: 400μM의 OH-Kyn을 첨가한 후 엔지니어링된 HsKYNase의 농도가 증가함에 따라 379nm에서 흡광도 대 시간 곡선. (A) 엔지니어링된 HsKYNase의 다양한 농도에 대한 반응 곡선. (B) 1x PBS 컨트롤과 관련하여 흡광도 곡선의 선형 영역 기울기의 폴드 변화(막대 = 평균 ± SD, n=3). 쌍을 이루지 않은 양측 t-검정은 ****p < 0.0001을 사용했습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5: 400μM의 OH-Kyn에서 열 비활성화 효소를 사용한 379nm에서의 흡광도 대 시간 곡선. 1x PBS에서 400μM의 OH-Kyn에 가열 비활성화 HsKYNase 효소를 첨가한 후 379nm에서 흡광도를 측정했습니다. (n=3)입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 효소의 활성을 측정하기 위해 기질이 생성물로 전환될 때 흡광도 변화를 사용합니다. 따라서 기판과 제품은 뚜렷한 스펙트럼 프로파일을 가져야 합니다. 이것은 아데노신과 이노신이 모두 260-265 nm 6,8,12,13 사이의 뚜렷한 스펙트럼 프로필과 흡광 계수를 갖는 경우입니다. 이 분석은 이전의 여러 연구에서 영감을 받았습니다. 예를 들어, Kalackar는 265nm에서의 흡광도 변화를 아데노신 데아미나제 활성에 대한 직접적인 상관관계로 활용했습니다14. Gracia et al. 및 Lu et al.은 초기 속도를 아데노신과 이노신 사이의 흡광 계수 차이와 관련시키는 Beer-Lambert 법칙에 뿌리를 둔 접근 방식을 사용했습니다 8,13. 비슷한 맥락에서 OH-Kyn과 OH-AA는 OH-Kyn이 379nm에서 강하게 흡수하는 반면 OH-AA는 9,10이 아니라는 점에서 뚜렷한 스펙트럼 프로필을 가지고 있습니다. 대사 산물의 흡광도 스펙트럼은 많은 마이크로플레이트 리더에서 전체 스펙트럼 스캔을 사용하여 쉽게 확인할 수 있으며, 이를 통해 사용자에게 효소 반응의 진행 상황을 추적할 수 있는지 여부를 알 수 있습니다. 앞서 언급했듯이 Lu 등은 이전에 다양한 체액에서 천연 HsADA1 안정성을 분석했으며 Jennings 등은 재조합 HsADA1 및 돌연변이 효소 6,8의 혈청 안정성을 측정하기 위해 매우 유사한 방법을 사용했습니다. Jennings et al.의 방법과 같은 이 방법은 자연 유래 효소와 달리 재조합 발현 효소를 사용할 수 있다는 점에서 독특합니다. 이를 통해 이 방법은 살아있는 유기체에서 본래 발견되지 않는 돌연변이 단백질로 외삽될 수 있습니다.
플레이트 기반 흡광도 분석을 사용하여 측정할 수 없는 제품/기판 조합의 경우, 이 프로토콜은 예를 들어 이전에 아데노신 데아미나제 및 키누레니나제 모두의 역학을 평가하는 데 사용된 고성능 액체 크로마토그래피(HPLC)와 같은 kinetic 분석을 위한 기판 분해 또는 생성물 형성을 추적하는 여러 다른 대체 분석 방법을 통합하도록 수정할 수 있습니다15, 16,17. 일정 시간(지속적으로 결정되지 않는 경우) 후에 남은 기판 또는 생성된 제품을 결정하는 방법만 달라야 합니다. 물론 분석법의 선택은 관심 효소에 의해 촉매되는 반응에 따라 달라지며, 이 선택의 주요 고려 사항은 주어진 분석 방법과 희석된 인간 혈청의 호환성이기도 합니다. 관심 있는 모든 시료를 분석하는 데 필요한 총 시간도 마찬가지로 중요할 수 있으며, 마이크로플레이트 분석을 활용하는 주요 이점은 한 번에 최대 96개 시료의 분해 속도를 쉽게 분석할 수 있다는 것입니다.
on-plate 효소 및 기질 농도와 같은 분석 파라미터는 관심 있는 개별 효소에 맞게 조정해야 합니다. 여기에서 수행된 모든 분석에 대해 더 큰 크기(1.15-1.26 OOM)만큼Km 이상의 기질 농도가 선택되었습니다. Wildtype HsADA1은 아데노신에 대해 ~ 14 μM의 Kl을 가지며 사용 된 최종 플레이트 아데노신 농도는 200 μM3 입니다. 유사하게, 테스트된 엔지니어링된 HsKYNase 변형체는 OH-Kyn에 대해 Km ~ 22 μM를 가지며 사용 된 최종 on-plate OH-Kyn 농도는 400 μM7 이었습니다. 마이크로플레이트 분석을 위한 관심 기질 농도에 대한 한 가지 중요한 요구 사항은 기질이 주어진 범위 내에서 Beer-Lambert 법칙을 준수하여 흡광도 감소가 기질 저하와 선형 상관 관계가 있을 수 있다는 것입니다(보충 그림 1 및 보충 그림 2). 이 선형 상관 관계는 이 변환을 수행해도 나머지 활성 분율이 변경되지 않기 때문에 흡광도 변화를 기판 농도로 변환할 필요성을 제거합니다.
효소 농도에 관해서는, 고려해야 할 주요 기준은 배경에 비해 충분한 기질 분해가 있는지 여부입니다. HsADA1과 엔지니어링된 HsKYNase 모두에 대해 이전에 발표된 문헌 값을 사용하여 대표 결과를 생성했습니다 6,7. 여기에서 보여준 바와 같이, 더 긴 시간과 더 낮은 효소 농도를 사용하는 것과 마찬가지로 더 높은 효소 농도로 더 짧은 시간을 사용하는 것이 가능할 수 있습니다. 일반적으로 더 긴 기간/더 낮은 효소 농도는 기질 자체가 분해되기 쉽지 않는 한 더 재현성 있는 결과를 제공할 수 있습니다. 이러한 맥락에서, OH-Kyn을 포함한 키누레닌 및 그 유도체는 모두 실온에서 상대적으로 빠르게 분해되어, 기판 혼합물(18)의 눈에 띄는 황변을 초래한다. 다른 효소의 경우, 가장 최적의 반응 곡선 및 배경 분리를 가진 농도를 식별하기 위해 간단한 농도 증량 실험을 수행할 수 있습니다. HsADA1에 대해 이러한 농도 에스컬레이션을 수행하면 1-10nM 범위 내에서 가장 큰 배경 분리가 달성됨을 알 수 있습니다(보충 그림 3). 엔지니어링된 HsKYNase를 사용하여 이와 동일한 농도 증량 실험을 수행하면 2μM에서 가장 큰 배경 분리와 유사한 추세를 보여줍니다(보충 그림 4). 그러나 두 분석법(HsADA1 대 HsKYNase) 모두 동일한 감도를 갖지 않습니다. HsADA1의 경우, 프로토콜에 사용된 농도의 1/10에 불과한 온플레이트(on-plate) 효소 농도는 여전히 통계적으로 유의한 수준에서 배경과 구별할 수 있습니다(보충 그림 3). HsKYNase의 경우에도 마찬가지이며, 이는 HsKYNase가 활동의 90% 이상을 잃으면 얼마나 많은 활동을 유지하는지 정량적으로 평가하기 어려울 수 있음을 의미합니다. 이는 마이크로플레이트 리더 방법의 잠재적인 한계를 나타냅니다.
또한 HsKYNase에 대해 관찰한 한 가지 사항은 플레이트 로딩 시 효소 + 1x PBS 샘플과 1x PBS 대조군 사이의 흡광도 판독값 사이에 즉각적인 간격이 있다는 것입니다(그림 5B,D). 이 격차는 모든 시점에 존재했습니다. 열-비활성화 효소(95°C에서 10분 동안 가열)를 테스트할 때도 이러한 현상이 관찰되었기 때문에 효소 매개 기질 분해의 결과가 아니라는 결론을 내렸습니다(보충 그림 5). 원래의 대조군 흡광도 값을 계속 진행했지만, 향후 연구에서는 이러한 불일치를 제거하기 위해 비활성화된 효소 대조군을 사용할 수 있습니다. 그러나 관심 효소를 구매하거나 생산하는 데 드는 비용을 고려해야 합니다. HsKYNase 및 HsADA1 모두의 경우 테스트 샘플의 시작 흡광도 값에 약간의 변동이 있었으며 일부는 관련 대조군보다 낮은 흡광도 값에서 시작했습니다(그림 3 및 그림 5). 이는 부분적으로 모든 단백질 샘플에 기질을 추가한 다음 플레이트 리더에 로드하는 데 걸리는 지연 시간에 기인할 수 있습니다. 그러나, 사용된 기질 농도가 사용된 효소의 Km 값보다 훨씬 높기 때문에, 이는 관찰된 기울기에 대한 기질 농도 의존적 효과로 이어지지 않을 것으로 예상된다.
protocol and representative results(프로토콜 및 대표 결과) 섹션에서 샘플은 표시된 시점에 분주되며, 샘플링 시간은 효소의 활성 프로파일에 따라 달라집니다. 이 샘플링 일정은 혈청에서 관심 효소의 활성 프로필에 따라 달라집니다. 효소가 활성을 빠르게 잃으면 테스트한 HsKYNase_66-W102H-T333N 돌연변이의 경우와 같이 더 작은 샘플링 간격이 필요하며, 혈청 안정성이 더 큰 효소의 경우 그 반대입니다. 따라서, 관심 있는 새로운 효소에 대한 혈청 안정성 프로파일이 어떻게 보이는지 조사하기 위해 작은 간격(1시간, 2시간 등)과 큰 간격(24시간, 48시간 등)으로 분취액을 샘플링하는 이 프로토콜의 시험을 실행하는 것이 도움이 될 수 있습니다. 물론, 혈청이 더욱 견고해짐에 따라, 혈청 안정성은 신장 청소율 또는 생체 내 단백질 제거의 다른 메커니즘에 비해 관련성이 낮아질 것입니다.
kynureninase는 HsADA1과 다르기 때문에 혈청 또는 1x PBS에서 배양 중 효소 농도, 샘플링 간격, 마이크로플레이트 분석 효소 농도, 마이크로플레이트 분석 기질 농도 및 물론 기질 자체와 같은 여러 분석 매개변수를 수정했습니다. 변경 사항은 다음과 같습니다: 10x 효소 스톡은 100μM의 농도였으며 혈청/1x PBS로 희석한 후 10μM의 농도가 되었습니다. 혈청 배양 방법의 샘플링 간격은 HsKYNase가 HsADA1보다 혈청에서 더 빨리 활성을 잃기 때문에 조정되었습니다. 따라서 이 방법에는 0.5시간, 3시간 및 24시간 시점에서의 샘플링이 포함되었습니다. 또한 HsKYNase 샘플은 급속 동결되지 않고 마이크로플레이트 분석을 사용하여 즉시 분석되었습니다. 플레이트 리더는 효소 반응의 진행 상황을 모니터링하기 위해 379nm에서 판독하도록 구성되었습니다. HsKYNase 효소를 연구할 때 마이크로플레이트 기반 분석의 또 다른 중요한 차이점은 기질의 준비입니다. OH-Kyn의 2mM 스톡은 4.5mg의 OH-Kyn을 1x PBS 10mL에 용해시켜 만들었습니다. 동시에 HsKYNase 보조 인자인 피리독살 포스페이트(PLP) 6mg을 1x PBS 1mL에 용해시켜 PLP 100배 스톡을 만들었습니다. OH-Kyn 500μM 희석액은 2.5mL의 OH-Kyn 스톡을 1x PBS 7.5mL 및 100x PLP 스톡 100μL에 첨가하여 제조했습니다. 마이크로플레이트 분석을 실행하기 위해 500μM OH-Kyn 희석 80μL와 분취된 단백질 샘플 또는 음성 대조군 20μL를 96웰 UV 호환 마이크로플레이트에 세 배로 추가했습니다. 그 결과 최종 OH-Kyn 농도는 400μM, 최종 효소 농도는 2μM가 생성되었으며, 그 후 379nm에서 흡광도를 37°C에서 30분 동안 측정했습니다. 플레이트 리더에서 분석하기 전에 희석된 HsADA1과 달리 HsKYNase는 희석되지 않았습니다.
이 프로토콜은 비교적 수월하지만, 원래의 효소 스톡을 준비하는 데 잠재적인 문제가 있을 수 있습니다. 대표적인 결과 섹션에 사용된 모든 효소를 대장균으로 발현시키고 니켈계 친화성 크로마토그래피에 이어 크기 배제 크로마토그래피(SEC)를 사용하여 정제하였다. 여러 다른 출처에서 숙주 유기체 및 다운스트림 공정에 걸친 당사의 정제 방법에 대한 대안을 전문적으로 설명했습니다19,20. 이 분석은 근본적으로 풀링된 인간 혈청에서 효소가 활성을 유지하는 능력을 결정하려고 합니다. 우리 방법론의 한 가지 가정은 효소의 활성 손실이 영구적이라는 것, 즉 혈청에서 비활성화된 효소를 제거해도 활성이 복원되지 않는다는 것입니다. 이는 이 프로토콜에서 효소 혼합물을 글리세롤과 1x PBS로 더 희석하기 때문에 급속 동결 전과 해동 후에 중요합니다. 이러한 활성 손실이 혈청 제거 시 되돌릴 수 있는 경우, 이러한 추가 희석은 분석이 이 현상을 포착하는 것을 방지합니다. 이것이 사용자에게 우려되는 경우 1.) 풀링된 인간 혈청은 모든 기질 및 테스트 샘플 용액의 준비에서 1x PBS 대신 희석제로 사용할 수 있으며, 2.) 글리세롤의 급속 동결 및 첨가는 건너뛸 수 있으며 샘플을 즉시 처리하여 효소를 원래 환경에서 유지할 수 있습니다. 마지막으로, 이 분석은 효소 활성에 대한 혈청 특이적 효과를 조사하는 데 사용할 수 있지만, 이러한 효과 이면의 특정 메커니즘에 대해서는 결론을 내릴 수 없습니다. 이러한 활성의 손실이 효소 풀림, 응집, 보조인자의 손실 또는 혈청 프로테아제에 의한 절단에 의해 발생하는지 여부는 추가 조사가 필요합니다. 1x PBS 배양 효소에 대해서도 이 분석에서 기계론적 결론을 도출할 수 없다는 점에서 유사한 자격을 말할 수 있습니다.
단백질 생물학적 제제를 치료제로 개발하는 맥락에서, 혈청 내 활성을 유지하는 능력은 중요한 지표이다21. 매우 빠르게 활성을 잃는 치료 효소는 임상적 이점을 얻기 위해 반복적으로 투여해야 합니다. 이 작업은 사용자에게 향상된 혈청 안정성을 위해 효소를 정량적으로 스크리닝하는 시험관 내 분석을 제공합니다. 유도 진화 노력과 결합하면 혈청 안정성이 우수한 효소를 스크리닝하고 선택할 수 있어 번역 가능성에 대한 더 큰 잠재력을 제공할 수 있습니다. 또한, 이 프로토콜은 예를 들어 효소가 캡슐화된 혈청 안정성을 측정하기 위해 더 발전된 시스템에서도 작동할 수 있을 것으로 예상합니다. Das et al.은 바이러스 유사 입자로 패키징된 여러 가지 효소에 대한 분석을 적용하고 유기 용매와 같은 다양한 변성 조건에서 안정성을 테스트했습니다22.
공개
JB 및 MRJ는 아데노신 데아미나제 및/또는 키누레니나제 효소와 관련된 특허 또는 특허 출원의 발명자입니다. 다른 모든 저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health)[1DP2CA280622-01]과 Biolocity의 자금 지원을 받았습니다. HsADA1 및 HsKYNase 발현 벡터를 제공해 주신 Maria Jennings 박사와 Andrea Fox 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
참고문헌
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유