Method Article
Détermination de la stabilité sérique de l’enzyme adénosine désaminase 1 humaine
Dans cet article
Résumé
Dans cet article, nous détaillons des méthodes pour caractériser la capacité d’une enzyme à conserver sa fonction lorsqu’elle est incubée à 37 °C dans le sérum humain, une propriété pharmacologique appelée stabilité sérique. Cette capacité peut être un facteur clé dans la prédiction du profil pharmacocinétique d’une enzyme et de son aptitude à un usage thérapeutique.
Résumé
Le concept de stabilité enzymatique est généralement utilisé pour faire référence à la thermostabilité d’une enzyme, c’est-à-dire à sa capacité à conserver sa structure et son activité lorsque la température augmente. Pour une enzyme thérapeutique, d’autres mesures de stabilité peuvent également être critiques, en particulier sa capacité à conserver sa fonction dans le sérum humain à 37 °C, ce que nous appelons la stabilité sérique. Ici, nous décrivons un test in vitro pour évaluer la stabilité sérique de l’enzyme sauvage Homo sapiens adénosine désaminase I (HsADA1) à l’aide d’une procédure de microplaque basée sur l’absorbance. Plus précisément, ce manuscrit décrit la préparation de tampons et de réactifs, une méthode d’organisation de la coïncubation de HsADA1 dans le sérum, une méthode d’analyse des échantillons de test à l’aide d’un lecteur de microplaques et une analyse d’accompagnement pour déterminer la fraction d’activité qu’une enzyme HsADA1 conserve dans le sérum en fonction du temps. Nous discutons plus en détail des considérations visant à adapter ce protocole à d’autres enzymes, en utilisant l’exemple d’une enzyme kynurénase Homo sapiens , afin d’aider à l’adaptation du protocole à d’autres enzymes où la stabilité sérique est intéressante.
Introduction
La méthode suivante permet à un utilisateur d’évaluer quantitativement la capacité d’une enzyme à conserver son activité lorsqu’elle est exposée à des conditions qui imitent ce qu’elle rencontrera après une injection intraveineuse. La méthode in vitro imite de telles conditions in vivo et consiste en l’incubation de l’enzyme dans du sérum humain groupé à 37 °C et des analyses chronologiques de la rétention de l’activité enzymatique. Nous nous référons à la capacité d’une enzyme à conserver son activité dans ces conditions comme sa stabilité sérique, et la méthode d’analyse de l’activité enzymatique tire parti des différences d’absorbance entre le substrat d’une enzyme et le produit résultant. Le concept de stabilité sérique n’est pas seulement spécifique à une enzyme et a également été appliqué à plusieurs autres modalités de traitement. Par exemple, la stabilité sérique des aptamères d’ARN ciblant les protéines de pointe COVID a déjà été évaluée en surveillant leur dégradation après l’incubation avec le sérum de veau fœtal1. Des peptides antibactériens ont également été évalués pour leur capacité à supprimer la croissance bactérienne après l’incubation avec du sérum humain2 mélangé.
HsADA1 est une enzyme qui catalyse la conversion de l’adénosine ou de la 2-désoxyadénosine en inosine ou en 2-désoxyinosine, respectivement3. L’adénosine a un pic d’absorption de 260 nm, tandis que l’inosine absorbe le plus fort à 250 nm4. Ce décalage des pics d’absorption peut être détecté sur un lecteur de microplaques par une diminution de l’intensité d’absorption à 260 nm lorsque HsADA1 est ajouté à l’adénosine. L’enzyme HsADA1 a des implications importantes dans le corps humain, et sa carence provoque une immunodéficience combinée sévère (ADA-SCID)5. L’homologue bovin de HsADA1, BtADA1, peut être utilisé comme thérapie de remplacement enzymatique pour le traitement de l’ADA-SCID, et nous avons précédemment montré que le HsADA1 de type sauvage perd son activité lorsqu’il est incubé avec du sérum humain mélangé, ce qui pourrait entraver son utilisation en tant que thérapeutique6. Par conséquent, nous avons sélectionné l’enzyme HsADA1 de type sauvage pour démontrer une procédure permettant de déterminer la stabilité sérique d’une enzyme. Une méthode de purification détaillée de HsADA1 a été décrite précédemment6.
Dans le protocole suivant (tel que détaillé dans la figure 1), nous démontrons comment co-incuber HsADA1 de type sauvage dans du sérum humain mélangé à 37 °C. Pendant ce temps, des échantillons d’essai sont prélevés à des moments définis et congelés pour une analyse future. Une fois que tous les échantillons ont été prélevés, un test sur microplaque est effectué dans lequel chaque échantillon est combiné avec le substrat, la diminution de l’absorbance résultante étant une corrélation avec l’activité conservée de l’enzyme. Des résultats représentatifs illustrant la stabilité sérique de HsADA1 sont présentés, et parce que cette métrique peut être pertinente pour déterminer la valeur thérapeutique potentielle d’autres enzymes, nous discutons également des considérations pour adapter ce protocole à une enzyme kynurénase Homo sapiens modifiée (HsKYNase) et à toute enzyme plus généralement. La HsKYNase est une enzyme impliquée dans le métabolisme du tryptophane et est capable de dégrader les sous-produits du tryptophane, la kynurénine et l’hydroxy-kynurénine (OH-Kyn), respectivement en acide anthranilique et en acide hydroxy-anthranilique (OH-AA). La modulation du métabolisme du tryptophane par l’intermédiaire enzymatique peut être d’une pertinence thérapeutique7.
Protocole
1. Incubation sérique
- Préparez une quantité 10x de HsADA1 dans 1x PBS pH 7,4 (1x PBS) à une concentration finale de 10 μM. Décongelez une aliquote de 15 mL de sérum humain mélangé et préchauffez-la à 37 °C. Préchauffer une aliquote de 50 mL de 1x PBS à 37 °C.
- Préparez les mélanges d’incubation enzyme-sérum en ajoutant 100 μL de la matrice 10x HsADA1 à 900 μL de sérum humain mélangé dans un tube de microcentrifugation à faible liaison, appelé mélange enzyme + sérum. Dans un tube de microcentrifugation séparé à faible liaison, ajoutez 100 μL de la matrice 10x HsADA1 à 900 μL de 1x PBS pour comparaison avec un témoin non sérum, appelé mélange enzyme + 1x PBS. La concentration finale de HsADA1 dans chaque mélange sera de 1 μM.
- Préparez un témoin supplémentaire dans un tube de microcentrifugation à faible liaison composé de 100 μL de 1x PBS mélangé à 900 μL de sérum humain mélangé. Cela servira de contrôle non enzymatique pour le mélange enzyme + sérum. De plus, faites un contrôle composé de 1 mL de 1x PBS. Cela servira de contrôle non enzymatique pour le mélange enzyme + 1x PBS.
- Aliquote 100 μL de chaque mélange à partir de l’étape 1.2 dans des tubes séparés à faible liaison et diluer 1:1 avec 100 μL de glycérol à 30 % (v/v) dans 1x PBS. Congeler rapidement avec de l’azote liquide et conserver à -80 °C. Ces échantillons seront le point temporel du jour 0, et la concentration de HsADA1 dans ceux-ci sera de 500 nM. Répétez cette étape pour les mélanges de contrôle non enzymatiques à partir de 1.3. Scellez toutes les enzymes et les mélanges de contrôle avec un film transparent et placez-les dans un incubateur à 37 °C.
- Après 24 h, aliquote 100 μL de chaque échantillon incubé et diluer 1:1 avec 100 μL de glycérol à 30 % (v/v) dans 1x PBS. Congeler rapidement avec de l’azote liquide et conserver à -80 °C. Ces échantillons seront le point temporel du jour 1. Remettre tous les mélanges d’enzymes et de témoins dans l’incubateur à 37 °C. Répétez cette étape à 72 h et 120 h.
REMARQUE : Les échantillons aliquotes n’ont pas nécessairement besoin d’être surgelés. L’utilisateur peut également effectuer le test sur microplaques immédiatement après le prélèvement de chaque échantillon, bien que de nouvelles courbes standard et des stocks de substrat d’adénosine doivent être préparés chaque fois qu’un échantillon est testé.
2. Dosage sur microplaque
- Préparez le lecteur de microplaques en mettant en place un protocole de lecture cinétique (Figure 2) pour mesurer l’absorbance à 260 nm avec l’intervalle de lecture le plus court pendant 30 min et préchauffer le lecteur à un point de consigne de 37 °C.
- Décongeler tous les échantillons prélevés sur de la glace. Diluer chaque échantillon décongelé à l’aide de 1x PBS préchauffé à 37 °C comme diluant dans des tubes de microcentrifugation à faible liaison. La nouvelle concentration de HsADA1 dans ces échantillons sera de 50 nM.
- Faites une dilution 10x dans 1x PBS à partir de l’échantillon de contrôle sérique non enzymatique également. De plus, préparez un stock d’adénosine de 5 mM en ajoutant 66,8 mg d’adénosine à 50 mL de 1x PBS. Préparez une dilution de 250 μM d’adénosine en ajoutant 400 μL de la pâte d’adénosine à 7 600 μL de 1x PBS et préchauffez-la à 37 °C dans un incubateur.
- À une microplaque compatible avec les UV à 96 puits, ajoutez 160 μL de dilution d’adénosine de 250 μM et 40 μL de chaque échantillon de protéine diluée en trois exemplaires pour un volume total de 200 μL. Cela donnera une concentration finale d’adénosine de 200 μM et une concentration finale d’enzyme de 10 nM.
- Répéter la dilution pour les échantillons témoins en ajoutant 40 μL de sérum dilué ou 1 témoin PBS et 160 μL de la dilution de 250 μM d’adénosine en trois exemplaires. Cela donnera également une concentration finale d’adénosine de 200 μM mais sans enzyme.
REMARQUE : Il peut être avantageux d’ajouter d’abord tous les échantillons d’enzymes et de contrôle dilués individuellement à la microplaque, puis d’ajouter le substrat d’adénosine avec une micropipette à 12 canaux pour réduire le temps de chargement total. De plus, des plaques transparentes aux UV doivent être utilisées dans cette étape pour éviter que la plaque elle-même ne confonde le signal d’absorbance mesuré. - Mesurer l’absorbance de chaque puits à 260 nm pendant 30 min à 37 °C. Une fois cela fait, exportez les données vers une feuille de calcul pour une analyse plus approfondie.
3. Analyse des données des lecteurs de microplaques
- Déterminez la pente de la région linéaire des données d’absorbance en fonction du temps pendant les premières minutes des données de microplaques. Pour les échantillons dilués dans le sérum, cela correspondait aux premiers ~120 s. Pour les échantillons 1x dilués par PBS, cela correspondait aux premiers ~270 s. Cette pente de valeurs d’absorbance décroissantes aura une valeur numérique négative et aura des unités de variation en unités d’absorbance par seconde (ΔA260/s).
- Soustrayez la pente du témoin négatif constitué de sérum humain regroupé de la pente des données enzyme + sérum. Effectuez la même opération sur les mélanges enzyme + 1x PBS en soustrayant la pente du témoin 1x PBS.
- Normalisez toutes les pentes ajustées à la pente d’origine à t = 0 h pour obtenir la fraction d’activité restante à l’aide de l’équation 1.
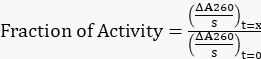 Équation 1
Équation 1 - Tracez la fraction d’activité restante en fonction du temps.
Résultats
Les figures montrent les résultats de l’analyse lorsqu’elle a été menée avec HsADA1 de type sauvage. Les figures 3A et B illustrent les courbes de baisse de l’absorbance à 260 nm des échantillons provenant des mélanges 1x PBS/sérum et enzymes pour HsADA1 de type sauvage après ajout d’adénosine. Cette absorbance décroissante en fonction des données temporelles est ce à quoi l’utilisateur peut s’attendre une fois le test sur microplaque réussi et est similaire aux données d’absorbance qui résulteraient de l’ajout de quantités suffisantes de HsADA1 fonctionnelle à l’adénosine. La figure 3C,D illustre les courbes d’absorbance des témoins négatifs testés, qui ne contiennent aucune enzyme après l’ajout d’adénosine. Par rapport aux échantillons d’enzymes réels, la variation de l’absorbance de ces témoins négatifs est presque négligeable. Sur la figure 3, on peut voir que les pentes des courbes enzymatiques changent en fonction du temps d’incubation. Par exemple, la pente du point de temps du jour 0 est considérablement plus raide que celle du point de temps du jour 5.
La figure 4 illustre la fraction de l’activité conservée par HsADA1 de type sauvage en fonction du temps lorsqu’il est incubé dans 1x PBS ou dans un sérum humain mélangé à 37 °C. Plus précisément, les pentes de toutes les courbes de baisse de l’absorbance de la figure 3A et B sont normalisées en fonction des pentes du jour 0 de leurs groupes respectifs. Comme on peut le voir sur la figure 4, il existe une divergence dans l’activité conservée pour le HsADA1 de type sauvage dans 1x PBS par rapport au sérum humain mélangé. Plus précisément, l’enzyme perd son activité plus rapidement dans le sérum humain mélangé, l’enzyme conservant environ 10 % de son activité d’origine au jour 5. Une perte d’activité est toujours détectable lorsque HsADA1 est incubé dans 1x PBS, bien que l’enzyme conserve environ 75% de son activité. Ceci est conforme aux résultats de Jennings et al., qui signalent également une diminution de l’activité après incubation avec du sérum à 37 °C de près de 40 % après 48 h6. Lu et al. ont également montré que l’activité de HsADA1 diminue dans les fluides corporels pleuraux, péritonéaux et céphalo-rachidiens à température ambiante (25 °C)8.
Pour démontrer la flexibilité de ce protocole, nous l’avons utilisé pour tester la stabilité sérique d’une autre enzyme d’origine humaine, une variante modifiée de la kynurénase humaine précédemment baptisée HsKYNase66-W102H-T333N7. HsKYNase66_W102H-T333N catalyse efficacement la conversion de OH-Kyn en OH-AA, similaire à l’enzyme HsKYNase de type sauvage, bien qu’il s’agisse en fait d’un mutant de réversion à deux acides aminés d’une variante de kynurénase humaine modifiée avec une spécificité de substrat modifiée, c’est-à-dire qui dégrade efficacement la kynurénine en acide anthranilique7. OH-Kyn absorbe fortement à 379 nm, contrairement à OH-AA, ce qui entraîne une baisse mesurable de l’absorbance lors de l’ajout de notre variante HsKYNase modifiée à OH-kyn 9,10. La figure 5A,B illustre les courbes de baisse de l’absorbance à 379 nm des échantillons provenant des mélanges 1x PBS/sérum-enzymes pour HsKYNase après l’ajout de OH-Kyn. La figure 5C,D illustre les courbes d’absorbance des témoins testés qui ne contiennent pas d’enzymes. Comme on l’a vu avec HsADA1, il y a une nette différence dans les pentes des courbes d’absorbance entre les échantillons. Cela est particulièrement évident dans la figure 5A, car la pente du point de temps de 0 h est beaucoup plus raide que celle des points de temps de 3 h et de 24 h. La figure 6 illustre la fraction correspondante de l’activité retenue pour la HsKYNase testée en fonction du temps. Comme HsADA1, HsKYNase66-W102H-T333N perd de l’activité dans le sérum plus rapidement que dans le PBS (~85% d’activité perdue contre ~40% au cours de 24 heures). Bien que la stabilité sérique de cette variante enzymatique n’ait pas été testée auparavant, elle suit la tendance générale des autres variantes de la HsKYNase, qui ont également perdu la majeure partie de leur activité en 24 heures dans le sérum à 37 °C7.
D’une manière générale, les enzymes peuvent perdre de leur activité au fil du temps en raison d’une foule de facteurs, notamment le pH, la concentration en sel, la température, etc. 11. Par conséquent, un résultat qui ne suit pas cette tendance pourrait être considéré comme anormal. Par exemple, si l’activité enzymatique augmente considérablement au fil du temps, cela pourrait indiquer que les résultats ne sont pas valides. Cela suppose que les conditions enzymatiques ne sont pas modifiées, et nous parlons strictement dans un sens temporel.

Figure 1 : Organigramme détaillant les étapes du protocole pour HsADA1. La figure montre les étapes suivies dans ce protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Paramètres de lecture cinétique du lecteur de microplaques. Un protocole de lecture cinétique a été créé pour mesurer l’absorbance à 260 nm pendant 30 min à 37 °C avec l’intervalle minimum. La figure représente les paramètres choisis pour configurer ce protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Courbes d’absorbance en fonction du temps pour HsADA1 après l’ajout de 200 μM d’adénosine. (A) Courbes d’absorbance en fonction du temps pour HsADA1 incubée dans le sérum après l’ajout de 200 μM d’adénosine. (B) 1x HsADA1 incubé par PBS. (C) Contrôle sérique négatif. (D) 1x témoin négatif PBS (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
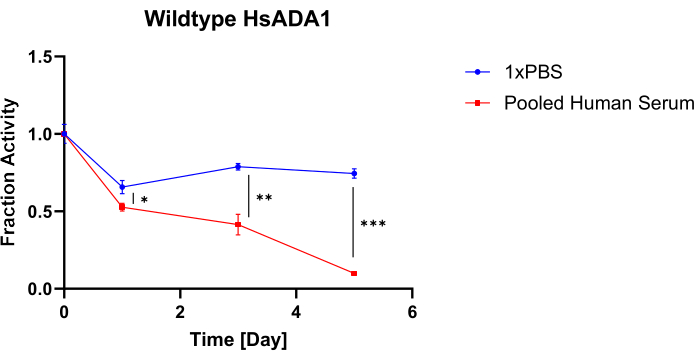
Figure 4 : Rétention de l’activité HsADA1. L’activité est évaluée dans 1x PBS par rapport au sérum humain combiné à 37 °C. La fraction de l’activité initiale retenue pour HsADA1 incubée dans 1x PBS par rapport au sérum humain combiné sur une période de 5 jours a été déterminée (barres = moyenne ± écart-type, n = 3). Un test t bilatéral non apparié a été utilisé *p<0,05, **p < 0,01 et ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
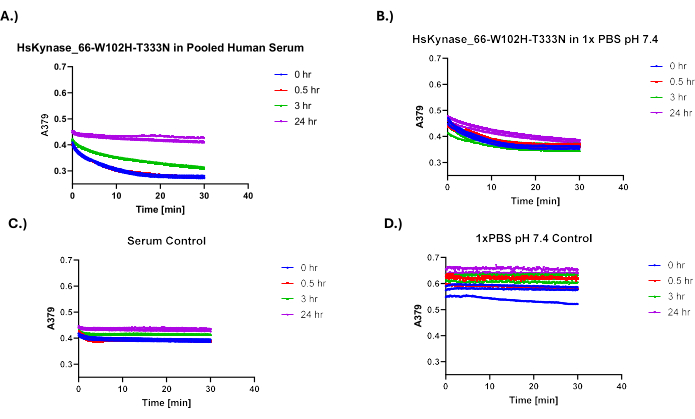
Figure 5 : Courbes d’absorbance en fonction du temps pour HsKYNase66-W102H-T333N après l’ajout de 400 μM OH-Kyn. (A) Courbes d’absorbance en fonction du temps pour la HsKYNase incubée dans le sérum après l’ajout de 400 μM OH-Kyn. (B) 1x HsKYNase incubée par PBS. (C) Contrôle sérique négatif. (D) 1x témoin négatif PBS (n=3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
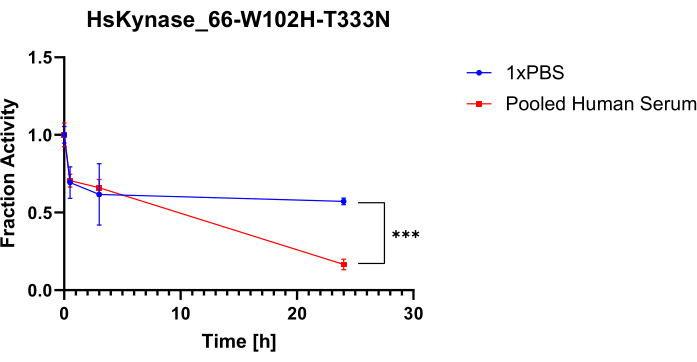
Figure 6 : Rétention d’activité HsKYNase66-W102H-T333N. L’activité est évaluée dans 1x PBS par rapport au sérum humain combiné à 37 °C. La fraction de l’activité initiale retenue pour HsKYNase66-W102H-T333N incubée dans 1x PBS par rapport au sérum humain mélangé au cours de 24 h a été déterminée (barres = moyenne ± écart-type, n = 3). Un test t bilatéral non apparié a été utilisé ; p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Courbe standard de l’adénosine et de l’inosine. Le graphique a été dessiné pour 0-200 μM. L’adénosine ou l’inosine a été ajoutée à 1x PBS aux concentrations notées, puis l’absorbance à 260 nm a été mesurée. (n=3). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Courbe standard de OH-Kyn. Le graphique a été dessiné pour 0-400 μM. OH-Kyn a été ajouté à 1x PBS aux concentrations notées, puis l’absorbance à 379 nm a été mesurée. (n=3). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Courbes d’absorbance en fonction du temps à 260 nm avec des concentrations croissantes de HsADA1 après l’ajout de 200 μM d’adénosine. (A) Courbes de réaction pour diverses concentrations de HsADA1. (B) Variation du pli de la pente de la région linéaire des courbes d’absorbance par rapport à un témoin PBS 1x (barres = moyenne ± SD, n = 3). Un test t bilatéral non apparié a été utilisé **p < 0,01 et ****p < 0,0001. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Courbes d’absorbance en fonction du temps à 379 nm avec des concentrations croissantes de HsKYNase modifiée après l’ajout de 400 μM d’OH-Kyn. (A) Courbes de réaction pour diverses concentrations de HsKYNase modifiée. (B) Variation du pli de la pente de la région linéaire des courbes d’absorbance par rapport à un témoin PBS 1x (barres = moyenne ± SD, n = 3). Un test t bilatéral non apparié a été utilisé ****p < 0,0001. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Courbes d’absorbance en fonction du temps à 379 nm à l’aide d’une enzyme désactivée par la chaleur dans 400 μM d’OH-Kyn. L’enzyme HsKYNase désactivée par la chaleur a été ajoutée à 400 μM d’OH-Kyn dans 1x PBS, puis l’absorbance à 379 nm a été mesurée. (n=3). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce protocole utilise le changement d’absorbance lorsque le substrat est converti en produit pour évaluer l’activité d’une enzyme. En tant que tels, le substrat et le produit doivent avoir des profils spectraux distincts. C’est le cas de l’adénosine et de l’inosine ayant toutes deux des profils spectraux distincts et des coefficients d’extinction compris entre 260 et 265 nm 6,8,12,13. Ce test s’inspire de plusieurs travaux antérieurs. Kalackar, par exemple, a utilisé la variation de l’absorbance à 265 nm comme corrélat direct de l’activité de l’adénosine désaminase14. Gracia et al. et Lu et al. ont utilisé une approche enracinée dans la loi de Beer-Lambert, qui relie la vitesse initiale à la différence des coefficients d’extinction entre l’adénosine et l’inosine 8,13. Dans le même ordre d’idées, OH-Kyn et OH-AA ont également des profils spectraux distincts en ce sens que OH-Kyn absorbe fortement à 379 nm alors que OH-AA ne le fait pas à 9,10. Le spectre d’absorbance des métabolites peut être facilement vérifié à l’aide d’un balayage à spectre complet sur de nombreux lecteurs de microplaques, ce qui informerait à son tour l’utilisateur s’il est possible de suivre la progression d’une réaction enzymatique. Comme indiqué précédemment, Lu et al. ont déjà analysé la stabilité native de HsADA1 dans différents fluides corporels, et Jennings et al. ont utilisé une méthode très similaire pour évaluer la stabilité sérique de HsADA1 recombinante et d’une enzyme mutante 6,8. Cette méthode, comme celle de Jennings et al., est unique en ce sens que nous pouvons utiliser des enzymes exprimées de manière recombinante par opposition à celles dérivées nativement. Ce faisant, cette méthode peut être extrapolée à des protéines mutantes qui ne se trouvent pas nativement dans les organismes vivants.
Pour les combinaisons produit/substrat qui ne peuvent pas être mesurées à l’aide d’un test d’absorbance sur plaque, ce protocole peut être modifié pour intégrer plusieurs autres méthodes analytiques qui suivent la dégradation du substrat ou la formation du produit pour les tests cinétiques, telles que la chromatographie liquide à haute performance (HPLC), qui, par exemple, a déjà été utilisée pour évaluer la cinétique de l’adénosine désaminase et de la kynurénase15, 16 et 17. Seule la méthode de détermination du substrat restant ou du produit créé après un certain temps (si elle n’est pas déterminée en continu) doit varier. Le choix du test dépendra, bien sûr, de la réaction catalysée par l’enzyme d’intérêt, et une considération clé dans ce choix sera également la compatibilité d’une méthode analytique donnée avec du sérum humain dilué. Tout aussi important peut également être le temps total nécessaire pour analyser tous les échantillons d’intérêt, et l’un des principaux avantages de l’utilisation du test sur microplaques est la possibilité d’analyser facilement les taux de dégradation dans jusqu’à 96 échantillons à la fois.
Les paramètres de dosage tels que l’enzyme sur plaque et les concentrations du substrat devront être ajustés pour chaque enzyme d’intérêt. Pour tous les tests réalisés ici, une concentration de substrat supérieure à Km d’un ordre de grandeur supérieur (1,15-1,26 OOM) a été choisie. Wildtype HsADA1 a un Km de ~14 μM pour l’adénosine, et la concentration finale d’adénosine sur plaque utilisée était de 200 μM3. De même, la variante HsKYNase testée a un Km ~ 22 μM pour OH-Kyn, et la concentration finale d’OH-Kyn sur plaque utilisée était de 400 μM7. Une exigence importante pour les concentrations de substrat d’intérêt pour l’essai sur microplaques est que le substrat obéit à la loi de Beer-Lambert dans la plage donnée, de sorte qu’une diminution de l’absorbance peut être corrélée linéairement avec la dégradation du substrat (figure supplémentaire 1 et figure supplémentaire 2). Cette corrélation linéaire élimine la nécessité de convertir la variation de l’absorbance en concentration du substrat, car la réalisation de cette conversion ne modifierait pas la fraction d’activité restante.
En ce qui concerne la concentration enzymatique, le principal critère à prendre en compte est qu’il y ait une dégradation suffisante du substrat par rapport au bruit de fond. Pour HsADA1 et la HsKYNase modifiée, nous avons utilisé les valeurs publiées précédemment dans la littérature pour générer des résultats représentatifs 6,7. Comme nous l’avons montré ici, il peut être possible d’utiliser des temps plus courts avec des concentrations enzymatiques plus élevées, tout comme d’utiliser des temps plus longs et des concentrations enzymatiques plus faibles. En général, une période plus longue ou une concentration enzymatique plus faible peuvent donner des résultats plus reproductibles, à moins que le substrat lui-même ne soit sujet à la dégradation. Dans cette veine, la kynurénine et ses dérivés, y compris l’OH-Kyn, se dégradent relativement rapidement à température ambiante, ce qui entraîne un jaunissement notable du mélange de substrats18. Pour d’autres enzymes, une simple expérience d’escalade de concentration peut être menée pour identifier les concentrations avec les courbes de réaction et la séparation de fond les plus optimales. L’exécution de cette escalade de concentration sur HsADA1 montre que dans une plage de 1 à 10 nM, la plus grande séparation de fond est obtenue (Figure supplémentaire 3). La réalisation de cette même expérience d’escalade de concentration avec de la HsKYNase modifiée montre une tendance similaire avec la plus grande séparation de fond à 2 μM (Figure supplémentaire 4). Cependant, les deux tests (HsADA1 versus HsKYNase) ne possèdent pas la même sensibilité. Pour le HsADA1, une concentration enzymatique sur plaque d’un dixième de celle utilisée dans le protocole peut encore être distinguée du bruit de fond à des niveaux statistiquement significatifs (figure supplémentaire 3). Il n’en va pas de même pour la HsKYNase, ce qui signifie qu’il peut être plus difficile d’évaluer quantitativement la quantité d’activité conservée par HsKYNase une fois qu’elle a perdu plus de 90 % de son activité. Cela représente une limitation potentielle de la méthode du lecteur de microplaques.
De plus, une observation que nous avons faite pour HsKYNase était qu’au moment de la charge de la plaque, il y avait un écart immédiat entre les lectures d’absorbance entre l’enzyme + 1x les échantillons PBS et le témoin 1x PBS (Figure 5B,D). Cet écart était présent pour tous les points temporels. Comme nous avons également observé ce phénomène lors de tests sur une enzyme désactivée par la chaleur (chauffée à 95 °C pendant 10 min), nous avons conclu qu’il n’était pas le résultat d’une dégradation du substrat médiée par des enzymes (figure supplémentaire 5). Bien que nous ayons procédé avec les valeurs d’absorbance initiales des témoins, des études futures pourraient utiliser des contrôles enzymatiques désactivés pour éliminer cet écart. Cependant, le coût d’achat ou de production de l’enzyme d’intérêt doit être pris en compte. Pour la HsKYNase et la HsADA1, il y avait une certaine variabilité dans les valeurs d’absorbance de départ des échantillons d’essai, certains commençant à une valeur d’absorbance inférieure à celle de leurs témoins associés (figure 3 et figure 5). Cela pourrait être attribué en partie au temps de latence dans l’ajout du substrat à tous les échantillons de protéines, suivi du chargement dans le lecteur de plaques. Cependant, comme la concentration du substrat utilisée est beaucoup plus élevée que les valeurs de Km des enzymes utilisées, cela ne devrait pas entraîner d’effets dépendants de la concentration du substrat sur les pentes observées.
Dans la section protocole et résultats représentatifs, les échantillons sont aliquotes aux points temporels indiqués, le temps d’échantillonnage variant en fonction du profil d’activité d’une enzyme. Ce schéma d’échantillonnage dépendra du profil d’activité d’une enzyme d’intérêt dans le sérum. Si une enzyme perd rapidement de son activité, un intervalle d’échantillonnage plus court sera souhaité, comme c’est le cas avec le mutant HsKYNase_66-W102H-T333N testé, et l’inverse est vrai pour les enzymes ayant une plus grande stabilité sérique. En tant que tel, il est probablement bénéfique d’effectuer un essai de ce protocole dans lequel les aliquotes sont échantillonnées à la fois à de petits intervalles (1 h, 2 h, etc.) et à de grands intervalles (24 h, 48 h, etc.) pour étudier à quoi ressemble le profil de stabilité sérique d’une nouvelle enzyme d’intérêt. Bien sûr, à mesure qu’il devient plus robuste, la stabilité sérique deviendra moins pertinente par rapport à la clairance rénale ou à d’autres mécanismes de clairance des protéines in vivo .
Parce que les kynurénases diffèrent de HsADA1, nous avons modifié plusieurs paramètres de dosage, à savoir la concentration enzymatique pendant l’incubation dans le sérum ou 1x PBS, l’intervalle d’échantillonnage, la concentration enzymatique du dosage des microplaques, la concentration du substrat du dosage des microplaques et, bien sûr, le substrat lui-même. Les changements sont les suivants : le stock d’enzymes 10x était à une concentration de 100 μM, ce qui, après dilution avec du sérum/1x PBS, a donné une concentration de 10 μM. L’intervalle d’échantillonnage dans la méthode d’incubation sérique a été ajusté parce que la HsKYNase perd son activité plus rapidement dans le sérum que dans la HsADA1. Par conséquent, la méthode comprenait un échantillonnage à des points temporels de 0,5 h, 3 h et 24 h. De plus, les échantillons de HsKYNase n’ont pas été congelés instantanément, mais ont été immédiatement analysés à l’aide du dosage sur microplaques. Le lecteur de plaques a été configuré pour lire à 379 nm afin de surveiller la progression de la réaction enzymatique. Une autre différence importante dans le dosage sur microplaque lors de l’étude de l’enzyme HsKYNase est la préparation du substrat. Un stock de 2 mM d’OH-Kyn a été fabriqué en dissolvant 4,5 mg d’OH-Kyn dans 10 mL de 1x PBS. Dans le même temps, 6 mg de phosphate de pyridoxal (PLP), le cofacteur HsKYNase, ont été dissous dans 1 mL de 1x PBS pour former un stock de 100x de PLP. Une dilution de 500 μM d’OH-Kyn a été préparée en ajoutant 2,5 mL de stock OH-Kyn à 7,5 mL de 1x PBS ainsi qu’à 100 μL de 100x PLP. Pour effectuer l’analyse sur microplaque, 80 μL de la dilution OH-Kyn de 500 μM et 20 μL d’échantillons de protéines aliquotes ou de témoins négatifs ont été ajoutés en trois exemplaires à une microplaque compatible avec les UV de 96 puits. Cela a donné une concentration finale d’OH-Kyn de 400 μM et une concentration enzymatique finale de 2 μM, après quoi l’absorbance à 379 nm a été mesurée pendant 30 min à 37 °C. Contrairement à la HsADA1, qui a été diluée avant d’être analysée sur le lecteur de plaques, la HsKYNase n’a pas été diluée.
Bien que ce protocole soit relativement simple, la préparation des stocks d’enzymes originaux pourrait constituer un défi. Toutes les enzymes utilisées dans la section des résultats représentatifs ont été exprimées chez E. coli et purifiées à l’aide d’une chromatographie d’affinité à base de nickel suivie d’une chromatographie d’exclusion stérique (SEC). Plusieurs autres sources ont décrit de manière experte des alternatives à notre méthode de purification, couvrant les organismes hôtes et le traitement en aval19,20. Ce test tente fondamentalement de déterminer la capacité d’une enzyme à conserver son activité dans le sérum humain mélangé. Une hypothèse de notre méthodologie est que la perte d’activité d’une enzyme est permanente, c’est-à-dire que l’élimination d’une enzyme désactivée du sérum ne restaurera pas son activité. Ceci est important car, dans ce protocole, nous diluons davantage les mélanges d’enzymes avec du glycérol et 1x PBS avant la congélation instantanée et après la décongélation. Si cette perte d’activité est réversible lors de l’élimination du sérum, ces dilutions supplémentaires empêcheront le test de capturer ce phénomène. Si cela préoccupe l’utilisateur, alors 1.) le sérum humain mélangé peut être utilisé comme diluant au lieu de 1x PBS dans la préparation de toutes les solutions de substrat et d’échantillons de test, et 2.) La congélation instantanée et l’ajout de glycérol peuvent être sautés, et les échantillons peuvent être immédiatement traités pour maintenir l’enzyme dans son environnement d’origine. Enfin, bien que ce test puisse être utilisé pour sonder les effets spécifiques du sérum sur l’activité enzymatique, aucune conclusion ne peut être tirée concernant le mécanisme spécifique derrière ces effets. Il faudrait approfondir la question de savoir si cette perte d’activité est causée par le dépliage enzymatique, l’agrégation, la perte de cofacteur ou le clivage par les protéases sériques. Des qualifications similaires peuvent être dites de l’enzyme 1x PBS incubée dans la mesure où des conclusions mécanistes ne peuvent pas être tirées de ce test.
Dans le contexte du développement de produits biologiques protéiques en tant que thérapeutiques, la capacité de conserver l’activité sérique est une mesure importante21. Une enzyme thérapeutique qui perd très rapidement son activité devrait être dosée à plusieurs reprises pour obtenir un bénéfice clinique. Ce travail fournit aux utilisateurs un test in vitro pour dépister quantitativement les enzymes afin d’améliorer la stabilité sérique. Si elles étaient associées à des efforts d’évolution dirigés, les enzymes ayant une stabilité sérique supérieure pourraient être criblées et sélectionnées, ce qui donnerait un plus grand potentiel de traduisabilité. De plus, nous prévoyons que ce protocole peut également fonctionner avec des systèmes plus avancés, par exemple, pour mesurer la stabilité sérique où l’enzyme est encapsulée. Das et al. ont appliqué un test pour plusieurs enzymes différentes emballées dans des particules pseudo-virales et ont testé leur stabilité dans différentes conditions de dénaturation, telles que les solvants organiques22.
Déclarations de divulgation
JB et MRJ sont des inventeurs de brevets ou de demandes de brevets liés aux enzymes adénosine désaminase et/ou kynurénase. Tous les autres auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par les National Institutes of Health [1DP2CA280622-01] et financé par Biolocity. Nous remercions la Dre Maria Jennings et Andrea Fox d’avoir fourni les vecteurs d’expression HsADA1 et HsKYNase.
matériels
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
Références
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon