Research Article
다발성 경화증 환자의 iPSC 유래 희소돌기아교세포 전구세포에서 페롭토시스 및 저산소증 관련 유전자 확인
요약
이 연구는 생물정보학 분석을 통해 다발성 경화증(MS)의 발병기전에서 저산소증, 페롭토시스 및 면역 침윤 간의 상호 작용에 대한 새로운 통찰력을 제공합니다. WGCNA(Weighted Gene Coexpression Network Analysis) 및 PPI(Protein-Protein Interaction) 분석을 사용하여 3개의 중추 허브 유전자(ITGB1, ITGB8 및 VIM)를 확인했습니다.
초록
다발성 경화증(MS)은 탈수초화를 특징으로 하는 만성 염증성 질환으로, 재수초화에 실패하면 만성 단계에서 진행성 축삭 소실이 발생합니다. 희소돌기아교세포 전구세포(OPC)는 재수초화에 매우 중요합니다. 최근 연구에 따르면 저산소증과 페롭토시스는 모두 OPC의 기능 장애를 분화하는 데 중요한 역할을 합니다. 본 연구는 다발성 경화증 환자의 유도만능줄기세포(iPSC)에서 유래한 OPC에서 저산소증 및 페롭토시스와 관련된 주요 유전자 및 면역 침투 특성을 규명하고, 이러한 중추 유전자를 중심으로 한 진단 모델을 구축하고자 한다.
GSE196575 및 GSE147315 데이터 세트의 유전자 발현 데이터를 분석하고 다발성 경화증 환자와 건강한 개인을 비교했습니다. WGCNA(Weighted Gene Coexpression Network Analysis)를 사용하여 저산소증, 페롭토시스 및 다발성 경화증과 관련된 1차 모듈 유전자와 필수 유전자를 정확히 찾아냈습니다. 유전자 세트 변이 분석(GSVA)을 통해 계산된 페롭토시스 Z 점수와 저산소증 Z 점수는 다발성경화증 환자의 iPSC 유래 OPC가 대조군보다 컸습니다. 관련 유전자는 유전자 온톨로지(GO) 및 KEGG(Kyoto Encyclopedia of Genes and Genomes) 경로 농축 분석을 통해 확인된 바와 같이 주로 PI3K/Akt/mTOR 경로와 연결되어 있습니다.
중요한 유전자의 단백질-단백질 상호작용(PPI) 네트워크는 10개의 중추 허브 유전자(COL4A1, COL4A2, ITGB5, ITGB1, ITGB8, ITGAV, VIM, FLNA, VCL 및 SPARC)를 밝혀냈습니다. ITGB1, ITGB8 및 VIM 의 강력한 발현은 GSE151306 데이터 세트에서 검증되어 주요 허브 유전자로서의 역할을 뒷받침합니다. 또한 TRRUST(Transcriptional Regulatory Relationships Unraveled by Sentence-based Text)를 통해 전사 인자(TF)와 허브 유전자 간의 상호 작용 네트워크가 구축되었으며, 이를 통해 5개의 주요 TF를 식별했습니다. 이 연구의 결과는 다발성 경화증에 대한 새로운 바이오마커 또는 치료 표적을 밝히는 데 도움이 될 수 있습니다.
서문
다발성 경화증(MS)은 탈수초화를 특징으로 하는 만성 염증성 질환으로, 전 세계적으로 약 250만 명에게 영향을 미칩니다. 다발성 경화증 진단을 받은 사람들의 대다수는 재발-완화(RR) 질환 경과를 보입니다. 재발 단계에서는 급성 염증으로 인해 불가피하게 미엘린과 축삭이 손실됩니다. 반대로, 관해 기간 동안 탈수초 병변은 재수초화에 의해 복구될 수 있으며, 축삭에 영양 지원을 제공하고 진행성 축삭 소실을 예방할 수 있습니다1. 재수초 실패는 다발성 경화증의 만성 단계에서 발생하며 진행성 축삭 변성으로 이어집니다2.
재수초화 과정은 희소돌기아교세포 전구세포(OPC)와 중요한 상관관계가 있으며, OPC의 증식 및 이동을 포함하여 중추신경계(CNS)에서 수초를 형성하는 세포인 성숙한 희소돌기아교세포(OL)로 분화하는 것을 포함합니다3. 초기 질환 단계에서는 탈수초성 병변 주변에서 OPC에 의해 생성된 새로운 OL의 수가 상대적으로 보존되고 재수초화를 성공적으로 촉진할 수 있습니다4. 그러나 진행된 다발성 경화 단계에서는 OPC의 부적절한 이동 및 분화로 인해 새로운 OL이 감소하고 재수초화가 손상되어 5 신경 퇴행과 장애 축적이 발생합니다.
다발성 경화증의 신경 퇴행을 설명하기 위해 두 가지 가설이 제안되었습니다. 외재적 가설(extrinsic hypothesis)은 활성화된 T 세포에 의해 시작된 면역 반응이 탈수초화와 신경 퇴행을 유발한다고 제안한다6. 그러나 내인성 모델은 OPC7, OL8 및 CNS의 다른 세포의 내재적 이상이 신경 퇴행에 기여할 수 있음을 시사합니다. 내재적 모델은 이전에는 1차 또는 2차 진행성 다발성경화증(PPMS 및 SPMS)과 같은 다발성 경화증의 더 진행된 단계에만 적용할 수 있는 것으로 간주되었습니다. 그럼에도 불구하고, 염증이나 재발과 무관한 신경퇴행이 최근 RRMS 9,10에서 관찰되었는데, 이는 RRMS를 포함한 모든 질병 단계에서 내인성 세포 이상이 관련될 수 있음을 시사합니다.
또한, 철분 매개 지질 대사 장애와 관련된 독특한 세포 사멸 경로인 페롭토시스(ferroptosis)는 신경 퇴행에서 중추적인 역할을 합니다. 이 경로는 과도한 철분에 의해 유발되는 세포 내 산화환원 상태의 불균형을 수반하며, 이는 과산화물 지질 축적 및 활성산소종(ROS) 생성을 유발하여 궁극적으로 산화적 세포 사멸을 초래합니다11. 알츠하이머병, 파킨슨병, 헌팅턴병과 같은 신경퇴행성 질환은 종종 신경 세포의 산화 손상으로 인해 발생하며, 이는 종종 병변 내 비정상적으로 높은 철분 농도에 의해 유발됩니다. 다발성 경화증에서는 CNS 세포의 높은 지질 함량 및 산소 소비로 인한 미토콘드리아 기능 장애와 결합되어 산화 손상에 대한 취약성 증가가 페롭토시스의 중요한 요인인 지질 과산화를 촉진합니다. OL은 페롭토시스12의 필수 특징인 지질 과산화에 민감합니다. 척추 염증성 병변13 근처의 철 침착과 지질 과산화14 및 활성산소15 에 대한 OL의 취약성은 페롭토시스에 대한 다발성경화증의 감수성을 강조합니다.
저산소증은 다발성경화증 발병의 또 다른 중요한 요인으로 희소돌기아교세포 손실에 기여합니다. 급성 다발성경화증 병변에서 저산소증과 유사한 손상과 ROS 및 질소산화물(NO)의 생성에 대한 증거는 이러한 스트레스 요인이 미토콘드리아 기능 장애와 그에 따른 에너지 결핍을 촉진할 수 있음을 시사한다16. 이 대사 스트레스는 OL에 영향을 미칠 뿐만 아니라 수초 채널이 수초와 축삭 주위 공간 사이에서 에너지를 전달하기 때문에 중단된 에너지 전달17을 통해 이웃 축삭돌기를 손상시킵니다.
다발성 경화증 환자는 원발성 인간 OPC 및 중추신경계의 OL에 접근하기가 매우 어렵습니다. 따라서 유도만능줄기세포(iPSC)에서 파생된 인간 OPC 및 OL은 다발성 경화증의 내인성 장애를 연구하기 위한 유망한 도구로 부상했습니다. 다발성경화증 발병기전에서 페롭토시스(ferroptosis)와 저산소증(hypoxia)의 중요한 역할과 희소돌기아교세포(oligodendrocyte) 계통에 미치는 영향에 비추어, 본 연구에서는 가중 유전자 공동발현 네트워크 분석(WGCNA)을 사용하여 모듈 정보18 를 추출하고 다발성경화증에서 이러한 현상과 관련된 유전자 발현 패턴을 규명했습니다. 유전자 간의 상관 계수를 스크리닝함으로써 동일하거나 유사한 공동 발현 네트워크 또는 모듈을 식별할 수 있으며, 다발성 경화증에 대한 새로운 바이오마커 또는 잠재적인 치료 표적을 밝힐 수 있습니다. 또한, 본 연구는 중요한 유전자를 조절하는 전사 인자(transcription factor, TF)에 초점을 맞춤으로써, 다발성 경화증에 대한 메커니즘과 잠재적 중재 전략에 대한 추가 탐구를 위한 토대를 제공합니다.
프로토콜
1. 데이터 다운로드 및 전처리
- GEO(Gene Expression Omnibus)에서 GSE196575 및 GSE147315 데이터 세트를 다운로드합니다.
- 온라인 분석 플랫폼을 사용하여 두 데이터 세트를 병합하고 배치 효과를 제거합니다( 재료 표 참조).
- 식 모듈 | 데이터 병합 모듈을 선택합니다. 두 개의 표현식 행렬 파일을 입력 파일로 업로드하고 실행을 클릭하여 병합된 행렬을 자동으로 출력합니다.
- 샘플 주석 파일을 스프레드시트로 만듭니다.
- Expression( 식) 모듈 | 배치 효과 모듈을 제거합니다. 주석 파일과 병합된 매트릭스를 입력하고 실행을 클릭하여 배치 효과가 제거된 병합된 매트릭스를 생성합니다(병합된 매트릭스 2).
- 온라인 분석 플랫폼에서 사용할 수 있는 병합 데이터셋, 배치 효과 및 정규화 기능을 사용하여 표현식 데이터를 정규화합니다. 표현식 모듈 및 정규화 모듈을 선택합니다. 1.2.3단계에서 만든 입력 병합 행렬 2 . 실행 버튼을 클릭합니다. ( 재료 표 참조).
- 위에서 설명한 전체 프로세스를 실행한 후 표현식 매트릭스 파일을 출력합니다. GEO 웹 사이트에 제공된 개입에 따라 그룹화 정보를 추출합니다. 위의 정보를 ".txt" 형식의 문서에 입력하여 병합된 데이터셋에 대한 그룹화 정보 파일을 생성합니다.
2. 차등 발현 유전자 분석
- R의 limma 패키지를 사용하여 차등 유전자 발현 분석을 수행합니다. 발현 매트릭스 파일과 그룹화 정보 파일을 입력합니다. 필터링 기준을 |logFC| = 1 및 p < 0.05 로 설정하여 다발성 경화증과 관련된 차등 발현 유전자(DEG)를 식별합니다.
3. 기능 강화 분석(GO 및 KEGG)
- 온라인 플랫폼에서 GO 및 KEGG 모듈을 통해 DEG에 대한 기능 강화 분석을 수행합니다.
- 모델 유기체를 호모 사피엔스(Homo sapiens)로 설정하고, Ensemble_109 버전을 배경 유전자 파일로, 유전자를 데이터 유형으로 설정했습니다.
- 광범위한 GO 용어를 피하십시오. ToppFun을 사용하여 분석을 구체화합니다. 필터를 적용하여 용어를 500개 및 1,000개의 관련 유전자로 제한합니다.
참고: 500개 유전자 필터의 결과는 주요 원고에 나와 있습니다. 전체 GO 결과는 보충 그림 S2에서 확인할 수 있습니다. 온라인 KEGG 플랫폼은 보충 그림 S3에 나와 있습니다.
4. 페롭토시스 및 저산소증에 대한 유전자 세트 변이 분석(GSVA)
- FerrDb에서 총 538개의 페롭토시스 관련 유전자와 MsigDB에서 200개의 저산소증 관련 유전자를 검색합니다.
- 두 유전자 세트에 대한 GMT 형식 파일을 만듭니다.
- GSVA 모듈을 사용하여 병합된 데이터 세트의 각 샘플에 대한 페롭토시스 Z 점수 및 저산소증 Z 점수를 계산하고 표현식 매트릭스 파일, 그룹화 정보 파일 및 GMT 파일을 입력으로 사용합니다.
- 서로 다른 그룹의 Z 점수를 비교합니다(보충 그림 S4).
5. 가중 유전자 공동 발현 네트워크 분석(WGCNA)
- 4.4단계에서 계산된 각 샘플의 페롭토시스 및 저산소증의 Z 점수를 추출합니다. 페롭토시스 및 저산소증에 대한 위의 Z 점수를 발현 매트릭스 파일과 함께 형질 파일로 사용하여 페롭토시스 및 저산소증과 관련된 주요 유전자 모듈을 식별합니다.
- WGCNA 모듈을 사용하고 R2 = 0.9 및 소프트 임계값 β = 18을 설정하여 가중 유전자 공동 발현 네트워크를 구성합니다. 페롭토시스(ferroptosis) 및 저산소증(hypoxia)과 유의미한 관련이 있는 모듈에 초점을 맞춥니다(보충 그림 S4).
6. 다발성경화증 환자에서 페롭토시스(ferroptosis) 및 저산소증(hypoxia)과 관련된 차등적으로 발현된 유전자 확인
- 온라인 분석 플랫폼의 벤 다이어그램 도구를 통해 질병 관련 DEG를 페롭토시스 및 저산소증 관련 유전자 모듈과 교차시킵니다(보충 그림 S3). 다발성 경화증에서 페롭토시스(ferroptosis) 및 저산소증(hypoxia)과 관련된 유전자를 확인합니다.
7. 단백질-단백질 상호 작용(PPI) 네트워크 분석
- 교차된 유전자를 STRING 데이터베이스의 Multiple Proteins 모듈에 입력합니다.
- 유기체를 Homo sapiens로 설정하고 검색을 클릭합니다.
- 웹 페이지 중앙에 있는 CONTINUE 옵션을 사용하여 PPI 네트워크를 생성합니다.
- 상호 작용 네트워크 정보를 TSV 형식으로 내보내고 생물정보학 네트워크 분석 소프트웨어로 가져옵니다(보충 그림 S5).
- Cytohubba 플러그인을 사용하여 MCC 알고리즘을 기반으로 상위 10개 허브 유전자를 식별합니다.
8. GSE151306 데이터 세트를 사용한 유효성 검사
- GEO에서 GSE151306 데이터 세트를 다운로드합니다.
- R studio 소프트웨어(R 언어 코드는 GitHub: https://github.com/Drxiazhang/Identification-of-Ferroptosis--and-Hypoxia-Related-Genes-in-iPSC-Derived-OPCs-from-MS 에 제공됨)의 limma 패키지를 사용하여 서로 다른 그룹에서 허브 유전자의 발현을 검증하고 발현 매트릭스 파일, 검증 세트의 그룹화 파일 및 허브 유전자 목록을 입력합니다.
9. 허브 유전자에 대한 ROC 곡선 플로팅
- R의 pROC 패키지를 사용하여 차등적으로 발현된 허브 유전자에 대한 ROC 곡선을 플로팅합니다.
- 유효성 검사 데이터 세트에서 이러한 허브 유전자의 진단 값을 검증합니다(R 언어 코드는 GitHub: https://github.com/Drxiazhang/Identification-of-Ferroptosis--and-Hypoxia-Related-Genes-in-iPSC-Derived-OPCs-from-MS 에 제공됨).
10. transcription factor-hub 유전자 조절 네트워크의 예측
- https://www.grnpedia.org/trrust/ 에서 TRRUST v2 데이터베이스에 액세스합니다.
- 쿼리 유전자에 대한 키 조절자 찾기 모듈을 사용하여 10개의 허브 유전자를 조절하는 전사 인자를 식별합니다.
- 종은 Human으로 설정합니다. 전사 인자(transcription factor)와 허브 유전자(hub genes)를 STRING의 Multiple Proteins 모듈에 입력하고, 유기체에 대한 호모 사피엔스(Homo sapiens)를 설정한 다음, CONTINUE를 클릭하여 조절 네트워크(regulatory network)를 생성합니다.
결과
대조군인 건강한 사람 4명과 다발성경화증(PwMS) 환자 9명으로 구성된 병합된 데이터 세트를 분석한 다음 4명의 PwMS와 건강한 대조군 4명으로 구성된 다른 데이터 세트에서 검증했습니다. 분석 프로토콜은 그림 1에 나와 있으며, 모든 샘플의 자세한 정보는 보충 표 S1에 나열되어 있습니다. 분석을 통해 706개의 차등적으로 발현된 유전자(DEGs, p < 0.01)가 확인되었으며, 이 중 378개의 유전자는 대조군과 비교하여 다발성 경화증 환자에서 상향 조절되었고 328개의 유전자는 하향 조절되었습니다(그림 2). 기능적 농축 분석은 다양한 생물학적 과정에서 이러한 DEG가 유의하게 관여하는 것으로 밝혀졌습니다. 특히, 500개의 유전자에 의해 정제된 상위 농축 GO 용어에는 국소 접착, 세포-기질 접합, 인테그린 매개 신호 경로, 인테그린 결합 및 카데린 결합이 포함되었습니다(그림 3A-C). KEGG 경로 분석을 통해 이러한 유전자가 다발성 경화증 발병과 관련된 세포 과정에 중요한 PI3K-Akt 신호 전달 경로 및 하마 신호 경로(그림 3D)에 주로 관여한다는 사실이 밝혀졌습니다.
GSVA를 통해 계산된 페롭토시스 및 저산소증 Z 점수는 다발성 경화증 환자의 iPSC 유래 희소돌기아교세포 전구세포(OPC)가 건강한 대조군의 세포보다 유의하게 높았으며(p = 0.0028 및 0.075, 각각 그림 4), 이는 이 질병에서 이러한 경로의 중추적인 역할을 나타냅니다. 이 발견은 WGCNA에 의해 뒷받침되었으며, WGCNA는 두 개의 주요 유전자 모듈을 확인했습니다(그림 5A). 이 중 3,671개의 유전자로 구성된 청록색 모듈은 페롭토시스 및 저산소증과 유의한 관련이 있었습니다(그림 5B). 중요한 것은 차등적으로 발현된 질병 관련 유전자와 WGCNA 모듈의 유전자가 교차하는 지점에서 71개의 유전자가 확인되었다는 점이며, 이는 다발성 경화증의 페롭토시스(베타=0.94, p=2e-06) 및 저산소증(베타=0.92, p=7e-06)과 강한 상관관계를 시사합니다(그림 6).
PPI 네트워크에 대한 추가 조사를 통해 10개의 중심 허브 유전자, 즉 COL4A1, COL4A2, ITGB5, ITGB1, ITGB8, ITGAV, VIM, FLNA, VCL 및 SPARC 가 밝혀졌습니다(그림 7). 이러한 허브 유전자는 페롭토시스(ferroptosis) 및 저산소증(hypoxia)과 관련된 세포 과정을 매개하는 데 중요한 역할을 하는 것으로 알려져 있습니다.
추가로 검증 데이터 세트(GSE151306)를 검증했습니다. 그 결과 3개의 허브 유전자(ITGAV, ITGB8 및 VIM)가 PwMS에서 상향 조절되었으며(그림 8), 이는 병합된 데이터 세트(보충 그림 S1)의 결과와 일치했습니다. 그 중 ITGB8은 가장 유의하게 상향 조절된 유전자였습니다. 이러한 연구 결과는 인테그린(integrin) 계열의 일종인 ITGB8이 다발성 경화증의 발병기전, 특히 페롭토시스(ferroptosis) 및 저산소증(hypoxia) 기전과 관련하여 결정적으로 관여할 수 있음을 시사합니다. 또한, ROC(Receiver Operating Characteristic) 곡선 분석을 통해 ITGAV, ITGB8 및 VIM이 질병 진단에 대한 민감도와 특이도가 우수한 것으로 확인되었습니다(각각 AUC=58.3%, 100% 및 91.7%; 그림 9A-C)에서 확인할 수 있으며, ITGB8은 100%의 AUC를 보이며 다발성 경화증에 대한 강력한 바이오마커로서의 잠재력을 입증했습니다.
마지막으로, 전사 인자-허브 유전자 조절 네트워크가 확립되었고, 세 가지 주요 전사 인자(HOXD3, SP1 및 VHL)가 허브 유전자의 조절자로 확인되었습니다(그림 10). 이러한 전사 인자는 저산소증 및 페롭토시스에 대한 반응으로 유전자 발현을 조절하는 데 필수적인 역할을 할 수 있으며, 다발성 경화증의 진행에 대한 잠재적인 관여를 더욱 강조할 수 있습니다.
비디오 1: 오른쪽 반횡막을 중심으로 한 저주파 변환기로 얻은 관상식 보기는 폐활량 호흡 중 질적으로 정상적인 횡격막 편위를 보여줍니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
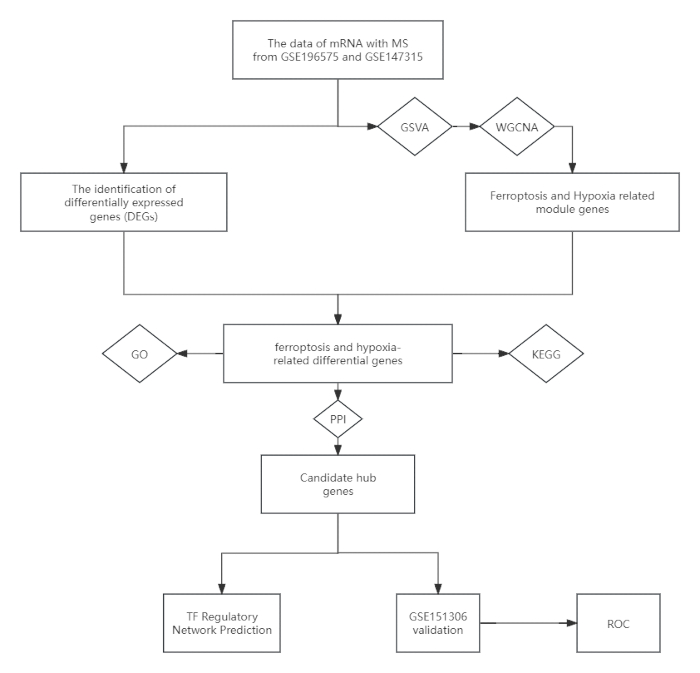
그림 1: 연구 설계를 보여주는 순서도. 약어: MS = 다발성 경화증; GSVA = 유전자 세트 변이 분석; WGCNA = 가중 유전자 공동 발현 네트워크 분석; KEGG = 교토 유전자 및 게놈 백과사전; GO = 유전자 온톨로지; PPI = 단백질-단백질 상호 작용; ROC = 수신기 작동 특성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
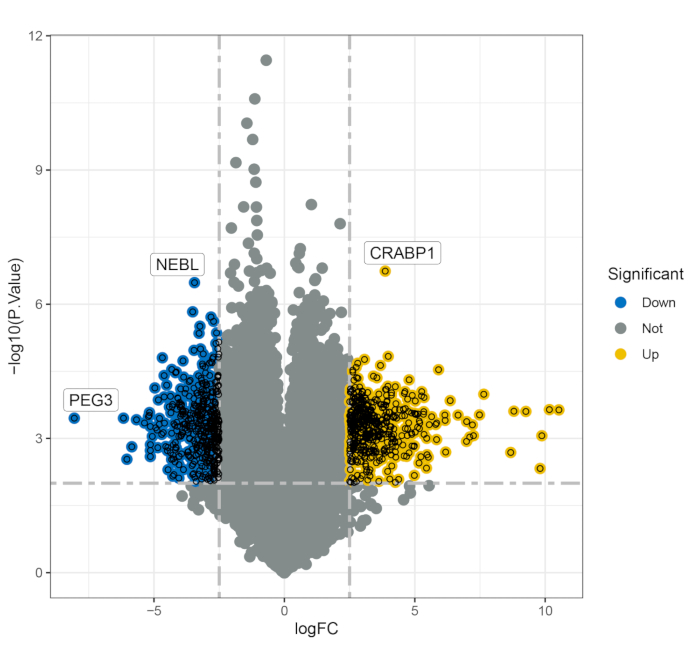
그림 2: 건강한 대조군과 다발성경화증 그룹 사이에 다르게 발현된 유전자를 보여주는 화산 플롯. 약어: FC = 필터링 기준; PEG3 = 부계로 발현된 유전자 3; NEBL = 성운; CRABP1 = 세포 레티노산 결합 단백질 1. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
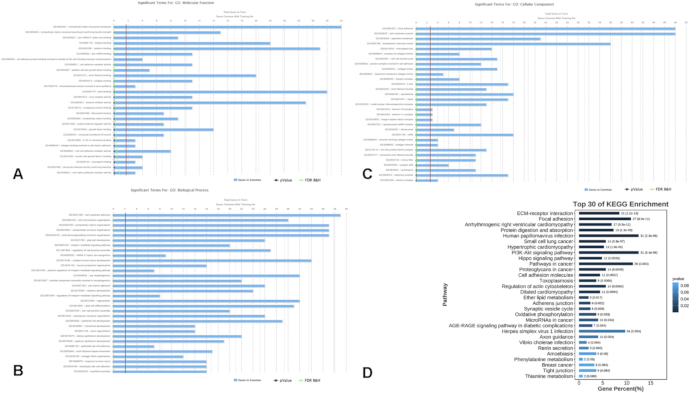
그림 3: 차등적으로 발현된 유전자의 기능적 농축 분석. (에이씨) 유전자 온톨로지 카테고리는 (A) Molecular Function, (B) Biological Process, (C) Cellular Component를 포함한 500개의 유전자를 필터링하여 정제되었습니다. (D) DEG 사이에서 농축된 경로를 나타내는 KEGG 경로 농축 분석. 약어: DEGs = 차등적으로 발현된 유전자; GO = 유전자 온톨로지; MF = 분자 기능; BP = 생물학적 과정; CC = 세포 성분; KEGG = 교토 유전자 및 게놈 백과사전. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
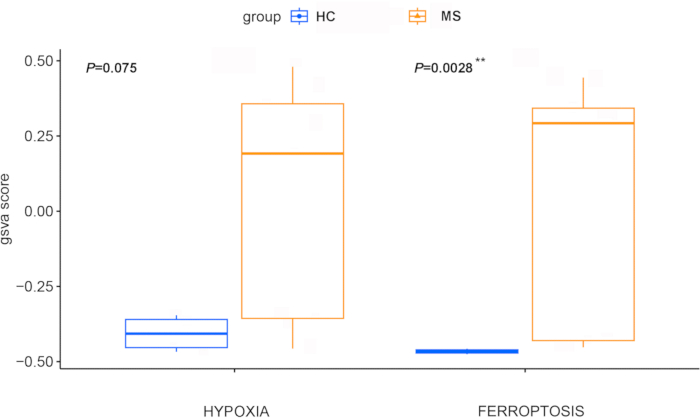
그림 4: 건강한 대조군과 다발성 경화증 그룹 간의 페롭토시스와 저산소증 Z 점수를 비교한 상자 그림. 페롭토시스(Ferroptosis) 및 저산소증 Z 점수는 GSVA를 통해 계산되었습니다. 대조군은 파란색으로, MS 군은 빨간색으로 표시됩니다. 통계적 비교는 Wilcoxon 테스트를 통해 수행되었습니다. **는 0에서 0.01 사이의 p 값을 나타냅니다. 약어: MS = 다발성 경화증; HC = 건강한 대조군; GSVA = 유전자 세트 변이 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 가중 유전자 공동발현 네트워크 분석 결과. (A) 모듈로 분류된 유전자의 클러스터 덴드로그램. (B) 저산소증 및 페롭토시스와 관련된 모듈과 특성 간의 상관 관계. 약어 : ADJ = 조정됨. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 71개의 교차하는 유전자를 보여주는 벤 다이어그램. 이 다이어그램은 다발성 경화증 환자의 DEG와 저산소증 및 페롭토시스 관련 모듈의 유전자가 겹치는 것을 보여줍니다. 약어: WGCNA = Weighted Gene Co-Expression Network Analysis; DEGs = 차등적으로 발현된 유전자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
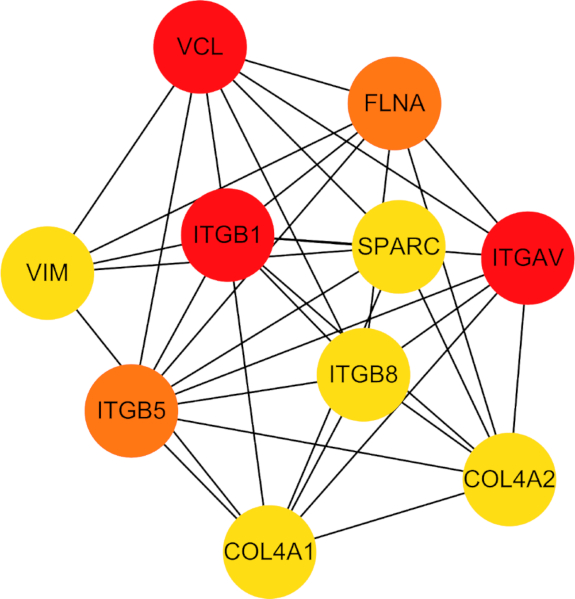
그림 7: 확인된 10개의 허브 유전자 간의 단백질-단백질 상호 작용에 대한 네트워크 다이어그램. 약어: VCL = 빈쿨린; FLNA = 필라민 A; ITGAV = 인테그린 소단위 알파 V; GOL4A2 = 콜라겐 유형 IV 알파 2 사슬; COL4A1 = 콜라겐 유형 IV 알파 1 사슬; ITGB5 = 인테그린 소단위 베타 5; VIM = 비멘틴; SPARC = 산성 및 시스테인이 풍부한 분비 단백질; ITGB8 = 인테그린 서브유닛 베타 8; ITGB1 = 인테그린 서브유닛 베타 1. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
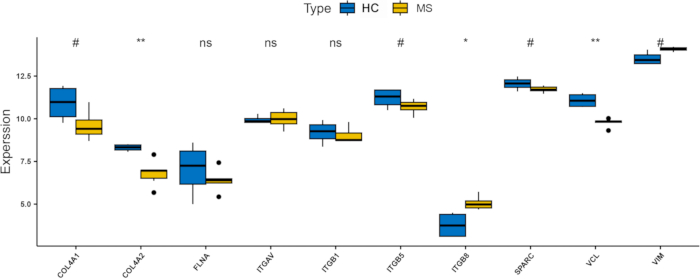
그림 8: 검증 데이터 세트(GSE151306)에서 허브 유전자의 발현 수준을 보여주는 막대 차트. *는 0.01에서 0.05 사이의 p 값을 나타내고 #은 0.05에서 0.2 사이의 p 값을 나타냅니다. ns는 0.2와 1 사이의 p 값을 나타냅니다. 약어: HC: 건강한 대조군; MS: 다발성 경화증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9: GSE151306에서 차등적으로 발현된 허브 유전자의 진단 민감도와 특이도를 평가하기 위한 ROC 곡선. (A) ITGAV의 ROC 곡선. (B) ITGB8의 ROC 곡선. (C) VIM에 대한 ROC 곡선. 약어 : ROC = 수신기 작동 특성; ITGAV = 인테그린 소단위 알파 V; ITGB8 = 인테그린 소단위 베타 8; VIM = 비멘틴. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
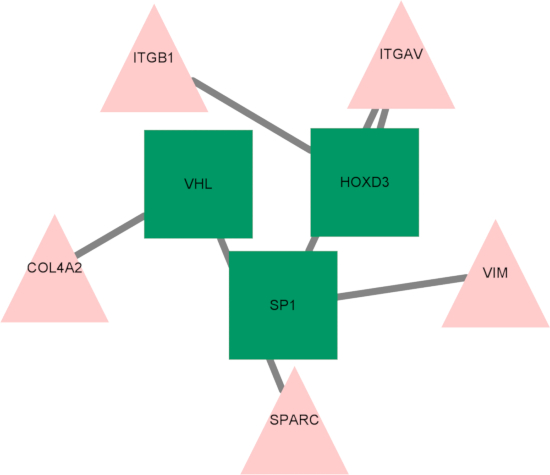
그림 10: 전사 인자 -허브 유전자 조절 네트워크의 다이어그램. 삼각형은 전사 인자를 나타냅니다. 사각형은 허브 유전자를 나타냅니다. 약어: ITGB1 = 인테그린 서브유닛 베타 1; ITGAV = 인테그린 소단위 알파 V; VIM = 비멘틴; SPARC = 산성 및 시스테인이 풍부한 분비 단백질; COL4A2 = 콜라겐 유형 IV 알파 2 사슬; HOXD3 = 호메오박스 D3; VHL = 폰 히펠-린다우 종양 억제제; SP1 = 특이성 단백질 1. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11: 인테그린 β1이 PI3K-Akt 경로에 미치는 영향. 오픈 헤드(활성 상태, 높은 친화력) 인테그린 β1을 가진 확장 형태는 "국소 접착"과 "국소 복합체"를 형성하고 FAK 및 Scr 키나아제와 상호 작용할 수 있습니다. 활성 FAK/Src 복합체는 어댑터 분자를 모집하여 PI3K-Akt 경로를 활성화합니다. 이 그림은 Yan and Cui37에서 각색한 것입니다. 약어: PI3K = 포스파티딜이노시티드-3-키나아제; FAK = 국소 접착 키나아제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: 병합된 데이터 세트에서 주요 유전자의 발현 추세. "limma" R 패키지의 Wilcox.test 함수가 통계 테스트에 사용되었습니다. "*"는 0.01에서 0.05 사이의 p값을 나타내고 "#"은 0.05에서 0.2 사이의 p값을 나타냅니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 차등적으로 발현된 유전자의 유전자 온톨로지 분석에서 나온 원본 레이아웃.이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S3: Omicshare 온라인 분석 플랫폼 홈페이지. 이 웹사이트는 KEGG가 수행된 중국의 생물정보학 허브입니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S4: WGCNA가 수행된 Biowinford 온라인 분석 플랫폼의 홈페이지. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S5: PPI가 수행된 STRING 데이터베이스의 홈페이지. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 표 S1: 풀링 및 분석된 샘플 및 데이터 세트의 특성. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
재수초화 과정에서 OPC가 중추적인 역할을 한다는 점을 감안할 때, OPC의 이동, 분화 및 사멸은 다발성경화증의 발병 기전 및 치료 표적에 중요한 요인으로 오랫동안 확인되어 왔습니다. 염증과 무관한 진행성 신경 변성은 세 가지 유형의 다발성 경화증 모두에서 관찰되었으며,19 탈수초성 병변의 중심에서 희소돌기아교세포의 뚜렷한 소실이 관찰되었습니다20이는 희소돌기아교세포 계통 세포의 원발성 질환이 다발성 경화증의 진행을 가속화할 수 있음을 시사합니다.
이 연구에서는 4개의 건강한 대조군과 9개의 PwMS의 병합된 데이터 세트를 통해 PwMS의 iPSC 유도 OPC와 건강한 대조군의 페롭토시스 및 저산소증과 관련된 유전자에 초점을 맞춘 표적 mRNA 염기서열의 생물정보학 분석을 수행했습니다. 우리는 706°C를 발견했으며, 그 중 378개는 상향 조정되었고 328개는 하향 조정되었습니다. 또한 페롭토시스 및 저산소증 관련 유전자를 확인하고 각 샘플의 Z 점수를 계산하여 다발성 경화증 환자의 iPSC 유도 OPC와 건강한 대조군에서 이러한 유전자의 발현을 비교했습니다. 페롭토시스(ferroptosis)와 저산소증(hypoxia)의 Z 점수는 건강한 대조군보다 PwMS에서 유의하게 컸다.
저산소증은 다발성경화증의 희소돌기아교병증에서 중요한 역할을 하며, 병리학적 연구는 허혈성 백질 뇌졸중과 유사한 III형 다발성경화증 병변에서 원위부 희소돌기아교병증을 입증했으며,16 급성 다발성경화증 병변에서 ROS 및 NO 수치 상승과 함께 저산소성 유사 손상이 입증되었다21. 미토콘드리아 호흡 사슬 복합체 IV의 파괴는 OPC와 성숙한 희소돌기아교세포의 형성과 생존력을 손상시키지만,15 이 손상의 기저에 있는 정확한 메커니즘은 아직 밝혀지지 않았습니다.
또한, 프로그래밍된 세포 사멸의 철 의존적 형태인 페롭토시스(ferroptosis)는 큐프리존에 의한 다발성 경화증 동물 모델에서 희소돌기아교세포의 손실과 탈수초형성의 진행을 매개하는 것으로 밝혀졌습니다22. 단일 세포 염기서열분석(singlecell sequencing)은 PwMS23으로 인한 뇌 조직의 OPC 및 OL에서 항페롭토시스(antiferroptosis) 유전자 발현의 감소를 밝혔습니다. 다발성경화증의 만성기에서 희소돌기아교세포의 철 결핍은 재수초화를 방해하고 백질의 축삭 무결성을 손상시켜 질병 진행을 초래할 수 있습니다24. 더욱이, 백질에서 다발성경화증 병변의 snRNA-seq는 페롭토시스가 다발성경화증 환자의 백질 병변에서 주로 활동적이며 식세포계의 활성화와 관련이 있음을 시사한다25. 실험용 자가면역 뇌척수염(EAE) 마우스에서 페롭토시스의 중요한 조절자인 GPX4 수치가 감소했다26. EAE의 질병 진행은 T세포 수용체(TCR) 신호전달을 향상시키는 ACSL4에 의해 유도되는 페롭토시스에 의해 가속화될 수 있습니다. 페롭토시스와 ACSL4를 차단하면 EAE27에서 장애 진행을 현저히 늦춥니다.
페롭토시스(Ferroptosis)는 쥐 모델에서 저산소증(hypoxia)으로 인한 인지 기능 저하에 관여한다28. 저산소증(Hypoxia)과 저산소증(hypoxia)에 의해 유발되는 인자-1α는 배측근신경절(dorsal root ganglia)의 증식과 이동을 촉진한다29. 따라서 페롭토시스(ferroptosis)와 저산소증(hypoxia)은 다발성 경화증의 발병기전에서 상승 작용을 할 수 있습니다. WGCNA를 통해 본 연구는 두 가지 중요한 모듈을 식별했습니다. 특히 청록색 모듈은 다발성 경화증 상태, 저산소증 및 페롭토시스와 밀접한 상관관계가 있었습니다. WGCNA 및 DEG의 결과를 바탕으로 페롭토시스, 저산소증 및 다발성 경화증과 동시에 상관관계가 있는 71개의 주요 유전자를 확인했습니다.
706 DEG에 대한 GO 및 KEGG 기능 강화 분석은 PI3K-Akt 신호 전달 경로가 MS 발달에서 중요한 경로임을 밝혔습니다. CXCR2의 억제는 OPC 분화를 향상시키고 PI3K/AKT/mTOR 신호30을 활성화하여 MS 마우스 모델에서 재수초화를 촉진합니다. 산소 공급의 불균형은 MAPK/PI3K-Akt 신호 경로에 영향을 미쳐 산화 스트레스와 관련된 주요 메커니즘을 유발할 수 있습니다31.
PPI 분석을 통해 COL4A1, COL4A2, ITGB5, ITGB1, ITGB8, ITGAV, VIM, FLNA, VCL 및 SPARC의 10개 허브 유전자가 저산소증, 페롭토시스 및 다발성경화증과 동시에 상관관계가 있는 것으로 나타났으며, 다발성 경화증 환자에서 대조군에 비해 현저한 과발현이 나타났습니다. 이러한 유전자는 SPMS 환자에서 유래한 iPSC 유도 OPC 계통의 데이터베이스인 GSE151306에서 추가로 검증되었습니다. ITGAV, ITGB8 및 VIM도 검증 세트에서 상향 조정된 것으로 나타났습니다. 특히, 인테그린 계열의 일부인 ITGB8은 MS에서 현저히 과발현되었으며, 이는 GSE147315 및 GSE196575 결합된 테스트 세트와 일치했습니다.
유전자 ITGB8은 인테그린(ITG) 계열의 구성원이며 이전에 종양 성장 및 전이의 조절자로 보고된 인테그린 베타 8을 암호화합니다32,33. 인테그린 베타 8은 OPC와 성숙한 희소돌기아교세포에 의해 강하게 발현됩니다. 한 연구에 따르면 오스테오폰틴은 ITGB8을 포함한 인테그린을 상향 조절하여 H2O2 유도 세포사멸로부터 OPC를 보호합니다34. 이러한 발견은 ITGB8이 산화 스트레스 조건에서 세포 생존에 중요한 역할을 한다는 것을 나타냅니다. 산화 스트레스가 만연한 다발성 경화증에서 ITGB8은 OPC가 생존하고 희소돌기아교세포로 분화하여 재수초화를 증가시키는 데 도움이 될 수 있습니다.
ITGAV 는 혈관 신생과 암 진행을 조절하는 인테그린 소단위 알파 V를 암호화합니다. ITGAV는 베타 5(인테그린 αvβ5 형성)와 병용하여 다발성 경화증 병변에서 상승하는 피브로넥틴 및 비트로넥틴 침착에 대한 반응으로 미세아교세포 활성화를 매개합니다. EAE의 MS rat 모델에서 integrin avβ5는 미세아교세포를 활성화하여 세포외 기질과 미엘린 단백질을 분해하는 효소인 기질 금속단백분해효소-9(MMP-9)의 발현을 증가시켜 탈수초화에 기여합니다35.
특히, 병합된 세트에서 차등적으로 발현된 허브 유전자 중 하나인 ITGB1 은 다발성 경화증 환자의 뇌척수액에서 추출한 CD4+ T 세포에서 상향 조절되는 것으로 밝혀졌습니다36. Integrin β1은 PI3K-Akt 신호 경로에 주목할 만한 영향을 미쳤으며, 이는 본 연구 결과와 일치합니다(그림 11)37. 또한, 다발성경화증 환자의 Th17 세포에서 β1-integrin의 발현 증가가 건강한 대조군과 비교하여 검출되었습니다. Th17 세포에서 β1-integrin의 활성화는 글루타메이트 수치를 크게 증가시키고 신경 염증을 촉진할 수 있습니다38.
다발성 경화증 위험 예측을 위한 바이오마커로서 OPC에서 ITGAV, ITGB8 및 VIM 발현 가능성을 평가하기 위해 ROC 곡선 분석을 수행했습니다. ITGB8 의 AUC는 100%였으며, VIM 이 91.7%, ITGAV가 58.3%로 그 뒤를 이었습니다. 현재, 희소돌기아교세포에서 ITGB8 의 발현과 다발성경화증의 연관성을 보고한 연구는 없습니다. 다발성 경화증 예측을 위한 바이오마커로 ITGB8 을 사용하는 방법을 모색하기 위해 추가 연구를 수행해야 합니다.
마지막으로, 전사 인자 허브 유전자 네트워크를 구축하고 HOXD3, SP1 및 VHL의 세 가지 주요 전사 인자를 식별했습니다. SP1은 많은 프로모터에 결합하는 전사 인자입니다. 광범위한 프로모터 결합으로 알려진 SP1은 Prdx6 발현을 조절하고, ROS를 억제하며, 고혈당 환경에서 페롭토시스를 제거하는 것으로 나타났습니다39. SP1의 발현은 또한 RRMS40의 발달에 중요한 역할을 하는 종양괴사인자(TNF) 활성과도 관련이 있습니다. 확인된 또 다른 전사 인자인 안드로겐 수용체(AR)는 스테로이드 호르몬에 의해 활성화되고 재수초 영역 내의 성상세포에서 검출되어 희소돌기아교세포 기능에 잠재적으로 관여할 수 있음을 강조합니다41.
면역 경로와 세포는 다발성경화증의 발병 기전 및 신경 퇴행에 중요한 역할을 하며 페롭토시스, 저산소증 및 OPC와 관련이 있을 수 있습니다. 쿠프리존에 취한 마우스와 진행성 다발성 경화증 병변을 관찰한 결과, 세포독성 과립 과발현을 가진 CD8+ T 세포의 유병률과 증식률이 높은 것으로 나타났습니다42. 충분히 활성화된 T 세포는 항원 제시 희소돌기아교세포와 상호 작용할 수 있으며, 이는 잠재적으로 CD8+ T 세포 매개 희소돌기아교구 파괴로 이어질 수 있습니다. 종양 미세환경에서 CD8+ T 세포가 분비하는 인터페론γ은 시스테인 글루타메이트 교환체(xCT) 발현을 감소시켜 페롭토시스를 강화합니다43. 또한, 페롭토시스(ferroptosis)는 EAE 모델24에서 T-세포 수용체 신호전달을 통해 T세포를 활성화하기 위해 제안되었다.
OPC에 대한 현재 연구는 이러한 세포의 부족으로 인해 상당히 제한적입니다. 이 제한은 iPSC 유도 OPC를 사용하여 부분적으로 해결할 수 있습니다. 그러나 iPSC 유도 OPC에 대한 대부분의 연구는 시간과 비용이 많이 드는 세포 유도 과정으로 인해 일반적으로 10명 미만의 공여자와 같은 작은 표본 크기를 포함합니다. 본 연구는 여러 연구의 샘플을 통합하여 보다 강력한 결과를 제공합니다.
우리는 사용 가능한 데이터 세트를 훈련 및 검증 세트로 나누어 생물정보학 파이프라인을 더욱 구체화했습니다. 이 접근 방식은 실험실 전반에 걸쳐 세포 유도 방법 및 염기서열분석 기술의 차이로 인해 유발되는 잠재적 편향을 최소화합니다. 다발성 경화증에 대한 대부분의 기존 연구는 염증에 의한 신경 퇴행에 초점을 맞추거나 페롭토시스에 대한 단독 분석을 사용합니다. 기존의 유전자 발현 분석은 개별적으로 다르게 발현된 유전자를 식별하는 데 유용하지만 MS 진행과 관련된 복잡한 상호 작용 네트워크 및 공동 발현 패턴을 밝히지 못하는 경우가 많습니다. 이와는 대조적으로, 당사의 방법론은 WGCNA를 활용하여 유전자 공동 발현 네트워크를 구축하여 페롭토시스 및 저산소증과 높은 상관관계가 있는 유전자 모듈을 식별할 수 있습니다. 이를 통해 이러한 경로가 MS 병리학 내에서 어떻게 상호 작용하는지에 대한 시스템 수준의 이해를 얻을 수 있으며, 이는 표준 차등 발현 방법만으로는 달성할 수 없습니다.
이 방법은 신경 퇴행을 줄이기 위한 치료법의 유전자 표적을 식별함으로써 새로운 다발성 경화증 치료에 적용할 수 있습니다. 또한 파킨슨병이나 알츠하이머병과 같은 페롭토시스 및 저산소증과 관련된 다른 신경퇴행성 질환에 사용되어 맞춤형 중재를 개발하고 치료 반응을 예측할 수 있습니다.
본 연구에는 몇 가지 한계가 있다. 첫째, 추가적인 in vivo 및 in vitro 검증이 필요합니다. 둘째, 본 연구의 결과는 두 개의 데이터베이스에서 발췌한 것이며 제한된 수의 환자를 대상으로 한 데이터베이스에서 검증되었습니다. 추가 탐색을 위해 더 큰 코호트를 수집해야 합니다. 셋째, 인간 OPC에 대한 접근의 어려움을 고려하여 우리가 채택한 데이터베이스는 인간 조직과 완전히 유사하지 않을 수 있는 iPSC 유도 OPC를 기반으로 했습니다. 다발성경화증에서 희소돌기아교세포 계통 세포의 분화 및 세포 사멸에 대한 저산소증과 페롭토시스의 영향을 조사하는 데 초점을 맞춘 더 많은 연구가 앞으로 수행되어야 합니다.
이 연구의 또 다른 한계는 다발성 경화증 병변에 존재하는 면역 세포가 부족한 iPSC에서 유래한 OPC를 사용하기 때문에 면역 세포 상호 작용을 분석할 수 없다는 것입니다. 면역 세포는 다발성 경화증 발병에 결정적인 역할을 하지만, 이러한 한계는 iPSC 유래 배양 사용의 어려움을 반영합니다. 향후 연구는 다발성 경화증 환경에서 세포 상호 작용을 더 잘 모델링할 수 있는 공동 배양 시스템 또는 오가노이드를 통한 OPC 면역 세포 누화에 초점을 맞출 것입니다.
공개
저자는 이 기사의 내용과 관련이 있다고 선언할 경쟁 이해관계가 없습니다.
감사의 말
이 연구는 National High Level Hospital Clinical Research Funding(2022-PUMCH-B-103)의 지원과 자금 지원을 받았습니다. 저자는 이 기사의 수정 단계에서 귀중한 조언과 지도를 해준 하버드 대학교 하버드 T. H. Chan 공중 보건 대학의 생물 통계학과의 Shuang Song 박사에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| BioInfoTools | / | online analysis website http://biowinford.site:3838/patrick_wang87/ | |
| Cytoscape | / | bioinformatics network analysis software | |
| GSE196575,GSE147315 and GSE151306 | / | RNA-seq from GEO dataset | |
| Omicshare | GENE DENOVO | online analysis tools https://www.omicshare.com/tools/Home/Soft/getsoft | |
| R-studio | RStudio, Inc | R integrated development environment software |
참고문헌
- Fünfschilling, U., et al. Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature. 485 (7399), 517-521 (2012).
- Nishiyama, A., et al. Polydendrocytes (NG2 cells): multifunctional cells with lineage plasticity. Nat Rev Neurosci. 10 (1), 9-22 (2009).
- Franklin, R. J. M., Ffrench-Constant, C. Remyelination in the CNS: from biology to therapy. Nat Rev Neurosci. 9 (11), 839-855 (2008).
- Lucchinetti, C., et al. A quantitative analysis of oligodendrocytes in multiple sclerosis lesions. A study of 113 cases. Brain. 122 (Pt 12), 2279-2295 (1999).
- Patrikios, P., et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain. 129 (Pt 12), 3165-3172 (2006).
- Starost, L., et al. Extrinsic immune cell-derived, but not intrinsic oligodendroglial factors contribute to oligodendroglial differentiation block in multiple sclerosis. Acta Neuropathol. 140 (5), 715-736 (2020).
- Niu, J., et al. Aberrant oligodendroglial-vascular interactions disrupt the blood-brain barrier, triggering CNS inflammation. Nat Neurosci. 22 (5), 709-718 (2019).
- Plastini, M. J., et al. Transcriptional abnormalities in induced pluripotent stem cell-derived oligodendrocytes of individuals with primary progressive multiple sclerosis. Front Cell Neurosci. 16, 972144 (2022).
- Pisa, M., et al. Subclinical anterior optic pathway involvement in early multiple sclerosis and clinically isolated syndromes. Brain. 144 (3), 848-862 (2021).
- Vidal-Jordana, A., et al. Optical coherence tomography measures correlate with brain and spinal cord atrophy and multiple sclerosis disease-related disability. Eur J Neurol. 27 (11), 2225-2232 (2020).
- Stockwell, B. R. Ferroptosis turns 10: Emerging mechanisms, physiological functions, and therapeutic applications. Cell. 185 (14), 2401-2421 (2022).
- Thamizhoviya, G., Vanisree, A. J. Enriched environment enhances the myelin regulatory factor by mTOR signaling and protects the myelin membrane against oxidative damage in rats exposed to chronic immobilization stress. Neurochem Res. 46 (12), 3314-3324 (2021).
- Williams, R., et al. Pathogenic implications of iron accumulation in multiple sclerosis. J Neurochem. 120 (1), 7-25 (2012).
- Stojkovic, L., et al. Targeted RNAseq revealed the gene expression signature of ferroptosis-related processes associated with disease severity in patients with multiple sclerosis. Int J Mol Sci. 25 (5), 3016 (2024).
- Ziabreva, I., et al. Injury and differentiation following inhibition of mitochondrial respiratory chain complex IV in rat oligodendrocytes. Glia. 58 (15), 1827-1837 (2010).
- Aboul-Enein, F., et al. Preferential loss of myelin-associated glycoprotein reflects hypoxia-like white matter damage in stroke and inflammatory brain diseases. J Neuropathol Exp Neurol. 62 (1), 25-33 (2003).
- Halder, S. K., Milner, R. Hypoxia in multiple sclerosis; is it the chicken or the egg. Brain. 144 (2), 402-410 (2021).
- Langfelder, P., Horvath, S. WGCNA: an R package for weighted correlation network analysis. BMC Bioinformatics. 9, 559 (2008).
- Pisa, M., et al. Subclinical neurodegeneration in multiple sclerosis and neuromyelitis optica spectrum disorder revealed by optical coherence tomography. Mult Scler. 26 (10), 1197-1206 (2020).
- Lucchinetti, C., et al. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol. 47 (6), 707-717 (2000).
- Aboul-Enein, F., Lassmann, H. Mitochondrial damage and histotoxic hypoxia: a pathway of tissue injury in inflammatory brain disease. Acta Neuropathol. 109 (1), 49-55 (2005).
- Jhelum, P., et al. Ferroptosis mediates cuprizone-induced loss of oligodendrocytes and demyelination. J Neurosci. 40 (48), 9327-9341 (2020).
- Zhang, D., et al. Evidence of pyroptosis and ferroptosis extensively involved in autoimmune diseases at the single-cell transcriptome level. J Transl Med. 20 (1), 363 (2022).
- Luoqian, J., et al. Ferroptosis promotes T-cell activation-induced neurodegeneration in multiple sclerosis. Cell Mol Immunol. 19 (8), 913-924 (2022).
- Wu, T., et al. Role of ferroptosis in neuroimmunity and neurodegeneration in multiple sclerosis revealed by multi-omics data. J Cell Mol Med. 28 (10), e18396 (2024).
- Zeng, L., et al. Advances in research on immunocyte iron metabolism, ferroptosis, and their regulatory roles in autoimmune and autoinflammatory diseases. Cell Death Dis. 15 (7), 481 (2024).
- Neel, D. V., et al. Catching a killer: Mechanisms of programmed cell death and immune activation in Amyotrophic Lateral Sclerosis. Immunol Rev. 311 (1), 130-150 (2022).
- Liu, L., et al. Ferritinophagy-mediated hippocampus ferroptosis is involved in cognitive impairment in immature rats induced by hypoxia combined with propofol. Neurochem Res. 49 (7), 1703-1719 (2024).
- An, S., et al. HIF-1α induced by hypoxia promotes peripheral nerve injury recovery through regulating ferroptosis in DRG neuron. Mol Neurobiol. 61 (9), 6300-6311 (2024).
- Wang, L., et al. CXCR2 antagonism promotes oligodendrocyte precursor cell differentiation and enhances remyelination in a mouse model of multiple sclerosis. Neurobiol Dis. 134, 104630 (2020).
- Merelli, A., et al. Understanding the role of hypoxia inducible factor during neurodegeneration for new therapeutics opportunities. Curr Neuropharmacol. 16 (10), 1484-1498 (2018).
- Huang, L., et al. miR19b-3p promotes the growth and metastasis of colorectal cancer via directly targeting ITGB8. Am J Cancer Res. 7 (10), 1996-2008 (2017).
- Li, J., et al. Exosomal circDNER enhances paclitaxel resistance and tumorigenicity of lung cancer via targeting miR-139-5p/ITGB8. Thorac Cancer. 13 (9), 1381-1390 (2022).
- Mazaheri, N., et al. Ameliorating effect of osteopontin on H2O2-induced apoptosis of human oligodendrocyte progenitor cells. Cell Mol Neurobiol. 38 (4), 891-899 (2018).
- Milner, R., et al. Fibronectin- and vitronectin-induced microglial activation and matrix metalloproteinase-9 expression is mediated by integrins alpha5beta1 and alphavbeta5. J Immunol. 178 (12), 8158-8167 (2007).
- Hrastelj, J., et al. CSF-resident CD4+ T-cells display a distinct gene expression profile with relevance to immune surveillance and multiple sclerosis. Brain Commun. 3 (3), fcab155 (2021).
- Yan, L., Cui, Z. Integrin β1 and the repair after nervous system injury. Eur Neurol. 86 (1), 2-12 (2023).
- Birkner, K., et al. β1-Integrin- and KV1.3 channel-dependent signaling stimulates glutamate release from Th17 cells. J Clin Invest. 130 (2), 715-732 (2020).
- Zhang, Q., et al. Sp1-mediated upregulation of Prdx6 expression prevents podocyte injury in diabetic nephropathy via mitigation of oxidative stress and ferroptosis. Life Sci. 278, 119529 (2021).
- Hadi, N., et al. Study of the correlation between miR-106a, miR-125b, and miR-330 on multiple sclerosis patients by targeting TNFSF4 and SP1 in NF-кb/TNF-α pathway: A case-control study. Cell J. 24 (7), 403-409 (2022).
- Asbelaoui, N., et al. Interplay between androgen and CXCR4 chemokine signaling in myelin repair. Acta Neuropathol Commun. 12 (1), 18 (2024).
- Kaddatz, H., et al. Cuprizone-induced demyelination triggers a CD8-pronounced T cell recruitment. Glia. 69 (4), 925-942 (2021).
- Wang, W., et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy. Nature. 569 (7755), 270-274 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유