Research Article
多発性硬化症患者のiPS細胞由来オリゴデンドロサイト前駆細胞におけるフェロトーシスおよび低酸素関連遺伝子の同定
要約
この研究は、バイオインフォマティクス分析を通じて、多発性硬化症(MS)の病因における低酸素症、フェロトーシス、および免疫浸潤の間の相互作用に関する新しい洞察を提供します。WGCNA(Weighted Gene Coexpression Network Analysis)とPPI(Protein-Interaction Analysis)を用いて、ITGB1、 ITGB8、 VIMの3つの重要なハブ遺伝子を同定しました。
要約
多発性硬化症(MS)は、脱髄を特徴とする慢性炎症性疾患であり、再髄鞘形成の失敗は慢性期の進行性軸索喪失につながります。オリゴデンドロサイト前駆細胞(OPC)は、再髄鞘形成に重要です。最近の研究では、低酸素症とフェロトーシスの両方がOPCの機能不全の分化に重要な役割を果たしていることが示唆されています。本研究では、MS患者の人工多能性幹細胞(iPSC)に由来するOPCの低酸素症やフェロトーシス、免疫浸潤特性に関連する主要な遺伝子を特定し、これらの重要な遺伝子を中心とした診断モデルを構築することを目指しています。
GSE196575データセットとGSE147315データセットから遺伝子発現データを解析し、MS患者と健常者を比較しました。WGCNA(Weighted Gene Coexpression Network Analysis)を用いて、低酸素症、フェロトーシス、MSに関連する一次モジュール遺伝子と必須遺伝子をピンポイントで同定しました。遺伝子セット変動解析(GSVA)により算出されたフェロトーシスZスコアと低酸素Zスコアは、MS患者のiPS細胞由来OPCの方が対照群よりも高かった。Gene Ontology(GO)およびKyoto Encyclopedia of Genes and Genomes(KEGG)のパスウェイエンリッチメント解析を通じて特定されたように、関与する遺伝子は主にPI3K/Akt/mTOR経路に関連しています。
重要な遺伝子のタンパク質間相互作用(PPI)ネットワークにより、10個の中央ハブ遺伝子(COL4A1、COL4A2、ITGB5、ITGB1、ITGB8、ITGAV、VIM、FLNA、VCL、 およびSPARC)が明らかになりました。ITGB1、ITGB8、VIMの頑健な発現がGSE151306データセットで検証され、主要なハブ遺伝子としての役割が裏付けられました。さらに、転写因子(TF)とハブ遺伝子との間の相互作用ネットワークは、Transcriptional Regulatory Relationships Unraveled by Sentence-based Text(TRRUST)によって確立され、5つの主要なTFが特定されました。この研究の結果は、MSの新規バイオマーカーまたは治療標的の解明に役立つ可能性があります。
概要
多発性硬化症(MS)は、脱髄を特徴とする慢性炎症性疾患で、世界中で約250万人が罹患しています。MSと診断された人の大多数は、再発寛解型(RR)疾患の経過を示します。再発期には、急性炎症によりミエリンと軸索が必然的に失われます。逆に、寛解期には、脱髄病変は再髄鞘形成によって修復され、軸索に栄養的サポートを提供し、進行性の軸索喪失を防ぐことができます1。再髄鞘形成不全は、MSの慢性期に発生し、進行性の軸索変性2につながります。
再髄鞘形成の過程は、オリゴデンドロサイト前駆細胞(OPC)と有意に相関しており、OPCの増殖と遊走が中枢神経系(CNS)のミエリン形成細胞である成熟オリゴデンドロサイト(OL)に分化します3。疾患の初期段階では、脱髄病変の周囲にOPCによって生成された新しいOLの数は比較的保存されており、再髄鞘形成をうまく促進できます4。しかし、進行したMSの段階では、OPCの不適切な移動と分化が新しいOLの減少と再髄鞘形成の障害5につながり、神経変性や障害の蓄積につながります。
多発性硬化症の神経変性を説明するために、2つの仮説が提案されています。この外因性仮説は、活性化されたT細胞によって開始される免疫応答が、神経変性だけでなく脱髄も引き起こすことを示唆しています6。しかし、内因性モデルは、OPCs7、OLs 8、およびCNSの他の細胞における内因性異常が神経変性に寄与している可能性があることを示唆しています。内因性モデルは、以前は、一次または二次進行性MS(PPMSおよびSPMS)などのMSのより進行した段階でのみ適用できると考えられていました。それにもかかわらず、最近、RRMS 9,10では炎症や再発とは無関係の神経変性が観察されており、RRMSを含むすべての疾患ステージに内因性細胞異常が関与している可能性が示唆されています。
さらに、鉄介在性脂質代謝障害に関連する特徴的な細胞死経路であるフェロトーシスは、神経変性において極めて重要な役割を果たしています。この経路は、過剰な鉄によって引き起こされる細胞内酸化還元状態の不均衡を伴い、過酸化脂質の蓄積と活性酸素種(ROS)の生成を引き起こし、最終的に酸化的細胞死をもたらします11。アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患は、ニューロン細胞の酸化的損傷に起因し、これは病変内の鉄濃度が異常に高いことによって引き起こされることがよくあります。MSでは、酸化的損傷に対する脆弱性の増加と、CNS細胞の高脂質含有量および酸素消費によるミトコンドリア機能障害が相まって、フェロトーシスの重要な因子である脂質過酸化が促進されます。OLは、フェロトーシス12の本質的な特徴である脂質過酸化に敏感です。脊髄炎症性病変13 の近くの鉄沈着と、脂質過酸化14 およびフリーラジカル15 に対するOLの脆弱性は、MSのフェロトーシスに対する感受性を強調しています。
低酸素症は、多発性硬化症の病因におけるもう一つの重要な要因であり、オリゴデンドロサイトの喪失に寄与します。急性MS病変における低酸素様損傷およびROSおよび窒素酸化物(NO)の生成の証拠は、そのようなストレッサーがミトコンドリア機能障害およびその後のエネルギー不足を引き起こす可能性があることを示している16。この代謝ストレスはOLに影響を与えるだけでなく、ミエリンチャネルがミエリン鞘と軸索周囲空間の間でエネルギーを伝達するため、エネルギー伝達の乱れを通じて隣接する軸索をも損ないます17。
CNSの初代ヒトOPCおよびOLは、MS患者においてアクセスが非常に困難です。したがって、人工多能性幹細胞(iPSC)由来のヒトOPCおよびOLは、MSの内因性疾患を研究するための有望なツールとして浮上しています。MSの病因におけるフェロトーシスと低酸素症の重要な役割とそれらがオリゴデンドロサイトの系統に与える影響に照らして、この研究では、重み付け遺伝子共発現ネットワーク解析(WGCNA)を使用してモジュール情報を抽出し18 、MSのこれらの現象に関連する遺伝子発現パターンを解明しました。遺伝子間の相関係数をスクリーニングすることで、同一または類似の共発現ネットワークまたはモジュールを同定し、MSの新規バイオマーカーまたは潜在的な治療標的に光を当てることができます。さらに、この研究は、重要な遺伝子を調節する転写因子(TF)に焦点を当てることにより、MSのメカニズムと潜在的な介入戦略をさらに調査するための基盤を提供します。
プロトコル
1. データのダウンロードと前処理
- Gene Expression Omnibus(GEO)からデータセットGSE196575およびGSE147315をダウンロードします。
- 2つのデータセットをマージし、オンライン分析プラットフォームを使用してバッチ効果を削除します( 材料の表を参照)。
- [式モジュール] | [データ マージ モジュール] を選択します。2 つの式マトリックス ファイルを入力ファイルとしてアップロードし、[実行] をクリックして、マージされたマトリックスを自動的に出力します。
- サンプルの注釈ファイルをスプレッドシートとして作成します。
- 式モジュールの選択 |バッチエフェクトモジュールを削除します。注釈ファイルとマージされたマトリックスを入力し、[実行]をクリックして、バッチ効果が削除されたマージされたマトリックス(マージされたマトリックス2)を作成します。
- オンライン分析プラットフォームで使用できる マージデータセット、 バッチエフェクト、 および正規化 機能を使用して、式データを正規化します。 式モジュール と 正規化モジュールを選択します。ステップ1.2.3で作成した 入力マージ行列2 。 「実行 」ボタンをクリックします。( 資料の表を参照)。
- 上記のプロセス全体を実行した後、式行列ファイルを出力します。GEO Web サイトで提供されている手順に従って、グループ化情報を抽出します。上記の情報を「.txt」形式のドキュメントに入力して、マージされたデータセットのグループ化情報ファイルを作成します。
2. 差次的発現遺伝子解析
- Rのlimmaパッケージを用いて遺伝子発現差出量解析を行い、発現マトリックスファイルとグルーピング情報ファイルを入力します。 フィルタリング基準 を |logFC| = 1 および p < 0.05 に設定して、多発性硬化症に関連する差次的に発現する遺伝子 (DEG) を特定します。
3. 機能強化解析(GOおよびKEGG)
- オンラインプラットフォーム上のGOモジュールとKEGGモジュールを介して、DEGの機能的濃縮分析を実施します。
- モデル生物を ホモ・サピエンスに設定し、Ensemble_109バージョンを背景遺伝子ファイル、遺伝子をデータタイプとして設定しました。
- 広範なGO用語は避けてください。ToppFun を使用して解析を絞り込みます。フィルターを適用して、用語を 500 個から 1,000 個の関連遺伝子に制限します。
注:500遺伝子フィルターの結果は、メイン原稿に記載されています。GOの全結果は 、補足図S2でご覧いただけます。オンラインKEGGプラットフォームは 、補足図S3に示されています。
4. フェロトーシスおよび低酸素症(GSVA)の遺伝子セット変異解析
- FerrDbから合計538個のフェロトーシス関連遺伝子を、MsigDBから200個の低酸素関連遺伝子を取り出します。
- 両方の遺伝子セットのGMT形式のファイルを作成します。
- GSVA モジュールを使用して、マージされたデータセットの各サンプルのフェロトーシス Z スコアと低酸素 Z スコアを計算し、式マトリックス ファイル、グループ化情報ファイル、および GMT ファイルを入力として使用します。
- 異なるグループのZスコアを比較します(補足図S4)。
5. 重み付け遺伝子共発現ネットワーク解析(WGCNA)
- ステップ4.4で計算した各サンプルのフェロトーシスと低酸素症のZスコアを抽出します。上記のフェロトーシスと低酸素症のZスコアを発現マトリックスファイルと一緒に形質ファイルとして使用し、フェロトーシスと低酸素症に関連する主要な遺伝子モジュールを特定します。
- WGCNAモジュールを使用し、R2 = 0.9、ソフトスレッショルドβ = 18に設定して、重み付けされた遺伝子共発現ネットワークを構築します。フェロトーシスと低酸素症の両方に有意に関連するモジュールに焦点を当てます(補足図S4)。
6. MS患者におけるフェロトーシスおよび低酸素症に関連する差次的に発現する遺伝子の同定
- オンライン解析プラットフォーム上のベン図ツールを介して、疾患関連のDEGをフェロトーシスおよび低酸素関連遺伝子モジュールと交差させます(補足図S3)。MSのフェロトーシスと低酸素症の両方に関連する遺伝子を特定します。
7. タンパク質間相互作用(PPI)ネットワーク解析
- 交差した遺伝子をSTRINGデータベースの Multiple Proteins モジュールに入力します。
- 生物を「Homo sapiens」に設定し、「検索」をクリックします。
- Webページの中央にある [続行 ]オプションを使用して、PPIネットワークを生成します。
- インタラクションネットワーク情報をTSV形式でエクスポートし、バイオインフォマティクスネットワーク解析ソフトウェアにインポートします(補足図S5)。
- Cytohubbaプラグインを使用して、MCCアルゴリズムに基づいて上位10のハブ遺伝子を同定します。
8. GSE151306データセットによる検証
- GEO から GSE151306 データセットをダウンロードします。
- R studioソフトウェアのlimmaパッケージ(R言語コードはGitHub:https://github.com/Drxiazhang/Identification-of-Ferroptosis--and-Hypoxia-Related-Genes-in-iPSC-Derived-OPCs-from-MS で提供されています)を使用して、異なるグループ間でのハブ遺伝子の発現を検証し、 発現マトリックスファイル、 検証セットのグループ化ファイル、 およびハブ遺伝子リストを入力します。
9. ハブ遺伝子のROC曲線プロット
- RのpROCパッケージを使用して、差次的に発現するハブ遺伝子のROC曲線をプロットします。
- 検証データセットでこれらのハブ遺伝子の診断値を検証します (R 言語コードは GitHub: https://github.com/Drxiazhang/Identification-of-Ferroptosis--and-Hypoxia-Related-Genes-in-iPSC-Derived-OPCs-from-MS で提供されています)。
10. 転写因子-ハブ遺伝子制御ネットワークの予測
- https://www.grnpedia.org/trrust/ でTRRUST v2データベースにアクセスします。
- 「Find key regulators for query genes」モジュールを使用して、10 個のハブ遺伝子を調節する転写因子を同定します。
- 種族に「人間」を設定します。転写因子とハブ遺伝子をSTRINGのMultiple Proteinsモジュールに入力し、Homo sapiensを生物に設定し、CONTINUEをクリックして制御ネットワークを生成します。
結果
対照として4人の健康な個人と9人のMS患者(PwMS)で構成されるマージされたデータセットは、分析され、4人のPwMSと4人の健康な対照の別のデータセットで検証されました。分析プロトコルを図1に示し、すべてのサンプルの詳細情報を補足表S1に示します。この解析により、706の差次的に発現する遺伝子(DEG、p < 0.01)が同定され、そのうち378の遺伝子がアップレギュレーションされ、そのうち328の遺伝子がコントロールと比較してMS患者でダウンレギュレーションされました(図2)。機能濃縮分析により、これらのDEGがさまざまな生物学的プロセスに大きく関与していることが明らかになりました。特に、500の遺伝子によって精製された上位の濃縮GO用語には、焦点接着、細胞-基質接合、インテグリン媒介シグナル伝達経路、インテグリン結合、およびカドヘリン結合が含まれていました(図3A-C)。KEGG経路解析により、これらの遺伝子は主にPI3K-Aktシグナル伝達経路とHippoシグナル伝達経路(図3D)に関与していることが明らかになりました。これらは、MSの病因に関連する細胞プロセスに重要です。
GSVAを通じて計算されたフェロトーシスおよび低酸素Zスコアは、MS患者のiPS細胞由来オリゴデンドロサイト前駆細胞(OPC)で、健康な対照の細胞よりも有意に高かった(それぞれp = 0.0028および0.075、 図4)、この疾患におけるこれらの経路の極めて重要な役割を示しています。この知見はWGCNAによって支持され、WGCNAは2つの主要な遺伝子モジュールを同定した(図5A)。これらのうち、3,671個の遺伝子を含むターコイズモジュールは、フェロトーシスと低酸素症の両方に有意に関連していました(図5B)。重要なことに、差次的に発現する疾患関連遺伝子とWGCNAモジュールの遺伝子の交点で71の遺伝子が同定され、MSにおけるフェロトーシス(β=0.94、p=2e-06)および低酸素症(β=0.92、p=7e-06)との強い相関関係が示唆されました(図6)。
PPIネットワークをさらに調査したところ、COL4A1、COL4A2、ITGB5、ITGB1、ITGB8、ITGAV、VIM、FLNA、VCL、およびSPARCの10個の中央ハブ遺伝子が明らかになりました(図7)。これらのハブ遺伝子は、フェロトーシスと低酸素症の両方に関連する細胞プロセスを媒介する重要な役割で注目されました。
さらに、検証データセット(GSE151306)を検証しました。その結果、3つのハブ遺伝子(ITGAV、ITGB8、VIM)がPwMSでアップレギュレーションされていることが示唆され(図8)、これはマージされたデータセット(補足図S1)の結果と一致していました。その中で、ITGB8は最も有意にアップレギュレーションされた遺伝子でした。これらの知見は、インテグリンファミリーの一員であるITGB8が、特にフェロトーシスと低酸素症のメカニズムに関連して、MSの病因に決定的に関与している可能性があることを示唆しています。さらに、受信者動作特性(ROC)曲線解析により、ITGAVは、ITGAVが、ITGB8が、疾患診断に対して良好な感度と特異性を有することが確認された(AUC=58.3%、100%、91.7%)。図9A-C)、ITGB8 は 100% の AUC を示しており、MS の堅牢なバイオマーカーとしての可能性を示しています。
最終的に、転写因子-ハブ遺伝子制御ネットワークが確立され、HOXD3、SP1、VHLの3つの主要な転写因子がハブ遺伝子の調節因子として同定されました(図10)。これらの転写因子は、低酸素症やフェロトーシスに応答した遺伝子発現の調節に重要な役割を果たす可能性があり、MSの進行への関与の可能性がさらに浮き彫りになっています。
ビデオ 1: 右半横隔膜を中心とした低周波トランスデューサーで得られた冠状図は、肺活量呼吸中の定性的正常な横隔膜の変動を示しています。このビデオをダウンロードするには、ここをクリックしてください。
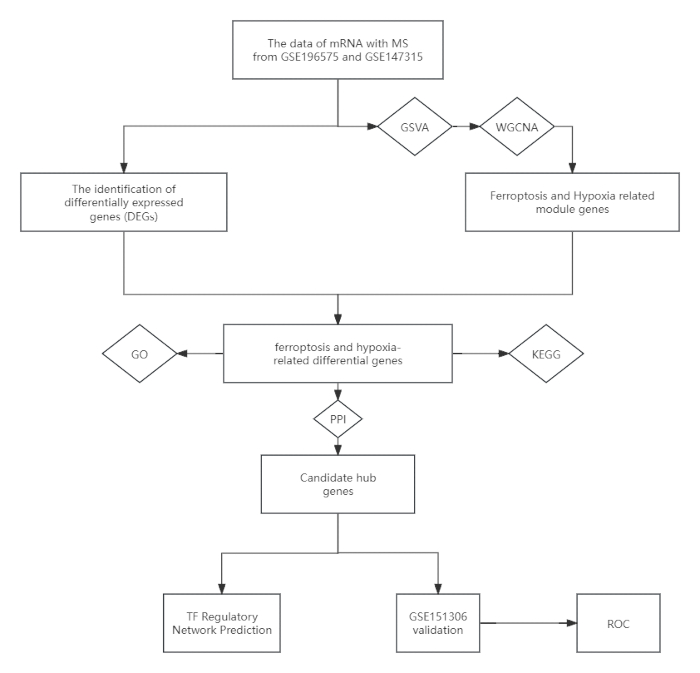
図1:試験デザインを示すフローチャート。 略語:MS =多発性硬化症;GSVA = 遺伝子セット変異解析;WGCNA = 重み付け遺伝子共発現ネットワーク解析;KEGG = 京都遺伝子・ゲノム百科事典;GO = 遺伝子オントロジー;PPI = タンパク質間相互作用;ROC = 受信機の動作特性。 この図の拡大版を表示するには、ここをクリックしてください。
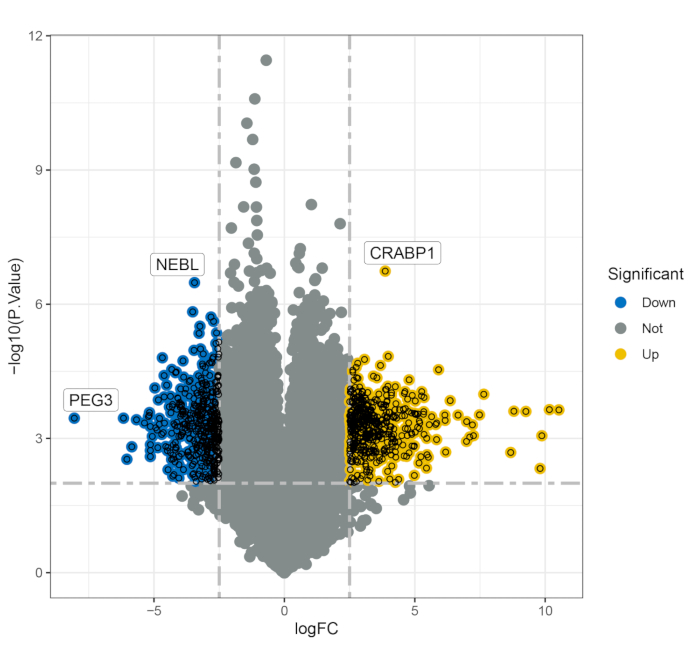
図2:健康な対照群とMS群の間で差次的に発現する遺伝子を示す火山プロット。 略語:FC =フィルタリング基準。PEG3 = 父方で発現した遺伝子3;NEBL =ネビュレット;CRABP1 = 細胞性レチノイン酸結合タンパク質 1. この図の拡大版を表示するには、ここをクリックしてください。
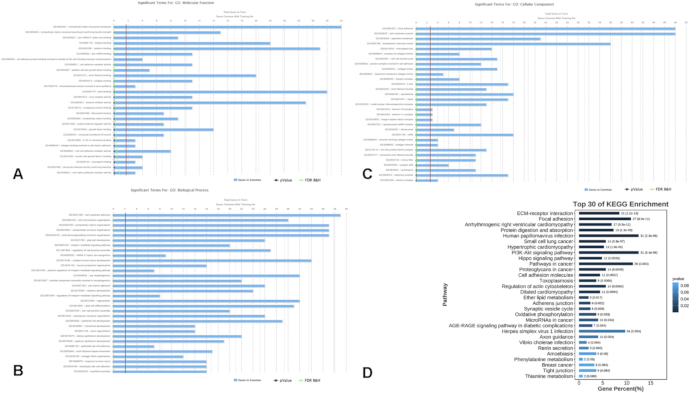
図3:差次的に発現する遺伝子の機能濃縮解析。 (A-C)Gene Ontologyのカテゴリーは、(A)分子機能、(B)生物学的プロセス、(C)細胞成分を含む500の遺伝子をフィルタリングすることで絞り込まれています。(D)DEG間で濃縮された経路を示すKEGG経路濃縮解析。略語:DEG =差次的に発現する遺伝子。GO = 遺伝子オントロジー;MF = 分子機能;BP = 生物学的プロセス;CC = 細胞成分;KEGG=京都遺伝子・ゲノム大百科事典。 この図の拡大版を表示するには、ここをクリックしてください。
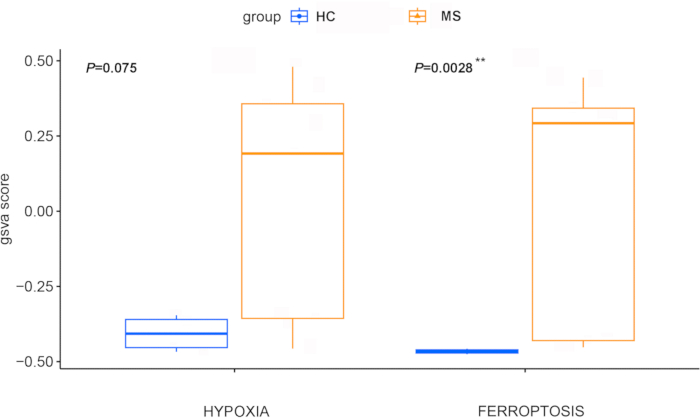
図4:健康な対照群とMS群の間でフェロトーシスと低酸素症のZスコアを比較する箱ひげ図。 フェロトーシスおよび低酸素Zスコアは、GSVAを介して計算されました。コントロールグループは青で、MSグループは赤で示されています。統計的比較は、Wilcoxon検定を介して実行されました。** は 0 から 0.01 までの p 値を示します。略語:MS =多発性硬化症;HC = 健康なコントロール;GSVA = 遺伝子セット変異解析。 この図の拡大版を表示するには、ここをクリックしてください。

図5:重み付けされた遺伝子共発現ネットワーク解析結果。 (A)モジュールに分類された遺伝子のクラスター樹状図。(B)低酸素症とフェロトーシスに関連するモジュールと形質との間の相関。略語:ADJ =調整済み。 この図の拡大版を表示するには、ここをクリックしてください。

図6:71の交差する遺伝子を明らかにするベン図。 この図は、多発性硬化症患者のDEGと低酸素症およびフェロトーシス関連モジュールの遺伝子の重なりを示しています。略語:WGCNA = weighted gene co-expression network analysis;DEGs = 差次的に発現する遺伝子。 この図の拡大版を表示するには、ここをクリックしてください。
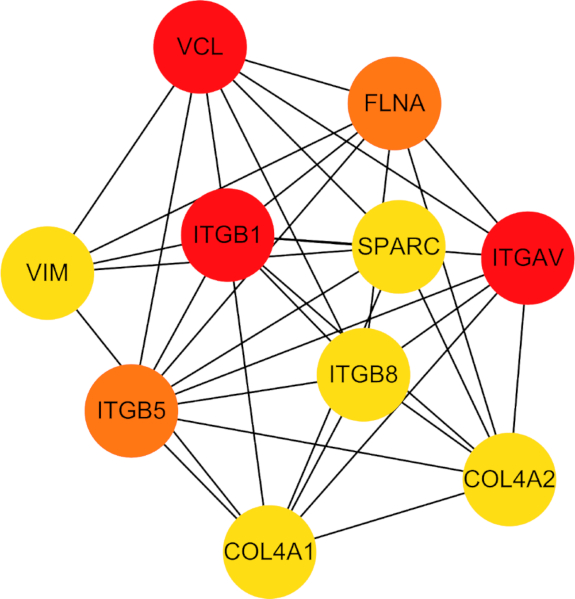
図7:同定された10個のハブ遺伝子間のタンパク質間相互作用のネットワーク図。 略語:VCL = vinculin;FLNA =フィラミンA;ITGAV = インテグリンサブユニットアルファV;GOL4A2 = コラーゲンIV型α2鎖;COL4A1 = コラーゲンIV型α1鎖;ITGB5 = インテグリンサブユニットベータ5;VIM = ビメンチン;SPARC = 酸性でシステインが豊富な分泌タンパク質。ITGB8 = インテグリンサブユニットベータ8;ITGB1 = インテグリン サブユニット ベータ 1。 この図の拡大版を表示するには、ここをクリックしてください。
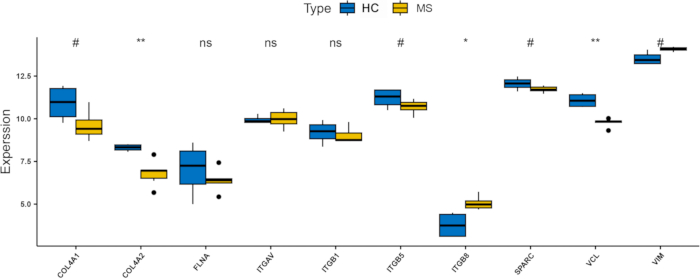
図8:検証データセット(GSE151306)内のハブ遺伝子の発現レベルを示す棒グラフ。 * は 0.01 から 0.05 までの p 値を示し、# は 0.05 から 0.2 までの p 値を示します。ns は 0.2 から 1 までの p 値を示します。略語:HC:健康なコントロール;MS:多発性硬化症。 この図の拡大版を表示するには、ここをクリックしてください。

図9:GSE151306で差次的に発現するハブ遺伝子の診断感度と特異性を評価するためのROC曲線。 (A) ITGAVの中ROC曲線。(B) ITGB8の中華圏曲線。(C) VIMのROC曲線。略語:ROC =レシーバーの動作特性。ITGAV = インテグリンサブユニット α V;ITGB8 = インテグリンサブユニットベータ 8;VIM = ビメンチン。 この図の拡大版を表示するには、ここをクリックしてください。
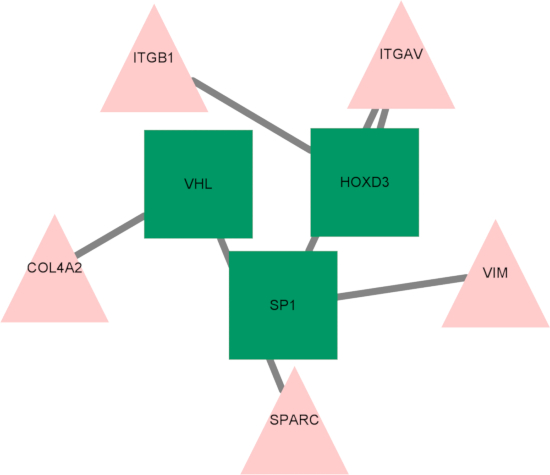
図10:転写因子-ハブ遺伝子制御ネットワークの図。 三角形は転写因子を表します。四角はハブ遺伝子を表します。略語:ITGB1 =インテグリンサブユニットベータ1;ITGAV = インテグリンサブユニット α V;VIM = ビメンチン;SPARC = 分泌タンパク質、酸性、システインリッチ;COL4A2 = コラーゲンIV型α 2鎖;HOXD3 = ホームボックス D3;VHL = von Hippel-Lindau腫瘍抑制因子;SP1 = 特異性タンパク質 1. この図の拡大版を表示するには、ここをクリックしてください。

図11:インテグリンβ1がPI3K-Akt経路に与える影響。 オープンヘッド(活性状態、高親和性)のインテグリンβ1による伸展形態は、「焦点接着」および「焦点複合体」を形成し、FAKおよびScrキナーゼと相互作用する可能性があります。活性FAK/Src複合体は、アダプター分子を動員してPI3K-Akt経路を活性化します。この図は、ヤンとクイ37から採用されました。略語:PI3K =ホスファチジルイノシチド-3-キナーゼ;FAK = 焦点接着キナーゼ。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:マージされたデータセットの主要な遺伝子の発現傾向。"limma" R パッケージの Wilcox.test 関数を統計テストに使用しました。「*」は0.01〜0.05のp値を示し、「#」は0.05〜0.2のp値を示します。 この図をダウンロードするには、ここをクリックしてください。
補足図S2:Gene Ontologyによる差次的に発現した遺伝子の解析から得られたオリジナルレイアウト。この図をダウンロードするには、ここをクリックしてください。
補足図S3:Omicshareオンライン分析プラットフォームのホームページ。 このウェブサイトは、KEGGが実施された中国のバイオインフォマティクスハブです。 この図をダウンロードするには、ここをクリックしてください。
補足図S4:WGCNAが実施されたBiowinfordオンライン分析プラットフォームのホームページ。この図をダウンロードするには、ここをクリックしてください。
補足図S5:PPIが実行されたSTRINGデータベースのホームページ。この図をダウンロードするには、ここをクリックしてください。
補足表S1:プールおよび分析されたサンプルとデータセットの特性。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
再髄鞘形成プロセスにおけるその極めて重要な役割を考えると、OPCの移動、分化、および死は、MSの病因およびMSの治療標的における重要な要因であると長い間決定されてきました。炎症非依存性の進行性神経変性は、MSの3つのタイプすべてで観察されています19、および脱髄病変の中心でオリゴデンドロサイトの顕著な喪失が認められました20から、オリゴデンドロサイト系譜細胞の原発性疾患がMSの進行を加速させる可能性があることを示唆しています。
本研究では、PwMS由来のiPS細胞誘導性OPCと健常対照群のフェロトーシスおよび低酸素症に関連する遺伝子に着目し、4人の健常対照群と9つのPwMSのデータセットを統合して、標的mRNA配列のバイオインフォマティクス解析を行いました。706のDEGを発見し、そのうち378がアップレギュレーションされ、328がダウンレギュレーションされました。さらに、フェロトーシスおよび低酸素関連遺伝子を同定し、各サンプルのZスコアを計算することにより、MS患者と健常対照のiPS細胞誘導OPCにおけるそれらの発現を比較しました。フェロトーシスと低酸素症のZスコアは、健康な対照群よりもPwMSで有意に高かった。
病理学的研究では、虚血性白質脳卒中16 に似た III 型 MS 病変における遠位オリゴデンドログリオパチーと、急性 MS 病変21 の ROS および NO レベルの上昇を伴う低酸素様損傷が示されています。ミトコンドリア呼吸鎖複合体IVの破綻は、OPCおよび成熟オリゴデンドロサイト15の形成および生存能力を損なうが、この障害の根底にある正確なメカニズムはまだ解明されていない。
さらに、プログラム細胞死の鉄依存性形態であるフェロトーシスは、キュプリゾン誘発性MS動物モデルにおいて、オリゴデンドロサイトの喪失と脱髄の進行を媒介することがわかっています22。シングルセルシーケンシングにより、PwMS23の脳組織におけるOPCおよびOLにおける抗フェロトーシス遺伝子発現の減少が明らかになりました。MSの慢性期では、オリゴデンドロサイトの鉄欠乏症は、白質の再髄鞘形成を混乱させ、軸索の完全性を損なう可能性があり、その結果、疾患の進行がもたらされます24。さらに、白質のMS病変のsnRNA-seqは、フェロトーシスがMS患者の白質病変で主に活性であり、食細胞系の活性化に関連していることを示唆しています25。実験的自己免疫性脳脊髄炎(EAE)マウスでは、フェロトーシスの重要な調節因子であるGPX4のレベルが低下します26。EAEの疾患進行は、T細胞受容体(TCR)シグナル伝達を増強するACSL4によって誘発されるフェロトーシスによって加速される可能性があります。フェロトーシスと ACSL4 をブロックすると、EAE27 の障害の進行が大幅に遅くなります。
フェロトーシスは、ラットモデル28の低酸素症によって引き起こされる認知機能低下に関与しています。低酸素症および低酸素誘導性因子-1αは、後根神経節の増殖と移動を促進する29。したがって、フェロトーシスと低酸素症は、MSの病因において相乗的に作用する可能性があります。WGCNAを通じて、私たちの研究は2つの重要なモジュールを特定しました。特にターコイズブルーのモジュールは、MSの状態、低酸素症、およびフェロトーシスと強く相関していました。WGCNAとDEGの結果に基づいて、フェロトーシス、低酸素症、MSと同時に相関する71の主要な遺伝子を同定しました。
706 DEGのGOおよびKEGG機能濃縮解析により、PI3K-Aktシグナル伝達経路がMS開発における重要な経路であることが明らかになりました。CXCR2の阻害は、PI3K/AKT/mTORシグナル伝達を活性化することにより、MSマウスモデルにおけるOPCの分化を促進し、再髄鞘形成を促進する30。酸素供給の不均衡は、MAPK/PI3K-Aktシグナル伝達経路に影響を及ぼし、酸化ストレスに関与する主要なメカニズムを引き起こす可能性があります31。
PPI解析の結果、COL4A1、COL4A2、ITGB5、ITGB1、ITGB8、ITGAV、VIM、FLNA、VCL、 SPARCの10のハブ遺伝子が、低酸素症、フェロトーシス、MSと同時に相関しており、対照群と比較してMS患者で顕著な過剰発現が認められました。これらの遺伝子は、SPMS患者由来のiPS細胞誘導性OPC株のデータベースであるGSE151306でさらに検証されました。ITGAV、ITGB8、VIMも検証セットでアップレギュレーションされていることがわかりました。特に、インテグリンファミリーの一部であるITGB8は、MSで有意に過剰発現しており、これはGSE147315とGSE196575を組み合わせたテストセットと一致していました。
遺伝子ITGB8はインテグリン(ITG)ファミリーのメンバーであり、腫瘍の成長と転移の調節因子であることが以前に報告されているインテグリンベータ8をコードしています32,33。インテグリンβ8は、OPCおよび成熟オリゴデンドロサイトによって強く発現します。ある研究では、オステオポンチンがITGB834を含むインテグリンをアップレギュレーションすることにより、H2O2誘発性アポトーシスからOPCを保護することが示されました。これらの知見は、ITGB8が酸化ストレス条件下での細胞生存に関与していることを示しています。酸化ストレスが蔓延する多発性硬化症では、ITGB8はOPCの生存を助け、オリゴデンドロサイトに分化して再髄鞘形成を増加させる可能性があります。
ITGAV は、血管新生とがんの進行を調節するインテグリンサブユニットαVをコードしています。 ITGAVは、β5(インテグリンαvβ5を形成する)と組み合わせて、MS病変で上昇するフィブロネクチンおよびビトロネクチン沈着に応答してミクログリアの活性化を媒介します。EAEのMSラットモデルでは、インテグリンavβ5がミクログリアを活性化し、細胞外マトリックスとミエリンタンパク質を分解する酵素であるマトリックスメタロプロテイナーゼ-9(MMP-9)の発現が増加し、脱髄に寄与します35。
特に、私たちのマージセットで差次的に発現したハブ遺伝子の1つである ITGB1は、 MS患者の脳脊髄液から抽出されたCD4+ T細胞でアップレギュレーションされることがわかりました36。インテグリンβ1はPI3K-Aktシグナル伝達経路に顕著な影響を及ぼし、これは我々の知見と一致している(図11)37。さらに、β1-インテグリンの発現増加は、健康な対照と比較して、MS患者のTh17細胞で検出されました。Th17細胞におけるβ1-インテグリンの活性化は、グルタミン酸レベルを有意に増加させ、神経炎症を促進することができる38。
OPCにおける ITGAVのITGAV発現、 ITGB8発現、 VIM 発現の可能性を評価するために、ROC曲線解析を実施した。 ITGB8 のAUCは100%で、 VIM が91.7%、 ITGAVが58.3%と続いた。現在、オリゴデンドロサイトにおける ITGB8 の発現とMSとの関連を報告した研究はありません。MSの予測のためのバイオマーカーとしての ITGB8 の使用を調査するために、さらなる研究を実施する必要があります。
最後に、転写因子-ハブ遺伝子ネットワークを構築し、HOXD3、SP1、VHLの3つの主要な転写因子を同定しました。SP1は、多くのプロモーターに結合する転写因子です。SP1は、その広範なプロモーター結合で知られており、高グルコース環境におけるPrdx6の発現を調節し、ROSを阻害し、フェロトーシスを排除することが示されています39。SP1の発現は、RRMS40の発症に重要な役割を果たす腫瘍壊死因子(TNF)活性にも関連しています。別の同定された転写因子であるアンドロゲン受容体(AR)は、ステロイドホルモンによって活性化され、再髄鞘形成ゾーン内の星状細胞で検出され、オリゴデンドロサイト機能への関与の可能性が強調されています41。
免疫経路と免疫細胞は、MSの病因と神経変性に重要な役割を果たしており、フェロトーシス、低酸素症、およびOPCに関連している可能性があります。クプリゾン中毒マウスおよび進行性MS病変からの観察は、細胞傷害性顆粒の過剰発現を有するCD8+ T細胞の高い有病率および増殖率を示している42。十分に活性化されたT細胞は、抗原提示オリゴデンドロサイトと相互作用することができ、CD8+ T細胞を介したオリゴデンドロサイトの破壊につながる可能性があります。腫瘍微小環境では、CD8+ T細胞によって分泌されるインターフェロンγは、システイングルタミン酸交換体(xCT)の発現を減少させ、フェロトーシスを増強します43。さらに、フェロトーシスは、EAEモデル24のT細胞受容体シグナル伝達を介してT細胞を活性化することが示唆されています。
OPCに関する現在の研究は、これらの細胞が不足しているため、大幅に制限されています。この制限は、iPSC誘導OPCを使用することで部分的に対処できます。しかし、iPS細胞誘導性OPCに関するほとんどの研究では、細胞誘導のプロセスに時間と費用がかかるため、サンプルサイズが小さく、通常はドナーが10人未満です。私たちの研究では、複数の研究からのサンプルを統合することにより、より堅牢な結果が得られます。
バイオインフォマティクスのパイプラインをさらに洗練させ、利用可能なデータセットを学習セットと検証セットに分割しました。このアプローチにより、研究室間での細胞導入法やシーケンシング技術の違いによって生じる潜在的なバイアスを最小限に抑えることができます。多発性硬化症に関する既存の研究のほとんどは、炎症による神経変性に焦点を当てているか、フェロトーシスの孤立した分析を採用しています。従来の遺伝子発現解析は、発現差のある個々の遺伝子の同定には有用ですが、MSの進行に関連する複雑な相互作用ネットワークや共発現パターンを明らかにすることができないことがよくあります。これに対し、私たちの方法論では、WGCNAを活用して遺伝子共発現ネットワークを構築し、フェロトーシスと低酸素症の両方と高い相関を持つ遺伝子モジュールの同定を可能にします。これにより、これらの経路がMSの病理学内でどのように相互作用するかをシステムレベルで理解することができますが、これは標準的な差次的発現法だけでは達成できません。
この方法は、神経変性の低減を目的とした治療法の遺伝子標的を特定することにより、MSの新しい治療法に適用できます。また、パーキンソン病やアルツハイマー病など、フェロトーシスや低酸素症が関与する他の神経変性疾患にも使用でき、カスタマイズされた介入を開発し、治療反応を予測することができます。
私たちの研究にはいくつかの限界があります。まず、さらなる in vivo および in vitro の検証が必要です。第二に、私たちの結果は2つのデータベースから得られたものであり、限られた数の患者をカバーする1つのデータベースで検証されました。より大きなコホートは、さらに探索するために収集する必要があります。第3に、ヒトOPCへのアクセスの難しさを考慮し、iPS細胞誘導OPCをベースとしたデータベースを採用しました。これは、ヒト組織に完全には似ていない可能性があります。MSのオリゴデンドロサイト系譜細胞の分化と細胞死に対する低酸素症とフェロトーシスの影響を調査することに焦点を当てたより多くの研究が将来実施されるべきです。
この研究のもう一つの限界は、MS病変に存在する免疫細胞を欠くiPS細胞由来のOPCを使用しているため、免疫細胞の相互作用を解析できないことです。免疫細胞はMSの病因に不可欠ですが、この制限はiPS細胞由来の培養物を使用する際の課題を反映しています。今後の研究では、共培養システムやオルガノイドを介したOPC免疫細胞のクロストークに焦点を当てるべきであり、これによりMS環境における細胞相互作用をより適切にモデル化することができます。
開示事項
著者は、この記事の内容に関連すると宣言する競合する利益を持っていません。
謝辞
この研究は、National High Level Hospital Clinical Research Funding(2022-PUMCH-B-103)の支援と資金提供を受けました。著者は、この記事の改訂段階で貴重なアドバイスと指導をくださったハーバード大学ハーバード大学公衆衛生大学院生物統計学部のShuang Song博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| BioInfoTools | / | online analysis website http://biowinford.site:3838/patrick_wang87/ | |
| Cytoscape | / | bioinformatics network analysis software | |
| GSE196575,GSE147315 and GSE151306 | / | RNA-seq from GEO dataset | |
| Omicshare | GENE DENOVO | online analysis tools https://www.omicshare.com/tools/Home/Soft/getsoft | |
| R-studio | RStudio, Inc | R integrated development environment software |
参考文献
- Fünfschilling, U., et al. Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature. 485 (7399), 517-521 (2012).
- Nishiyama, A., et al. Polydendrocytes (NG2 cells): multifunctional cells with lineage plasticity. Nat Rev Neurosci. 10 (1), 9-22 (2009).
- Franklin, R. J. M., Ffrench-Constant, C. Remyelination in the CNS: from biology to therapy. Nat Rev Neurosci. 9 (11), 839-855 (2008).
- Lucchinetti, C., et al. A quantitative analysis of oligodendrocytes in multiple sclerosis lesions. A study of 113 cases. Brain. 122 (Pt 12), 2279-2295 (1999).
- Patrikios, P., et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain. 129 (Pt 12), 3165-3172 (2006).
- Starost, L., et al. Extrinsic immune cell-derived, but not intrinsic oligodendroglial factors contribute to oligodendroglial differentiation block in multiple sclerosis. Acta Neuropathol. 140 (5), 715-736 (2020).
- Niu, J., et al. Aberrant oligodendroglial-vascular interactions disrupt the blood-brain barrier, triggering CNS inflammation. Nat Neurosci. 22 (5), 709-718 (2019).
- Plastini, M. J., et al. Transcriptional abnormalities in induced pluripotent stem cell-derived oligodendrocytes of individuals with primary progressive multiple sclerosis. Front Cell Neurosci. 16, 972144 (2022).
- Pisa, M., et al. Subclinical anterior optic pathway involvement in early multiple sclerosis and clinically isolated syndromes. Brain. 144 (3), 848-862 (2021).
- Vidal-Jordana, A., et al. Optical coherence tomography measures correlate with brain and spinal cord atrophy and multiple sclerosis disease-related disability. Eur J Neurol. 27 (11), 2225-2232 (2020).
- Stockwell, B. R. Ferroptosis turns 10: Emerging mechanisms, physiological functions, and therapeutic applications. Cell. 185 (14), 2401-2421 (2022).
- Thamizhoviya, G., Vanisree, A. J. Enriched environment enhances the myelin regulatory factor by mTOR signaling and protects the myelin membrane against oxidative damage in rats exposed to chronic immobilization stress. Neurochem Res. 46 (12), 3314-3324 (2021).
- Williams, R., et al. Pathogenic implications of iron accumulation in multiple sclerosis. J Neurochem. 120 (1), 7-25 (2012).
- Stojkovic, L., et al. Targeted RNAseq revealed the gene expression signature of ferroptosis-related processes associated with disease severity in patients with multiple sclerosis. Int J Mol Sci. 25 (5), 3016 (2024).
- Ziabreva, I., et al. Injury and differentiation following inhibition of mitochondrial respiratory chain complex IV in rat oligodendrocytes. Glia. 58 (15), 1827-1837 (2010).
- Aboul-Enein, F., et al. Preferential loss of myelin-associated glycoprotein reflects hypoxia-like white matter damage in stroke and inflammatory brain diseases. J Neuropathol Exp Neurol. 62 (1), 25-33 (2003).
- Halder, S. K., Milner, R. Hypoxia in multiple sclerosis; is it the chicken or the egg. Brain. 144 (2), 402-410 (2021).
- Langfelder, P., Horvath, S. WGCNA: an R package for weighted correlation network analysis. BMC Bioinformatics. 9, 559 (2008).
- Pisa, M., et al. Subclinical neurodegeneration in multiple sclerosis and neuromyelitis optica spectrum disorder revealed by optical coherence tomography. Mult Scler. 26 (10), 1197-1206 (2020).
- Lucchinetti, C., et al. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol. 47 (6), 707-717 (2000).
- Aboul-Enein, F., Lassmann, H. Mitochondrial damage and histotoxic hypoxia: a pathway of tissue injury in inflammatory brain disease. Acta Neuropathol. 109 (1), 49-55 (2005).
- Jhelum, P., et al. Ferroptosis mediates cuprizone-induced loss of oligodendrocytes and demyelination. J Neurosci. 40 (48), 9327-9341 (2020).
- Zhang, D., et al. Evidence of pyroptosis and ferroptosis extensively involved in autoimmune diseases at the single-cell transcriptome level. J Transl Med. 20 (1), 363 (2022).
- Luoqian, J., et al. Ferroptosis promotes T-cell activation-induced neurodegeneration in multiple sclerosis. Cell Mol Immunol. 19 (8), 913-924 (2022).
- Wu, T., et al. Role of ferroptosis in neuroimmunity and neurodegeneration in multiple sclerosis revealed by multi-omics data. J Cell Mol Med. 28 (10), e18396 (2024).
- Zeng, L., et al. Advances in research on immunocyte iron metabolism, ferroptosis, and their regulatory roles in autoimmune and autoinflammatory diseases. Cell Death Dis. 15 (7), 481 (2024).
- Neel, D. V., et al. Catching a killer: Mechanisms of programmed cell death and immune activation in Amyotrophic Lateral Sclerosis. Immunol Rev. 311 (1), 130-150 (2022).
- Liu, L., et al. Ferritinophagy-mediated hippocampus ferroptosis is involved in cognitive impairment in immature rats induced by hypoxia combined with propofol. Neurochem Res. 49 (7), 1703-1719 (2024).
- An, S., et al. HIF-1α induced by hypoxia promotes peripheral nerve injury recovery through regulating ferroptosis in DRG neuron. Mol Neurobiol. 61 (9), 6300-6311 (2024).
- Wang, L., et al. CXCR2 antagonism promotes oligodendrocyte precursor cell differentiation and enhances remyelination in a mouse model of multiple sclerosis. Neurobiol Dis. 134, 104630 (2020).
- Merelli, A., et al. Understanding the role of hypoxia inducible factor during neurodegeneration for new therapeutics opportunities. Curr Neuropharmacol. 16 (10), 1484-1498 (2018).
- Huang, L., et al. miR19b-3p promotes the growth and metastasis of colorectal cancer via directly targeting ITGB8. Am J Cancer Res. 7 (10), 1996-2008 (2017).
- Li, J., et al. Exosomal circDNER enhances paclitaxel resistance and tumorigenicity of lung cancer via targeting miR-139-5p/ITGB8. Thorac Cancer. 13 (9), 1381-1390 (2022).
- Mazaheri, N., et al. Ameliorating effect of osteopontin on H2O2-induced apoptosis of human oligodendrocyte progenitor cells. Cell Mol Neurobiol. 38 (4), 891-899 (2018).
- Milner, R., et al. Fibronectin- and vitronectin-induced microglial activation and matrix metalloproteinase-9 expression is mediated by integrins alpha5beta1 and alphavbeta5. J Immunol. 178 (12), 8158-8167 (2007).
- Hrastelj, J., et al. CSF-resident CD4+ T-cells display a distinct gene expression profile with relevance to immune surveillance and multiple sclerosis. Brain Commun. 3 (3), fcab155 (2021).
- Yan, L., Cui, Z. Integrin β1 and the repair after nervous system injury. Eur Neurol. 86 (1), 2-12 (2023).
- Birkner, K., et al. β1-Integrin- and KV1.3 channel-dependent signaling stimulates glutamate release from Th17 cells. J Clin Invest. 130 (2), 715-732 (2020).
- Zhang, Q., et al. Sp1-mediated upregulation of Prdx6 expression prevents podocyte injury in diabetic nephropathy via mitigation of oxidative stress and ferroptosis. Life Sci. 278, 119529 (2021).
- Hadi, N., et al. Study of the correlation between miR-106a, miR-125b, and miR-330 on multiple sclerosis patients by targeting TNFSF4 and SP1 in NF-кb/TNF-α pathway: A case-control study. Cell J. 24 (7), 403-409 (2022).
- Asbelaoui, N., et al. Interplay between androgen and CXCR4 chemokine signaling in myelin repair. Acta Neuropathol Commun. 12 (1), 18 (2024).
- Kaddatz, H., et al. Cuprizone-induced demyelination triggers a CD8-pronounced T cell recruitment. Glia. 69 (4), 925-942 (2021).
- Wang, W., et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy. Nature. 569 (7755), 270-274 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved