Method Article
EEG 기록 중 쥐의 측면 꼬리 정맥에서 뇌척수액 및 혈액 샘플링
요약
이 프로토콜은 지속적인 비디오 뇌전도(EEG) 모니터링과 병행하여 수행된 간질 쥐의 반복적인 뇌척수액 및 혈액 수집을 보여줍니다. 이는 다양한 체액 분자의 변화와 발작 활동 사이의 가능한 연관성을 탐구하는 데 도움이 됩니다.
초록
체액의 조성은 많은 생리학적 및 병리학적 역학을 반영하기 때문에 생물학적 액체 샘플은 일반적으로 호르몬, 성장 인자, 단백질 또는 작은 비암호화 RNA와 같은 관심 분자를 측정하기 위해 많은 실험 맥락에서 얻어집니다. 구체적인 예는 간질에 대한 바이오마커 연구에서 생물학적 액체의 샘플링입니다. 이러한 연구에서는 뇌척수액(CSF)과 혈장 내 분자 수준을 비교하고, 뇌척수액과 혈장을 병렬로 채취하고, 발작 시 샘플링까지의 시간 거리를 고려하는 것이 바람직합니다. 뇌척수액과 혈장 샘플링을 결합한 이 연구는 뇌전증 동물의 비디오-EEG 모니터링과 결합되어 추정 진단 및 예후 바이오마커의 검증을 위한 유망한 접근법입니다. 여기에서, 지속적으로 비디오 EEG를 모니터링하는 간질 쥐의 수조 마그나에서 뇌척수액을 채취하고 측면 꼬리 정맥에서 혈액을 샘플링하는 과정을 결합하는 절차를 설명합니다. 이 절차는 일반적으로 사용되는 다른 기술에 비해 상당한 이점을 제공합니다. 통증이나 침습을 최소화하고 마취 시간을 단축하면서 신속한 샘플링이 가능합니다. 또한 테더 및 원격 측정 EEG 기록 쥐 모두에서 CSF 및 혈장 샘플을 얻는 데 사용할 수 있으며 여러 날의 실험에 걸쳐 반복적으로 사용할 수 있습니다. 이소플루란 마취를 단축하여 샘플링으로 인한 스트레스를 최소화함으로써 생체 유체에서 조사된 분자의 실제 수준을 보다 정확하게 반영할 수 있을 것으로 기대됩니다. 적절한 분석 분석의 가용성에 따라 이 기술은 EEG 기록을 동시에 수행하면서 여러 개의 다른 분자 수준을 측정하는 데 사용할 수 있습니다.
서문
뇌척수액(CSF)과 혈액 채취는 전임상 및 임상 연구 모두에서 뇌전증의 바이오마커를 식별하고 검증하는 데 중요합니다 1,2. 오늘날 뇌전증의 진단과 뇌전증 바이오마커에 대한 대부분의 연구는 EEG 및 신경영상에 초점을 맞추고 있습니다 3,4,5. 그러나 이러한 접근 방식에는 몇 가지 제한 사항이 있습니다. 일상적인 두피 측정 외에도 많은 경우 EEG는 깊이 전극6과 같은 침습적 기술을 필요로 한다. 뇌 영상 기법은 시간적, 공간적 해상도가 낮고 상대적으로 비용과 시간이 많이 든다 7,8. 이러한 이유로, 비침습적, 저비용, 생체유체 기반 바이오마커의 식별은 매우 매력적인 대안을 제공할 것입니다. 또한 이러한 생체 유체 바이오마커를 사용 가능한 진단 접근법과 결합하여 예측성을 높일 수 있습니다.
뇌전증 진단을 받은 환자는 일상적으로 EEG 9,10 및 혈액 샘플링 11,12,13,14 을 시행하며, 많은 경우 생명을 위협하는 원인(예: 급성 감염, 자가면역 뇌염)을 배제하기 위해 뇌척수액 중단을 시행한다15. 이 혈액 및 CSF 샘플은 간질에 대한 바이오마커를 식별하기 위한 임상 연구에 사용할 수 있습니다. 예를 들어, Hogg와 동료들은 인간 간질에서 발작이 일어나기 전에 3개의 혈장 tRNA 단편이 증가한다는 것을 발견했다14. 마찬가지로, 인간 뇌척수액과 혈청의 인터루킨-1베타(IL-1β) 수치는 혈청 대비 뇌척수액의 IL-1β 수치의 비율로 표현되며, 외상성 뇌손상 후 외상 후 뇌전증 발병을 예측할 수 있다16. 이러한 연구는 뇌전증 바이오마커 연구를 위한 생체유체 샘플링의 중요성을 강조하지만, 혈액 내 항간질제(AED)의 공동 설립 인자, 병인 정보의 빈번한 부족, 부적절한 대조군, 적당한 수의 환자 수 등 임상시험에 내재된 여러 가지 한계에 직면해 있습니다17,18.
전임상 연구는 뇌전증에 대한 잠재적인 바이오마커로서 생체 유체의 분자를 조사할 수 있는 다른 기회를 제공합니다. 실제로, EEG 기록을 수행하는 동안 동물에서 혈장 및/또는 CSF를 추출할 수 있습니다. 또한, 샘플링은 실험의 여러 날에 걸쳐 반복적으로 수행될 수 있으며, 연구의 견고성을 향상시키기 위해 여러 연령, 성별 및 간질 모욕 일치 대조군을 사용할 수 있습니다. 여기에서, EEG 모니터링 쥐의 꼬리 정맥에서 혈장을 병렬로 인출하여 수조 마그나에서 CSF를 얻는 유연한 기술이 자세히 설명되어 있습니다. 제시된 기술은 대체 방법에 비해 몇 가지 장점이 있습니다. 나비 바늘 접근법을 사용하면 뇌파 전극 또는 이와 유사한 머리 임플란트의 기능을 손상시키지 않고 뇌척수액을 여러 번 채취할 수 있습니다. 이는 상대적으로 높은 감염 위험과 관련된 척수강내 카테터 제거 절차의 개선을 나타냅니다. 또한, 채혈에 사용되는 보고된 자유 낙하 접근 방식은 혈액이 튜브를 통과하지 않고 진공 압력이 가해지지 않기 때문에 용혈 위험이 크게 감소하기 때문에 꼬리 정맥 혈액 인출의 다른 접근 방식보다 우수합니다. 세균이 없는 엄격한 조건에서 수행하면 동물의 감염 위험이 특히 낮습니다. 또한 동물의 꼬리 끝에서 혈액 채취를 시작하여 샘플링을 여러 번 반복할 수 있습니다. 이러한 기술은 마스터하기 쉽고 중추 신경계 장애에 대한 많은 전임상 연구에 적용될 수 있습니다.
프로토콜
모든 실험 절차는 실험 및 기타 과학적 목적으로 사용되는 동물의 보호에 관한 1986년 11월 24일 유럽 공동체 위원회 지침(86/609/EEC)에 설명된 지침에 따라 페라라 대학교 기관 동물 관리 및 사용 위원회와 이탈리아 보건부(승인: DM 603/2022-PR)의 승인을 받았습니다. 이 프로토콜은 쥐 CSF의 작은 비코딩 리보핵산(sncRNA) 및 간질 동물의 EEG 제어 하에 얻은 혈장의 추가 정량적 중합효소연쇄반응(qPCR) 분석을 위해 특별히 조정됩니다. 선택에 따라 수술에 대한 더 나은 이해와 개선을 위해 관련 JoVE 비디오를 참조하십시오 19,20,21.
1. 전극 또는 텔레미터의 외과적 이식을 위한 동물의 준비
참고: 입체 수술 기법은 사용되는 EEG 시스템에 따라 다릅니다. 다음 방법 섹션에서는 두 가지 유형의 수술에 공통적으로 적용되는 단계에 대해 설명합니다.
- Sprague-Dawley(SD) 쥐(수컷, 생후 7-8주, 체중 250-290g)를 실험실 동물의 관리 및 사용에 대한 현지 법률에 따라 유지 관리하십시오. 음식과 식수를 무료로 이용할 수 있는 표준 조건에서 동물을 수용합니다.
- 수술 전 며칠 동안 쥐를 다루고 실험 프로토콜 절차를 진행하십시오.
- 전극 또는 텔레미터 이식을 위해 입체 탁 장치를 사용하십시오. 무균 수술에 대한 최신 표준을 따르십시오. 멸균되고 잘 작동하는 전극과 트랜스미터를 사용하십시오.
- 전기 면도기로 동물의 머리를 면도하십시오. 케타민(45mg/kg)과 자일라진(7.5mg/kg)의 혼합물을 복강내(i.p.)로 투여하여 동물의 마취를 유도한 다음, 안면 마스크를 통해 전달되는 이소플루란 마취제(공기 중 1.4%, 1.2mL/분)를 넣고 동물의 머리를 입체장치에 고정합니다.
- 두 동물의 뒷발을 발바닥이 꼬집은 후 페달 인출 반사를 테스트하여 적절한 마취 깊이를 보장하고 수술이 끝날 때까지 이소플루란 마취를 유지합니다. 시술 기간 내내 마취 깊이를 정기적으로 확인하십시오.
- 마취로 인한 눈 깜빡임 반사 손실로 인한 각막 손상을 방지하기 위해 두 동물의 눈에 충분한 양의 눈 연고를 바릅니다.
- 액체 소독제로 동물의 두피를 철저히 청소하고 멸균 메스를 사용하여 세로 2cm 길이로 자릅니다. 두피를 열고 피부 피판에 수술용 클립을 붙여서 두피를 열어 둡니다.
- 부드럽게 골막을 분리하여 브레그마와 기록 전극이 삽입될 두개골 영역을 노출시킵니다.
2. 테더 전극의 외과적 이식
참고: 이 프로토콜의 천자 뇌척수액 인출 절차를 수립하기 전에(자세한 내용은 9단계 참조), 자유롭게 움직이는 마취되지 않은 쥐 몇 마리에서 가이드 캐뉼라를 통해 뇌척수액 인출을 반복했습니다. 다중 CSF 샘플링과 결합된 장기 EEG 기록에 대한 이중 머리 임플란트의 영향을 평가하기 위해 테더 전극이 이식된 캐뉼레이션 동물을 사용했습니다. 이러한 특정 실험에서, 쥐는 이전에 발표된 프로토콜22에 따라 정위적으로 7mm 깊이로 삽입된 더미 가이드 캐뉼라를 수조 마그나에 이식했습니다. 이중 임플란트 수술 접근법은 과거에 미세투석 가이드 캐뉼라 및 테더 전극 이식을 위해 일부 작업자가 채택한 것과 유사했다23,24.
- 입체 프레임의 한쪽 암을 사용하여 전극 홀더를 그 위에 장착하고 전극을 홀더에 똑바로 세웁니다. 전극 끝을 브레그마 바로 위로 이동합니다. bregma의 전후 및 내측 좌표를 적어 원하는 좌표로 변환합니다.
- 끝이 두개골에 거의 닿을 때까지 전극을 내립니다. 드릴링 지점을 표시하고 표시된 지점에 두개골을 뚫습니다. 뇌와 수막이 손상되지 않도록 주의하십시오.
- 나사를 고정하기 위해 4개 이상의 구멍을 만들고 두개골에 나사로 고정합니다. 나사 고정용 구멍을 만들 때 전극의 크기에 주의하십시오. 전극 크기는 위치가 지정된 고정 나사를 방해하지 않아야 합니다.
- 등쪽 축에 전극을 운반하는 정위 팔을 천천히 내리고 뇌 조직에 들어가 원하는 위치에서 멈춥니다. 두개골에 나사로 고정된 나사 중 하나에 전극 접지선을 고정합니다.
- 메타크릴 시멘트를 전극에 놓고 전극 받침대 높이의 약 절반을 차지하는 나사를 조입니다. 테더링 와이어의 끝단에 맞는 전극의 위쪽 절반 부분은 맨 상태로 둡니다.
- 홀더에서 전극을 분리하고 정위 암을 올립니다. 동물을 입체 장치에서 풀어주고 수술 후 관리를 하십시오.
- 동물을 별도의 회복 케이지에 넣고 깨어나 보행할 수 있을 때까지 10분마다 관찰하십시오. 동물을 표준 사육장으로 돌려보내고 완전히 회복된 후에만 마취되지 않은 다른 동물의 회사로 돌려보냅니다.
3. 텔레미터의 외과적 이식
알림: 멸균 텔레미터만 사용하십시오. 원격 측정기를 재사용하는 경우 제조업체 지침에 따라 수술 전에 세척하고 멸균하십시오. 이 프로토콜에서는 EEG 기록을 위한 DSI(Data Science International) 텔레미터가 사용되었습니다.
- 자석을 사용하여 원격 측정 송신기를 켜고 AM 주파수 라디오로 신호를 테스트합니다. 수술 전에 강하고 명확한 신호를 확인하십시오. 필요한 경우 제대로 작동하지 않는 텔레미터를 폐기하십시오.
- 원격 측정기 리드를 성인 쥐에 대한 최적의 길이로 줄여 준비합니다. 두 개의 (음극 및 양극) 리드의 실리콘 코팅을 벗겨내어 약 5mm의 나선형 강철 리드를 노출시킵니다. 리드 끝에 길이 약 2mm, 너비 1mm의 고리 모양의 핸들을 만듭니다.
- 동물의 옆구리를 왼쪽 어깨 아래와 뒤쪽으로 면도합니다. 안정화된 과산화물과 4차 암모늄 활성을 기반으로 한 소독제로 수술 부위를 소독합니다. 소독제가 15분 동안 작동하도록 합니다.
- 동물의 어깨 바로 뒤에 약 2cm의 측면 절개를 하고 송신기 배치를 위한 약 5cm3 공간의 피하 주머니를 만듭니다. 트랜스미터를 몸체의 장축과 평행하게 놓고 리드가 방향을 향하도록 합니다.
- 송신기를 3-0 면 봉합사로 피하 주머니의 내벽에 고정합니다. 끝이 뭉툭한 가위를 사용하여 동물의 옆구리와 목을 관통하는 피하 터널(길이 약 2.5cm)을 만들어 송신기 주머니를 1.6단계에서 동물의 두피에 있는 정중선 절개와 연결합니다.
- 양쪽 텔레미터 리드를 겸자로 잡고 터널을 통해 위로 당겨 두피 절개 출구에서 튀어나오도록 합니다. 상처 클립으로 두피 절개 부위에서 리드를 잡아냅니다.
- 입체 프레임을 사용하여 양극(빨간색) 리드에 대해 원하는 좌표를 개별화하고 양극 리드 팁의 두개골에 구멍을 뚫습니다(2.1단계와 유사). 나사를 연단에 위쪽으로 고정하기 위한 구멍을 하나 더 만들고 두개골에 나사로 고정합니다.
- 양극 납 끝을 두개골과 경막 아래에 삽입하고 뇌 표면에 눕힙니다. 음극(흰색) 리드의 고리 끝을 나사에 연결합니다. 양극 납 배출구와 음극 납 주위에 소량의 메타크릴 시멘트를 넣어 두개골에 고정시킵니다.
- 3-0면 봉합사로 두개골 피부의 내벽에 리드를 고정합니다. 고정 리드와 고정 봉합사가 뇌척수액 인출 부위(즉, 후두부 돌출부와 아틀라스 척추 사이에 마름모꼴 모양이 있는 함몰 표면)를 방해하지 않는지 확인하십시오.
- 3-0 면 봉합사를 사용하여 두피 절개와 옆구리 절개 부위를 봉합합니다. 상처에 소독제를 바른다. 이것들이 마른 후에만 봉합된 상처에 항생제 크림을 바른다.
4. 수술 후 관리
- 수술 후 약 1시간 동안 동물을 똑바로 세우고 케이지 주위를 움직일 때까지 모니터링합니다. 저체온증을 방지하기 위해 보온 패드에 보관하십시오. 감염을 예방하기 위해 전신 항생제를 동물에게 투여하고 수술 후 통증을 예방하기 위해 2-3일 동안 전신 진통제를 투여합니다.
- 수술 후 쥐가 최소 7일 동안 회복할 수 있도록 하십시오. 3일 동안 적어도 하루에 한 번 동물을 모니터링하여 통증이나 괴로움의 징후가 있는지 확인합니다.
5. 쥐의 상태 간질 유도
참고: 쥐에서 간막 측두엽 간질(mTLE)을 재현하는 데 필요한 상태 간질(SE) 유도에 대한 자세한 프로토콜은 Guarino et al.25를 참조하십시오.
- 수술 후 일주일 회복 후 동물을 무작위로 그룹에 배정합니다: (i) 비히클을 투여받은 대조군 동물과 (ii) 필로카르핀을 투여받을 간질 동물. 간질 그룹에는 비례적으로 더 많은 수의 동물을 사용하는데, 필로카르핀을 투여한 모든 쥐가 생존하거나 SE를 개발하는 것은 아니기 때문입니다.
- SE 유도 전날, 동물에게 0.9% 식염수(3M)에 용해된 염화 리튬 127mg/kg을 위 위축에 의해 1mL/kg의 부피로 투여합니다. SE 발병까지의 시간 변동성을 줄이기 위해 SE 유도 약 14시간 전에 필로카르핀 효능26을 증가시키는 동물의 리튬을 투여한다.
- 리튬 투여 후 약 14시간 후 쥐에게 메틸 스코폴라민(1mg/kg, 피하)을 1회 주사합니다.
- 메틸 스코폴라민 투여 후 정확히 30분 후 쥐에게 필로카르핀(50mg/kg, ip)을 1회 주사하여 SE를 유도합니다. 메틸 스코폴라민과 비히클(0.9% NaCl 용액)을 투여하여 쥐를 대조군하게 합니다.
- 필로카르핀 주사는 동물의 전형적인 행동을 유도합니다: 초기 부분 발작(필로카르핀 투여 후 5분 이내에 진동과 고개를 끄덕이는 움직임)이 25-30분 이내에 재발성 전신 경련(SE)으로 발전합니다. 30분 이내에 SE가 발생하지 않는 쥐의 경우 필로카르핀(25mg/kg, ip)을 추가로 투여하고 여전히 SE가 발생하지 않으면 연구에서 제외합니다(SE 무반응자).
- 필로카르핀 주사 직후부터 5분마다 쥐의 발작 행동을 관찰하고 점수를 매깁니다. 27점을 매기기 위해 라신 척도를 사용하십시오.
- 디아제팜(10mg/kg), 페노바르비탈(25mg/kg) 및 스코폴라민(1mg/kg)과 같은 약물 칵테일을 i.p. 투여하여 발병 후 2시간 후에 SE를 중단합니다.
- 4시간 후에 쥐에게 이 칵테일을 다시 주십시오. 마지막으로, 또 다른 4 시간 후, 완전히 발작 활동을 멈추기 위하여 쥐 i.p. 약물의 마지막 혼합물 (diazepam 10 mg / kg 플러스 스코폴라민 1 mg / kg)을 제공합니다.
- 동물에게 식염수(0.9% NaCl 용액 1mL, pH를 7.0으로 조정)를 주입하고 SE 후 2-3일 동안 10% 자당 용액을 먹여 SE에 따른 체중 감소로부터 회복을 촉진합니다.
- SE 이후 생존 동물을 특정 실험 프로토콜의 요구 사항에 따라 다른 실험 그룹에 무작위로 할당합니다. 간질 쥐에 대한 추가 실험을 위해 다음 포함/제외 기준을 사용하십시오: 필로카르핀 투여 후 1시간 이내에 경련성 SE의 발달, SE 후 첫 주에의 체중 증가, EEG 등록을 위한 뇌 관심 영역에서 전극의 올바른 위치25.
6. 간질 쥐의 테더 비디오 EEG 및 발작 활동 분석
참고: 이 섹션에서는 표준 조건에서 자유롭게 움직이는 단일 하우징 쥐의 EEG 신호를 기록하는 실험 절차에 대해 설명합니다. 케이지에는 동물이나 녹음 케이블이 끼일 수 있는 물체가 포함되어서는 안 됩니다. 해결해야 할 과학적 질문에 따라 몇 가지 매개변수를 분석할 수 있습니다. 간질 연구의 경우 전기 및 운동 발작을 인식하기 위해 EEG 흔적을 검사합니다. 발작을 식별하는 데 사용되는 가장 일반적인 매개변수는 발작성 전기 활동의 진폭, 빈도 및 지속 시간입니다.
- 동물을 녹음실의 깨끗한 케이지에 넣어 습관을 들이고 새로운 환경으로 인한 스트레스를 줄이십시오. 환경 전자기장으로 EGG 신호가 오염되지 않도록 동물의 케이지를 패러데이 케이지에 넣으십시오.
- 녹음 케이블의 한쪽 끝을 녹음 장치에 연결합니다. 전압계를 사용하여 전위를 측정하고 접지 전극과 기준 전극을 구별합니다.
- 녹음 케이블의 다른 쪽 끝을 쥐의 머리에 고정된 전극에 연결합니다. 이를 위해 케이블 플러그를 전극 커넥터에 삽입할 때 동물의 머리에 시멘트 덮개를 잡고 쥐의 머리에 압력을 가하지 마십시오.
- 녹음 케이블의 무게를 상쇄하여 동물이 자유롭게 움직일 수 있도록 하면서 케이블이 꼬일 위험을 방지합니다. 이렇게하려면 균형 잡힌 암 또는 정류자를 사용하십시오. 녹음 케이블이 균형을 이루더라도 동물이 먹이에 닿기 위해 올라와야 하는 먹이 홀더 대신 케이지 안에 음식을 넣으십시오.
- 등록을 시작하기 전에 EEG에서 데이터를 수집하고 처리하는 데 사용되는 모든 설정을 확인하십시오.
알림: 이 프로토콜은 EEG 기록을 수행하는 데 필요한 장치에 대한 소개를 제공하지 않지만 적절한 필터링 및 sampEEG 신호의 아티팩트와 노이즈를 피하기 위해 속도를 적용해야 합니다.- 일상적인 실험의 경우 샘플링 속도를 500Hz로 설정하고 증폭 게인을 5000x로 설정합니다. 0.005Hz 필터와 노치 필터를 함께 사용하여 신호를 필터링하여 50Hz 대역에서 주변 전기 활동을 제거합니다(유럽 국가에만 해당).
- 비디오 및 EEG 기록을 모두 시작하고 시간 동안 특정 주파수 대역의 전력을 확인하여 트레이스가 예상 EEG 신호와 일치하는지 확인합니다. 동물에 대한 개입을 시작하기 전에 기준 기간을 기록하십시오.
- 동물과 EEG 흔적을 주기적으로 확인하십시오. 녹음 케이블이 쥐 머리의 전극 커넥터에서 분리되는 것은 드문 일이 아닙니다. 이 경우 쥐 머리의 전극을 기록 케이블에 다시 연결하고 EEG 신호가 깨끗한지 확인하십시오.
- 상업적으로 이용 가능한 소프트웨어를 사용하여 EEG 신호를 수동 또는 자동으로 분석합니다. 수동으로 분석하는 경우 EEG 기록을 통해 스크리닝하여 발작과 유사한 활동을 식별합니다. 소프트웨어를 사용하려는 경우 진폭, 주파수 및 전기 활동 지속 시간과 같은 발작 이벤트의 주요 매개변수를 구성합니다.
참고: 단일 발작은 진폭이 기준선보다 3배 높고, 주파수가 5Hz 이상이며, 지속 시간이 최소 5초인 전기적 활동을 특징으로 할 수있습니다 22. - 어떤 방법을 사용하든 뇌파와 동시에 수집된 동기화된 영상 녹화를 확인하여 잠재적인 경련 발작을 확인합니다.
7. 간질 쥐의 원격 측정 비디오 EEG 및 발작 활동 분석
참고: 이 섹션에서는 표준 조건에서 자유롭게 움직이는 단일 하우징 쥐에서 방사선 원격 측정 EEG 신호를 기록하는 실험 절차에 대해 설명합니다. 이 프로토콜은 상업적으로 이용 가능한 텔레메트리 시스템을 기반으로 합니다. 그러나 여러 원격 측정 시스템은 기능 및 기술 사양이 약간 다릅니다. 시스템은 실험실 요구 사항 및 연구 목표에 따라 선택해야 합니다.
- 신호 수신기 위에 동물 사육장을 놓습니다. 신호 수신기를 데이터 수집 시스템에 연결하고 이를 수집 소프트웨어가 있는 컴퓨터에 연결합니다.
- 쥐 옆구리에 삽입된 텔레미터 근처에 자석을 배치하여 무선 주파수 원격 측정 임플란트를 켭니다. 무선 장치를 사용하여 신호를 테스트합니다. 범용 무선 장치를 사용하여 텔레미터를 테스트하고 텔레미터가 활성화되었음을 나타내는 명확한 신호음이 들리고 지글지글 소리가 들리면 텔레미터가 비활성화되었음을 나타냅니다.
알림: 녹음 시간을 정의하기 전에 무선 주파수 송신기 배터리의 수명을 고려해야 합니다. - 수집 소프트웨어를 설정하고 원격 측정 신호와 비디오 시스템을 동기화하여 EEG 및 비디오 데이터를 동시에 수집합니다. 이식된 각 송신기에 하나의 신호 수신기를 할당하고 송신기의 교정 값을 설정합니다. 샘플링 속도를 1000Hz로, 노이즈 감지를 -500mV에서 +500mV 사이로, 적분 간격을 100ms로 설정합니다. 저역 및 고역 통과 필터를 사용하지 마십시오.
- 원격 분석 및 비디오 녹화를 시작합니다. 간질과 유사한 활동을 획득하기 전에 장기 기준선 기록을 수행하십시오. 6.8 및 6.9 단계에서 설명한 대로 EEG 신호를 분석합니다.
8. 꼬리 정맥에서 혈액을 채취하는 절차
메모. 진공 채혈 시스템은 나비 바늘(23G x 3/4 x 12(0.8mm x 19mm x 305mm))로 구성됩니다. 채혈 기술은 한 명의 작업자가 쉽게 수행할 수 있으며 절차는 약 5분이 소요됩니다.
- 철수 직전에 버터플라이 바늘과 튜브를 증류수에 1% K2EDTA로 코팅합니다(즉, 1mL 주사기를 사용하여 시스템에서 K2EDTA 용액을 흡입하고 배출합니다). 흡인 없이 혈액을 한 방울씩 채취하기 위해 바늘 바로 뒤에 있는 튜브를 자릅니다(그림 1A).
- 쥐를 유도 챔버에 넣고 이소플루란(공기 중 1.4%, 1.2mL/분)으로 마취합니다. 입체 프레임으로 전환하고 안면 마스크를 통해 마취를 유지합니다. 발열 패드를 동물 아래에 놓고 꼬리의 일부가 패드와 직접 접촉하도록 합니다.
- 측면 꼬리 정맥이 상단에 유지되도록 동물의 등을 옆으로 부드럽게 움직입니다.
- 꼬리를 따뜻한 물(42°C)에 2분 동안 담가 측면 정맥을 확장시킵니다. 정맥이 더 잘 보이도록 70% 에탄올로 꼬리를 닦습니다. 일반 백열 전구를 사용하여 꼬리에 따뜻한 빛을 비추십시오.
- 21G 나비 바늘을 깊이 5mm, 각도 20°로 측면 꼬리 정맥에 삽입합니다. 항응고제로 5mg K2EDTA가 포함된 500μL 진공 수집 튜브에 혈액을 수집합니다(그림 1B,C).
- 바늘을 제거하고 천자 부위에 압력을 가하여 혈액의 흐름을 멈춥니다. 쥐를 집 우리로 돌려보냅니다.
- 튜브를 부드럽게 뒤집어 혈액 내 항응고제를 혼합합니다. 수집 튜브를 수용하기 위해 얼음에 약 1.5cm 깊이의 구멍을 뚫습니다. 샘플을 얼음 위에 부드럽게 수직으로 놓습니다.
- 혈액 샘플을 1300 x g 의 냉장 원심분리기(4°C)에서 10분 동안 원심분리하여 혈장을 분리합니다. 최대 1시간 이내에 이 절차를 수행하십시오.
- 적혈구층과 백혈구층을 피하면서 약 200μL의 혈장을 채취합니다. 회수된 혈장을 0.2mL 멸균 마이크로튜브에 넣습니다. 필요한 경우 원심분리 후 4°C에서 최대 1시간 동안 보관하십시오.
- 품질 관리를 위해 5μL의 샘플을 따로 보관합니다. 분석할 때까지 샘플을 -80°C에서 보관하십시오.
참고: 일부 연구자가 권장하더라도 진공을 사용하지 마십시오28 또는 더 많은 혈액을 얻기 위해 8.5 단계에서 설명한 절차 중에 꼬리를 착유하면 다음 sncRNA 정량 분석을 위한 샘플 품질이 저하됩니다(자세한 내용은 대표 결과 참조). 랫드에서 한 번에 뽑아낼 수 있는 최대 혈액량은 총 혈액량의 <10%(즉, 250-300g의 랫트의 경우 약 1.6-1.9mL)이며, 1개월 동안 총 혈액량의 <15%(약 2.64mL)이다29. 이 프로토콜에서는 단일 동물에서 최대 5 회 동안 단일 경우에 최대 500 μL의 혈액 수집이 사용됩니다30,31.
9. 뇌척수액 채취 절차
메모. 이 기술은 한 명의 작업자가 쉽게 수행할 수 있으며 절차에는 약 2-4분이 소요됩니다. 뇌척수액 채취에 사용되는 재료는 저렴한 일회용 진공 버터플라이 바늘과 추출 튜브입니다. 이 프로토콜에서는 진공을 생성하기 위해 멸균 주사기에 연결된 나비 날개 주입 세트가 사용됩니다(그림 2A).
- 23G 나비 바늘을 준비하고 플라스틱 슬리브 보호 장치를 절단하여 맨 바늘의 끝이 7mm 노출되도록 하여 인출 중에 수조 마그나에 7mm 이상 침투하지 않도록 합니다(그림 2B).
- 폴리머 튜브가 장착된 버터플라이 바늘을 1mL 주사기에 연결합니다.
- 쥐를 유도 챔버에 넣고 이소플루란(공기 중 1.4%, 1.2mL/분)으로 마취합니다. 이소플루란 흐름을 입체 프레임으로 전환하고 안면 마스크를 통해 전달되는 마취를 유지합니다. 면도칼로 쥐의 뒷머리와 목에 있는 털을 제거합니다.
- 귀 막대로 쥐의 머리를 고정하십시오. 동물의 머리를 수직으로 약 45° 아래로 내리고 입체 프레임의 코 막대 아래로 이동합니다(그림 2C). 동물의 뒷머리를 검사하고 후두부 돌출부와 아틀라스 척추 사이에 마름모꼴 측면이 있는 약간 움푹 들어간 표면을 찾습니다.
- 이 표면을 70% 에탄올로 문질러 더 잘 보이게 하고 소독하십시오.
- 나비 바늘을 마름모꼴 모양의 함몰된 표면의 중앙에 수직으로 삽입하여 바늘의 플라스틱 슬리브 보호 크기로 절단하여 움직임이 차단될 때까지 CSF 수집을 위해 수조 마그나에 삽입합니다(그림 2D). 1mL 주사기 피스톤을 부드럽게 당겨 뇌척수액이 바늘을 통해 천천히 흐르도록 합니다.
- 약 100μL의 CSF를 폴리머 튜브에 수집합니다(그림 2D). 혈액이나 기타 눈에 보이는 오염이 들어가지 않도록 하십시오. 폴리머 튜브를 나비 바늘에 매우 가깝게 꼬집고 이 지점에서 튜브를 자릅니다.
- 투명한(오염되지 않은) 샘플을 주사기에 넣습니다. 눈에 보이는 오염이 수집 튜브에 들어가면 오염된 샘플을 폐기하십시오.
- 시료를 멸균된 0.2mL 마이크로튜브로 배출하고 얼음 위에서 최대 1시간 동안 보관합니다.
- 동물의 머리에 있는 뇌척수액 철수 부위를 소독합니다. 입체 프레임에서 쥐를 꺼내 다시 케이지에 넣습니다.
- 품질 관리를 위해 2μL의 샘플을 따로 보관합니다. 추가 분석을 위해 나머지 샘플은 -80°C에서 보관합니다.
참고: 랫트의 경우, 여러 번의 뇌척수액 인출이 반복적으로 수행되는 경우, 각 수집에서 회수되는 권장 부피는 100 μL32입니다. 이 프로토콜에서는 단일 동물에서 15일 동안 최대 5배의 최대 회수율과 함께 한 번에 최대 100μL의 CSF를 수행했습니다.
10. 샘플의 품질에 대한 분광 광도계 분석
참고: CSF 및 혈장 시료를 적절하게 채취한 후 시료는 분광광도계 분석을 위한 준비가 되었으며 특정 취급이 필요하지 않습니다. 414nm에서 UV 분광광도계로 헤모글로빈 흡광도를 측정하여 샘플의 용혈 위험을 평가합니다. 쥐 샘플에서 0.25의 차단 흡광도 값을 사용합니다. 이 한계의 선택은 후속 qPCR 분석 및 sncRNA 정량화에 대한 특정 요구 사항에 따라 달라질 수 있습니다.
- UV 분광 광도계를 켭니다. PLASMA 또는 CSF에 대해 414nm의 단일 파장에서 흡광도 측정 방법을 선택합니다. 다음을 클릭합니다.
- 정제수로 1mm 큐벳을 헹굽니다. 5μL의 70% 에탄올을 큐벳 측정 지점에 넣습니다. 종이 타월로 말리고 보푸라기가 없는 티슈 페이퍼로 문지릅니다. 완벽하게 투명한지 확인하십시오.
- 정제수 1.5μL를 1mm 큐벳에 넣고 닫습니다. 큐벳을 분광광도계의 측정 챔버에 삽입하고 Blank 버튼을 클릭하여 blank 샘플 흡광도를 측정합니다. 414nm에서의 흡광도 값이 0.000인지 확인합니다.
- 종이 타월로 큐벳을 말리고 보푸라기가 없는 티슈 페이퍼로 청소합니다. 완벽하게 투명한지 확인하십시오.
- 시료 1.5μL를 1mm 큐벳에 넣고 닫습니다. 큐벳을 분광 광도계의 측정 챔버에 삽입합니다. Sample 버튼을 클릭하여 샘플을 측정합니다. 414nm에서 샘플의 흡광도를 확인하고 주석을 답니다.
- 사용 가능한 모든 샘플에서 헤모글로빈 흡광도를 정량화합니다. 플라즈마 또는 CSF 샘플보다 먼저 블랭크 시료를 측정하고 Blank 및 Sample 버튼을 번갈아 클릭합니다.
- -80°C에서 A414nm < 0.25인 샘플을 보존하고 A414nm가 0.25> 경우 샘플을 폐기합니다.
- 1mm 큐벳을 정제수와 70% 에탄올로 순차적으로 헹굽니다. 큐벳을 말리십시오.
- 먼지가 쌓이지 않도록 빈 큐벳을 측정 챔버로 닫습니다. 분광 광도계를 끕니다.
결과
9명의 대조군과 18마리의 만성 간질 쥐에서 수행된 다양한 CSF 및 혈액 인출 절차의 결과는 모두 SE 후 1개월에 전극을 이식한 것으로 성공률 측면에서 보고됩니다. 이식 후, 모든 쥐는 1개월 동안 비디오 EEG를 모니터링했으며, 그 동안 실험의 마지막 2주 동안(즉, SE 후 52, 55, 58, 61 및 64일, dpSE) 3일마다 CSF와 혈액을 5회 인출했습니다. 서로 다른 동물에서 여러 번 인출한 데이터를 사용하여 쌍두종 임플란트 부여 쥐(뇌척수액 인출을 위해 캐뉼레이션)의 뇌척수액 채취 성공률과 테더 또는 원격 측정 전극을 이식한 동물에서만 뇌척수액 채취 성공률(수조 마그나 천자에 의해 수행)을 비교했습니다(표 1). 다른 동물에서 진공 채혈 또는 꼬리 착유가 혈장 샘플의 품질에 미치는 영향을 평가했습니다(표 2). 이를 위해 유리 헤모글로빈의 검출을 위해 414nm의 UV 분광 광도법 분석이 사용되었습니다. 통계 분석에는 상용 소프트웨어가 사용되었으며, Kruskal-Wallis 또는 사후 Tukey의 다중 비교 검정을 사용한 일원 분산 분석이 사용되었습니다(p<0.05는 통계적으로 유의한 것으로 간주됨). 데이터는 평균 ± SEM으로 표현됩니다.
캐뉼라 및 천공된 쥐에서 다중 CSF 샘플링의 성공률
뇌척수액은 3개의 쥐 그룹에서 2주 이내에 5회 샘플링되었습니다: (i) 캐뉼레이션 및 테더링 전극 이식 쥐(CT 그룹 동물); 이들에서, 뇌척수액 인출은 마취되지 않고 비디오 EEG 하에서 자유롭게 움직일 때 더미 가이드 캐뉼라 및 PTFE 튜브 조인트를 통해 1mL 주사기로 수행되었습니다. (ii) 천공(단계 9) 및 테더링된 전극 이식 쥐(PT 그룹); (iii) 천공 및 원격 측정 전극 이식 쥐(PTe 그룹). 그룹당 총 9마리의 동물(간질 쥐 6마리, 대조군 쥐 3마리)을 사용하였다. 5회 이상 성공한 컬렉션 수를 평가했습니다. 성공률은 구멍이 뚫린 쥐에서 비슷했다: 묶인 쥐에서는 86.7% ± 5.8%, 원격 측정 전극 이식 동물에서는 88.9% ± 4.8%였다. 대신, 통조림에 갇힌 쥐에서는 유의한 차이가 없더라도 비율이 감소했습니다(71.1% ± 8.9%, 표 1). 이러한 결과는 동물의 머리에 있는 캐뉼라가 반복적인 뇌척수액 샘플링을 방해하고 종단 연구를 손상시킬 수 있음을 나타냅니다. 펑크 기술은 전극을 이식한 동물의 여러 뇌척수액 인출에 더 적합합니다.
진공 및 꼬리 착유가 플라즈마 수집 방법에 미치는 영향
혈액은 SE 후 52, 55, 58, 61 및 64 일에 9 마리의 쥐 (6 마리의 간질 쥐와 3 명의 대조군 쥐)로부터 5 배 수집되었으며 혈장 품질은 414nm에서 육안 및 UV 분광 광도계에 의해 용혈에 대해 평가되었습니다. 각 쥐에서 첫 번째 샘플을 얻기 위해 1mL 주사기에 부착된 21G 버터플라이 바늘을 통한 진공 인출을 사용했습니다. 두 번째 샘플에서는 꼬리를 동시에 착유할 때 드롭 인출과 21G 버터플라이 바늘 시스템을 사용했습니다. 3-5번째 샘플을 얻기 위해, 꼬리를 착유하지 않고 드롭 철회 절차(단계 9에서 설명)를 사용하였다.
진공을 사용했을 때, 육안 검사에서 혈장은 분홍색이었고, 9마리의 쥐 샘플의 평균 흡광도 값은 0.647 ± 0.067이었다(표 2, 그림 3). 절차 도중 꼬리 젖을 짜는 것을 이용하는 경우에 유사한 결과가 얻어졌다: 0.620 ± 0.043 평균 흡광도를 가진 분홍색 플라스마는 (표 2, 도 3). 대조적으로, 중력 활성화 방울 인출 및 21G 버터플라이 바늘 시스템을 사용하면 평균 플라즈마 흡광도 값이 크게 감소했습니다(58dpSE에서 0.226 ± 0.017, 61dpSE에서 0.223 ± -0.09, 64dpSE에서 0.226 ± 0.018; 표 2, 그림 3) 진공 또는 꼬리 착유 방법과 관련하여. 또한, 방울 혈장 샘플은 주로 투명했습니다. 흡광도 값이 높을수록(52 및 55 dpSE) 샘플의 분홍색과 상관관계가 있습니다(데이터는 표시되지 않음). 이러한 결과는 마지막 방법이 분석을 위해 매우 높은 품질의 샘플을 얻는 데 가장 적합하다는 것을 시사할 수 있습니다.

그림 1: 혈장 샘플링 워크플로우의 주요 단계. (A) 채취 준비가 된 입체 프레임의 혈액 인출 및 쥐에 필요한 재료; (나, 씨) 21G 나비 바늘을 측면 꼬리 정맥에 삽입한 꼬리와 항응고제로 채취 튜브의 벽을 따라 떨어지는 핏방울의 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 뇌척수액(CSF) 샘플링 워크플로우의 주요 단계. (A) 채취 직전의 입체 프레임에서 CSF 인출 및 쥐에 필요한 재료; (B) 수조 마그나로의 정확한 침투를 보장하기 위해 맨 바늘의 끝이 7mm 동안 노출되도록 플라스틱 슬리브 보호 장치를 절단하여 23G 나비 바늘 준비; (C) 쥐 머리는 철수하는 동안 아래쪽으로 45° 기울어져 있습니다. (D) cisterna magna에 삽입된 나비 바늘로 마름모꼴 부위의 확대. 마커 끝으로 표시된 튜브에서 상승하는 CSF에 유의하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
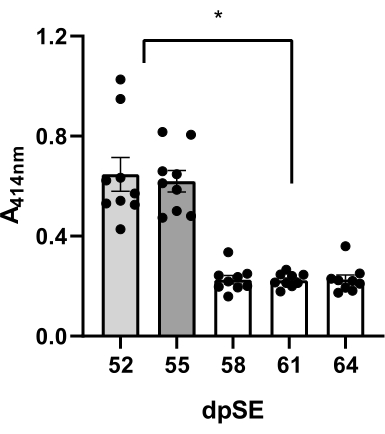
그림 3: 혈장 샘플의 품질 평가. 다른 방법을 사용하여 5개의 시점(52, 55, 58, 61 및 64일의 간질 후 상태, dpSE)에서 9마리의 동물의 혈장 샘플에서 UV 분광법에 의해 유리 헤모글로빈에 대해 414nm에서 측정된 용혈 정도: 52일 - 진공 기술; 55 일째 - 꼬리 착유; 58-64일째 낙하 기법이 사용되었다. 진공 및 꼬리 착유 방법에 비해 방울 기술로 얻은 혈장 내 유리 헤모글로빈의 감소는 유의했습니다(*편도 분산 분석 및 사후 Tukey의 다중 비교 테스트에 따른 <0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: CSF 인출 성공률. 5일 동안 성공적인 금단 횟수의 백분율로 표현된 3개의 실험 동물 그룹에서 반복적인 CSF 금단의 성공률 비교. 값 1은 > 100μL의 투명 CSF의 성공적인 회수에 할당되었습니다. 0 값은 100μL 및/또는 불분명한 CSF< 인출에 할당되었습니다. 약어: N/A - 샘플링 절차 중 캐뉼라 손실로 인한 수집 부재(CT 동물만 해당); CT - 캐뉼러형 테더링; PT - 구멍이 뚫린 테더링; PTe - 구멍이 뚫린 원격 측정 전극이 이식되었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 혈장 샘플의 용혈 평가. 세 가지 다른 혈액 샘플링 방법을 사용하여 5개의 시점에서 용혈 측정 결과: 52일 - 진공 기술; 55 일째 - 꼬리 착유; 58-64 일 드롭 기술. 흡광도 값 >0.3은 샘플의 분홍색과 상관 관계가 있습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
본 연구는 쥐의 뇌척수액 및 채혈 기술을 쉽게 습득할 수 있는 방법을 보여주며, 이는 간질 모델뿐만 아니라 알츠하이머, 파킨슨 또는 다발성 경화증과 같은 다른 신경학적 상태 또는 질병의 연구에도 유용할 수 있습니다. 간질 연구에서 비디오 EEG와 결합된 샘플링 절차는 서로 다른 용해성 분자의 수준과 발작 활동 사이의 상관 관계를 추구할 때 이상적입니다. 이러한 특별한 이유로, i) 간질을 정확하게 진단하기 위해, ii) 질병 진행의 여러 단계를 모니터링하기 위해, 및/또는 iii) 샘플링과 자연 발작의 발생을 연관시키기 위해 연속적인 비디오 EEG 기록이 사용되었습니다. 이러한 샘플링 기술은 마취된 쥐에서 수행될 수 있으며, 따라서 최소한의 스트레스를 유발합니다.
중요한 단계, 문제 해결, 방법 제한 사항
프로토콜에는 몇 가지 중요한 기술 단계가 있습니다. 첫째, 첫 번째 시도에서 CSF 채취를 위한 올바른 장소를 찾기가 어려울 수 있습니다. 작업자가 첫 번째 시도에서 수조 마그나를 놓치면 동물이 바늘 상처에서 피를 흘리기 때문에 후속 시도는 혈액에 오염됩니다. 이러한 관점에서 컬렉션의 성공은 운영자의 기술에 크게 좌우됩니다. 둘째로, 혈액 채취의 일부 단계에는 특별한 주의가 필요합니다. 특히, 작업자가 꼬리를 에탄올로 너무 세게 문지르거나, 꼬리 정맥 혈관 확장에 사용되는 물의 온도가 42°C 이상이거나, 채취 튜브의 혈액이 항응고제와 너무 정력적으로 혼합되면 용혈의 위험이 높습니다. 만성 간질 동물에서 혈액 수집의 또 다른 특징은 꼬리 정맥에서 혈액이 떨어지는 속도에 대한 서맥의 영향이다33. 이것이 너무 느리면 혈액이 채취 튜브의 벽에 응고될 수 있습니다. 이 문제를 피하기 위한 한 가지 옵션은 샘플링을 두 개의 수집 튜브로 분할하여 혈액/튜브의 부피를 줄이는 것입니다. 마지막으로, 간질 연구에 내재된 한 가지 함정이 있습니다. 샘플링 전에 동물 조작에 의해 유발된 스트레스는 발작을 유발할 수 있으며, 이는 차례로 조사 하에 있는 분자의 수준을 방해할 수 있다(34). 가능할 때마다 마취 유도 챔버를 가정용 케이지에 놓고 동물이 자발적으로 들어갈 수 있도록 합니다. 제안된 프로토콜의 수정으로서, 억제제는 이소플루란 마취 없이 혈액 회수를 수행하는데 사용될 수 있다. 그러나 이것은 원격 측정에서 수행할 수 있지만 묶인 동물에서는 수행할 수 없는데, 묶인 쥐는 이 절차 중에 머리 임플란트를 잃을 수 있기 때문입니다.
잘 훈련된 작업자를 두고 스트레스를 피하기 위해 최대한의 노력을 기울이는 현재 프로토콜의 유일한 한계는 동물의 건강을 손상시키지 않고 인출할 수 있는 최대 부피입니다. 현행 기준에 따르면, 한 마리의 동물에서 15일 동안 4배에 걸쳐 최대 100μL의 뇌척수액을 채취하는 것이 권장된다32. 유사하게, 단일 샘플링에서 총 혈액 체적의 10% 미만을 수집하고 28일 동안 총 혈액 체적의 15% 미만을 수집하는 것이 좋습니다30,31.
다른 기법과 방법 비교
제안된 시간 분해 CSF 및 혈장 샘플링 접근법은 기존 대체 방법과 관련하여 몇 가지 장점이 있습니다. 첫째, 간질이 있는 쥐에서 뇌척수액을 채취하는 데 사용되는 수조 마그나 천자는 테더링된 EEG와 결합할 경우 캐뉼레이션 시스템에 비해 머리 임플란트 손실 위험이 낮습니다. 천자 절차와 달리 치과용 시멘트(동물의 머리에 비해 부피가 크고 무거움)로 전극에 부착된 캐뉼라는 뇌척수액 인출에 대한 반복적인 부착/분리에 의해 요청되지만 며칠 간의 샘플링을 통해 손실되기 훨씬 더 쉽습니다. 실제로, 성공률 결과는 일부 캐뉼라 동물(N/A)이 고급 샘플링 시점에 도달하지 못하여 해당 샘플이 손실되는 방법을 보여줍니다(표 1). 또한, 천자 방법은 이전에 다른 22,35,36에 의해 문서화된 바와 같이 뇌척수액에서 세포 및 알부민 함량의 제한된 증가와 함께 더 나은 무균성 및 감소된 수막 반응 측면에서 캐뉼레이션 접근법보다 우수한 것으로 보입니다. 뇌척수액 백혈구 및 알부민 오염의 정도는 간질 바이오마커 정량화에 사용되는 방법의 타당성에 중요할 수 있다35. 둘째, 반복 측정에 사용되는 혈장 채취의 자유낙하 방법은 참수, 심장 천자, 복부/흉부 혈관 또는 후안와 철수와 달리 말기(비회복)가 아니며 다중 혈액 채취가 가능하기 때문에 다른 어떤 인출 방법보다 우수합니다. 이는 튜빙(tubing) 28,37을 필요로 하지 않고, 간질 형성(epileptogenesis)의 추정 바이오마커를 식별하는 데 초점을 맞춘 추가 sncRNA 분석을 위한 고품질의 용혈이 없는 혈장 샘플을 생산하기 때문에 많은 꼬리 정맥 혈액 진공 인출 기술보다 간단하다(38). 방울 샘플링 기술을 사용하거나 꼬리 착유를 피할 때 샘플에서 유리 헤모글로빈이 없다는 것은 sncRNA 혈장 함량39,40의 평가에 적합한 이전에 발표된 절차에 따라 혈장 샘플의 낮은 흡광도 결과(표 2)에 의해 확인되었습니다.
적용 및 향후 방향
상술한 방법들은 임의의 신경학적 질환 모델에서 관심의 용해성 분자를 측정하는데 적용될 수 있다. 구체적인 예는 잠재적/추정적 간질 바이오마커의 식별을 위한 생물학적 액체의 샘플링입니다. 뇌전증 환자를 위한 이러한 바이오마커, 특히 예후 및 감수성/위험 바이오마커는 아직 존재하지 않기 때문에 발견해야 할 긴급한 미충족 의학적 필요성이 있습니다.
결론적으로, 본 프로토콜은 간질 쥐를 포함한 쥐에서 실현 가능하며, 훈련된 개인을 위해 작동하기 쉽다. 또한 3R(즉, 교체, 축소 및 정제)41의 원칙에 따라 종단 연구에서 여러 고품질 샘플링을 허용합니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 보조금 계약 964712(PRIME, M. Simonato)에 따라 유럽 연합의 Horizon 2020 Work Programme(H2020-FETOPEN-2018-2020)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Blood collection set BD Vacutainer Safety-Lok | BD Italy SpA, Milan, Italy | 367246 | Material |
| Blood Collection tubes (Microtainer K2E) | BD Italy SpA, Milan, Italy | 365975 | Material |
| Butterfly Winged Infusion Set 23G x 3/4'' 0.6 x 19 mm | Nipro, Osaka, Japan | PSY-23-ET-ICU | Material |
| Centrifuge refrigerated ALC PK 130R | DJB Labcare Ltd, Buckinghamshire, England | 112000033 | Material |
| Cotton suture 3-0 | Ethicon, Johnson & Johnson surgical technologies, Raritan, New Jersey, USA | 7343H | Material |
| Diazepam 5 mg/2ml, Solupam | Dechra Veterinary Products, Torino, Italy | 105183014 (AIC) | Solution |
| Digital video 8-channel media recorder system of telemetry EEG set up | Data Sciences International (DSI), St Paul, MN, USA | PNM-VIDEO-008 | Equipment |
| Digital video surveillance system of tethered EEG set up | EZVIZ Network, Hangzhou, Cina | EZVIZ (V5.3.2) | Equipment |
| Disinfectant based on stabilized peroxides and quaternary ammonium activity | Laboratoire Garcin-Bactinyl, France | LB 920111 | Solution |
| Dummy guide cannula 8 mm | Agn Tho's, Lindigö, Sweden | CXD-8 | Material |
| Electrode 3-channel two-twisted | Invivo1, Plastic One, Roanoke, Virginia, USA | MS333/3-B/SPC | Material |
| Electrode holder for stereotxic surgery | Agn Tho's, Lindigö, Sweden | 1776-P1 | Equipment |
| Eppendorf BioSpectrometer basic | Eppendorf AG, Hamburg, Germany | 6137 | Equipment |
Eppendorf PCR Tubes 0.2 mL | Eppendorf Srl, Milan, Italy | 30124332 | Material |
| Eppendorf μCuvette G1.0 | Eppendorf AG, Hamburg, Germany | 6138 | Equipment |
| Feeding needle flexible 17G for rat | Agn Tho's, Lindigö Sweden | 7206 | Material |
| Grass Technology apparatus | Grass Technologies, Natus Neurology Incorporated, Pleasanton, California, USA | M665G08 | Equipment (AS40 amplifier, head box, interconnecting cables, telefactor model RPSA S40) |
| Isoflurane 100%, IsoFlo | Zoetis, Rome, Italy | 103287025 (AIC) | Solution |
| Ketamine (Imalgene) | Merial, Toulouse, France | 221300288 (AIC) | Solution |
| Lithium chloride | Sigma-Aldrich, Milan, Italy | L9650 | Material |
| Microinjection cannula 31G 9 mm | Agn Tho's, Lindigö Sweden | CXMI-9 | Material |
| MP150 modular data acquisition and analysis system | Biopac, Goleta, California, USA | MP150WSW | Equipment |
| Ophthalmic vet ointment, Hylo night | Ursapharm, Milan, Italy | 941791927 (AIC) | Material |
| Pilocarpine hydrochloride | Sigma-Aldrich, Milan, Italy | P6503 | Material |
| PTFE Tube with joint | Agn Tho's, Lindigö, Sweden | JT-10 | Material |
| Saline | 0.9% NaCl, pH adjusted to 7.0 | Solution | |
| Scopolamine hydrobromide trihydrate | Sigma-Aldrich, Milan, Italy | S2250 | Material |
| Scopolamine methyl nitrate | Sigma-Aldrich, Milan, Italy | S1876 | Material |
| Silver sulfadiazine 1% cream | Sofar, Trezzano Rosa, Milan, Italy | 025561010 (AIC) | Material |
| Simplex rapid dental methacrylic cement | Kemdent, Associated Dental Products Ltd, Swindon, United Kingdom | ACR811 | Material |
| Stereotaxic apparatus | David Kopf Instruments, Los Angeles, CA, USA | Model 963 | Equipment |
| Sucrose solution | 10% sucrose in distilled water | Home-made | Solution |
| Syringe 1 mL | Biosigma, Cona, Venezia, Italy | 20,71,26,03,00,350 | Material |
| Telemeters | Data Sciences International (DSI), St Paul, MN, USA | CTA-F40 | Material |
| Telemetry EEG traces analyzer | Data Sciences International (DSI), St Paul, MN, USA | NeuroScore v3-0 | Equipment |
| Telemetry system | Data Sciences International (DSI), St Paul, MN, USA | Hardware plus software Ponemah core 6.51 | Equipment |
| Xylazine hydrochloride | Sigma-Aldrich, Milan, Italy | X1251 | Material |
참고문헌
- Hanin, A., et al. Cerebrospinal fluid and blood biomarkers of status epilepticus. Epilepsia. 61 (1), 6-18 (2020).
- Pitkänen, A., et al. Advances in the development of biomarkers for epilepsy. The Lancet Neurology. 15 (8), 843-856 (2016).
- Dlugos, D., et al. Childhood Absence Epilepsy Study Team (2013). Pretreatment EEG in childhood absence epilepsy: associations with attention and treatment outcome. Neurology. 81 (2), 150-156 (2013).
- Lorenzo, N. Y., et al. Intractable frontal lobe epilepsy: pathological and MRI features. Epilepsy research. 20 (2), 171-178 (1995).
- van Dellen, E., et al. Epilepsy surgery outcome and functional network alterations in longitudinal MEG: a minimum spanning tree analysis. NeuroImage. 86, 354-363 (2014).
- Shah, A. K., Mittal, S. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy of Neurology. 17 (Suppl 1), S89-S94 (2014).
- Whiting, P., et al. A systematic review of the effectiveness and cost-effectiveness of neuroimaging assessments used to visualise the seizure focus in people with refractory epilepsy being considered for surgery. Health technology assessment. 10 (4), 1-iv (2006).
- Lenkov, D. N., Volnova, A. B., Pope, A. R., Tsytsarev, V. Advantages and limitations of brain imaging methods in the research of absence epilepsy in humans and animal models. Journal of neuroscience methods. 212 (2), 195-202 (2013).
- Leach, J. P., Stephen, L. J., Salveta, C., Brodie, M. J. Which electroencephalography (EEG) for epilepsy? The relative usefulness of different EEG protocols in patients with possible epilepsy. Journal of neurology, neurosurgery, and psychiatry. 77 (9), 1040-1042 (2006).
- Huppertz, H. J., et al. Localization of interictal delta and epileptiform EEG activity associated with focal epileptogenic brain lesions. NeuroImage. 13 (1), 15-28 (2001).
- Linder, C., et al. Comparison between dried blood spot and plasma sampling for therapeutic drug monitoring of antiepileptic drugs in children with epilepsy: A step towards home sampling. Clinical biochemistry. 50 (7-8), 418-424 (2017).
- Wegner, I., Wilhelm, A. J., Lambrechts, D. A., Sander, J. W., Lindhout, D. Effect of oral contraceptives on lamotrigine levels depends on comedication. Acta neurologica Scandinavica. 129 (6), 393-398 (2014).
- Palmio, J., et al. CSF and plasma adipokines after tonic-clonic seizures. Seizure. 39, 10-12 (2016).
- Hogg, M. C., et al. Elevation in plasma tRNA fragments precede seizures in human epilepsy. Journal of Clinical Investigation. 129 (7), 2946-2951 (2019).
- Ellul, M., Solomon, T. Acute encephalitis - diagnosis and management. Clinical medicine. 18 (2), 155-159 (2018).
- Diamond, M. L., et al. IL-1β associations with posttraumatic epilepsy development: a genetics and biomarker cohort study. Epilepsia. 55 (7), 1109-1119 (2014).
- Auvin, S., et al. Prospective clinical trials to investigate clinical and molecular biomarkers. Epilepsia. 58 (Suppl 3), 20-26 (2017).
- Weber, Y. G., Nies, A. T., Schwab, M., Lerche, H. Genetic biomarkers in epilepsy. Neurotherapeutics. 11 (2), 324-333 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), e880(2008).
- Gardiner, T. W., Toth, L. A. Stereotactic Surgery and Long-Term Maintenance of Cranial Implants in Research Animals. Contemporary Topics in Laboratory Animal Science. 38 (1), 56-63 (1999).
- Westergren, I., Johansson, B. B. Changes in physiological parameters of rat cerebrospinal fluid during chronic sampling: evaluation of two sampling methods. Brain Research Bulletin. 27 (2), 283-286 (1991).
- Soukupová, M., et al. Impairment of GABA release in the hippocampus at the time of the first spontaneous seizure in the pilocarpine model of temporal lobe epilepsy. Experimental Neurology. 257, 39-49 (2014).
- Soukupová, M., et al. Microdialysis of Excitatory Amino Acids During EEG Recordings in Freely Moving Rats. Journal of Visualized Experiments. (141), e58455(2018).
- Guarino, A., et al. Low-dose 7,8-Dihydroxyflavone Administration After Status Epilepticus Prevents Epilepsy Development. Neurotherapeutics. 19 (6), 1951-1965 (2022).
- Curia, G., Longo, D., Biagini, G., Jones, R. S. G., Avoli, M. The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods. 172 (2), 143-157 (2008).
- Racine, R. J. Modification of seizure activity by electrical stimulation: II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Zou, W., et al. Repeated Blood Collection from Tail Vein of Non-Anesthetized Rats with a Vacuum Blood Collection System. Journal of Visualized Experiments. (130), e55852(2017).
- Blood sampling: Rat. , https://nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-rat (2022).
- Powles-Glover, N., Kirk, S., Wilkinson, C., Robinson, S., Stewart, J. Assessment of toxicological effects of blood microsampling in the vehicle dosed adult rat. Regulatory Toxicology and Pharmacology. 68 (3), 325-331 (2014).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animal. 32 (4), 369-376 (1998).
- Wang, D., Zhao, Y., Yang, Y., Xie, H. Safety assessment of multiple repeated percutaneous punctures for the collection of cerebrospinal fluid in rats. Brazilian Journal of Medical and Biological Research. 54 (6), e10032(2021).
- Möller, C., et al. Impact of repeated kindled seizures on heart rate rhythms, heart rate variability, and locomotor activity in rats. Epilepsy & Behavior. 92, 36-44 (2019).
- Espinosa-Garcia, C., Zeleke, H., Rojas, A. Impact of Stress on Epilepsy: Focus on Neuroinflammation-A Mini Review. International Journal of Molecular Sciences. 22 (8), 4061(2021).
- Cassar, S. C., et al. Comparing levels of biochemical markers in CSF from cannulated and non-cannulated rats. Journal of Neuroscience Methods. 192 (2), 249-253 (2010).
- Huang, Y. L., Säljö, A., Suneson, A., Hansson, H. A. Comparison among different approaches for sampling cerebrospinal fluid in rats. Brain Research Bulletin. 41 (5), 273-279 (1996).
- Hattori, N., Takumi, A., Saito, K., Saito, Y. Effects of serial cervical or tail blood sampling on toxicity and toxicokinetic evaluation in rats. Journal of Toxicological Sciences. 45 (10), 599-609 (2020).
- Roncon, P., et al. MicroRNA profiles in hippocampal granule cells and plasma of rats with pilocarpine-induced epilepsy--comparison with human epileptic samples. Scientific Reports. 5, 14143(2015).
- van Vliet, E. A., et al. Standardization procedure for plasma biomarker analysis in rat models of epileptogenesis: Focus on circulating microRNAs. Epilepsia. 58 (12), 2013-2024 (2017).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), e24145(2011).
- Grimm, H., et al. Advancing the 3Rs: innovation, implementation, ethics and society. Frontiers in Veterinary Science. 10, 1185706(2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유