Method Article
Entnahme von Liquor und Blut aus der seitlichen Schwanzvene bei Ratten während EEG-Aufzeichnungen
In diesem Artikel
Zusammenfassung
Das Protokoll zeigt wiederholte Liquor- und Blutentnahmen von epileptischen Ratten, die parallel zur kontinuierlichen Video-Elektroenzephalogramm-Überwachung (EEG) durchgeführt werden. Diese sind von entscheidender Bedeutung, um mögliche Zusammenhänge zwischen Veränderungen verschiedener Körperflüssigkeitsmoleküle und der Anfallsaktivität zu untersuchen.
Zusammenfassung
Da die Zusammensetzung von Körperflüssigkeiten viele physiologische und pathologische Dynamiken widerspiegelt, werden in vielen experimentellen Kontexten üblicherweise biologische Flüssigkeitsproben gewonnen, um Moleküle von Interesse wie Hormone, Wachstumsfaktoren, Proteine oder kleine nicht-kodierende RNAs zu messen. Ein konkretes Beispiel ist die Probenahme biologischer Flüssigkeiten bei der Erforschung von Biomarkern für Epilepsie. In diesen Studien ist es wünschenswert, die Konzentrationen von Molekülen in der Zerebrospinalflüssigkeit (CSF) und im Plasma zu vergleichen, indem Liquor und Plasma parallel entnommen werden und der zeitliche Abstand der Probenahme von und zu den Anfällen berücksichtigt wird. Die kombinierte Liquor- und Plasmaprobenahme, gekoppelt mit Video-EEG-Monitoring bei epileptischen Tieren, ist ein vielversprechender Ansatz für die Validierung von putativen diagnostischen und prognostischen Biomarkern. Hier wird ein Verfahren der kombinierten Liquorentnahme aus der Cisterna magna und der Blutentnahme aus der lateralen Schwanzvene bei epileptischen Ratten beschrieben, die kontinuierlich per Video-EEG überwacht werden. Dieses Verfahren bietet erhebliche Vorteile gegenüber anderen häufig verwendeten Techniken. Es ermöglicht eine schnelle Probenentnahme mit minimalen Schmerzen oder Invasivität und verkürzter Anästhesiezeit. Darüber hinaus kann es verwendet werden, um Liquor- und Plasmaproben sowohl bei angebundenen als auch bei telemetrischen EEG-aufgezeichneten Ratten zu erhalten, und es kann wiederholt über mehrere Experimenttage hinweg verwendet werden. Durch die Minimierung des Stresses durch die Probenahme durch Verkürzung der Isofluran-Anästhesie sollen die Messungen die wahren Konzentrationen der untersuchten Moleküle in Bioflüssigkeiten genauer widerspiegeln. Abhängig von der Verfügbarkeit eines geeigneten analytischen Assays kann diese Technik verwendet werden, um die Konzentrationen mehrerer verschiedener Moleküle zu messen und gleichzeitig eine EEG-Aufzeichnung durchzuführen.
Einleitung
Liquor cerebrospinalis (CSF) und Blutproben sind wichtig, um Biomarker für Epilepsie zu identifizieren und zu validieren, sowohl in der präklinischen als auch in der klinischen Forschung 1,2. Heutzutage konzentrieren sich die Diagnose der Epilepsie und die meisten Forschungen zu Epilepsie-Biomarkern auf EEG und Neuroimaging 3,4,5. Diese Ansätze weisen jedoch einige Einschränkungen auf. Abgesehen von routinemäßigen Kopfhautmessungen erfordert das EEG in vielen Fällen invasive Techniken wie Tiefenelektroden6. Bildgebende Verfahren des Gehirns haben eine schlechte zeitliche und räumliche Auflösung und sind relativ teuer und zeitaufwändig 7,8. Aus diesem Grund wäre die Identifizierung von nicht-invasiven, kostengünstigen und biofluidbasierten Biomarkern eine sehr attraktive Alternative. Darüber hinaus könnten diese Biofluid-Biomarker mit verfügbaren diagnostischen Ansätzen kombiniert werden, um ihre Vorhersagefähigkeit zu schärfen.
Patienten, bei denen Epilepsie diagnostiziert wurde, werden routinemäßig einem EEG 9,10 und einer Blutentnahme 11,12,13,14 unterzogen, und viele auch einer Liquorentnahme, um lebensbedrohliche Ursachen (z. B. akute Infektionen, autoimmune Enzephalitis) auszuschließen15. Diese Blut- und Liquorproben können in der klinischen Forschung verwendet werden, um Biomarker für Epilepsie zu identifizieren. Zum Beispiel haben Hogg und Mitarbeiter herausgefunden, dass ein Anstieg von drei Plasma-tRNA-Fragmenten dem Auftreten von Anfällen bei menschlicher Epilepsie vorausgeht14. In ähnlicher Weise können Interleukin-1beta (IL-1β)-Spiegel im menschlichen Liquor und Serum, ausgedrückt als Verhältnis der IL-1β-Spiegel im Liquor zum Serum, die Entwicklung einer posttraumatischen Epilepsie nach einem Schädel-Hirn-Trauma vorhersagen16. Diese Studien unterstreichen die Bedeutung der Probenahme von Bioflüssigkeiten für die Epilepsie-Biomarker-Forschung, aber sie sehen sich mit mehreren Einschränkungen konfrontiert, die klinischen Studien innewohnen, z. B. der Mitbegründungsfaktor von Antiepileptika (AEDs) im Blut, der häufige Mangel an Informationen über die Ätiologie, unzureichende Kontrollen, eine bescheidene Anzahl von Patienten und andere17,18.
Die präklinische Forschung bietet weitere Möglichkeiten, Moleküle in Bioflüssigkeiten als potenzielle Biomarker für Epilepsie zu untersuchen. Tatsächlich ist es möglich, Plasma und/oder Liquor von Tieren zu entnehmen, während EEG-Aufzeichnungen durchgeführt werden. Darüber hinaus kann die Probenahme wiederholt über mehrere Tage des Experiments durchgeführt werden, und eine Reihe von Kontrollen, die mit Alter, Geschlecht und epileptischen Beleidigungen übereinstimmen, können verwendet werden, um die Robustheit der Studie zu verbessern. Hier wird eine flexible Technik zur Gewinnung von Liquor aus Cisterna magna mit paralleler Entnahme von Plasma aus der Schwanzvene bei EEG-überwachten Ratten detailliert beschrieben. Die vorgestellte Technik hat mehrere Vorteile gegenüber alternativen Methoden. Durch die Verwendung eines Schmetterlingsnadelansatzes ist es möglich, Liquor mehrmals zu entnehmen, ohne die Funktion von EEG-Elektroden oder ähnlichen Kopfimplantaten zu beeinträchtigen. Dies stellt eine Verfeinerung der intrathekalen Katheterentnahmeverfahren dar, die mit einem relativ hohen Infektionsrisiko verbunden sind. Darüber hinaus ist der für die Blutentnahme verwendete Freifall-Tropfen-Ansatz anderen Ansätzen der Schwanzvenen-Blutentnahme überlegen, da das Risiko einer Hämolyse stark reduziert ist, da das Blut nicht durch Schläuche fließt und kein Vakuumdruck ausgeübt wird. Unter streng keimfreien Bedingungen durchgeführt, besteht für die Tiere ein besonders geringes Infektionsrisiko. Darüber hinaus kann durch den Beginn der Blutentnahme ganz am Ende des Schwanzes der Tiere die Entnahme mehrmals wiederholt werden. Solche Techniken sind leicht zu beherrschen und können in vielen präklinischen Studien zu Erkrankungen des zentralen Nervensystems angewendet werden.
Protokoll
Alle Versuchsverfahren wurden vom Ausschuss für institutionelle Tierpflege und -verwendung der Universität Ferrara und vom italienischen Gesundheitsministerium (Zulassung: D.M. 603/2022-PR) gemäß den Richtlinien der Richtlinie des Rates der Europäischen Gemeinschaften vom 24. November 1986 (86/609/EWG) zum Schutz von Tieren, die für Versuche und andere wissenschaftliche Zwecke verwendet werden, genehmigt. Dieses Protokoll ist speziell für weitere quantitative Polymerase-Kettenreaktionsanalysen (qPCR) von kleinen nicht-kodierenden Ribonukleinsäuren (sncRNAs) im Liquor und Plasma der Ratte angepasst, die unter EEG-Kontrolle bei epileptischen Tieren gewonnen wurden. Bitte sehen Sie sich das zugehörige JoVE-Video an, um die Operation besser zu verstehen und zu verbessern 19,20,21.
1. Vorbereitung von Tieren für die chirurgische Implantation von Elektroden oder Telemetern
HINWEIS: Die stereotaktische Operationstechnik variiert je nach verwendetem EEG-System. Der folgende Methodenabschnitt enthält eine Beschreibung der Schritte, die für die beiden Arten von Operationen gemeinsam sind.
- Verwenden Sie Sprague-Dawley (SD)-Ratten (Männchen, 7-8 Wochen alt, Gewicht 250-290 g), die in Übereinstimmung mit den örtlichen Gesetzen für die Pflege und Verwendung von Labortieren gehalten werden. Unterbringung der Tiere unter Standardbedingungen mit freiem Zugang zu Futter und Trinkwasser.
- Fahren Sie mit dem Umgang mit den Ratten für einige Tage vor der Operation und den experimentellen Protokollverfahren fort.
- Verwenden Sie ein stereotaktisches Gerät für die Implantation von Elektroden oder Telemetern. Befolgen Sie die modernen Standards für aseptische Operationen. Verwenden Sie sterile und gut funktionierende Elektroden und Transmitter.
- Rasieren Sie den Kopf des Tieres mit dem elektrischen Rasierer. Mit der Mischung aus Ketamin (45 mg/kg) und Xylazin (7,5 mg/kg), die intraperitoneal (i.p.) verabreicht wird, wird eine Anästhesie beim Tier eingeleitet, dann wird die Isofluran-Anästhesie (1,4 % an der Luft; 1,2 ml/min) durch eine Gesichtsmaske verabreicht und der Kopf des Tieres im stereotaktischen Apparat fixiert.
- Stellen Sie eine ausreichende Narkosetiefe sicher, indem Sie den Pedalrückzugsreflex testen, nachdem die Hinterfüße beider Tiere eingeklemmt wurden, und halten Sie die Isofluran-Anästhesie bis zum Ende der Operation aufrecht. Kontrollieren Sie regelmäßig die Narkosetiefe während der gesamten Dauer des Eingriffs.
- Tragen Sie eine ausreichende Menge Augensalbe auf die Augen beider Tiere auf, um eine Hornhautschädigung durch den Verlust des Blinzelreflexes durch die Anästhesie zu vermeiden.
- Reinigen Sie die Kopfhaut des Tieres gründlich mit flüssigem Desinfektionsmittel und machen Sie mit einem sterilisierten Skalpell einen 2 cm langen Längsschnitt. Öffnen Sie die Kopfhaut und bringen Sie chirurgische Clips an den Hautlappen an, um sie offen zu halten.
- Lösen Sie vorsichtig das Periost, um das Bregma und den Bereich des Schädels freizulegen, durch den die Aufzeichnungselektrode eingeführt wird.
2. Chirurgische Implantation von angebundenen Elektroden
HINWEIS: Vor der Festlegung des Punktions-Liquor-Entnahmeverfahrens dieses Protokolls (siehe Schritt 9 für Details) wurden wiederholte Liquorentnahmen über eine Führungskanüle bei einigen frei beweglichen, nicht anästhesierten Ratten durchgeführt. Kanülierte Tiere, denen angebundene Elektroden implantiert wurden, wurden verwendet, um den Einfluss von Doppelkopfimplantaten auf die Langzeit-EEG-Aufzeichnung in Verbindung mit mehreren Liquorproben zu bewerten. In diesen spezifischen Experimenten wurde den Ratten eine Dummy-Führungskanüle implantiert, die in die Cisterna magna platziert wurde und deren Spitze stereotaktisch 7 mm in sie eingeführt wurde, gemäß den zuvor veröffentlichten Protokollen22. Die Ansätze der Doppelimplantatchirurgie ähnelten denen, die in der Vergangenheit von einigen Arbeitnehmern für Mikrodialyse-Führungskanülen und die Implantation mit gefesselten Elektroden verwendet wurden23,24.
- Verwenden Sie einen Arm des stereotaktischen Rahmens, montieren Sie den Elektrodenhalter darauf und setzen Sie die Elektrode aufrecht in die Halterung ein. Bewegen Sie die Elektrodenspitze genau über die Bregma. Notieren Sie sich die anteroposterioren und mediolateralen Koordinaten des Bregmas und übersetzen Sie sie in die gewünschten Koordinaten.
- Senken Sie die Elektrode ab, bis ihre Spitze fast den Schädel berührt. Markieren Sie die Bohrstelle und bohren Sie den Schädel an der markierten Stelle. Achten Sie darauf, das Gehirn und die Hirnhäute nicht zu schädigen.
- Machen Sie vier oder mehr Löcher für die Verankerungsschrauben und schrauben Sie sie in den Schädel. Achten Sie bei der Herstellung der Löcher für Verankerungsschrauben auf die Größe der Elektrode. Die Elektrodengröße sollte die positionierten Verankerungsschrauben nicht beeinträchtigen.
- Senken Sie den stereotaktischen Arm, der die Elektrode trägt, langsam auf der dorsoventralen Achse ab, dringen Sie in das Hirngewebe ein und stoppen Sie an der gewünschten Position. Befestigen Sie das Elektroden-Erdungskabel um eine der Schrauben, die in den Schädel geschraubt sind.
- Tragen Sie den Methacrylzement auf die Elektrode und Schrauben auf, die etwa die Hälfte der Höhe des Elektrodensockels abdecken. Lassen Sie die obere Hälfte der Elektrode, die auf das Ende des Anbindedrahts passt, frei.
- Lösen Sie die Elektrode aus der Halterung und heben Sie den stereotaktischen Arm an. Befreien Sie das Tier aus dem stereotaktischen Apparat und versorgen Sie es postoperativ.
- Setzen Sie das Tier in einen separaten Aufwachkäfig und beobachten Sie es alle 10 Minuten, bis es wach und gehfähig ist. Bringen Sie das Tier erst dann in seinen Standardkäfig und in eine andere, nicht betäubte Tiergesellschaft zurück, wenn es sich vollständig erholt hat.
3. Chirurgische Implantation der Telemeter
HINWEIS: Verwenden Sie nur sterile Telemeter. Wenn Telemeter wiederverwendet werden, reinigen und sterilisieren Sie sie vor der Operation gemäß den Anweisungen des Herstellers. In diesem Protokoll wurde ein Data Science International (DSI) Telemeter für die EEG-Aufzeichnung verwendet.
- Schalten Sie den Telemetriesender mit einem Magneten ein und testen Sie das Signal mit einem AM-Frequenzfunkgerät. Achten Sie vor der Operation auf ein starkes und klares Signal. Entsorgen Sie bei Bedarf die schlecht funktionierenden Telemeter.
- Bereiten Sie die Telemeterleitungen vor, indem Sie diese auf optimale Längen für erwachsene Ratten kürzen. Ziehen Sie die Silikonbeschichtung von zwei (negativen und positiven) Leitungen ab, so dass etwa 5 mm der spiralförmigen Stahlmine freigelegt werden. Erstellen Sie einen Schlaufengriff von ca. 2 mm Länge und 1 mm Breite an der Spitze der Minen.
- Rasieren Sie die Flanke des Tieres unter und hinter der linken Schulter. Desinfizieren Sie den Operationsbereich mit einem Desinfektionsmittel auf Basis stabilisierter Peroxide und quartärer Ammoniumaktivität. Lassen Sie das Desinfektionsmittel 15 Minuten einwirken.
- Machen Sie einen etwa 2 cm langen seitlichen Schnitt direkt hinter der Schulter des Tieres und schaffen Sie eine subkutane Tasche von ca. 5 cm3 Platz für die Platzierung des Senders. Platzieren Sie den Sender parallel zur Längsachse des Körpers, wobei die Leitungen in rostraler Richtung gerichtet sind.
- Befestigen Sie den Sender mit einem 3-0 Wattefaden an der Innenwand der Unterhauttasche. Legen Sie mit einer Schere mit stumpfem Ende den subkutanen Tunnel (ca. 2,5 cm lang) durch die Flanke und den Hals des Tieres und verbinden Sie so die Sendertasche mit dem Mittellinienschnitt auf der Kopfhaut des Tieres in Schritt 1.6.
- Nehmen Sie beide Telemeter-Elektroden mit einer Pinzette und ziehen Sie sie durch den Tunnel nach oben, so dass sie aus dem Auslass des Kopfhautschnitts herausragen. Halten Sie die Elektroden mit Wundklammern aus dem Kopfhautschnitt heraus.
- Verwenden Sie den stereotaktischen Rahmen, um die gewünschten Koordinaten für positives (rotes) Blei zu individualisieren und bohren Sie das Loch in den Schädel für die positive Elektrodenspitze (ähnlich Schritt 2.1.). Machen Sie ein weiteres Loch, um die Schraube oben am Rostrum zu verankern und schrauben Sie sie in den Schädel.
- Führen Sie die Spitze des positiven Bleis unter die Schädeldecke und die Dura ein und legen Sie sie auf die Gehirnoberfläche. Befestigen Sie die geschlungene Spitze des negativen (weißen) Bleis an der Schraube. Tragen Sie eine kleine Menge Methacrylzement um den positiven Bleiauslass und den negativen Abfluss auf, um sie auf dem Schädel zu immobilisieren.
- Befestigen Sie die Elektroden mit einer 3-0 Baumwollnaht an der Innenwand der Schädelhaut. Stellen Sie sicher, dass die fixierten Elektroden und die fixierende Naht die Stelle der Liquorentnahme nicht beeinträchtigen (d. h. eine depressive Oberfläche mit dem Aussehen einer Raute zwischen dem Hinterhauptsvorsprung und der Wirbelsäule des Atlasses).
- Schließen Sie den Kopfhautschnitt und den Flankenschnitt mit einer 3-0-Baumwollnaht. Desinfektionsmittel auf die Wunden auftragen. Erst nachdem diese getrocknet sind, tragen Sie eine antibiotische Creme auf die vernähten Wunden auf.
4. Nachsorge nach der Operation
- Beobachten Sie die Tiere nach der Operation etwa 1 Stunde lang, bis sie sich aufrichten und sich im Käfig bewegen. Bewahren Sie sie auf einer Wärmeunterlage auf, um eine Unterkühlung zu vermeiden. Verabreichen Sie den Tieren 2-3 Tage lang ein systemisches Antibiotikum zur Vorbeugung von Infektionen und ein systemisches Analgetikum zur Vorbeugung postoperativer Schmerzen.
- Lassen Sie Ratten mindestens 7 Tage nach chirurgischen Eingriffen sich erholen. Überwachen Sie die Tiere mindestens einmal täglich für 3 Tage auf Anzeichen von Schmerzen oder Stress.
5. Status epilepticus-Induktion bei Ratten
ANMERKUNG: Ein detailliertes Protokoll der Induktion des Status epilepticus (SE), das zur Reproduktion der mesialen Temporallappenepilepsie (mTLE) bei Ratten erforderlich ist, finden Sie bei Guarino et al.25.
- Nach einer Woche postoperativer Genesung werden die Tiere nach dem Zufallsprinzip in Gruppen eingeteilt: (i) Kontrolltiere, die Vehikel erhalten, und (ii) Epilepsie, die Pilocarpin erhalten. Verwenden Sie eine proportional höhere Anzahl von Tieren für die Epilepsiegruppe, da nicht alle mit Pilocarpin verabreichten Ratten überleben oder SE entwickeln.
- Am Tag vor der SE-Induktion ist den Tieren eine Einzeldosis von 127 mg/kg Lithiumchlorid zu verabreichen, gelöst in 0,9%iger Kochsalzlösung (3M) als Volumen von 1 ml/kg durch Magensonde. Verabreichen Sie dem Tier etwa 14 Stunden vor der Einleitung von SE das Lithium, das die Pilocarpin-Wirksamkeit26 erhöht, um die Variabilität bis zum Auftreten der SE zu verringern.
- Etwa 14 Stunden nach der Verabreichung von Lithium erhalten die Ratten eine einmalige Injektion von Methylscopolamin (1 mg/kg, subkutan).
- Genau 30 Minuten nach der Verabreichung von Methylscopolamin geben Sie den Ratten eine einmalige Injektion von Pilocarpin (50 mg/kg, i.p.), um die SE zu induzieren. Geben Sie Methylscopolamin und Vehikel (0,9% NaCl-Lösung) an Kontrollratten.
- Die Injektion von Pilocarpin induziert ein typisches Verhalten bei Tieren: frühe partielle Anfälle (Bewegungen von Vibrissen und Kopfnicken innerhalb von 5 Minuten nach Pilocarpin-Verabreichung), die sich innerhalb von 25-30 Minuten zu rezidivierenden generalisierten Krämpfen (SE) entwickeln. Ratten, die nicht innerhalb von 30 Minuten SE entwickeln, erhalten eine zusätzliche Dosis Pilocarpin (25 mg/kg, i.p.), und wenn sie immer noch keine SE entwickeln, schließen Sie sie von der Studie aus (SE-Non-Responder).
- Beobachten und bewerten Sie das Anfallsverhalten bei Ratten alle 5 Minuten, beginnend unmittelbar nach der Pilocarpin-Injektion. Verwenden Sie die Racine-Skala für eine Punktzahlvon 27.
- Unterbrechen Sie die SE 2 Stunden nach Beginn durch i.p. Verabreichung eines Cocktails von Medikamenten: Diazepam (10 mg/kg), Phenobarbital (25 mg/kg) und Scopolamin (1 mg/kg).
- Geben Sie den Ratten diesen Cocktail nach 4 h erneut. Schließlich wird den Ratten nach weiteren 4 h i.p. die letzte Medikamentenmischung (Diazepam 10 mg/kg plus Scopolamin 1 mg/kg) verabreicht, um die Anfallsaktivität vollständig zu stoppen.
- Injizieren Sie den Tieren i.p. Kochsalzlösung (1 ml 0,9%ige NaCl-Lösung, pH-Wert auf 7,0 eingestellt) und füttern Sie sie 2-3 Tage nach SE mit einer 10%igen Saccharoselösung, um die Erholung von dem auf SE folgenden Körpergewichtsverlust zu begünstigen.
- Ordnen Sie überlebende Tiere nach dem Zufallsprinzip verschiedenen Versuchsgruppen zu, entsprechend den Anforderungen des spezifischen Versuchsprotokolls. Verwenden Sie die folgenden Ein-/Ausschlusskriterien für weitere Experimente an epileptischen Ratten: Entwicklung einer konvulsiven SE innerhalb von 1 h nach Pilocarpin-Verabreichung, Gewichtszunahme in der ersten Woche nach SE und die korrekte Positionierung der Elektrode in dem Hirnareal, das für EEG-Registrierungen von Interesse ist25.
6. Tethered Video-EEG bei epileptischen Ratten und Analysen der Anfallsaktivität
HINWEIS: In diesem Abschnitt wird das experimentelle Verfahren zur Aufzeichnung von EEG-Signalen bei einschaligen, sich frei bewegenden Ratten unter Standardbedingungen beschrieben. Der Käfig sollte keine Gegenstände enthalten, in denen das Tier oder das Aufnahmekabel stecken bleiben kann. Abhängig von der zu bearbeitenden wissenschaftlichen Fragestellung können mehrere Parameter analysiert werden. Bei der Epilepsieforschung werden die EEG-Spuren gescreent, um elektrische und motorische Anfälle zu erkennen. Die häufigsten Parameter, die zur Identifizierung eines Anfalls verwendet werden, sind die Amplitude, Frequenz und Dauer der paroxysmalen elektrischen Aktivität.
- Setzen Sie das Tier in einen sauberen Käfig im Aufnahmeraum, um eine Gewöhnung zu ermöglichen und den durch die neue Umgebung verursachten Stress zu reduzieren. Stellen Sie den Käfig des Tieres in einen Faradayschen Käfig, um eine Kontamination des EGG-Signals mit dem elektromagnetischen Feld der Umgebung zu vermeiden.
- Schließen Sie ein Ende des Aufnahmekabels an das Aufnahmegerät an. Verwenden Sie ein Voltmeter, um das elektrische Potential zu messen und zwischen Masse- und Referenzelektroden zu unterscheiden.
- Verbinden Sie das andere Ende des Aufzeichnungskabels mit der Elektrode, die am Kopf der Ratte befestigt ist. Halten Sie dazu die Zementabdeckung auf dem Kopf des Tieres, wenn Sie den Kabelstecker in den Elektrodenstecker einführen, und vermeiden Sie jeglichen Druck auf den Kopf der Ratte.
- Gleichen Sie das Gewicht des Aufzeichnungskabels aus, um eine freie Bewegung des Tieres zu ermöglichen und gleichzeitig die Gefahr eines Verdrehens des Kabels zu vermeiden. Verwenden Sie dazu einen Ausgleichsarm oder Kommutatoren. Auch wenn das Aufzeichnungskabel ausbalanciert ist, legen Sie das Futter in den Käfig statt in eine Futterhalterung, in der sich die Tiere erheben müssen, um an das Futter zu gelangen.
- Bevor Sie mit der Registrierung beginnen, überprüfen Sie alle Einstellungen, mit denen die Daten aus dem EEG erfasst und verarbeitet werden.
HINWEIS: Dieses Protokoll bietet keine Einführung in die Geräte, die für die Durchführung der EEG-Aufzeichnung erforderlich sind, es sollten jedoch angemessene Filter- und Abtastraten angewendet werden, um Artefakte und Rauschen in EEG-Signalen zu vermeiden.- Stellen Sie für ein Routineexperiment die Abtastrate auf 500 Hz und die Verstärkungsverstärkung auf 5000x ein. Filtern Sie das Signal mit einem 0,005-Hz-Filter zusätzlich zu einem Kerbfilter, um die umgebende elektrische Aktivität im 50-Hz-Band (spezifisch für europäische Länder) zu verwerfen.
- Starten Sie sowohl Video- als auch EEG-Aufzeichnungen und stellen Sie sicher, dass die Spuren mit einem erwarteten EEG-Signal übereinstimmen, indem Sie die Leistung in bestimmten Frequenzbändern über die Zeit überprüfen. Zeichnen Sie einen Ausgangszeitraum auf, bevor Sie mit den Interventionen bei den Tieren beginnen.
- Kontrollieren Sie Tiere und EEG-Spuren regelmäßig. Es kommt nicht selten vor, dass sich ein Aufzeichnungskabel vom Elektrodenstecker im Rattenkopf löst. Schließen Sie in diesem Fall die Elektrode im Rattenkopf wieder an ein Aufzeichnungskabel an und prüfen Sie, ob ein klares EEG-Signal vorhanden ist.
- Analysieren Sie das EEG-Signal manuell oder automatisch mit handelsüblicher Software. Wenn Sie manuell analysieren, überprüfen Sie die EEG-Aufzeichnung, um anfallsähnliche Aktivitäten zu identifizieren. Wenn Software verwendet werden soll, konfigurieren Sie die wichtigsten Parameter eines Anfallsereignisses, wie Amplitude, Frequenz und Dauer der elektrischen Aktivität.
ANMERKUNG: Ein einzelner Anfall kann durch eine elektrische Aktivität mit einer Amplitude gekennzeichnet sein, die 3x höher als die Basislinie ist, einer Frequenz, die gleich oder höher als 5 Hz ist, und einer Dauer von mindestens 5 s22. - Unabhängig von der verwendeten Methode sollten Sie die potenziellen Krampfanfälle bestätigen, indem Sie die synchronisierte Videoaufzeichnung überprüfen, die gleichzeitig mit dem EEG aufgezeichnet wurde.
7. Telemetrie-Video-EEG bei epileptischen Ratten und Analyse der Anfallsaktivität
ANMERKUNG: In diesem Abschnitt wird das experimentelle Verfahren zur Aufzeichnung von Radiotelemetrie-EEG-Signalen in einstämmigen, sich frei bewegenden Ratten unter Standardbedingungen beschrieben. Das Protokoll basiert auf einem kommerziell erhältlichen Telemetriesystem. Einige Telemetriesysteme unterscheiden sich jedoch geringfügig in ihren funktionalen und technischen Spezifikationen. Das System sollte in Abhängigkeit von den Anforderungen des Labors und den Forschungszielen ausgewählt werden.
- Platzieren Sie den Tierkäfig über dem Signalempfänger. Verbinden Sie den Signalempfänger mit dem Datenerfassungssystem und diesen mit einem Computer mit der Erfassungssoftware.
- Schalten Sie das Hochfrequenz-Telemetrie-Implantat ein, indem Sie einen Magneten in der Nähe des Telemeters platzieren, das in die Rattenflanke eingesetzt wird. Testen Sie das Signal mit einem Funkgerät. Verwenden Sie ein universelles Funkgerät, um die Telemeter zu testen, und hören Sie einen deutlichen Piepton, der anzeigt, dass der Telemeter aktiviert ist, während ein knisterndes Geräusch auf ein deaktiviertes Telemeter hinweist.
HINWEIS: Die Lebensdauer der Hochfrequenz-Senderbatterie sollte berücksichtigt werden, bevor die Dauer der Aufzeichnungen festgelegt wird. - Richten Sie die Erfassungssoftware ein und synchronisieren Sie das Telemetriesignal und das Videosystem, um gleichzeitig EEG- und Videodaten zu erfassen. Weisen Sie jedem implantierten Sender einen Signalempfänger zu und stellen Sie die Kalibrierungswerte des Senders ein. Stellen Sie die Abtastrate auf 1000 Hz, die Rauscherkennung zwischen -500 mV und +500 mV und das Integrationsintervall auf 100 ms ein. Verwenden Sie keine Tief- und Hochpassfilter.
- Starten Sie die Telemetrie- und Videoaufzeichnungen. Führen Sie eine langfristige Baseline-Aufzeichnung durch, bevor Sie die epileptisch-ähnliche Aktivität erfassen. Analysieren Sie das EEG-Signal wie in den Schritten 6.8 und 6.9 beschrieben.
8. Ablauf der Blutentnahme aus der Schwanzvene
ANMERKUNG. Das Vakuum-Blutentnahmesystem besteht aus einer Schmetterlingsnadel (23 G x 3/4 x 12 (0,8 mm x 19 mm x 305 mm). Die Blutentnahmetechnik kann problemlos von einem Bediener durchgeführt werden und der Eingriff dauert etwa 5 Minuten.
- Die Schmetterlingsnadel und ihr Schlauch werden kurz vor den Entnahmen mit 1 %K2 EDTAin destilliertem Wasser bestrichen, d. h. die K2 EDTA-Lösung mit der 1ml-Spritze eingezogen und aus dem System ausgestoßen. Schneiden Sie den Schlauch direkt hinter der Nadel durch, um Blut tropfenweise ohne Aspiration zu sammeln (Abbildung 1A).
- Setzen Sie die Ratte in eine Induktionskammer und betäuben Sie sie mit Isofluran (1,4 % an der Luft; 1,2 ml/min). Wechseln Sie in den stereotaktischen Rahmen und halten Sie die Anästhesie durch eine Gesichtsmaske aufrecht. Legen Sie das Heizkissen unter das Tier und halten Sie einen Teil seines Schwanzes in direktem Kontakt mit dem Pad.
- Bewegen Sie den Rücken des Tieres vorsichtig zur Seite, so dass die seitliche Schwanzvene oben bleibt.
- Tauchen Sie den Schwanz für 2 Minuten in warmes Wasser (42 °C), um die Seitenvene zu erweitern. Wischen Sie den Schwanz mit 70%igem Ethanol ab, um die Vene besser sichtbar zu machen. Lege warmes Licht mit einer normalen Glühbirne auf den Schwanz.
- Stechen Sie die 21G Butterfly-Nadel mit einer Tiefe von 5 mm und einem Winkel von 20° in die seitliche Schwanzvene. Blut wird in einem 500-μl-Vakuumsammelröhrchen gesammelt, das 5 mg K2EDTAals Antikoagulans enthält (Abbildung 1B,C).
- Entfernen Sie die Nadel und stoppen Sie den Blutfluss, indem Sie Druck auf die Einstichstelle ausüben. Setze die Ratte in ihren Heimatkäfig zurück.
- Drehen Sie das Röhrchen vorsichtig 10x um, um das Antikoagulans im Blut zu mischen. Bohren Sie ca. 1,5 cm tiefe Löcher in das Eis, um die Auffangröhrchen unterzubringen. Legen Sie die Probe vorsichtig und senkrecht auf Eis.
- Die Blutprobe wird in einer gekühlten Zentrifuge (4 °C) bei 1300 x g für 10 min zentrifugiert, um das Plasma abzutrennen. Führen Sie diesen Vorgang innerhalb von maximal 1 Stunde durch.
- Nehmen Sie etwa 200 μl Plasma und vermeiden Sie dabei die rote und weiße Blutkörperchenschicht. Geben Sie das entnommene Plasma in das sterile 0,2-ml-Mikroröhrchen. Bei Bedarf bis zu 1 h nach der Zentrifugation bei 4 °C lagern.
- Legen Sie 5 μl der Probe zur Qualitätskontrolle beiseite. Lagern Sie die Probe bis zur Analyse bei -80 °C.
HINWEIS: Verwenden Sie das Vakuum nicht, auch wenn dies voneinigen Forschern empfohlen wird, und melken Sie den Schwanz während der in Schritt 8.5 beschriebenen Verfahren, um mehr Blut zu gewinnen, da dies die Probenqualität für die nächsten sncRNA-Quantifizierungsanalysen verringert (Einzelheiten finden Sie in den repräsentativen Ergebnissen). Denken Sie daran, dass bei Ratten die maximale Blutmenge, die auf einmal entnommen werden kann, <10 % des Gesamtblutvolumens (d. h. etwa 1,6-1,9 ml bei einer 250-300 g Ratte) und <15 % des gesamten Blutvolumens (etwa 2,64 ml) in 1 Monat beträgt29. In diesem Protokoll werden maximal 500 μl Blut einmalig für bis zu fünf Mal bei einem einzigen Tier entnommen30,31.
9. Verfahren zur Entnahme von GFK
ANMERKUNG. Die Technik kann leicht von einem einzigen Bediener durchgeführt werden, und der Eingriff dauert etwa 2-4 Minuten. Die Materialien, die für die Entnahme von Liquor verwendet werden, sind kostengünstige Einweg-Vakuum-Schmetterlingsnadeln und Extraktionsröhrchen. In diesem Protokoll wird ein Infusionsset mit Schmetterlingsflügeln verwendet, das mit einer sterilen Spritze verbunden ist, um das Vakuum zu erzeugen (Abbildung 2A).
- Bereiten Sie die 23G-Schmetterlingsnadel vor und schneiden Sie den Schutz der Kunststoffhülse so ab, dass das Ende der blanken Nadel um 7 mm freiliegt, um zu verhindern, dass sie während des Entzugs mehr als 7 mm tief in die Cisterna magna eindringt (Abbildung 2B).
- Verbinden Sie die mit einem Polymerschlauch ausgestattete Schmetterlingsnadel mit einer 1-ml-Spritze.
- Die Ratte wird in eine Induktionskammer gegeben und mit Isofluran (1,4 % an der Luft; 1,2 ml/min) betäubt. Schalten Sie den Isofluranfluss auf den stereotaktischen Rahmen um und halten Sie die Anästhesie aufrecht, die durch eine Gesichtsmaske verabreicht wird. Entferne das Fell am Hinterkopf und Hals der Ratte mit einem Rasiermesser.
- Befestigen Sie den Kopf der Ratte mit Ohrstangen. Senken Sie den Kopf des Tieres vertikal um ca. 45° nach unten und bewegen Sie sich dabei an der Nasenleiste des stereotaktischen Rahmens nach unten (Abbildung 2C). Untersuchen Sie den Hinterkopf des Tieres und finden Sie eine leicht eingedrückte Oberfläche mit dem Aussehen einer Raute, zwischen dem Hinterhauptsvorsprung und der Atlaswirbelsäule.
- Reiben Sie diese Oberfläche mit 70%igem Ethanol ein, um sie besser sichtbar zu machen und zu desinfizieren.
- Führen Sie die Schmetterlingsnadel senkrecht in die Mitte der rautenförmigen eingedrückten Fläche in die Zisterna magna für die Liquorentnahme ein, bis die Bewegung durch Zuschneiden der Kunststoffhülse der Nadel blockiert wird (Abbildung 2D). Ziehen Sie den 1-ml-Spritzenkolben vorsichtig zurück, um den Liquor langsam durch die Nadel fließen zu lassen.
- Etwa 100 μl des Liquors werden in Polymerschläuchen gesammelt (Abbildung 2D). Vermeiden Sie das Eindringen von Blut oder anderen sichtbaren Verunreinigungen. Drücken Sie den Polymerschlauch ganz nah an die Butterfly-Nadel und schneiden Sie den Schlauch an dieser Stelle ab.
- Ziehen Sie die durchsichtige (nicht kontaminierte) Probe in die Spritze. Verwerfen Sie die kontaminierte Probe, wenn sichtbare Verunreinigungen in den Auffangschlauch gelangen.
- Die Probe wird in das sterile 0,2-ml-Mikroröhrchen ausgestoßen und bis zu 1 Stunde auf Eis gelagert.
- Desinfizieren Sie die Liquorentnahmestelle am Kopf des Tieres. Entferne die Ratte aus dem stereotaktischen Rahmen und setze sie zurück in ihren Käfig.
- Legen Sie 2 μl der Probe zur Qualitätskontrolle beiseite. Den Rest der Probe zur weiteren Analyse bei -80 °C lagern.
HINWEIS: Wenn bei Ratten wiederholt mehrere Liquorentnahmen durchgeführt werden, beträgt das empfohlene Volumen, das bei jeder Entnahme entnommen werden muss, 100 μl32. In diesem Protokoll wurden bei einem einzigen Tier maximal 100 μl Liquor auf einmal mit 5x maximaler Entnahme in 15 Tagen verabreicht.
10. Spektrophotometrische Analyse der Probenqualität
HINWEIS: Nach der ordnungsgemäßen Entnahme von Liquor- und Plasmaproben sind die Proben bereit für Spektralphotometeranalysen und erfordern keine besondere Handhabung. Messen Sie die Hämoglobin-Absorption mittels UV-Spektrophotometrie bei 414 nm, um das Hämolyserisiko in Proben zu bewerten. Verwenden Sie einen Cut-off-Absorptionswert von 0,25 in Rattenproben. Die Wahl dieses Grenzwerts kann von der anschließenden qPCR-Analyse und ihren spezifischen Anforderungen an die Quantifizierung von sncRNAs abhängen.
- Schalten Sie das UV-Spektralphotometer ein. Wählen Sie die Methode für die Absorptionsmessung bei einer einzelnen Wellenlänge von 414 nm für PLASMA oder CSF. Klicken Sie auf Weiter.
- Spülen Sie die 1 mm Küvette mit gereinigtem Wasser ab. 5 μl 70%iges Ethanol auf den Messfleck der Küvette geben. Mit einem Papiertuch abtrocknen und mit fusselfreiem Seidenpapier abreiben. Prüfen Sie, ob es vollkommen transparent ist.
- Geben Sie 1,5 μl gereinigtes Wasser in die 1-mm-Küvette und verschließen Sie sie. Führen Sie die Küvette in die Messkammer des Spektralphotometers ein und messen Sie die Extinktion der Blindprobe, indem Sie auf die Schaltfläche Blank klicken. Stellen Sie sicher, dass der Absorptionswert bei 414 nm 0,000 beträgt.
- Trocknen Sie die Küvette mit einem Papiertuch ab und reinigen Sie sie mit fusselfreiem Seidenpapier. Prüfen Sie, ob es vollkommen transparent ist.
- Geben Sie 1,5 μl der Probe in die 1-mm-Küvette und verschließen Sie sie. Führen Sie die Küvette in die Messkammer des Spektralphotometers ein. Messen Sie die Probe, indem Sie auf die Schaltfläche Probe klicken. Überprüfen Sie die Absorption der Probe bei 414 nm und kommentieren Sie sie.
- Fahren Sie mit der Quantifizierung der Hämoglobinabsorption in allen verfügbaren Proben fort. Messen Sie die Leerprobe vor einer Plasma- oder Liquorprobe, indem Sie alternativ auf die Schaltflächen Leer und Probe klicken.
- Konservieren Sie die Proben mit A414 nm < 0,25 bei -80 °C und verwerfen Sie die Proben, wenn A414 nm 0,25 >.
- Spülen Sie die 1-mm-Küvette nacheinander mit gereinigtem Wasser und 70%igem Ethanol. Trocknen Sie die Küvette.
- Verschließen Sie die leere Küvette in der Messkammer, um eine Verstaubung zu verhindern. Schalten Sie das Spektralphotometer aus.
Ergebnisse
Das Ergebnis verschiedener Liquor- und Blutentnahmeverfahren, die bei 9 Kontroll- und 18 chronisch epileptischen Ratten durchgeführt wurden, die alle 1 Monat nach der SE mit Elektroden implantiert wurden, wird in Bezug auf die Erfolgsrate berichtet. Nach der Implantation wurden alle Ratten 1 Monat lang mit einem Video-EEG überwacht, wobei der Liquor plus Blut in den beiden letzten Wochen des Experiments (d.h. an den Tagen 52, 55, 58, 61 und 64 nach SE; dpSE) 5x alle 3 Tage entnommen wurde. Daten von mehreren Entnahmen bei verschiedenen Tieren wurden verwendet, um die Erfolgsrate der Liquorentnahme bei den mit Doppelkopfimplantaten ausgestatteten Ratten (kanüliert für die Liquorentnahme) mit der Erfolgsrate der Liquorentnahme (durchgeführt durch Cisterna Magna-Punktion) bei nur angebundenen oder telemetrischen Elektroden implantierten Tieren zu vergleichen (Tabelle 1). Bei verschiedenen Tieren wurde der Einfluss der Vakuumblutentnahme oder des Schwanzmelkens auf die Qualität der Plasmaproben untersucht (Tabelle 2). Zu diesem Zweck wurde die UV-Spektrophotometrie bei 414 nm zum Nachweis von freiem Hämoglobin eingesetzt. Für statistische Analysen wurde kommerzielle Software verwendet, und es wurden Kruskal-Wallis oder eine Einweg-ANOVA mit post-hoc Tukey-Mehrfachvergleichstests verwendet (p<0,05 als statistisch signifikant angesehen). Die Daten werden als Mittelwert ± SEM ausgedrückt.
Erfolgsrate der multiplen Liquorentnahme bei kanülierten und punktierten Ratten
Der Liquor wurde 5x innerhalb von 2 Wochen in 3 Gruppen von Ratten beprobt: (i) kanülierte und mit angebundener Elektrode implantierte Ratten (CT-Gruppe von Tieren); bei diesen wurde die Liquorentnahme über eine Dummy-Führungskanüle und eine PTFE-Schlauchverbindung zu einer 1-ml-Spritze durchgeführt, wenn sie nicht anästhesiert waren und sich unter Video-EEG frei bewegten; ii) punktierte (Schritt 9) und mit angebundener Elektrode implantierte Ratten (PT-Gruppe); (iii) punktierte und telemetrieelektrodenimplantierte Ratten (PTe-Gruppe). Insgesamt wurden 9 Tiere pro Gruppe (6 Epileptiker und 3 Kontrollratten) verwendet. Ausgewertet wurde die Anzahl der erfolgreichen Sammlungen über 5 Mal. Die Erfolgsrate war bei punktierten Ratten ähnlich: 86,7 % ± 5,8 % bei angebundenen und 88,9 % ± 4,8 % bei telemetrieimplantierten Tieren. Stattdessen war die Rate bei den kanülierten Ratten reduziert, wenn auch nicht signifikant unterschiedlich (71,1 % ± 8,9 %, Tabelle 1). Solche Ergebnisse deuten darauf hin, dass die Kanüle auf den Köpfen der Tiere wiederholte Liquorproben stören und Längsschnittstudien beeinträchtigen kann. Die Punktionstechnik eignet sich besser für mehrfache Liquorentnahmen bei elektrodierten Tieren.
Einfluss von Vakuum und Schwanzmelken auf die Plasmasammelmethode
Blut wurde 5x von 9 Ratten (6 Epileptiker und 3 Kontrollratten) an den Tagen 52, 55, 58, 61 und 64 nach SE entnommen und die Plasmaqualität wurde visuell und mittels UV-Spektrophotometrie bei 414 nm auf Hämolyse untersucht. Um die erste Probe bei jeder Ratte zu erhalten, wurde die Vakuumentnahme über eine 21G-Butterfly-Nadel verwendet, die an einer 1-ml-Spritze befestigt war. Bei der zweiten Probe wurden die Tropfenentnahme und das 21G-Schmetterlingsnadelsystem beim gleichzeitigen Melken des Schwanzes eingesetzt. Um die 3.-5. Probe zu erhalten, wurde das Tropfenentnahmeverfahren ohne Melken des Schwanzes (beschrieben in Schritt 9) angewendet.
Bei Verwendung eines Vakuums war das Plasma unter der visuellen Inspektion rosa gefärbt, und der mittlere Absorptionswert der Proben von 9 Ratten betrug 0,647 ± 0,067 (Tabelle 2, Abbildung 3). Ähnliche Ergebnisse wurden erzielt, wenn das Schwanzmelken während des Eingriffs angewendet wurde: rosafarbenes Plasma mit 0,620 ± 0,043 mittlerer Absorption (Tabelle 2, Abbildung 3). Im Gegensatz dazu waren die mittleren Plasmaabsorptionswerte mit dem gravitationsfähigen Tropfenrückzug und dem 21G-Butterfly-Nadelsystem signifikant reduziert (0,226 ± 0,017 bei 58 dpSE; 0,223 ± -0,09 bei 61 dpSE; 0,226 ± 0,018 bei 64 dpSE; Tabelle 2, Abbildung 3) in Bezug auf die Vakuum- oder Schwanzmelkmethode. Darüber hinaus waren die Tropfenplasmaproben überwiegend transparent. Höhere Absorptionswerte (52 und 55 dpSE) korrelierten mit der rosa Farbe der Proben (Daten nicht gezeigt). Diese Ergebnisse könnten darauf hindeuten, dass die letzte Methode die beste ist, um Proben von sehr hoher Qualität für Analysen zu erhalten.

Abbildung 1: Die wichtigsten Schritte des Arbeitsablaufs bei der Plasmaprobenahme. (A) Materialien, die für die Blutentnahme und die Ratte im stereotaktischen Rahmen erforderlich sind, bereit zur Entnahme; (B, C) Vergrößerung des Schwanzes mit 21G Schmetterlingsnadel, die in die seitliche Schwanzvene eingeführt wird, und der Blutstropfen, der mit einem Antikoagulans an den Wänden des Sammelröhrchens herunterfällt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die wichtigsten Schritte des Arbeitsablaufs bei der Probenahme von Liquor (CSF). (A) Materialien, die für die Liquorentnahme und Ratte im stereotaktischen Rahmen kurz vor der Entnahme erforderlich sind; (B) die 23G-Butterfly-Nadelvorbereitung durch Durchschneiden des Kunststoffhüllenschutzes, so dass das Ende der blanken Nadel 7 mm lang freiliegt, um ein korrektes Eindringen in die Cisterna magna zu gewährleisten; (C) Der Rattenkopf ist während des Rückzugs um 45° nach unten geneigt. (D) Vergrößerung an der Rautenstelle mit einer Schmetterlingsnadel, die in die Cisterna magna eingeführt wird. Beachten Sie den Liquor, der im Schlauch aufsteigt, was durch die Spitze des Markers angezeigt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
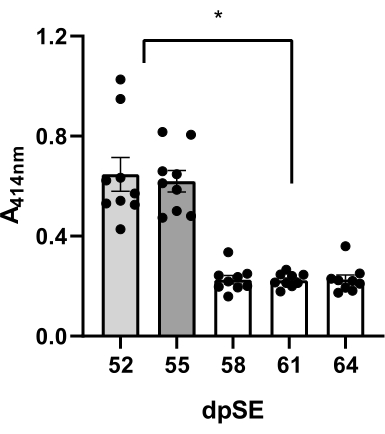
Abbildung 3: Qualitätsbewertung von Plasmaproben. Grad der Hämolyse, gemessen bei 414 nm für freies Hämoglobin durch UV-Spektroskopie in Plasmaproben von 9 Tieren zu 5 Zeitpunkten (52, 55, 58, 61 und 64 Tage nach dem Status epilepticus, dpSE) mit verschiedenen Methoden: Tag 52 - die Vakuumtechnik; Tag 55 - Das Melken der Schwänze; An den Tagen 58-64 wurden die Drop-Techniken angewendet. Die Abnahme des freien Hämoglobins im Plasma, das durch Tropfentechnik im Vergleich zu Vakuum- und Schwanzmelkmethoden erhalten wurde, war signifikant (*p <0,05 gemäß Einweg-ANOVA und post-hoc-Tukey-Mehrfachvergleichstest). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Erfolgsquoten der Entnahme von Liquor. Vergleich der Erfolgsraten der wiederholten Liquorentnahme in drei Versuchsgruppen von Tieren, ausgedrückt als Prozentsatz der erfolgreichen Entnahmen über 5 Tage. Der Wert 1 wurde der erfolgreichen Entnahme von > 100 μl klarem Liquor zugewiesen; Der Nullwert wurde Entnahmen < 100 μl und/oder unklarem Liquor zugewiesen. Abkürzungen: N/A - das Fehlen einer Entnahme aufgrund des Verlusts der Kanüle während des Probenahmeverfahrens (nur CT-Tiere); CT - kanüliert angebunden; PT - punktiert, angebunden; PTe - punktierte Telemetrieelektroden implantiert. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Bewertung der Hämolyse in Plasmaproben. Ergebnisse der Hämolysemessungen zu 5 Zeitpunkten mit drei verschiedenen Methoden der Blutentnahme: Tag 52 - Vakuumtechnik; Tag 55 - Das Melken der Schwänze; Tage 58-64 Die Drop-Techniken. Werte >0,3 der Absorption korrelierten mit der rosa Farbe der Proben. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die vorliegende Arbeit veranschaulicht eine leicht zu beherrschende Technik der Liquor- und Blutentnahme bei Ratten, die nicht nur für Studien in Modellen der Epilepsie, sondern auch für andere neurologische Zustände oder Krankheiten wie Alzheimer, Parkinson oder Multiple Sklerose nützlich sein kann. In der Epilepsieforschung sind beide Probenahmeverfahren gekoppelt mit Video-EEG ideal, wenn eine Korrelation zwischen den Konzentrationen verschiedener löslicher Moleküle und der Anfallsaktivität angestrebt wird. Aus diesem speziellen Grund wurde eine kontinuierliche Video-EEG-Aufzeichnung eingesetzt: i) um Epilepsie korrekt zu diagnostizieren oder ii) um die verschiedenen Phasen des Krankheitsverlaufs zu überwachen und/oder iii) um die Probenentnahme mit dem Auftreten spontaner Anfälle zu korrelieren. Solche Probenahmetechniken können bei anästhesierten Ratten durchgeführt werden und verursachen so minimalen Stress.
Kritische Schritte, Fehlerbehebung, Methodeneinschränkungen
Das Protokoll enthält einige kritische technische Schritte. Erstens kann es schwierig sein, auf Anhieb den richtigen Ort für die Liquorentnahme zu finden. Wenn der Bediener die Cisterna magna beim ersten Versuch verfehlt, wäre jeder weitere Versuch mit Blut verunreinigt, da das Tier aus der Nadelwunde blutet. Unter diesem Gesichtspunkt hängt der Erfolg in der Sammlung stark vom Geschick des Bedieners ab. Zweitens erfordern einige Schritte der Blutentnahme besondere Aufmerksamkeit. Insbesondere besteht ein hohes Hämolyserisiko, wenn der Operateur den Schwanz zu stark mit Ethanol einreibt, wenn die Temperatur des für die Vasodilatation der Schwanzvene verwendeten Wassers höher als 42 °C ist oder wenn das Blut im Sammelröhrchen zu energetisch mit Antikoagulans vermischt wird. Eine weitere Besonderheit der Blutentnahme bei chronisch epileptischen Tieren ist der Einfluss ihrer Bradykardie auf die Geschwindigkeit, mit der das Blut aus der Schwanzvene tropft33. Ist dies zu langsam, kann das Blut an den Wänden des Sammelröhrchens gerinnen. Um dieses Problem zu vermeiden, besteht eine Möglichkeit darin, die Probe in zwei Sammelröhrchen aufzuteilen, wodurch das Volumen des Blutes/der Röhrchen reduziert wird. Schließlich gibt es noch einen Fallstrick, der Epilepsiestudien innewohnt. Der Stress, der durch die Manipulation von Tieren vor der Probenahme hervorgerufen wird, kann Krampfanfälle hervorrufen, die wiederum die Konzentrationen der untersuchten Moleküle beeinträchtigenkönnen 34. Wann immer es möglich ist, stellen Sie die Anästhesie-Induktionskammer in den häuslichen Käfig und lassen Sie das Tier spontan hinein. Als Modifikation des vorgeschlagenen Protokolls kann ein Fixierer verwendet werden, um eine Blutentnahme ohne Isofluran-Anästhesie durchzuführen. Dies kann jedoch in der Telemetrie erfolgen, jedoch nicht bei angebundenen Tieren, da angebundene Ratten bei diesem Verfahren ihre Kopfimplantate verlieren können.
Mit einem gut ausgebildeten Bediener und maximaler Anstrengung, um Stress zu vermeiden, ist die einzige Einschränkung des vorliegenden Protokolls das maximale Volumen, das entnommen werden kann, ohne die Gesundheit des Tieres zu gefährden. Nach den aktuellen Standards wird empfohlen, maximal 100 μl Liquor für 4x über 15 Tage bei einem einzigen Tier zu sammeln32. In ähnlicher Weise wird empfohlen, weniger als 10 % des gesamten Blutkörpervolumens bei einer einzigen Probe und weniger als 15 % des gesamten Blutkörpervolumens in 28 Tagen zu sammeln 30,31.
Vergleich der Methode mit anderen Techniken
Die vorgeschlagenen zeitaufgelösten Liquor- und Plasmaprobenansätze haben mehrere Vorteile gegenüber bestehenden Alternativmethoden. Erstens hat eine Cisterna-Magna-Punktion, die zur Liquorprobe bei epileptischen Ratten verwendet wird, ein geringeres Risiko für den Verlust von Kopfimplantaten im Vergleich zu einem kanülierten System, wenn sie mit einem angebundenen EEG gekoppelt ist. Im Gegensatz zu Punktionsverfahren ist die Kanüle, die mit Zahnzement an der Elektrode befestigt ist (sperrig und schwer für die Köpfe der Tiere), während sie durch wiederholtes Anbringen/Ablösen der Liquorentnahmen angefordert wird, viel anfälliger für den Verlust über mehrere Tage der Probenahme. In der Tat zeigen die Ergebnisse der Erfolgsrate, dass einige kanülierte Tiere (N/A) nicht zu den fortgeschrittenen Probenahmezeitpunkten gelangen, so dass ihre jeweiligen Proben verloren gehen (Tabelle 1). Darüber hinaus scheint die Punktionsmethode dem kanülierten Ansatz in Bezug auf eine bessere Sterilität und eine reduzierte meningeale Reaktion mit begrenztem Anstieg des Zell- und Albumingehalts im Liquor überlegen zu sein, wie bereits durch andere dokumentiert wurde 22,35,36. Der Grad der Liquor-Leukozyten- und Albumin-Kontamination kann für die Validität von Methoden zur Quantifizierung von Epilepsie-Biomarkern wichtig sein35. Zweitens ist die Freifall-Tropfen-Methode der Blutplasmaentnahme, die für wiederholte Messungen verwendet wird, jeder anderen Entnahmemethode überlegen, da sie im Gegensatz zur Enthauptung, Herzpunktion, abdominalen/thorakalen Blutgefäßen oder retroorbitalen Entnahme nicht tödlich ist (nicht wiederherstellend) ist und mehrere Blutentnahmen ermöglicht. Es ist einfacher als viele Schwanzvenen-Blutvakuum-Entnahmetechniken, da es keine Schläuche benötigt28,37 und hämolysefreie Plasmaproben von hoher Qualität für weitere sncRNA-Analysen erzeugt, die sich auf die Identifizierung mutmaßlicher Biomarker der Epileptogenese konzentrieren38. Das Fehlen von freiem Hämoglobin in den Proben bei Anwendung der Tropfenprobenahmetechnik oder bei Vermeidung des Schwanzmelkens wurde durch niedrige Absorptionsergebnisse der Plasmaproben (Tabelle 2) in Übereinstimmung mit zuvor veröffentlichten Verfahren bestätigt, die für die Bestimmung des sncRNA-Plasmagehalts geeignet sind39,40.
Anwendungen und zukünftige Richtungen
Die oben beschriebenen Methoden können angewendet werden, um lösliche Moleküle zu messen, die in jedem Modell neurologischer Erkrankungen von Interesse sind. Ein konkretes Beispiel ist die Probenahme biologischer Flüssigkeiten zur Identifizierung potenzieller/vermeintlicher Epilepsie-Biomarker. Es besteht ein dringender ungedeckter medizinischer Bedarf, diese Biomarker für Menschen mit Epilepsie zu entdecken, insbesondere prognostische und Suszeptibilitäts-/Risiko-Biomarker, da sie noch nicht existieren.
Zusammenfassend lässt sich sagen, dass das vorliegende Protokoll bei Ratten, einschließlich epileptischer Ratten, durchführbar ist und für geschulte Personen leicht umzusetzen ist. Darüber hinaus ermöglicht es mehrere qualitativ hochwertige Stichproben in Längsschnittstudien in Übereinstimmung mit dem Prinzip der 3R (d. h. Ersatz, Reduktion und Verfeinerung)41.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Studie wurde durch einen Zuschuss aus dem Horizon 2020-Arbeitsprogramm der Europäischen Union (Ausschreibung H2020-FETOPEN-2018-2020) im Rahmen der Finanzhilfevereinbarung 964712 (PRIME; an M. Simonato) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Blood collection set BD Vacutainer Safety-Lok | BD Italy SpA, Milan, Italy | 367246 | Material |
| Blood Collection tubes (Microtainer K2E) | BD Italy SpA, Milan, Italy | 365975 | Material |
| Butterfly Winged Infusion Set 23G x 3/4'' 0.6 x 19 mm | Nipro, Osaka, Japan | PSY-23-ET-ICU | Material |
| Centrifuge refrigerated ALC PK 130R | DJB Labcare Ltd, Buckinghamshire, England | 112000033 | Material |
| Cotton suture 3-0 | Ethicon, Johnson & Johnson surgical technologies, Raritan, New Jersey, USA | 7343H | Material |
| Diazepam 5 mg/2ml, Solupam | Dechra Veterinary Products, Torino, Italy | 105183014 (AIC) | Solution |
| Digital video 8-channel media recorder system of telemetry EEG set up | Data Sciences International (DSI), St Paul, MN, USA | PNM-VIDEO-008 | Equipment |
| Digital video surveillance system of tethered EEG set up | EZVIZ Network, Hangzhou, Cina | EZVIZ (V5.3.2) | Equipment |
| Disinfectant based on stabilized peroxides and quaternary ammonium activity | Laboratoire Garcin-Bactinyl, France | LB 920111 | Solution |
| Dummy guide cannula 8 mm | Agn Tho's, Lindigö, Sweden | CXD-8 | Material |
| Electrode 3-channel two-twisted | Invivo1, Plastic One, Roanoke, Virginia, USA | MS333/3-B/SPC | Material |
| Electrode holder for stereotxic surgery | Agn Tho's, Lindigö, Sweden | 1776-P1 | Equipment |
| Eppendorf BioSpectrometer basic | Eppendorf AG, Hamburg, Germany | 6137 | Equipment |
Eppendorf PCR Tubes 0.2 mL | Eppendorf Srl, Milan, Italy | 30124332 | Material |
| Eppendorf μCuvette G1.0 | Eppendorf AG, Hamburg, Germany | 6138 | Equipment |
| Feeding needle flexible 17G for rat | Agn Tho's, Lindigö Sweden | 7206 | Material |
| Grass Technology apparatus | Grass Technologies, Natus Neurology Incorporated, Pleasanton, California, USA | M665G08 | Equipment (AS40 amplifier, head box, interconnecting cables, telefactor model RPSA S40) |
| Isoflurane 100%, IsoFlo | Zoetis, Rome, Italy | 103287025 (AIC) | Solution |
| Ketamine (Imalgene) | Merial, Toulouse, France | 221300288 (AIC) | Solution |
| Lithium chloride | Sigma-Aldrich, Milan, Italy | L9650 | Material |
| Microinjection cannula 31G 9 mm | Agn Tho's, Lindigö Sweden | CXMI-9 | Material |
| MP150 modular data acquisition and analysis system | Biopac, Goleta, California, USA | MP150WSW | Equipment |
| Ophthalmic vet ointment, Hylo night | Ursapharm, Milan, Italy | 941791927 (AIC) | Material |
| Pilocarpine hydrochloride | Sigma-Aldrich, Milan, Italy | P6503 | Material |
| PTFE Tube with joint | Agn Tho's, Lindigö, Sweden | JT-10 | Material |
| Saline | 0.9% NaCl, pH adjusted to 7.0 | Solution | |
| Scopolamine hydrobromide trihydrate | Sigma-Aldrich, Milan, Italy | S2250 | Material |
| Scopolamine methyl nitrate | Sigma-Aldrich, Milan, Italy | S1876 | Material |
| Silver sulfadiazine 1% cream | Sofar, Trezzano Rosa, Milan, Italy | 025561010 (AIC) | Material |
| Simplex rapid dental methacrylic cement | Kemdent, Associated Dental Products Ltd, Swindon, United Kingdom | ACR811 | Material |
| Stereotaxic apparatus | David Kopf Instruments, Los Angeles, CA, USA | Model 963 | Equipment |
| Sucrose solution | 10% sucrose in distilled water | Home-made | Solution |
| Syringe 1 mL | Biosigma, Cona, Venezia, Italy | 20,71,26,03,00,350 | Material |
| Telemeters | Data Sciences International (DSI), St Paul, MN, USA | CTA-F40 | Material |
| Telemetry EEG traces analyzer | Data Sciences International (DSI), St Paul, MN, USA | NeuroScore v3-0 | Equipment |
| Telemetry system | Data Sciences International (DSI), St Paul, MN, USA | Hardware plus software Ponemah core 6.51 | Equipment |
| Xylazine hydrochloride | Sigma-Aldrich, Milan, Italy | X1251 | Material |
Referenzen
- Hanin, A., et al. Cerebrospinal fluid and blood biomarkers of status epilepticus. Epilepsia. 61 (1), 6-18 (2020).
- Pitkänen, A., et al. Advances in the development of biomarkers for epilepsy. The Lancet Neurology. 15 (8), 843-856 (2016).
- Dlugos, D., et al. Childhood Absence Epilepsy Study Team (2013). Pretreatment EEG in childhood absence epilepsy: associations with attention and treatment outcome. Neurology. 81 (2), 150-156 (2013).
- Lorenzo, N. Y., et al. Intractable frontal lobe epilepsy: pathological and MRI features. Epilepsy research. 20 (2), 171-178 (1995).
- van Dellen, E., et al. Epilepsy surgery outcome and functional network alterations in longitudinal MEG: a minimum spanning tree analysis. NeuroImage. 86, 354-363 (2014).
- Shah, A. K., Mittal, S. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy of Neurology. 17 (Suppl 1), S89-S94 (2014).
- Whiting, P., et al. A systematic review of the effectiveness and cost-effectiveness of neuroimaging assessments used to visualise the seizure focus in people with refractory epilepsy being considered for surgery. Health technology assessment. 10 (4), 1-iv (2006).
- Lenkov, D. N., Volnova, A. B., Pope, A. R., Tsytsarev, V. Advantages and limitations of brain imaging methods in the research of absence epilepsy in humans and animal models. Journal of neuroscience methods. 212 (2), 195-202 (2013).
- Leach, J. P., Stephen, L. J., Salveta, C., Brodie, M. J. Which electroencephalography (EEG) for epilepsy? The relative usefulness of different EEG protocols in patients with possible epilepsy. Journal of neurology, neurosurgery, and psychiatry. 77 (9), 1040-1042 (2006).
- Huppertz, H. J., et al. Localization of interictal delta and epileptiform EEG activity associated with focal epileptogenic brain lesions. NeuroImage. 13 (1), 15-28 (2001).
- Linder, C., et al. Comparison between dried blood spot and plasma sampling for therapeutic drug monitoring of antiepileptic drugs in children with epilepsy: A step towards home sampling. Clinical biochemistry. 50 (7-8), 418-424 (2017).
- Wegner, I., Wilhelm, A. J., Lambrechts, D. A., Sander, J. W., Lindhout, D. Effect of oral contraceptives on lamotrigine levels depends on comedication. Acta neurologica Scandinavica. 129 (6), 393-398 (2014).
- Palmio, J., et al. CSF and plasma adipokines after tonic-clonic seizures. Seizure. 39, 10-12 (2016).
- Hogg, M. C., et al. Elevation in plasma tRNA fragments precede seizures in human epilepsy. Journal of Clinical Investigation. 129 (7), 2946-2951 (2019).
- Ellul, M., Solomon, T. Acute encephalitis - diagnosis and management. Clinical medicine. 18 (2), 155-159 (2018).
- Diamond, M. L., et al. IL-1β associations with posttraumatic epilepsy development: a genetics and biomarker cohort study. Epilepsia. 55 (7), 1109-1119 (2014).
- Auvin, S., et al. Prospective clinical trials to investigate clinical and molecular biomarkers. Epilepsia. 58 (Suppl 3), 20-26 (2017).
- Weber, Y. G., Nies, A. T., Schwab, M., Lerche, H. Genetic biomarkers in epilepsy. Neurotherapeutics. 11 (2), 324-333 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), e880(2008).
- Gardiner, T. W., Toth, L. A. Stereotactic Surgery and Long-Term Maintenance of Cranial Implants in Research Animals. Contemporary Topics in Laboratory Animal Science. 38 (1), 56-63 (1999).
- Westergren, I., Johansson, B. B. Changes in physiological parameters of rat cerebrospinal fluid during chronic sampling: evaluation of two sampling methods. Brain Research Bulletin. 27 (2), 283-286 (1991).
- Soukupová, M., et al. Impairment of GABA release in the hippocampus at the time of the first spontaneous seizure in the pilocarpine model of temporal lobe epilepsy. Experimental Neurology. 257, 39-49 (2014).
- Soukupová, M., et al. Microdialysis of Excitatory Amino Acids During EEG Recordings in Freely Moving Rats. Journal of Visualized Experiments. (141), e58455(2018).
- Guarino, A., et al. Low-dose 7,8-Dihydroxyflavone Administration After Status Epilepticus Prevents Epilepsy Development. Neurotherapeutics. 19 (6), 1951-1965 (2022).
- Curia, G., Longo, D., Biagini, G., Jones, R. S. G., Avoli, M. The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods. 172 (2), 143-157 (2008).
- Racine, R. J. Modification of seizure activity by electrical stimulation: II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Zou, W., et al. Repeated Blood Collection from Tail Vein of Non-Anesthetized Rats with a Vacuum Blood Collection System. Journal of Visualized Experiments. (130), e55852(2017).
- Blood sampling: Rat. , https://nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-rat (2022).
- Powles-Glover, N., Kirk, S., Wilkinson, C., Robinson, S., Stewart, J. Assessment of toxicological effects of blood microsampling in the vehicle dosed adult rat. Regulatory Toxicology and Pharmacology. 68 (3), 325-331 (2014).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animal. 32 (4), 369-376 (1998).
- Wang, D., Zhao, Y., Yang, Y., Xie, H. Safety assessment of multiple repeated percutaneous punctures for the collection of cerebrospinal fluid in rats. Brazilian Journal of Medical and Biological Research. 54 (6), e10032(2021).
- Möller, C., et al. Impact of repeated kindled seizures on heart rate rhythms, heart rate variability, and locomotor activity in rats. Epilepsy & Behavior. 92, 36-44 (2019).
- Espinosa-Garcia, C., Zeleke, H., Rojas, A. Impact of Stress on Epilepsy: Focus on Neuroinflammation-A Mini Review. International Journal of Molecular Sciences. 22 (8), 4061(2021).
- Cassar, S. C., et al. Comparing levels of biochemical markers in CSF from cannulated and non-cannulated rats. Journal of Neuroscience Methods. 192 (2), 249-253 (2010).
- Huang, Y. L., Säljö, A., Suneson, A., Hansson, H. A. Comparison among different approaches for sampling cerebrospinal fluid in rats. Brain Research Bulletin. 41 (5), 273-279 (1996).
- Hattori, N., Takumi, A., Saito, K., Saito, Y. Effects of serial cervical or tail blood sampling on toxicity and toxicokinetic evaluation in rats. Journal of Toxicological Sciences. 45 (10), 599-609 (2020).
- Roncon, P., et al. MicroRNA profiles in hippocampal granule cells and plasma of rats with pilocarpine-induced epilepsy--comparison with human epileptic samples. Scientific Reports. 5, 14143(2015).
- van Vliet, E. A., et al. Standardization procedure for plasma biomarker analysis in rat models of epileptogenesis: Focus on circulating microRNAs. Epilepsia. 58 (12), 2013-2024 (2017).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), e24145(2011).
- Grimm, H., et al. Advancing the 3Rs: innovation, implementation, ethics and society. Frontiers in Veterinary Science. 10, 1185706(2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten