Method Article
أخذ عينات من السائل الدماغي الشوكي والدم من الوريد الذيل الجانبي في الفئران أثناء تسجيلات EEG
In This Article
Summary
يظهر البروتوكول عمليات جمع متكررة للسائل النخاعي والدم من الفئران المصابة بالصرع بالتوازي مع المراقبة المستمرة لتخطيط كهربية الدماغ بالفيديو (EEG). هذه مفيدة لاستكشاف الروابط المحتملة بين التغيرات في جزيئات سوائل الجسم المختلفة ونشاط النوبات.
Abstract
نظرا لأن تكوين سوائل الجسم يعكس العديد من الديناميات الفسيولوجية والمرضية ، يتم الحصول على عينات السائل البيولوجي بشكل شائع في العديد من السياقات التجريبية لقياس الجزيئات ذات الأهمية ، مثل الهرمونات أو عوامل النمو أو البروتينات أو الحمض النووي الريبي الصغير غير المشفر. مثال محدد هو أخذ عينات من السوائل البيولوجية في البحث عن المؤشرات الحيوية للصرع. في هذه الدراسات ، من المستحسن مقارنة مستويات الجزيئات في السائل النخاعي (CSF) وفي البلازما ، عن طريق سحب السائل الدماغي الشوكي والبلازما بالتوازي والنظر في المسافة الزمنية لأخذ العينات من وإلى النوبات. يعد الجمع بين CSF وأخذ عينات البلازما ، إلى جانب مراقبة تخطيط كهربية الدماغ بالفيديو في المصابة بالصرع ، نهجا واعدا للتحقق من صحة المؤشرات الحيوية التشخيصية والتنبؤية المفترضة. هنا ، يتم وصف إجراء انسحاب السائل الدماغي الشوكي المشترك من الصهريج العظيم وأخذ عينات الدم من الوريد الجانبي للذيل في الفئران المصابة بالصرع والتي يتم مراقبتها باستمرار بواسطة تخطيط كهربية الدماغ بالفيديو. يوفر هذا الإجراء مزايا كبيرة مقارنة بالتقنيات الأخرى شائعة الاستخدام. يسمح بأخذ العينات بسرعة مع الحد الأدنى من الألم أو الغزو ، وتقليل وقت التخدير. بالإضافة إلى ذلك ، يمكن استخدامه للحصول على عينات CSF والبلازما في كل من الفئران المسجلة EEG المربوطة والقياس عن بعد ، ويمكن استخدامه بشكل متكرر عبر أيام متعددة من التجربة. من خلال تقليل الإجهاد الناتج عن أخذ العينات عن طريق تقصير تخدير الأيزوفلوران ، من المتوقع أن تعكس التدابير بشكل أكثر دقة المستويات الحقيقية للجزيئات التي تم فحصها في السوائل الحيوية. اعتمادا على توافر مقايسة تحليلية مناسبة ، يمكن استخدام هذه التقنية لقياس مستويات جزيئات متعددة ومختلفة أثناء إجراء تسجيل EEG في نفس الوقت.
Introduction
يعد السائل الدماغي الشوكي (CSF) وأخذ عينات الدم مهمين لتحديد المؤشرات الحيوية للصرع والتحقق من صحتها ، في كل من الأبحاث قبل السريرية والسريرية 1,2. في الوقت الحاضر ، يركز تشخيص الصرع ومعظم الأبحاث حول المؤشرات الحيوية للصرع على EEG والتصوير العصبي3،4،5. غير أن هذه النهج تنطوي على العديد من القيود. بصرف النظر عن قياسات فروة الرأس الروتينية ، في كثير من الحالات ، يتطلب تخطيط كهربية الدماغ تقنيات غازية مثل أقطاب العمق6. تتميز طرق تصوير الدماغ بضعف الدقة الزمنية والمكانية وهي مكلفة نسبيا وتستغرقوقتا طويلا 7,8. ولهذا السبب، فإن تحديد المؤشرات الحيوية غير الغازية والمنخفضة التكلفة والقائمة على السوائل الحيوية من شأنه أن يوفر بديلا جذابا للغاية. بالإضافة إلى ذلك ، يمكن دمج هذه المؤشرات الحيوية للسوائل الحيوية مع مناهج التشخيص المتاحة لشحذ قدرتها على التنبؤ.
يتم تقديم المرضى الذين تم تشخيص إصابتهم بالصرع بشكل روتيني إلى EEG 9,10 وأخذ عينات الدم11,12,13,14 ، والعديد منهم أيضا إلى انسحاب السائل الدماغي النخاعي لاستبعاد الأسباب التي تهدد الحياة (مثل الالتهابات الحادة والتهاب الدماغ المناعي الذاتي)15. يمكن استخدام عينات الدم والسائل الدماغي الشوكي هذه في الأبحاث السريرية التي تهدف إلى تحديد المؤشرات الحيوية للصرع. على سبيل المثال ، وجد هوغ وزملاؤه في العمل أن الزيادة في ثلاث شظايا من الحمض النووي الريبي البلازمي تسبق حدوث النوبات في الصرع البشري14. وبالمثل ، يمكن لمستويات إنترلوكين -1بيتا (IL-1β) في السائل الدماغي النخاعي البشري والمصل ، معبرا عنها كنسبة من مستويات IL-1β في السائل الدماغي النخاعي على المصل ، أن تتنبأ بتطور الصرع بعد الصدمة بعد إصابة الدماغالرضحية 16. تسلط هذه الدراسات الضوء على أهمية أخذ عينات السوائل الحيوية لأبحاث المؤشرات الحيوية للصرع ، لكنها تواجه قيودا متعددة جوهرية للتجارب السريرية ، على سبيل المثال ، العامل التأسيسي للأدوية المضادة للصرع (AEDs) في الدم ، والنقص المتكرر في معلومات المسببات ، وعدم كفاية الضوابط ، وأعداد متواضعة من المرضى ، وغيرهم17،18.
توفر الأبحاث قبل السريرية فرصا أخرى للتحقيق في الجزيئات في السوائل الحيوية كمؤشرات حيوية محتملة للصرع. في الواقع ، من الممكن سحب البلازما و / أو السائل الدماغي الشوكي من أثناء إجراء تسجيلات EEG. علاوة على ذلك ، يمكن إجراء أخذ العينات بشكل متكرر عبر أيام متعددة من التجربة ، ويمكن استخدام عدد من عناصر التحكم المتطابقة مع العمر والجنس والصرع لتحسين قوة الدراسة. هنا ، يتم وصف تقنية مرنة للحصول على السائل الدماغي الشوكي من cisterna magna مع الانسحاب المتوازي للبلازما من الوريد الذيلي في الفئران التي يراقبها EEG بالتفصيل. التقنية المقدمة لها العديد من المزايا على الطرق البديلة. باستخدام نهج إبرة الفراشة ، من الممكن جمع السائل الدماغي النخاعي عدة مرات دون المساس بوظيفة أقطاب EEG أو غرسات الرأس المماثلة. وهذا يمثل صقلا لإجراءات سحب القسطرة داخل القراب ، والتي ترتبط بخطر مرتفع نسبيا للإصابة بالعدوى. بالإضافة إلى ذلك ، فإن نهج إسقاط السقوط الحر المبلغ عنه المستخدم لجمع الدم يتفوق على الأساليب الأخرى لسحب الدم في الوريد الذيل بسبب انخفاض خطر انحلال الدم بشكل كبير ، نظرا لحقيقة أن الدم لا يمر عبر الأنابيب ولا يتم تطبيق ضغط فراغ. إذا تم إجراؤها في ظل ظروف صارمة خالية من الجراثيم ، فهناك خطر منخفض بشكل خاص للإصابة بالحيوانات. بالإضافة إلى ذلك ، من خلال بدء سحب الدم في نهاية ذيول ، يمكن تكرار أخذ العينات عدة مرات. من السهل إتقان هذه التقنيات ويمكن تطبيقها في العديد من الدراسات قبل السريرية لاضطرابات الجهاز العصبي المركزي.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة فيرارا ووزارة الصحة الإيطالية (الترخيص: D.M. 603/2022-PR) وفقا للمبادئ التوجيهية الموضحة في توجيه مجلس المجتمعات الأوروبية المؤرخ 24 نوفمبر 1986 (86/609 / EEC) بشأن حماية المستخدمة لأغراض تجريبية وعلمية أخرى. تم تعديل هذا البروتوكول خصيصا لمزيد من تحليلات تفاعل البوليميراز المتسلسل الكمي (qPCR) للحمض النووي الريبي الصغير غير المشفر (sncRNAs) في السائل الدماغي الشوكي للفئران والبلازما التي تم الحصول عليها تحت سيطرة EEG في المصابة بالصرع. حسب اختياره ، يرجى الاطلاع على فيديو JoVE ذي الصلة لفهم أفضل وتحسينات الجراحة19،20،21.
1. إعداد للزرع الجراحي للأقطاب الكهربائية أو أجهزة القياس عن بعد
ملاحظة: تختلف تقنية الجراحة التجسيمية وفقا لنظام تخطيط كهربية الدماغ المستخدم. يوفر قسم الطريقة التالي وصفا للخطوات المشتركة بين نوعي العمليات الجراحية.
- استخدم فئران Sprague-Dawley (SD) (ذكور ، عمرها 7-8 أسابيع ، تزن 250-290 جم) يتم الاحتفاظ بها وفقا للقوانين المحلية لرعاية واستخدام المختبر. إيواء في ظل ظروف قياسية مع حرية الوصول إلى الطعام ومياه الشرب.
- استمر في التعامل مع الفئران لبضعة أيام قبل الجراحة وإجراءات البروتوكول التجريبي.
- استخدم جهازا مجسما للأقطاب الكهربائية أو زرع أجهزة القياس عن بعد. اتباع المعايير المعاصرة لجراحات التعقيم. استخدم أقطاب كهربائية وأجهزة إرسال معقمة وجيدة العمل.
- حلق رأس بشفرة الحلاقة الكهربائية. تحفيز التخدير في بمزيج من الكيتامين (45 مجم / كجم) والزيلازين (7.5 مجم / كجم) يتم إعطاؤه داخل الصفاق (IP) ، ثم أضف تخدير الأيزوفلوران (1.4٪ في الهواء ؛ 1.2 مل / دقيقة) يتم تسليمه من خلال قناع الوجه وتثبيت رأس في الجهاز التجسيمي.
- تأكد من عمق التخدير الكافي عن طريق اختبار منعكس سحب الدواسة بعد قرصة وسادة القدم على القدمين الخلفيتين لكلا الحيوانين والحفاظ على تخدير الأيزوفلوران حتى نهاية الجراحة. تحقق بانتظام من عمق التخدير طوال مدة الإجراء.
- ضع كمية كافية من مرهم العين على عيون كلا الحيوانين لمنع تلف القرنية بسبب فقدان منعكس الوميض الناجم عن التخدير.
- قم بتنظيف فروة رأس جيدا بمطهر سائل وقم بعمل قطع طولي بطول 2 سم باستخدام مشرط معقم. افتح فروة الرأس وضع المشابك الجراحية على اللوحات الجلدية لإبقائها مفتوحة.
- برفق ، افصل السمحاق لفضح البريغما ومنطقة الجمجمة التي سيتم من خلالها إدخال قطب التسجيل.
2. الزرع الجراحي للأقطاب المربوطة
ملاحظة: قبل إنشاء إجراء سحب السائل الدماغي الشوكي لهذا البروتوكول (انظر الخطوة 9 للحصول على التفاصيل) ، تم إجراء عمليات سحب متكررة من السائل الدماغي الشوكي عبر قنية إرشادية في عدد قليل من الفئران غير المخدرة التي تتحرك بحرية. تم استخدام ذات القنية المزروعة بأقطاب كهربائية مربوطة من أجل تقييم تأثير الغرسات ذات الرأس المزدوج على تسجيل EEG على المدى الطويل إلى جانب أخذ عينات متعددة من السائل الدماغي النخاعي. في هذه التجارب المحددة ، تم زرع الفئران بقنية إرشادية وهمية موضوعة في الصهريج العظيم ، تم إدخال طرفها 7 مم فيه بشكل مجسم ، وفقا للبروتوكولاتالمنشورة سابقا 22. كانت مناهج جراحة الزرع المزدوج مماثلة لتلك التي اعتمدها بعض العمال في الماضي لدليل غسيل الكلى وزرع القطب المربوط23,24.
- استخدم ذراعا واحدة من الإطار التجسيمي ، وقم بتركيب حامل القطب عليه ، وضع القطب في وضع مستقيم في الحامل. حرك طرف القطب فوق البريجما بالضبط. اكتب الإحداثيات الأمامية الخلفية والمتوسطة لبريغما وترجمها إلى الإحداثيات المطلوبة.
- اخفض القطب حتى يلامس طرفه الجمجمة تقريبا. ضع علامة على بقعة الحفر وحفر الجمجمة على المكان المحدد. احرص على عدم إتلاف الدماغ والسحايا.
- اصنع أربعة ثقوب أو أكثر لتثبيت البراغي وقم بتثبيتها في الجمجمة. انتبه إلى حجم القطب عند عمل ثقوب لتثبيت البراغي. يجب ألا يتداخل حجم القطب مع مسامير التثبيت الموضوعة.
- قم بخفض الذراع التجسيمي الذي يحمل القطب على المحور الظهري البطني ببطء ، وأدخل أنسجة المخ ، وتوقف عند الموضع المطلوب. ثبت السلك الأرضي الكهربائي حول أحد البراغي المثبتة في الجمجمة.
- ضع الأسمنت الميثاكريليك على القطب والبراغي التي تغطي حوالي نصف ارتفاع قاعدة القطب. اترك الجزء النصف العلوي من القطب ، الذي يناسب نهاية سلك الربط ، عاريا.
- حرر القطب من الحامل وارفع ذراع التجسيم. الافراج عن من جهاز stereotaxic وإعطائه الرعاية بعد العملية الجراحية.
- ضع في قفص استرداد منفصل وراقبه كل 10 دقائق حتى يستيقظ ومتنقل. إعادة إلى قفصه السكني القياسي وإلى شركة أخرى غير مخدرة فقط بعد الشفاء التام.
3. الزرع الجراحي لأجهزة القياس عن بعد
ملاحظة: استخدم أجهزة قياس التحكم عن بعد المعقمة فقط. إذا تم إعادة استخدام أجهزة القياس عن بعد ، فقم بتنظيفها وتعقيمها قبل الجراحة وفقا لتعليمات الشركة المصنعة. في هذا البروتوكول ، تم استخدام مقاييس تليمتر دولية لعلوم البيانات (DSI) لتسجيل EEG.
- قم بتشغيل جهاز إرسال القياس عن بعد باستخدام مغناطيس واختبر الإشارة باستخدام راديو تردد AM. تحقق من وجود إشارة قوية وواضحة قبل الجراحة. إذا لزم الأمر ، تخلص من أجهزة القياس عن بعد السيئة التي تعمل عن بعد.
- قم بإعداد خيوط مقياس الاتصال عن بعد عن طريق تقصيرها إلى الأطوال المثلى للفئران البالغة. قشر طلاء السيليكون على سلكين (سلبيين وإيجابيين) ، مما يعرض حوالي 5 مم من الرصاص الفولاذي الحلزوني. قم بإنشاء مقبض حلقي يبلغ طوله حوالي 2 مم وعرضه 1 مم عند طرف الخيوط.
- حلق جناح تحت وخلف الكتف الأيسر. تطهير منطقة الجراحة بمطهر على أساس بيروكسيدات مستقرة ونشاط الأمونيوم الرباعي. دع المطهر يعمل لمدة 15 دقيقة.
- قم بعمل شق جانبي بطول 2 سم خلف كتف مباشرة وقم بعمل جيب تحت الجلد بمساحة حوالي 5 سم3 لوضع جهاز الإرسال. ضع جهاز الإرسال موازيا للمحور الطويل للجسم ، مع توجيه الخيوط إلى اتجاه المنضدة.
- ثبت جهاز الإرسال على الجدار الداخلي للجيب تحت الجلد بخياطة قطنية 3-0. باستخدام مقص غير حاد ، قم بإنشاء النفق تحت الجلد (طوله حوالي 2.5 سم) عبر جناح وعنق ، وبالتالي توصيل جيب جهاز الإرسال بشق خط الوسط الذي تم إجراؤه على فروة رأس في الخطوة 1.6.
- خذ كلا من خيوط أجهزة القياس عن بعد بالملقط واسحبها لأعلى عبر النفق ، بحيث تبرز من مخرج شق فروة الرأس. أمسك الخيوط من شق فروة الرأس بمشابك الجرح.
- استخدم الإطار التجسيمي لتمييز الإحداثيات المطلوبة للرصاص الموجب (الأحمر) وحفر الثقب في الجمجمة للحصول على طرف الرصاص الموجب (على غرار الخطوة 2.1.). اصنع فتحة أخرى لتثبيت المسمار لأعلى على المنصة وقم بتثبيته في الجمجمة.
- أدخل طرف الرصاص الإيجابي تحت قلنسوة القلنسوة والجافية وضعه على سطح الدماغ. قم بتوصيل الطرف الحلقي للرصاص السالب (الأبيض) على المسمار. ضع كمية صغيرة من الأسمنت الميثاكريليك حول مخرج الرصاص الموجب والرصاص السلبي لشل حركتهما على الجمجمة.
- إصلاح يؤدي إلى الجدار الداخلي لجلد الجمجمة مع خياطة القطن 3-0. تأكد من أن الخيوط الثابتة والخيط المثبت لن تتداخل مع موقع انسحاب السائل الدماغي النخاعي (أي سطح قابل للانخفاض مع ظهور المعين بين النتوء القذالي والعمود الفقري للأطلس).
- أغلق شق فروة الرأس وشق الخاصرة باستخدام خياطة قطنية 3-0. ضع المطهرات على الجروح. فقط بعد أن تجف ، ضع كريم مضاد حيوي على الجروح المخيطة.
4. رعاية ما بعد الجراحة
- مراقبة لمدة 1 ساعة بعد الجراحة حتى تستقيم وتتحرك حول القفص. احتفظ بها على وسادة تدفئة لمنع انخفاض حرارة الجسم. إدارة مع المضادات الحيوية الجهازية لمنع العدوى ومسكن الجهازية لمنع الألم بعد الجراحة لمدة 2-3 أيام.
- السماح للفئران بالتعافي لمدة 7 أيام على الأقل بعد العمليات الجراحية. راقب مرة واحدة على الأقل يوميا لمدة 3 أيام بحثا عن علامات الألم أو الضيق.
5. حالة تحريض الصرع في الفئران
ملاحظة: للحصول على بروتوكول مفصل لتحريض حالة الصرع (SE) اللازم لإعادة إنتاج صرع الفص الصدغي المتوسط (mTLE) في الفئران ، راجع Guarino et al.25.
- بعد أسبوع من التعافي بعد الجراحة ، قم بتعيين بشكل عشوائي إلى مجموعات: (i) مراقبة التي تتلقى مركبة و (ii) الصرع التي ستتلقى بيلوكاربين. استخدم عددا أكبر نسبيا من لمجموعة الصرع ، حيث لن تنجو جميع الفئران التي تدار بيلوكاربين أو تتطور SE.
- في اليوم السابق لتحريض SE ، أعط جرعة واحدة من 127 مجم / كجم من كلوريد الليثيوم المذاب في محلول ملحي 0.9٪ (3M) بحجم 1 مل / كجم عن طريق التزويج المعدي. إدارة الليثيوم الحيواني ، مما يزيد من فعالية بيلوكاربين26 ، حوالي 14 ساعة قبل تحريض SE من أجل تقليل التباين في الوقت المناسب لبداية SE.
- بعد حوالي 14 ساعة من إعطاء الليثيوم ، أعط الفئران حقنة واحدة من ميثيل سكوبولامين (1 مجم / كجم ، تحت الجلد).
- بعد 30 دقيقة بالضبط من إعطاء ميثيل سكوبولامين ، أعط الفئران حقنة واحدة من بيلوكاربين (50 مجم / كجم ، i.p) للحث على SE. إعطاء ميثيل سكوبولامين ومركبة (0.9٪ محلول كلوريد الصوديوم) للسيطرة على الفئران.
- يؤدي حقن بيلوكاربين إلى سلوك نموذجي في: نوبات جزئية مبكرة (حركات الاهتزازات وإيماءات الرأس في غضون 5 دقائق بعد إعطاء بيلوكاربين) تتطور إلى تشنجات معممة متكررة (SE) في غضون 25-30 دقيقة. بالنسبة للفئران التي لا تصاب ب SE في غضون 30 دقيقة ، يتم تطبيق جرعة إضافية من بيلوكاربين (25 مجم / كجم ، i.p.) ، وإذا كانت لا تزال لا تتطور SE ، يتم استبعادها من الدراسة (SE غير المستجيبين).
- مراقبة وتسجيل سلوك النوبة في الفئران كل 5 دقائق تبدأ مباشرة بعد حقن بيلوكاربين. استخدم مقياس راسين لتسجيل27.
- يجب إيقاف SE 2h بعد البدء عن طريق إعطاء i.p. لكوكتيل من الأدوية: ديازيبام (10 ملغ/كغ)، فينوباربيتال (25 ملغ/كغ)، سكوبولامين (1 ملغ/كغ).
- أعط الفئران هذا الكوكتيل مرة أخرى بعد 4 ساعات. أخيرا ، بعد 4 ساعات أخرى ، أعط الفئران أي الخليط الأخير من الأدوية (ديازيبام 10 مجم / كجم بالإضافة إلى سكوبولامين 1 مجم / كجم) من أجل إيقاف نشاط النوبة تماما.
- حقن بالمحلول الملحي (1 مل من محلول كلوريد الصوديوم 0.9٪ ، وتعديل درجة الحموضة إلى 7.0) وإطعامها بمحلول سكروز 10٪ لمدة 2-3 أيام بعد SE لصالح التعافي من فقدان وزن الجسم الذي يتبع SE.
- تعيين الباقية بعد SE بشكل عشوائي لمجموعات تجريبية مختلفة وفقا لمتطلبات البروتوكول التجريبي المحدد. استخدم معايير التضمين / الاستبعاد التالية لمزيد من التجارب على الفئران المصابة بالصرع: تطوير SE المتشنج في غضون 1 ساعة بعد إعطاء بيلوكاربين ، وزيادة الوزن في الأسبوع الأول بعد SE ، والموضع الصحيح للقطب في منطقة الدماغ ذات الأهمية لتسجيلات EEG25.
6. ربط الفيديو EEG في الفئران الصرع وتحليل نشاط النوبات
ملاحظة: يصف هذا القسم الإجراء التجريبي لتسجيل إشارات EEG في الفئران ذات المنزل الواحد والتي تتحرك بحرية في ظل الظروف القياسية. يجب ألا يحتوي القفص على أشياء يمكن أن يعلق فيها أو كابل التسجيل. اعتمادا على السؤال العلمي الذي يجب معالجته ، يمكن تحليل العديد من المعلمات. في حالة أبحاث الصرع ، يتم فحص آثار EEG للتعرف على النوبات الكهربائية والحركية. المعلمات الأكثر شيوعا المستخدمة لتحديد النوبة هي سعة وتواتر ومدة النشاط الكهربائي الانتيابي.
- ضع في قفص نظيف في غرفة التسجيل للسماح بالتعود وتقليل الإجهاد الناجم عن البيئة الجديدة. ضع قفص في قفص فاراداي لتجنب تلوث إشارة EGG بالمجال الكهرومغناطيسي البيئي.
- قم بتوصيل أحد طرفي كابل التسجيل بجهاز التسجيل. استخدم الفولتميتر لقياس الجهد الكهربي والتفريق بين الأقطاب الأرضية والأقطاب المرجعية.
- قم بتوصيل الطرف الآخر من كابل التسجيل بالقطب المثبت على رأس الفأر. لهذا الهدف ، أمسك الغطاء الأسمنتي على رأس عند إدخال قابس الكابل في موصل القطب وتجنب ممارسة أي ضغط على رأس الجرذ.
- موازنة وزن كابل التسجيل للسماح بحرية حركة مع منع خطر التواء الكابل. للقيام بذلك ، استخدم ذراع موازنة أو مبدلات. حتى إذا كان كابل التسجيل متوازنا ، ضع الطعام داخل القفص بدلا من حامل التغذية ، حيث يجب أن ترتفع للوصول إلى الطعام.
- قبل البدء في التسجيل ، تحقق من جميع الإعدادات المستخدمة للحصول على البيانات ومعالجتها من EEG.
ملاحظة: لا يوفر هذا البروتوكول مقدمة للجهاز المطلوب لإجراء تسجيل EEG ، ومع ذلك ، يجب تطبيق معدلات ترشيح وأخذ عينات كافية لتجنب القطع الأثرية والضوضاء في إشارات EEG.- لإجراء تجربة روتينية ، اضبط معدل العينة على 500 هرتز ، وكسب التضخيم عند 5000x. قم بتصفية الإشارة باستخدام مرشح 0.005 هرتز بالإضافة إلى مرشح الشق للتخلص من النشاط الكهربائي المحيط في نطاق 50 هرتز (خاص بالدول الأوروبية).
- ابدأ كل من تسجيلات الفيديو وتخطيط كهربية الدماغ وتأكد من تطابق الآثار مع إشارة EEG المتوقعة عن طريق التحقق من الطاقة في نطاقات تردد محددة عبر الوقت. سجل فترة خط الأساس قبل البدء في التدخلات في.
- تحقق من وآثار EEG بشكل دوري. ليس من النادر أن ينفصل كابل التسجيل عن موصل القطب في رأس الفئران. إذا حدث هذا ، فأعد توصيل القطب الموجود في رأس الجرذ بكابل تسجيل مرة أخرى وتحقق من وجود إشارة EEG واضحة.
- تحليل إشارة EEG يدويا أو تلقائيا باستخدام البرامج المتاحة تجاريا. في حالة التحليل يدويا ، قم بفحص تسجيل EEG لتحديد الأنشطة الشبيهة بالنوبات. إذا كان سيتم استخدام البرنامج ، فقم بتكوين المعلمات الرئيسية لحدث النوبة ، مثل السعة والتردد ومدة النشاط الكهربائي.
ملاحظة: قد تتميز النوبة الواحدة بنشاط كهربائي بسعة 3 مرات أعلى من خط الأساس ، وتردد يساوي أو يزيد عن 5 هرتز ، ومدة لا تقل عن 5 ثوان22. - بغض النظر عن الطريقة المستخدمة ، تأكد من النوبات المتشنجة المحتملة عن طريق التحقق من تسجيل الفيديو المتزامن الذي تم جمعه في وقت واحد مع EEG.
7. القياس عن بعد بالفيديو-EEG في الفئران المصابة بالصرع وتحليل نشاط النوبات
ملاحظة: يصف هذا القسم الإجراء التجريبي لتسجيل إشارات EEG للقياس الراديوي عن بعد في الفئران ذات المنزل الواحد والتي تتحرك بحرية في ظل الظروف القياسية. يعتمد البروتوكول على نظام القياس عن بعد المتاح تجاريا. ومع ذلك ، تختلف العديد من أنظمة القياس عن بعد اختلافا طفيفا في مواصفاتها الوظيفية والفنية. يجب اختيار النظام وفقا لمتطلبات المختبر وأهداف البحث.
- ضع قفص منزل فوق مستقبل الإشارة. قم بتوصيل مستقبل الإشارة بنظام الحصول على البيانات وهذا بجهاز كمبيوتر باستخدام برنامج الاستحواذ.
- قم بتشغيل غرسة القياس عن بعد بالترددات الراديوية عن طريق وضع مغناطيس بالقرب من مقياس التحكم عن بعد الذي تم إدخاله في جناح الفئران. اختبر الإشارة باستخدام جهاز راديو. استخدم جهاز راديو عالمي لاختبار أجهزة القياس عن بعد وسماع صوت تنبيه واضح يشير إلى تنشيط مقياس التحكم عن بعد ، بينما يشير الصوت الأزيز إلى مقياس تيلي معطل.
ملاحظة: يجب مراعاة عمر بطارية جهاز إرسال الترددات الراديوية قبل تحديد مدة التسجيلات. - قم بإعداد برنامج الاستحواذ ومزامنة إشارة القياس عن بعد ونظام الفيديو للحصول على بيانات EEG والفيديو في وقت واحد. قم بتعيين مستقبل إشارة واحد لكل جهاز إرسال مزروع واضبط قيم معايرة جهاز الإرسال. اضبط معدل العينة على 1000 هرتز ، واكتشاف الضوضاء بين -500 مللي فولت و +500 مللي فولت ، والفاصل الزمني للتكامل عند 100 مللي ثانية. لا تستخدم مرشحات تمرير منخفضة وعالية.
- ابدأ القياس عن بعد وتسجيلات الفيديو. قم بإجراء تسجيل خط الأساس على المدى الطويل قبل الحصول على النشاط الشبيه بالصرع. قم بتحليل إشارة EEG كما هو موضح في الخطوتين 6.8 و6.9.
8. إجراء جمع الدم من الوريد الذيل
ملاحظه. يتكون نظام جمع الدم الفراغي من إبرة فراشة (23 جم × 3/4 × 12 (0.8 مم × 19 مم × 305 مم). يمكن إجراء تقنية جمع الدم بسهولة بواسطة مشغل واحد وتستغرق العملية حوالي 5 دقائق.
- قم بتغطية إبرة الفراشة وأنبوبها ب 1٪ K2EDTA في الماء المقطر قبل وقت قصير من عمليات السحب ، أي سحب وطرد محلول K2EDTA من النظام باستخدام حقنة 1 مل. اقطع الأنبوب خلف الإبرة مباشرة من أجل جمع الدم قطرة قطرة ، دون شفط (الشكل 1 أ).
- ضع الجرذ في غرفة تحريض وقم بتخديره بالإيزوفلوران (1.4٪ في الهواء ؛ 1.2 مل / دقيقة). قم بالتبديل إلى الإطار التجسيمي والحفاظ على التخدير من خلال قناع الوجه. ضع وسادة التدفئة تحت ، مع الحفاظ على جزء من ذيله على اتصال مباشر مع الوسادة.
- حرك ظهر برفق إلى الجانب بحيث يتم الاحتفاظ بوريد الذيل الجانبي في الأعلى.
- اغمس الذيل في ماء دافئ (42 درجة مئوية) لمدة 2 دقيقة لتوسيع الوريد الجانبي. امسح الذيل بنسبة 70٪ من الإيثانول لجعل الوريد أكثر وضوحا. ضع ضوءا دافئا على الذيل باستخدام لمبة متوهجة عادية.
- أدخل إبرة الفراشة 21G في وريد الذيل الجانبي بعمق 5 مم وزاوية 20 درجة. جمع الدم في أنبوب جمع فراغ 500 ميكرولتر يحتوي على 5 ملغ K2EDTA كمضاد للتخثر (الشكل 1B ، C).
- قم بإزالة الإبرة ووقف تدفق الدم عن طريق الضغط على موقع البزل. إعادة الفئران إلى قفص المنزل.
- اقلب الأنبوب برفق 10x لخلط مضادات التخثر في الدم. اصنع ثقوبا بعمق حوالي 1.5 سم في الجليد لاستيعاب أنابيب التجميع. ضع العينة برفق وعموديا على الجليد.
- جهاز طرد مركزي عينة الدم في جهاز طرد مركزي مبرد (4 درجات مئوية) عند 1300 × جم لمدة 10 دقائق لفصل البلازما. نفذ هذا الإجراء في غضون 1 ساعة على الأكثر.
- خذ حوالي 200 ميكرولتر من البلازما ، وتجنب طبقة خلايا الدم الحمراء والبيضاء. ضع البلازما المسحوبة في الأنبوب الدقيق المعقم سعة 0.2 مل. إذا لزم الأمر ، قم بتخزينها في درجة حرارة 4 درجات مئوية لمدة تصل إلى 1 ساعة بعد الطرد المركزي.
- ضع جانبا 5 ميكرولتر من العينة لمراقبة الجودة. قم بتخزين العينة في درجة حرارة -80 درجة مئوية حتى التحليل.
ملاحظة: لا تستخدم الفراغ حتى لو أوصى به بعض الباحثين28 أو حليب الذيل أثناء الإجراءات الموضحة في الخطوة 8.5 للحصول على المزيد من الدم ، لأنه يقلل من جودة العينة لتحليلات القياس الكمي sncRNA التالية (يرجى الاطلاع على النتائج التمثيلية للحصول على التفاصيل). ضع في اعتبارك أنه في الفئران ، فإن الحد الأقصى لكمية الدم التي يمكن سحبها في وقت واحد هو <10٪ من إجمالي حجم الدم (أي حوالي 1.6-1.9 مل في الفئران 250-300 جم) و <15٪ من إجمالي حجم الدم (حوالي 2.64 مل) في شهرواحد 29. في هذا البروتوكول ، يتم استخدام 500 ميكرولتر كحد أقصى من جمع الدم في مناسبة واحدة لمدة تصل إلى خمس مرات في واحد30,31.
9. إجراءات جمع السائل الدماغي النخاعي
ملاحظه. يمكن تنفيذ هذه التقنية بسهولة بواسطة مشغل واحد ، ويتطلب الإجراء حوالي 2-4 دقائق. المواد المستخدمة في جمع السائل الدماغي النخاعي هي إبر فراشة مفرغة منخفضة التكلفة تستخدم مرة واحدة وأنابيب استخراج. في هذا البروتوكول ، يتم استخدام مجموعة ضخ مجنحة فراشة متصلة بحقنة معقمة من أجل إنشاء الفراغ (الشكل 2 أ).
- قم بإعداد إبرة الفراشة 23G ، وقطع حماية الغلاف البلاستيكي بحيث تتعرض نهاية الإبرة العارية بمقدار 7 مم لمنعها من اختراق عمق أكثر من 7 مم في الصهريج العظيم أثناء الانسحاب (الشكل 2 ب).
- قم بتوصيل إبرة الفراشة المجهزة بأنابيب بوليمر بحقنة سعة 1 مل.
- ضع الجرذ في غرفة تحريض وقم بتخديره باستخدام الأيزوفلوران (1.4٪ في الهواء ؛ 1.2 مل / دقيقة). قم بتبديل تدفق الأيزوفلوران إلى الإطار التجسيمي والحفاظ على التخدير الذي يتم توصيله من خلال قناع الوجه. إزالة الفراء على رأس الفئران الخلفي والرقبة مع الحلاقة.
- إصلاح رأس الفئران مع قضبان الأذن. اخفض رأس لأسفل حوالي 45 درجة عموديا ، وتحرك لأسفل شريط الأنف للإطار التجسيمي (الشكل 2C). افحص الرأس الخلفي للحيوان وابحث عن سطح منخفض قليلا مع جانب المعين ، بين النتوء القذالي والعمود الفقري للأطلس.
- فرك هذا السطح مع 70 ٪ من الإيثانول من أجل جعله أكثر وضوحا وتطهيره.
- أدخل إبرة الفراشة عموديا في وسط السطح المكتئب على شكل معين في الخزان العظيم لجمع السائل الدماغي النخاعي حتى يتم حظر الحركة عن طريق قطع حماية الغلاف البلاستيكي للإبرة حسب الحجم (الشكل 2 د). اسحب مكبس المحقنة سعة 1 مل برفق للسماح للسائل الدماغي النخاعي بالتدفق ببطء عبر الإبرة.
- اجمع حوالي 100 ميكرولتر من السائل الدماغي النخاعي في أنابيب البوليمر (الشكل 2 د). تجنب دخول الدم أو أي تلوث مرئي آخر. اضغط على أنبوب البوليمر بالقرب من إبرة الفراشة واقطع الأنبوب عند هذه النقطة.
- ارسم العينة الشفافة (غير الملوثة) في المحقنة. تخلص من العينة الملوثة ، إذا دخل التلوث المرئي إلى أنبوب التجميع.
- اطرد العينة إلى الأنبوب الدقيق المعقم سعة 0.2 مل واحفظها على الثلج لمدة تصل إلى 1 ساعة.
- تطهير موقع انسحاب السائل الدماغي النخاعي على رأس. إزالة الفئران من الإطار التجسيمي وإعادته إلى قفصه.
- ضع جانبا 2 ميكرولتر من العينة لمراقبة الجودة. قم بتخزين بقية العينة في -80 درجة مئوية لمزيد من التحليل.
ملاحظة: في الفئران ، إذا تم إجراء عمليات سحب متعددة من السائل الدماغي النخاعي بشكل متكرر ، فإن الحجم الموصى بسحبه في كل مجموعة هو 100 ميكرولتر32. في هذا البروتوكول ، تم إجراء 100 ميكرولتر كحد أقصى من السائل الدماغي الشوكي في مناسبة واحدة مع سحب 5x كحد أقصى في 15 يوما في واحد.
10. تحليل القياس الطيفي لجودة العينة
ملاحظة: بعد الجمع الصحيح لعينات السائل الدماغي الشوكي والبلازما ، تكون العينات جاهزة لتحليل مقياس الطيف الضوئي ولا تتطلب أي معالجة محددة. قياس امتصاص الهيموجلوبين عن طريق قياس الطيف الضوئي للأشعة فوق البنفسجية عند 414 نانومتر لتقييم خطر انحلال الدم في العينات. استخدم قيمة امتصاص قطع تبلغ 0.25 في عينات الفئران. قد يعتمد اختيار هذا الحد على تحليل qPCR اللاحق ومتطلباته المحددة للقياس الكمي ل sncRNAs.
- قم بتشغيل مقياس الطيف الضوئي للأشعة فوق البنفسجية. حدد طريقة قياس الامتصاص بطول موجي واحد يبلغ 414 نانومتر للبلازما أو السائل الدماغي الشوكي. انقر فوق التالي.
- شطف كوفيت 1 مم بالماء النقي. ضع 5 ميكرولتر من الإيثانول بنسبة 70٪ على بقعة قياس كوفيت. جفف بمنشفة ورقية وافركها بمناديل ورقية خالية من النسالة. تحقق مما إذا كانت شفافة تماما.
- ضع 1.5 ميكرولتر من الماء النقي في كفيت 1 مم وأغلقه. أدخل الكوفيت في غرفة القياس الخاصة بمقياس الطيف الضوئي وقم بقياس امتصاص العينة الفارغة بالنقر فوق الزر فارغ . تأكد من أن قيمة الامتصاص عند 414 نانومتر هي 0.000.
- جفف كوفيت بمنشفة ورقية وقم بتنظيفه بمناديل ورقية خالية من النسالة. تحقق مما إذا كانت شفافة تماما.
- ضع 1.5 ميكرولتر من العينة في كوفيت 1 مم وأغلقها. أدخل كوفيت في غرفة القياس في مقياس الطيف الضوئي. قم بقياس العينة ، بالنقر فوق الزر عينة . تحقق من امتصاص العينة عند 414 نانومتر وقم بالتعليق عليها.
- المضي قدما في قياس امتصاص الهيموغلوبين في جميع العينات المتاحة. قم بقياس العينة الفارغة قبل أي عينة بلازما أو CSF ، بالنقر بدلا من ذلك على الزرين فارغ وعينة.
- احتفظ بالعينات التي تحتوي على A414 نانومتر < 0.25 عند -80 درجة مئوية وتخلص من العينات إذا كان A414 نانومتر > 0.25.
- شطف كوفيت 1 مم بالماء النقي و 70 ٪ من الإيثانول ، بالتتابع. تجفيف كوفيت.
- أغلق الكوفيت الفارغ في غرفة القياس لمنع غباره. قم بإيقاف تشغيل مقياس الطيف الضوئي.
النتائج
تم الإبلاغ عن نتائج إجراءات CSF وسحب الدم المختلفة التي أجريت في 9 فئران تحكم و 18 فأرا مزمنا مصابا بالصرع ، وكلها مزروعة بأقطاب كهربائية في شهر واحد بعد SE ، من حيث معدل النجاح. بعد الزرع ، تمت مراقبة جميع الفئران بالفيديو EEG لمدة شهر واحد ، تم خلالها سحب السائل الدماغي الشوكي بالإضافة إلى الدم 5x كل 3 أيام خلال الأسبوعين الأخيرين من التجربة (أي في الأيام 52 و 55 و 58 و 61 و 64 بعد SE ؛ dpSE). تم استخدام البيانات من عمليات سحب متعددة في مختلفة لمقارنة معدل نجاح جمع السائل الدماغي الشوكي في الفئران ذات الرأسين المزروعات (المقنية لسحب السائل الدماغي النخاعي) مع معدل نجاح جمع السائل الدماغي الشوكي (الذي يتم بواسطة ثقب cisterna magna) في المزروعة بأقطاب كهربائية مربوطة أو عن بعد فقط (الجدول 1). في المختلفة ، تم تقييم تأثير جمع الدم الفراغي أو حلب الذيل على جودة عينات البلازما (الجدول 2). لهذا الغرض ، تم استخدام تحليل قياس الطيف الضوئي للأشعة فوق البنفسجية عند 414 نانومتر للكشف عن الهيموغلوبين الحر. بالنسبة للتحليلات الإحصائية ، تم استخدام البرامج التجارية ، وتم استخدام Kruskal-Wallis أو ANOVA أحادي الاتجاه مع اختبارات المقارنة المتعددة اللاحقة ل Tukey (p<0.05 تعتبر ذات دلالة إحصائية). يتم التعبير عن البيانات كوسيط ± SEM.
معدل نجاح أخذ عينات متعددة من السائل الدماغي الشوكي في الفئران المقننة والمثقوبة
تم أخذ عينات من السائل الدماغي الشوكي 5x في غضون 2 أسابيع في 3 مجموعات من الفئران: (i) الفئران المزروعة بالقطب المقنية والمربوطة (مجموعة CT من) ؛ في هذه ، تم إجراء سحب السائل الدماغي الشوكي عبر قنية توجيه وهمية ومفصل أنابيب PTFE إلى حقنة 1 مل عندما كانت غير مخدرة وتتحرك بحرية تحت فيديو EEG ؛ '2' الفئران المثقوبة (الخطوة 9) والجرذان المزروعة بقطب كهربائي مربوط (مجموعة PT)؛ (iii) الفئران المزروعة بالقطب الكهربائي المثقوب والقياس عن بعد (مجموعة PTe). تم استخدام ما مجموعه 9 لكل مجموعة (6 فئران صرع و 3 فئران ضابطة). تم تقييم عدد المجموعات الناجحة أكثر من 5 مرات. كان معدل النجاح مشابها في الفئران المثقوبة: 86.7٪ ± 5.8٪ في المربوطة و 88.9٪ ± 4.8٪ في المزروعة بأقطاب القياس عن بعد. بدلا من ذلك ، في الفئران المقنية ، انخفض المعدل حتى لو لم يكن مختلفا بشكل كبير (71.1 ٪ ± 8.9 ٪ ، الجدول 1). تشير هذه النتائج إلى أن القنية الموجودة على رؤوس قد تتداخل مع أخذ عينات السائل الدماغي الشوكي المتكررة وتعرض الدراسات الطولية للخطر. تقنية البزل أكثر ملاءمة لعمليات سحب السائل الدماغي الشوكي المتعددة في المزروعة بالأقطاب الكهربائية.
تأثير الفراغ وحلب الذيل على طريقة جمع البلازما
تم جمع الدم 5 مرات من 9 فئران (6 فئران صرع و 3 فئران ضابطة) في الأيام 52 و 55 و 58 و 61 و 64 بعد SE وتم تقييم جودة البلازما لانحلال الدم بصريا وقياس الطيف الضوئي للأشعة فوق البنفسجية عند 414 نانومتر. للحصول على العينة الأولى في كل فأر ، تم استخدام سحب الفراغ عبر إبرة فراشة 21G متصلة بحقنة 1 مل. مع العينة الثانية ، تم استخدام سحب السقوط ونظام إبرة الفراشة 21G عند حلب الذيل في وقت واحد. للحصول على العينة 3-5 ، تم استخدام إجراء سحب السقوط دون حلب الذيل (الموصوف في الخطوة 9).
عند استخدام فراغ ، كانت البلازما وردية اللون تحت الفحص البصري ، وكان متوسط قيمة الامتصاص لعينات 9 فئران 0.647 ± 0.067 (الجدول 2 ، الشكل 3). تم الحصول على نتائج مماثلة في حالة استخدام حلب الذيل أثناء العملية: بلازما وردية اللون مع 0.620 ± 0.043 متوسط امتصاص (الجدول 2 ، الشكل 3). في المقابل ، مع سحب السقوط المدعوم بالجاذبية ونظام إبرة الفراشة 21G ، تم تخفيض متوسط قيم امتصاص البلازما بشكل كبير (0.226 ± 0.017 عند 58 نقطة في SE ؛ 0.223 ± -0.09 عند 61 نقطة في SE ؛ 0.226 ± 0.018 عند 64 نقطة في SE ؛ الجدول 2 ، الشكل 3) فيما يتعلق بطريقة الحلب بالفراغ أو الذيل. علاوة على ذلك ، كانت عينات البلازما المتساقطة شفافة بشكل أساسي. ترتبط قيم الامتصاص الأعلى (52 و 55 dpSE) باللون الوردي للعينات (البيانات غير معروضة). قد تشير هذه النتائج إلى أن الطريقة الأخيرة هي الأفضل للحصول على عينات ذات جودة عالية جدا للتحليل.

الشكل 1: الخطوات الرئيسية لسير عمل أخذ عينات البلازما. (أ) المواد اللازمة لسحب الدم والفئران في الإطار التجسيمي ، جاهزة للتجميع ؛ (ب، ج) تكبير الذيل بإبرة فراشة 21G يتم إدخالها في وريد الذيل الجانبي وتسقط قطرة الدم على جدران أنبوب التجميع بمضاد للتخثر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الخطوات الرئيسية لسير عمل أخذ عينات السائل الدماغي الشوكي (CSF). (أ) المواد اللازمة لسحب السائل الدماغي الشوكي والجرذان في الإطار التجسيمي ، قبل وقت قصير من الجمع ؛ (ب) تحضير إبرة الفراشة 23G عن طريق قطع حماية الغلاف البلاستيكي بحيث يتم كشف نهاية الإبرة العارية لمدة 7 مم لضمان الاختراق الصحيح في الصهريج العظيم ؛ (ج) يميل رأس الجرذ لأسفل بمقدار 45 درجة أثناء الانسحاب. د: التكبير في الموقع المعيني بإدخال إبرة فراشة في الصهريج الكبير. لاحظ السائل الدماغي النخاعي الذي يرتفع في الأنبوب ، ويشار إليه بطرف العلامة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
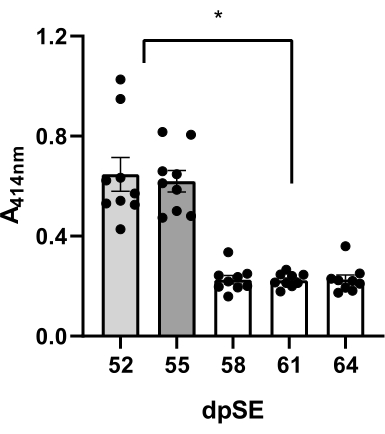
الشكل 3: تقييم جودة عينات البلازما. تم قياس درجة انحلال الدم عند 414 نانومتر للهيموجلوبين الحر بواسطة التحليل الطيفي للأشعة فوق البنفسجية في عينات البلازما ل 9 في 5 نقاط زمنية (52 و 55 و 58 و 61 و 64 يوما بعد حالة الصرع ، dpSE) باستخدام طرق مختلفة: اليوم 52 - تقنية الفراغ. اليوم 55 - حلب الذيل. أيام 58-64 تم استخدام تقنيات الإسقاط. كان الانخفاض في الهيموجلوبين الحر في البلازما التي تم الحصول عليها بتقنية السقوط مقارنة بطرق الحلب الفراغي والذيل كبيرا (* p <0.05 وفقا لاختبار ANOVA أحادي الاتجاه واختبار المقارنة المتعددة ل Tukey بعد التخصيص). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: معدلات نجاح عمليات سحب CSF. مقارنة معدلات نجاح الانسحاب المتكرر ل CSF في ثلاث مجموعات تجريبية من معبرا عنها كنسبة مئوية من الانسحابات الناجحة خلال 5 أيام. تم تعيين القيمة 1 للسحب الناجح لما > 100 ميكرولتر من السائل الدماغي النخاعي الصافي ؛ تم تعيين القيمة الصفرية لعمليات السحب < 100 ميكرولتر و / أو CSF غير واضح. الاختصارات: N / A - عدم وجود مجموعة بسبب فقدان القنية أثناء إجراء أخذ العينات (التصوير المقطعي فقط) ؛ CT - مربوط مقنن ؛ PT - ثقب مربوط ؛ PTe - أقطاب القياس عن بعد المثقوبة المزروعة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: تقييم انحلال الدم في عينات البلازما. نتائج قياسات انحلال الدم في 5 نقاط زمنية باستخدام ثلاث طرق مختلفة لأخذ عينات الدم: اليوم 52 - تقنية الفراغ. اليوم 55 - حلب الذيل. أيام 58-64 تقنيات الإسقاط. ترتبط قيم >0.3 من الامتصاص باللون الوردي للعينات. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
يوضح هذا العمل تقنية سهلة الإتقان ل CSF وجمع الدم في الفئران ، والتي قد تكون مفيدة ليس فقط للدراسات في نماذج الصرع ولكن أيضا للحالات أو الأمراض العصبية الأخرى مثل مرض الزهايمر أو باركنسون أو التصلب المتعدد. في أبحاث الصرع ، تعتبر كل من إجراءات أخذ العينات إلى جانب تخطيط كهربية الدماغ بالفيديو مثالية عند متابعة العلاقة بين مستويات الجزيئات المختلفة القابلة للذوبان ونشاط النوبات. لهذا السبب المحدد ، تم استخدام تسجيل مستمر لتخطيط كهربية الدماغ بالفيديو: i) من أجل تشخيص الصرع بشكل صحيح أو ii) لمراقبة المراحل المختلفة لتطور المرض ، و / أو iii) لربط أخذ العينات بحدوث نوبات عفوية. يمكن إجراء تقنيات أخذ العينات هذه في الفئران المخدرة ، مما يسبب الحد الأدنى من الإجهاد.
الخطوات الحرجة واستكشاف الأخطاء وإصلاحها وقيود الأسلوب
يحتوي البروتوكول على بعض الخطوات الفنية الهامة. أولا ، قد يكون من الصعب العثور على المكان الصحيح لجمع CSF في المحاولة الأولى. إذا غاب المشغل عن الصهريج العظيم في المحاولة الأولى ، فإن أي تجربة لاحقة ستكون ملوثة بالدم ، حيث سينزف من جرح الإبرة. من وجهة النظر هذه ، يعتمد النجاح في المجموعة بشكل كبير على مهارة المشغل. ثانيا ، تحتاج بعض خطوات سحب الدم إلى عناية خاصة. على وجه الخصوص ، هناك خطر كبير من انحلال الدم إذا قام المشغل بفرك الذيل بقوة شديدة بالإيثانول ، أو إذا كانت درجة حرارة الماء المستخدم في توسع أوعية الوريد الذيل أعلى من 42 درجة مئوية ، أو إذا تم خلط الدم في أنبوب التجميع مع مضادات التخثر بقوة كبيرة. خصوصية أخرى لجمع الدم في الصرع المزمن هي تأثير بطء القلب على معدل سقوط الدم من الوريد الذيل33. إذا كان هذا بطيئا جدا ، فقد يتخثر الدم على جدران أنبوب التجميع. لتجنب هذه المشكلة ، يتمثل أحد الخيارات في تقسيم العينات إلى أنبوبين للتجميع ، مما يقلل من حجم الدم / الأنبوب. أخيرا ، هناك مأزق واحد جوهري لدراسات الصرع. قد يؤدي الإجهاد الناجم عن التلاعب بالحيوانات قبل أخذ العينات إلى حدوث نوبات ، والتي بدورها قد تتداخل مع مستويات الجزيئات قيد التحقيق34. كلما كان ذلك ممكنا ، ضع غرفة تحريض التخدير في قفص المنزل واسمح للحيوان بدخوله تلقائيا. كتعديل للبروتوكول المقترح ، يمكن استخدام المقيد لإجراء سحب الدم دون تخدير إيزوفلوران. ومع ذلك ، يمكن القيام بذلك في القياس عن بعد ، ولكن ليس في المربوطة ، لأن الفئران المربوطة قد تفقد غرسات رأسها أثناء هذا الإجراء.
وجود مشغل مدرب جيدا وبذل أقصى جهد لتجنب الإجهاد ، فإن القيد الوحيد للبروتوكول الحالي هو الحد الأقصى للحجم الذي يمكن سحبه دون المساس بصحة. وفقا للمعايير الحالية ، يوصى بجمع 100 ميكرولتر كحد أقصى من السائل الدماغي الشوكي لمدة 4 مرات على مدار 15 يوما فيواحد 32. وبالمثل ، يقترح جمع أقل من 10٪ من إجمالي حجم الجسم في عينة واحدة وأقل من 15٪ من إجمالي حجم جسم الدم في 28 يوما30,31.
مقارنة الطريقة مع التقنيات الأخرى
وللنهج المقترحة لأخذ عينات السائل الدماغي النخاعي والبلازما التي تم حلها زمنيا العديد من المزايا فيما يتعلق بالطرق البديلة الموجودة. أولا ، ثقب الصهريج الكبير المستخدم لأخذ عينات من السائل الدماغي النخاعي في الفئران المصابة بالصرع لديه خطر أقل لفقدان زرع الرأس مقارنة بالنظام المقن إذا اقترن بمخطط كهربية الدماغ المربوط. على عكس إجراءات البزل ، فإن القنية المتصلة بالقطب بواسطة الأسمنت السني (ضخمة وثقيلة لرؤوس) ، في حين يتم طلبها من خلال المرفقات / الانفصالات المتكررة لعمليات سحب السائل الدماغي الشوكي ، فهي أكثر عرضة للضياع على مدار عدة أيام من أخذ العينات. في الواقع ، تظهر نتائج معدل النجاح كيف أن بعض المقننة (N / A) لا تصل إلى النقاط الزمنية المتقدمة لأخذ العينات ، وبالتالي تفقد العينات الخاصة بها (الجدول 1). بالإضافة إلى ذلك ، يبدو أن طريقة البزل تتفوق على النهج المقنوي من حيث العقم الأفضل وتقليل التفاعل السحائي مع زيادة محدودة في محتوى الخلايا والألبومين في السائل الدماغي الشوكي ، كما تم توثيقه سابقا من قبل22،35،36 أخرى. قد تكون درجة الكريات البيض CSF وتلوث الألبومين مهمة لصحة الطرق المستخدمة لقياس المؤشرات الحيوية للصرع35. ثانيا ، طريقة إسقاط السقوط الحر لأخذ عينات بلازما الدم المستخدمة للمقاييس المتكررة تتفوق على أي طريقة انسحاب أخرى لأنها ليست نهائية (عدم التعافي) ، على عكس قطع الرأس أو ثقب القلب أو الأوعية الدموية البطنية / الصدرية أو الانسحاب خلف الحجاج وتسمح بأخذ عينات دم متعددة. إنه أبسط من العديد من تقنيات سحب فراغ الدم في الوريد الذيل ، لأنه لا يتطلب أنابيب28,37 وينتج عينات بلازما خالية من انحلال الدم ذات جودة عالية لمزيد من تحليلات sncRNA التي تركز على تحديد المؤشرات الحيوية المفترضة لتكوين الصرع38. تم تأكيد عدم وجود الهيموجلوبين الحر في العينات ، عند استخدام تقنية أخذ العينات بالسقوط أو تجنب حلب الذيل ، من خلال نتائج امتصاص منخفضة لعينات البلازما (الجدول 2) بما يتماشى مع الإجراءات المنشورة سابقا المناسبة لتقييم محتوى بلازما sncRNA39,40.
التطبيقات والتوجهات المستقبلية
يمكن تطبيق الطرق الموصوفة أعلاه لقياس الجزيئات القابلة للذوبان ذات الأهمية في أي نموذج للأمراض العصبية. مثال محدد هو أخذ عينات من السوائل البيولوجية لتحديد المؤشرات الحيوية المحتملة / المفترضة للصرع. هناك حاجة طبية ملحة لم تتم تلبيتها لاكتشاف هذه المؤشرات الحيوية للأشخاص المصابين بالصرع ، وخاصة المؤشرات الحيوية للتنبؤ والحساسية / المخاطر ، لأنها غير موجودة بعد.
في الختام ، فإن البروتوكول الحالي ممكن في الفئران ، بما في ذلك الفئران المصابة بالصرع ، ويسهل تشغيله للأفراد المدربين. علاوة على ذلك ، فإنه يسمح بأخذ عينات متعددة عالية الجودة في الدراسات الطولية وفقا لمبدأ 3Rs (أي الاستبدال والتخفيض والصقل)41.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة بمنحة من برنامج عمل أفق 2020 التابع للاتحاد الأوروبي (اتصل ب H2020-FETOPEN-2018-2020) بموجب اتفاقية المنحة 964712 (PRIME ؛ إلى M. Simonato).
Materials
| Name | Company | Catalog Number | Comments |
| Blood collection set BD Vacutainer Safety-Lok | BD Italy SpA, Milan, Italy | 367246 | Material |
| Blood Collection tubes (Microtainer K2E) | BD Italy SpA, Milan, Italy | 365975 | Material |
| Butterfly Winged Infusion Set 23G x 3/4'' 0.6 x 19 mm | Nipro, Osaka, Japan | PSY-23-ET-ICU | Material |
| Centrifuge refrigerated ALC PK 130R | DJB Labcare Ltd, Buckinghamshire, England | 112000033 | Material |
| Cotton suture 3-0 | Ethicon, Johnson & Johnson surgical technologies, Raritan, New Jersey, USA | 7343H | Material |
| Diazepam 5 mg/2ml, Solupam | Dechra Veterinary Products, Torino, Italy | 105183014 (AIC) | Solution |
| Digital video 8-channel media recorder system of telemetry EEG set up | Data Sciences International (DSI), St Paul, MN, USA | PNM-VIDEO-008 | Equipment |
| Digital video surveillance system of tethered EEG set up | EZVIZ Network, Hangzhou, Cina | EZVIZ (V5.3.2) | Equipment |
| Disinfectant based on stabilized peroxides and quaternary ammonium activity | Laboratoire Garcin-Bactinyl, France | LB 920111 | Solution |
| Dummy guide cannula 8 mm | Agn Tho's, Lindigö, Sweden | CXD-8 | Material |
| Electrode 3-channel two-twisted | Invivo1, Plastic One, Roanoke, Virginia, USA | MS333/3-B/SPC | Material |
| Electrode holder for stereotxic surgery | Agn Tho's, Lindigö, Sweden | 1776-P1 | Equipment |
| Eppendorf BioSpectrometer basic | Eppendorf AG, Hamburg, Germany | 6137 | Equipment |
Eppendorf PCR Tubes 0.2 mL | Eppendorf Srl, Milan, Italy | 30124332 | Material |
| Eppendorf μCuvette G1.0 | Eppendorf AG, Hamburg, Germany | 6138 | Equipment |
| Feeding needle flexible 17G for rat | Agn Tho's, Lindigö Sweden | 7206 | Material |
| Grass Technology apparatus | Grass Technologies, Natus Neurology Incorporated, Pleasanton, California, USA | M665G08 | Equipment (AS40 amplifier, head box, interconnecting cables, telefactor model RPSA S40) |
| Isoflurane 100%, IsoFlo | Zoetis, Rome, Italy | 103287025 (AIC) | Solution |
| Ketamine (Imalgene) | Merial, Toulouse, France | 221300288 (AIC) | Solution |
| Lithium chloride | Sigma-Aldrich, Milan, Italy | L9650 | Material |
| Microinjection cannula 31G 9 mm | Agn Tho's, Lindigö Sweden | CXMI-9 | Material |
| MP150 modular data acquisition and analysis system | Biopac, Goleta, California, USA | MP150WSW | Equipment |
| Ophthalmic vet ointment, Hylo night | Ursapharm, Milan, Italy | 941791927 (AIC) | Material |
| Pilocarpine hydrochloride | Sigma-Aldrich, Milan, Italy | P6503 | Material |
| PTFE Tube with joint | Agn Tho's, Lindigö, Sweden | JT-10 | Material |
| Saline | 0.9% NaCl, pH adjusted to 7.0 | Solution | |
| Scopolamine hydrobromide trihydrate | Sigma-Aldrich, Milan, Italy | S2250 | Material |
| Scopolamine methyl nitrate | Sigma-Aldrich, Milan, Italy | S1876 | Material |
| Silver sulfadiazine 1% cream | Sofar, Trezzano Rosa, Milan, Italy | 025561010 (AIC) | Material |
| Simplex rapid dental methacrylic cement | Kemdent, Associated Dental Products Ltd, Swindon, United Kingdom | ACR811 | Material |
| Stereotaxic apparatus | David Kopf Instruments, Los Angeles, CA, USA | Model 963 | Equipment |
| Sucrose solution | 10% sucrose in distilled water | Home-made | Solution |
| Syringe 1 mL | Biosigma, Cona, Venezia, Italy | 20,71,26,03,00,350 | Material |
| Telemeters | Data Sciences International (DSI), St Paul, MN, USA | CTA-F40 | Material |
| Telemetry EEG traces analyzer | Data Sciences International (DSI), St Paul, MN, USA | NeuroScore v3-0 | Equipment |
| Telemetry system | Data Sciences International (DSI), St Paul, MN, USA | Hardware plus software Ponemah core 6.51 | Equipment |
| Xylazine hydrochloride | Sigma-Aldrich, Milan, Italy | X1251 | Material |
References
- Hanin, A., et al. Cerebrospinal fluid and blood biomarkers of status epilepticus. Epilepsia. 61 (1), 6-18 (2020).
- Pitkänen, A., et al. Advances in the development of biomarkers for epilepsy. The Lancet Neurology. 15 (8), 843-856 (2016).
- Dlugos, D., et al. Childhood Absence Epilepsy Study Team (2013). Pretreatment EEG in childhood absence epilepsy: associations with attention and treatment outcome. Neurology. 81 (2), 150-156 (2013).
- Lorenzo, N. Y., et al. Intractable frontal lobe epilepsy: pathological and MRI features. Epilepsy research. 20 (2), 171-178 (1995).
- van Dellen, E., et al. Epilepsy surgery outcome and functional network alterations in longitudinal MEG: a minimum spanning tree analysis. NeuroImage. 86, 354-363 (2014).
- Shah, A. K., Mittal, S. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy of Neurology. 17 (Suppl 1), S89-S94 (2014).
- Whiting, P., et al. A systematic review of the effectiveness and cost-effectiveness of neuroimaging assessments used to visualise the seizure focus in people with refractory epilepsy being considered for surgery. Health technology assessment. 10 (4), 1-iv (2006).
- Lenkov, D. N., Volnova, A. B., Pope, A. R., Tsytsarev, V. Advantages and limitations of brain imaging methods in the research of absence epilepsy in humans and animal models. Journal of neuroscience methods. 212 (2), 195-202 (2013).
- Leach, J. P., Stephen, L. J., Salveta, C., Brodie, M. J. Which electroencephalography (EEG) for epilepsy? The relative usefulness of different EEG protocols in patients with possible epilepsy. Journal of neurology, neurosurgery, and psychiatry. 77 (9), 1040-1042 (2006).
- Huppertz, H. J., et al. Localization of interictal delta and epileptiform EEG activity associated with focal epileptogenic brain lesions. NeuroImage. 13 (1), 15-28 (2001).
- Linder, C., et al. Comparison between dried blood spot and plasma sampling for therapeutic drug monitoring of antiepileptic drugs in children with epilepsy: A step towards home sampling. Clinical biochemistry. 50 (7-8), 418-424 (2017).
- Wegner, I., Wilhelm, A. J., Lambrechts, D. A., Sander, J. W., Lindhout, D. Effect of oral contraceptives on lamotrigine levels depends on comedication. Acta neurologica Scandinavica. 129 (6), 393-398 (2014).
- Palmio, J., et al. CSF and plasma adipokines after tonic-clonic seizures. Seizure. 39, 10-12 (2016).
- Hogg, M. C., et al. Elevation in plasma tRNA fragments precede seizures in human epilepsy. Journal of Clinical Investigation. 129 (7), 2946-2951 (2019).
- Ellul, M., Solomon, T. Acute encephalitis - diagnosis and management. Clinical medicine. 18 (2), 155-159 (2018).
- Diamond, M. L., et al. IL-1β associations with posttraumatic epilepsy development: a genetics and biomarker cohort study. Epilepsia. 55 (7), 1109-1119 (2014).
- Auvin, S., et al. Prospective clinical trials to investigate clinical and molecular biomarkers. Epilepsia. 58 (Suppl 3), 20-26 (2017).
- Weber, Y. G., Nies, A. T., Schwab, M., Lerche, H. Genetic biomarkers in epilepsy. Neurotherapeutics. 11 (2), 324-333 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), e880(2008).
- Gardiner, T. W., Toth, L. A. Stereotactic Surgery and Long-Term Maintenance of Cranial Implants in Research Animals. Contemporary Topics in Laboratory Animal Science. 38 (1), 56-63 (1999).
- Westergren, I., Johansson, B. B. Changes in physiological parameters of rat cerebrospinal fluid during chronic sampling: evaluation of two sampling methods. Brain Research Bulletin. 27 (2), 283-286 (1991).
- Soukupová, M., et al. Impairment of GABA release in the hippocampus at the time of the first spontaneous seizure in the pilocarpine model of temporal lobe epilepsy. Experimental Neurology. 257, 39-49 (2014).
- Soukupová, M., et al. Microdialysis of Excitatory Amino Acids During EEG Recordings in Freely Moving Rats. Journal of Visualized Experiments. (141), e58455(2018).
- Guarino, A., et al. Low-dose 7,8-Dihydroxyflavone Administration After Status Epilepticus Prevents Epilepsy Development. Neurotherapeutics. 19 (6), 1951-1965 (2022).
- Curia, G., Longo, D., Biagini, G., Jones, R. S. G., Avoli, M. The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods. 172 (2), 143-157 (2008).
- Racine, R. J. Modification of seizure activity by electrical stimulation: II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Zou, W., et al. Repeated Blood Collection from Tail Vein of Non-Anesthetized Rats with a Vacuum Blood Collection System. Journal of Visualized Experiments. (130), e55852(2017).
- Blood sampling: Rat. , https://nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-rat (2022).
- Powles-Glover, N., Kirk, S., Wilkinson, C., Robinson, S., Stewart, J. Assessment of toxicological effects of blood microsampling in the vehicle dosed adult rat. Regulatory Toxicology and Pharmacology. 68 (3), 325-331 (2014).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animal. 32 (4), 369-376 (1998).
- Wang, D., Zhao, Y., Yang, Y., Xie, H. Safety assessment of multiple repeated percutaneous punctures for the collection of cerebrospinal fluid in rats. Brazilian Journal of Medical and Biological Research. 54 (6), e10032(2021).
- Möller, C., et al. Impact of repeated kindled seizures on heart rate rhythms, heart rate variability, and locomotor activity in rats. Epilepsy & Behavior. 92, 36-44 (2019).
- Espinosa-Garcia, C., Zeleke, H., Rojas, A. Impact of Stress on Epilepsy: Focus on Neuroinflammation-A Mini Review. International Journal of Molecular Sciences. 22 (8), 4061(2021).
- Cassar, S. C., et al. Comparing levels of biochemical markers in CSF from cannulated and non-cannulated rats. Journal of Neuroscience Methods. 192 (2), 249-253 (2010).
- Huang, Y. L., Säljö, A., Suneson, A., Hansson, H. A. Comparison among different approaches for sampling cerebrospinal fluid in rats. Brain Research Bulletin. 41 (5), 273-279 (1996).
- Hattori, N., Takumi, A., Saito, K., Saito, Y. Effects of serial cervical or tail blood sampling on toxicity and toxicokinetic evaluation in rats. Journal of Toxicological Sciences. 45 (10), 599-609 (2020).
- Roncon, P., et al. MicroRNA profiles in hippocampal granule cells and plasma of rats with pilocarpine-induced epilepsy--comparison with human epileptic samples. Scientific Reports. 5, 14143(2015).
- van Vliet, E. A., et al. Standardization procedure for plasma biomarker analysis in rat models of epileptogenesis: Focus on circulating microRNAs. Epilepsia. 58 (12), 2013-2024 (2017).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), e24145(2011).
- Grimm, H., et al. Advancing the 3Rs: innovation, implementation, ethics and society. Frontiers in Veterinary Science. 10, 1185706(2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved