Method Article
Prélèvement de liquide céphalorachidien et de sang de la veine caudale latérale chez le rat pendant les enregistrements EEG
Dans cet article
Résumé
Le protocole montre des prélèvements répétés de liquide céphalorachidien et de sang de rats épileptiques effectués en parallèle avec une surveillance continue du vidéo-électroencéphalogramme (EEG). Ceux-ci sont essentiels pour explorer les liens possibles entre les changements dans diverses molécules de fluides corporels et l’activité convulsive.
Résumé
Parce que la composition des fluides corporels reflète de nombreuses dynamiques physiologiques et pathologiques, des échantillons de liquides biologiques sont couramment obtenus dans de nombreux contextes expérimentaux pour mesurer des molécules d’intérêt, telles que des hormones, des facteurs de croissance, des protéines ou de petits ARN non codants. Un exemple concret est l’échantillonnage de liquides biologiques dans la recherche de biomarqueurs de l’épilepsie. Dans ces études, il est souhaitable de comparer les niveaux de molécules dans le liquide céphalorachidien (LCR) et dans le plasma, en prélevant le LCR et le plasma en parallèle et en tenant compte de la distance temporelle de l’échantillonnage entre et les crises. La combinaison de l’échantillonnage du LCR et du plasma, couplée à la surveillance vidéo-EEG chez les animaux épileptiques, est une approche prometteuse pour la validation de biomarqueurs diagnostiques et pronostiques putatifs. Ici, une procédure de retrait combiné du LCR de la citerne magna et d’un prélèvement sanguin de la veine latérale de la queue chez des rats épileptiques qui sont surveillés en permanence par vidéo-EEG est décrite. Cette procédure offre des avantages significatifs par rapport à d’autres techniques couramment utilisées. Il permet un prélèvement rapide avec un minimum de douleur ou d’invasivité, et une durée d’anesthésie réduite. De plus, il peut être utilisé pour obtenir des échantillons de LCR et de plasma chez des rats captifs et enregistrés par télémétrie EEG, et il peut être utilisé à plusieurs reprises sur plusieurs jours d’expérience. En minimisant le stress dû à l’échantillonnage en raccourcissant l’anesthésie à l’isoflurane, on s’attend à ce que les mesures reflètent plus précisément les niveaux réels des molécules étudiées dans les biofluides. En fonction de la disponibilité d’un test analytique approprié, cette technique peut être utilisée pour mesurer les niveaux de plusieurs molécules différentes tout en effectuant un enregistrement EEG en même temps.
Introduction
Le liquide céphalorachidien (LCR) et les prélèvements sanguins sont importants pour identifier et valider les biomarqueurs de l’épilepsie, tant dans la recherche préclinique que clinique 1,2. De nos jours, le diagnostic de l’épilepsie et la plupart des recherches sur les biomarqueurs de l’épilepsie se concentrent sur l’EEG et la neuroimagerie 3,4,5. Ces approches présentent toutefois plusieurs limites. Outre les mesures de routine du cuir chevelu, dans de nombreux cas, l’EEG nécessite des techniques invasives telles que les électrodes de profondeur6. Les méthodes d’imagerie cérébrale ont une faible résolution temporelle et spatiale et sont relativement coûteuses et prennent beaucoup de temps 7,8. Pour cette raison, l’identification de biomarqueurs non invasifs, peu coûteux et à base de biofluides constituerait une alternative très intéressante. De plus, ces biomarqueurs biofluides pourraient être combinés avec les approches diagnostiques disponibles pour affiner leur prédictivité.
Les patients diagnostiqués avec l’épilepsie sont systématiquement soumis à un EEG 9,10 et à des prélèvements sanguins 11,12,13,14, et beaucoup d’entre eux sont également soumis à un retrait du LCR pour exclure les causes potentiellement mortelles (c’est-à-dire les infections aiguës, l’encéphalite auto-immune)15. Ces échantillons de sang et de LCR peuvent être utilisés dans la recherche clinique visant à identifier des biomarqueurs de l’épilepsie. Par exemple, Hogg et ses collègues ont découvert qu’une augmentation de trois fragments d’ARNt plasmatiques précède l’apparition de crises dans l’épilepsie humaine14. De même, les taux d’interleukine-1bêta (IL-1β) dans le LCR humain et le sérum, exprimés par le rapport des taux d’IL-1β dans le LCR par rapport au sérum, peuvent prédire le développement de l’épilepsie post-traumatique après un traumatisme crânien16. Ces études soulignent l’importance de l’échantillonnage des biofluides pour la recherche sur les biomarqueurs de l’épilepsie, mais elles se heurtent à de multiples limites intrinsèques aux essais cliniques, par exemple, le facteur cofondateur des médicaments antiépileptiques (DEA) dans le sang, le manque fréquent d’informations sur l’étiologie, les contrôles inadéquats, le nombre modeste de patients, etc. 17,18.
La recherche préclinique offre d’autres possibilités d’étudier les molécules dans les biofluides en tant que biomarqueurs potentiels de l’épilepsie. En fait, il est possible de prélever du plasma et/ou du LCR sur des animaux lors d’enregistrements EEG. De plus, l’échantillonnage peut être effectué à plusieurs reprises sur plusieurs jours de l’expérience, et un certain nombre de témoins appariés en fonction de l’âge, du sexe et de l’agression épileptique peuvent être utilisés pour améliorer la robustesse de l’étude. Ici, une technique flexible pour obtenir du LCR à partir de la citerne magna avec retrait parallèle de plasma de la veine caudale chez des rats surveillés par EEG est décrite en détail. La technique présentée présente plusieurs avantages par rapport aux méthodes alternatives. En utilisant une approche à l’aiguille papillon, il est possible de prélever plusieurs fois le LCR sans compromettre la fonction des électrodes EEG ou des implants crâniens similaires. Il s’agit d’un raffinement des procédures de retrait des cathéters intrathécaux, qui sont associées à un risque relativement élevé d’infection. De plus, l’approche de chute libre utilisée pour le prélèvement sanguin est supérieure aux autres approches de prélèvement sanguin dans la veine caudale en raison du risque d’hémolyse très réduit, dû au fait que le sang ne passe pas à travers la tubulure et qu’aucune pression de vide n’est appliquée. S’il est effectué dans des conditions strictes exemptes de germes, le risque d’infection est particulièrement faible pour les animaux. De plus, en commençant les prélèvements sanguins à l’extrémité de la queue des animaux, les prélèvements peuvent être répétés plusieurs fois. Ces techniques sont faciles à maîtriser et peuvent être appliquées dans de nombreuses études précliniques sur les troubles du système nerveux central.
Protocole
Toutes les procédures expérimentales ont été approuvées par le Comité institutionnel de protection et d’utilisation des animaux de l’Université de Ferrare et par le ministère italien de la Santé (autorisation : D.M. 603/2022-PR) conformément aux lignes directrices énoncées dans la directive du Conseil des Communautés européennes du 24 novembre 1986 (86/609/CEE) relative à la protection des animaux utilisés à des fins expérimentales et à d’autres fins scientifiques. Ce protocole est spécifiquement ajusté pour d’autres analyses quantitatives par réaction en chaîne par polymérase (qPCR) de petits acides ribonucléiques non codants (ARNsnc) dans le LCR et le plasma de rat obtenus sous contrôle EEG chez des animaux épileptiques. À sa discrétion, veuillez consulter la vidéo JoVE correspondante pour une meilleure compréhension et des améliorations de la chirurgie 19,20,21.
1. Préparation des animaux pour l’implantation chirurgicale d’électrodes ou de télémètres
REMARQUE : La technique de chirurgie stéréotaxique varie en fonction du système EEG utilisé. La section suivante sur la méthode fournit une description des étapes communes aux deux types de chirurgies.
- Utilisez des rats Sprague-Dawley (SD) (mâles, âgés de 7 à 8 semaines, pesant 250 à 290 g) maintenus conformément aux lois locales sur le soin et l’utilisation des animaux de laboratoire. Hébergez les animaux dans des conditions standard avec un accès gratuit à la nourriture et à l’eau potable.
- Procéder à la manipulation des rats pendant quelques jours avant la chirurgie et les procédures du protocole expérimental.
- Utiliser un appareil stéréotaxique pour l’implantation d’électrodes ou de télémètres. Suivez les normes contemporaines pour les chirurgies aseptiques. Utilisez des électrodes et des transmetteurs stériles et en bon état de fonctionnement.
- Rasez la tête de l’animal avec le rasoir électrique. Induire l’anesthésie chez l’animal avec le mélange de kétamine (45 mg/kg) et de xylazine (7,5 mg/kg) administré par voie intrapéritonéale (i.p.), puis ajouter l’anesthésie à l’isoflurane (1,4 % dans l’air ; 1,2 mL/min) administrée à travers un masque facial et fixer la tête de l’animal dans l’appareil stéréotaxique.
- Assurez-vous d’une profondeur d’anesthésie adéquate en testant le réflexe de retrait de la pédale après le pincement des coussinets plantaires sur les pattes arrière des deux animaux et maintenez l’anesthésie à l’isoflurane jusqu’à la fin de la chirurgie. Vérifiez régulièrement la profondeur de l’anesthésie pendant toute la durée de l’intervention.
- Appliquez une quantité suffisante de pommade ophtalmique sur les yeux des deux animaux pour prévenir les lésions cornéennes dues à la perte du réflexe de clignement des yeux causée par l’anesthésie.
- Nettoyez soigneusement le cuir chevelu de l’animal avec un désinfectant liquide et faites une incision longitudinale de 2 cm de long à l’aide d’un scalpel stérilisé. Ouvrez le cuir chevelu et appliquez des clips chirurgicaux sur les lambeaux de peau pour le maintenir ouvert.
- Délicatement, détachez le périoste pour exposer le bregma et la zone du crâne à travers laquelle l’électrode enregistreuse sera insérée.
2. Implantation chirurgicale d’électrodes attachées
NOTA : Avant d’établir la procédure de ponction du LCR de ce protocole (voir l’étape 9 pour plus de détails), des prélèvements répétés du LCR à l’aide d’une canule guide chez quelques rats non anesthésiés se déplaçant librement ont été effectués. Des animaux canulés implantés avec des électrodes attachées ont été utilisés afin d’évaluer l’impact des implants à double tête sur l’enregistrement EEG à long terme couplé à de multiples prélèvements de LCR. Dans ces expériences spécifiques, des rats ont été implantés avec une canule guide factice placée dans la citerne magna, dont l’extrémité y a été insérée de 7 mm de manière stéréotaxique, selon des protocoles précédemment publiés22. Les approches de chirurgie à double implant étaient similaires à celles adoptées par certains travailleurs dans le passé pour l’implantation de canules guides de microdialyse et d’électrodes attachantes23,24.
- Utilisez un bras du cadre stéréotaxique, montez le porte-électrode dessus et placez l’électrode à la verticale dans le support. Déplacez la pointe de l’électrode exactement au-dessus du bregma. Notez les coordonnées antéropostérieures et médiolatérales du bregma et traduisez-les aux coordonnées souhaitées.
- Abaissez l’électrode jusqu’à ce que sa pointe touche presque le crâne. Marquez l’endroit du perçage et percez le crâne sur l’endroit marqué. Veillez à ne pas endommager le cerveau et les méninges.
- Faites quatre trous ou plus pour les vis d’ancrage et vissez-les dans le crâne. Faites attention à la taille de l’électrode lorsque vous faites les trous pour les vis d’ancrage. La taille de l’électrode ne doit pas interférer avec les vis d’ancrage positionnées.
- Abaissez lentement le bras stéréotaxique portant l’électrode sur l’axe dorso-ventral, entrez dans le tissu cérébral et arrêtez-vous à la position souhaitée. Fixez le fil de terre de l’électrode autour de l’une des vis vissées dans le crâne.
- Placez le ciment méthacrylique sur l’électrode et les vis couvrant environ la moitié de la hauteur du piédestal de l’électrode. Laissez la moitié supérieure de l’électrode, qui correspond à l’extrémité du fil d’attache, nue.
- Libérez l’électrode du support et soulevez le bras stéréotaxique. Libérez l’animal de l’appareil stéréotaxique et donnez-lui des soins postopératoires.
- Placez l’animal dans une cage de récupération séparée et observez-le toutes les 10 minutes jusqu’à ce qu’il soit éveillé et ambulatoire. Ne remettez l’animal dans sa cage d’hébergement standard et dans une autre compagnie d’animaux non anesthésiés qu’après s’être complètement rétabli.
3. Implantation chirurgicale des télémètres
REMARQUE : N’utilisez que des télémètres stériles. Si les télémètres sont réutilisés, nettoyez-les et stérilisez-les avant la chirurgie selon les instructions du fabricant. Dans ce protocole, un télémètre de science des données International (DSI) pour l’enregistrement EEG a été utilisé.
- Allumez l’émetteur de télémétrie à l’aide d’un aimant et testez le signal avec une radio de fréquence AM. Vérifiez s’il y a un signal fort et clair avant la chirurgie. Si nécessaire, jetez les télémètres qui fonctionnent mal.
- Préparez les fils du télémètre en les raccourcissant à des longueurs optimales pour les rats adultes. Décollez le revêtement en silicone sur deux fils (négatif et positif), exposant environ 5 mm du fil d’acier hélicoïdal. Créez une poignée bouclée d’environ 2 mm de longueur et 1 mm de largeur à l’extrémité des laisses.
- Rasez le flanc de l’animal sous et derrière l’épaule gauche. Désinfecter la zone de chirurgie avec un désinfectant à base de peroxydes stabilisés et d’activité d’ammonium quaternaire. Laissez agir le désinfectant pendant 15 min.
- Faites une incision latérale d’environ 2 cm juste derrière l’épaule de l’animal et faites une poche sous-cutanée d’environ 5 cm3 d’espace pour la mise en place de l’émetteur. Placez l’émetteur parallèlement à l’axe long du corps, avec les fils dirigés vers la direction rostrale.
- Fixez l’émetteur à la paroi interne de la poche sous-cutanée avec une suture en coton 3-0. À l’aide de ciseaux à bout émoussé, créez le tunnel sous-cutané (d’environ 2,5 cm de longueur) à travers le flanc et le cou de l’animal, reliant ainsi la poche de l’émetteur à l’incision médiane pratiquée sur le cuir chevelu de l’animal à l’étape 1.6.
- Prenez les deux fils de télémètres avec une pince et tirez-les vers le haut à travers le tunnel, de sorte qu’ils dépassent de la sortie de l’incision du cuir chevelu. Maintenez les fils hors de l’incision du cuir chevelu avec des pinces à plaie.
- Utilisez le cadre stéréotaxique pour identifier les coordonnées souhaitées pour la dérivation positive (rouge) et percez le trou dans le crâne pour la pointe de dérivation positive (similaire à l’étape 2.1.). Faites un autre trou pour ancrer la vis vers le haut au rostre et vissez-la dans le crâne.
- Insérez l’extrémité de la sonde positive sous la scutellaire et la dure-mère et posez-la sur la surface du cerveau. Accrochez la pointe bouclée du fil négatif (blanc) sur la vis. Mettez une petite quantité de ciment méthacrylique autour de la sortie du plomb positif et du plomb négatif pour les immobiliser sur le crâne.
- Fixez les sondes à la paroi interne de la peau du crâne avec une suture en coton 3-0. Assurez-vous que les sondes fixes et la suture de fixation n’interféreront pas avec le site de retrait du LCR (c’est-à-dire une surface dépressible avec l’apparence d’un losange entre la protubérance occipitale et la colonne vertébrale de l’atlas).
- Fermez l’incision du cuir chevelu et l’incision du flanc à l’aide d’une suture en coton 3-0. Appliquez des désinfectants sur les plaies. Ce n’est qu’une fois celles-ci sèches qu’il faut appliquer une crème antibiotique sur les plaies suturées.
4. Soins postopératoires
- Surveillez les animaux pendant environ 1 h après l’opération jusqu’à ce qu’ils se tiennent debout et se déplacent dans la cage. Gardez-les sur un coussin chauffant pour éviter l’hypothermie. Administrer aux animaux un antibiotique systémique pour prévenir l’infection et un analgésique systémique pour prévenir la douleur post-chirurgicale pendant 2 à 3 jours.
- Laissez les rats récupérer pendant au moins 7 jours après les interventions chirurgicales. Surveillez les animaux au moins une fois par jour pendant 3 jours pour détecter tout signe de douleur ou de détresse.
5. Induction de l’état de mal épileptique chez le rat
REMARQUE : Pour un protocole détaillé d’induction de l’état de mal épileptique (SE) nécessaire à la reproduction de l’épilepsie mésiale du lobe temporal (mTLE) chez le rat, se référer à Guarino et al.25.
- Après une semaine de récupération post-chirurgicale, répartissez les animaux au hasard dans des groupes : (i) les animaux témoins recevant le véhicule et (ii) les animaux épileptiques qui recevront de la pilocarpine. Utilisez un nombre proportionnellement plus élevé d’animaux pour le groupe épileptique, car tous les rats à qui l’on a administré de la pilocarpine ne survivront pas ou ne développeront pas d’ES.
- La veille de l’induction de l’ES, administrer aux animaux une dose unique de 127 mg/kg de chlorure de lithium dissous dans une solution saline à 0,9 % (3M) à raison de 1 mL/kg par gavage gastrique. Administrer le lithium de l’animal, qui augmente l’efficacité de la pilocarpine26, environ 14 h avant l’induction de l’ES afin de réduire la variabilité dans le temps jusqu’à l’apparition de l’ES.
- Environ 14 h après l’administration de lithium, administrer aux rats une seule injection de méthylscopolamine (1 mg/kg, par voie sous-cutanée).
- Exactement 30 minutes après l’administration de méthylscopolamine, administrer aux rats une seule injection de pilocarpine (50 mg/kg, i.p.) pour induire l’ES. Donner de la méthylscopolamine et du véhicule (solution de NaCl à 0,9 %) pour contrôler les rats.
- L’injection de pilocarpine induit un comportement typique chez l’animal : crises partielles précoces (mouvements des vibrisses et hochements de tête dans les 5 minutes suivant l’administration de pilocarpine) évoluant vers des convulsions généralisées récurrentes (SE) dans les 25 à 30 minutes. Pour les rats qui ne développent pas d’ES dans les 30 minutes, administrer une dose supplémentaire de pilocarpine (25 mg/kg, i.p.), et s’ils ne développent toujours pas d’ES, les exclure de l’étude (non-répondeurs à l’ES).
- Observez et notez le comportement épileptique chez le rat toutes les 5 minutes en commençant immédiatement après l’injection de pilocarpine. Utilisez l’échelle de Racine pour obtenirune note de 27.
- Interrompre l’ES 2h après le début par l’administration i.p. d’un cocktail de médicaments : diazépam (10 mg/kg), phénobarbital (25 mg/kg) et scopolamine (1 mg/kg).
- Donnez à nouveau ce cocktail aux rats après 4 h. Enfin, après encore 4 h, donnez aux rats le dernier mélange de médicaments (diazépam 10 mg/kg plus scopolamine 1 mg/kg) afin d’arrêter complètement l’activité convulsive.
- Injecter i.p. aux animaux avec une solution saline (1 mL de solution de NaCl à 0,9 %, pH ajusté à 7,0) et les nourrir avec une solution de saccharose à 10 % pendant 2 à 3 jours après l’ES pour favoriser la récupération de la perte de poids corporel qui suit l’ES.
- Assigner au hasard les animaux survivants post-SE à différents groupes expérimentaux selon les exigences du protocole expérimental spécifique. Utiliser les critères d’inclusion/exclusion suivants pour d’autres expériences chez des rats épileptiques : développement d’une SE convulsive dans l’heure suivant l’administration de pilocarpine, prise de poids au cours de la première semaine après l’ES et positionnement correct de l’électrode dans la zone cérébrale d’intérêt pour les enregistrements EEG25.
6. Vidéo-EEG captif chez le rat épileptique et analyses de l’activité convulsive
NOTA : Cette section décrit la procédure expérimentale d’enregistrement des signaux EEG chez des rats logés et se déplaçant librement dans des conditions normales. La cage ne doit pas contenir d’objets où l’animal ou le câble d’enregistrement peuvent se coincer. En fonction de la question scientifique à aborder, plusieurs paramètres peuvent être analysés. Dans le cas de la recherche sur l’épilepsie, les traces EEG sont examinées pour reconnaître les crises électriques et motrices. Les paramètres les plus couramment utilisés pour identifier une crise sont l’amplitude, la fréquence et la durée de l’activité électrique paroxystique.
- Placez l’animal dans une cage propre dans la salle d’enregistrement pour permettre l’accoutumance et réduire le stress induit par le nouvel environnement. Placez la cage de l’animal dans une cage de Faraday pour éviter la contamination du signal EGG par le champ électromagnétique environnemental.
- Connectez une extrémité du câble d’enregistrement à l’appareil d’enregistrement. Utilisez un voltmètre pour mesurer le potentiel électrique et différencier les électrodes de masse des électrodes de référence.
- Connectez l’autre extrémité du câble d’enregistrement à l’électrode fixée sur la tête du rat. Pour ce faire, tenez le couvercle en ciment sur la tête de l’animal lors de l’insertion de la fiche du câble dans le connecteur de l’électrode et évitez d’appliquer une pression sur la tête du rat.
- Contrebalancez le poids du câble d’enregistrement pour permettre la libre circulation de l’animal tout en évitant le risque de torsion du câble. Pour ce faire, utilisez un bras d’équilibrage ou des collecteurs. Même si le câble d’enregistrement est contrebalancé, placez la nourriture à l’intérieur de la cage plutôt que dans un support d’alimentation, dans lequel les animaux doivent se lever pour atteindre la nourriture.
- Avant de commencer l’enregistrement, vérifiez tous les paramètres utilisés pour acquérir et traiter les données de l’EEG.
REMARQUE : Ce protocole ne fournit pas d’introduction à l’appareil requis pour effectuer l’enregistrement EEG, cependant, des taux de filtrage et d’échantillonnage adéquats doivent être appliqués pour éviter les artefacts et le bruit dans les signaux EEG.- Pour une expérience de routine, réglez la fréquence d’échantillonnage à 500 Hz et le gain d’amplification à 5000x. Filtrez le signal à l’aide d’un filtre de 0,005 Hz en plus d’un filtre coupe-bande pour éliminer l’activité électrique environnante dans la bande de 50 Hz (spécifique aux pays européens).
- Démarrez les enregistrements vidéo et EEG et assurez-vous que les traces correspondent à un signal EEG attendu en vérifiant la puissance dans des bandes de fréquences spécifiques au fil du temps. Enregistrez une période de référence avant de commencer les interventions chez les animaux.
- Vérifiez périodiquement les traces des animaux et de l’EEG. Il n’est pas rare qu’un câble d’enregistrement se détache du connecteur de l’électrode dans la tête du rat. Si cela se produit, reconnectez à nouveau l’électrode de la tête de rat à un câble d’enregistrement et vérifiez si le signal EEG est clair.
- Analysez le signal EEG manuellement ou automatiquement à l’aide d’un logiciel disponible dans le commerce. En cas d’analyse manuelle, passez au crible l’enregistrement EEG pour identifier les activités semblables à des crises. Si un logiciel doit être utilisé, configurez les paramètres clés d’un événement de crise, tels que l’amplitude, la fréquence et la durée de l’activité électrique.
NOTA : Une seule crise peut être caractérisée par une activité électrique d’une amplitude 3 fois supérieure à la ligne de base, d’une fréquence égale ou supérieure à 5 Hz et d’une durée d’au moins 5 s22. - Quelle que soit la méthode utilisée, confirmez les crises convulsives potentielles en vérifiant l’enregistrement vidéo synchronisé recueilli simultanément avec l’EEG.
7. Vidéo-EEG de télémétrie chez le rat épileptique et analyse de l’activité convulsive
NOTA : Cette section décrit la procédure expérimentale d’enregistrement des signaux EEG de radiotélémétrie chez des rats logés et se déplaçant librement dans des conditions normales. Le protocole est basé sur un système de télémétrie disponible dans le commerce. Cependant, plusieurs systèmes de télémétrie diffèrent légèrement dans leurs spécifications fonctionnelles et techniques. Le système doit être choisi en fonction des besoins du laboratoire et des objectifs de recherche.
- Placez la cage de l’animal au-dessus du récepteur de signal. Connectez le récepteur de signal au système d’acquisition de données et celui-ci à un ordinateur avec le logiciel d’acquisition.
- Allumez l’implant de télémétrie par radiofréquence en plaçant un aimant à proximité du télémètre inséré dans le flanc du rat. Testez le signal à l’aide d’un appareil radio. Utilisez un appareil radio universel pour tester les télémètres et entendez un bip clair indiquant que le télémètre est activé, tandis qu’un grésillement indique un télémètre inactivé.
REMARQUE : La durée de vie de la batterie de l’émetteur radiofréquence doit être prise en compte avant de définir la durée des enregistrements. - Configurez le logiciel d’acquisition et synchronisez le signal de télémétrie et le système vidéo pour acquérir simultanément des données EEG et vidéo. Attribuez un récepteur de signal à chaque émetteur implanté et définissez les valeurs d’étalonnage de l’émetteur. Réglez la fréquence d’échantillonnage à 1000 Hz, la détection de bruit entre -500 mV et +500 mV et l’intervalle d’intégration à 100 ms. N’utilisez pas de filtres passe-bas et passe-haut.
- Démarrez les données de télémétrie et les enregistrements vidéo. Effectuez un enregistrement de base à long terme avant d’acquérir l’activité de type épileptique. Analysez le signal EEG comme décrit aux étapes 6.8 et 6.9.
8. Procédure de prélèvement sanguin de la veine caudale
NOTE. Le système de prélèvement sanguin sous vide se compose d’une aiguille papillon (23 G x 3/4 x 12 (0,8 mm x 19 mm x 305 mm). La technique de prélèvement sanguin peut être facilement effectuée par un seul opérateur et la procédure prend environ 5 minutes.
- Enrober l’aiguille papillon et sa tubulure avec de l’EDTA K2à 1 % dans de l’eau distillée peu de temps avant les prélèvements, c’est-à-dire aspirer et expulser la solution d’EDTA K2du système à l’aide de la seringue de 1 mL. Coupez le tube juste derrière l’aiguille afin de recueillir le sang goutte à goutte, sans aspiration (Figure 1A).
- Placez le rat dans une chambre d’induction et anesthésiez-le avec de l’isoflurane (1,4 % dans l’air ; 1,2 mL/min). Passez au cadre stéréotaxique et maintenez l’anesthésie à l’aide d’un masque facial. Placez le coussin chauffant sous l’animal, en gardant une partie de sa queue en contact direct avec le coussin.
- Déplacez doucement le dos de l’animal sur le côté de manière à ce que la veine caudale latérale soit maintenue en haut.
- Trempez la queue dans de l’eau tiède (42 °C) pendant 2 min pour dilater la nervure latérale. Essuyez la queue avec de l’éthanol à 70 % pour rendre la veine plus visible. Mettez une lumière chaude sur la queue à l’aide d’une ampoule à incandescence ordinaire.
- Insérez l’aiguille papillon 21G dans la veine caudale latérale avec une profondeur de 5 mm et un angle de 20°. Prélever du sang dans un tube de prélèvement sous vide de 500 μL contenant 5 mg d’EDTA K2comme anticoagulant (Figure 1B,C).
- Retirez l’aiguille et arrêtez l’écoulement du sang en exerçant une pression sur le site de ponction. Ramenez le rat dans sa cage d’origine.
- Retournez doucement le tube 10x pour mélanger l’anticoagulant dans le sang. Faites des trous d’environ 1,5 cm de profondeur dans la glace pour accueillir les tubes de collecte. Mettez doucement et verticalement l’échantillon sur de la glace.
- Centrifuger l’échantillon de sang dans une centrifugeuse réfrigérée (4 °C) à 1300 x g pendant 10 min pour séparer le plasma. Effectuez cette procédure dans un délai de 1 h maximum.
- Prélevez environ 200 μL de plasma, en évitant la couche de globules rouges et blancs. Placer le plasma prélevé dans le microtube stérile de 0,2 ml. Si nécessaire, conserver à 4 °C jusqu’à 1 h après centrifugation.
- Mettez de côté 5 μL de l’échantillon pour le contrôle de la qualité. Conserver l’échantillon à -80 °C jusqu’à l’analyse.
REMARQUE : N’utilisez pas l’aspirateur, même si certains chercheurs le recommandent28, et ne traitez pas la queue pendant les procédures décrites à l’étape 8.5 pour obtenir plus de sang, car cela diminue la qualité de l’échantillon pour les prochaines analyses de quantification de l’ARNsnc (veuillez consulter les résultats représentatifs pour plus de détails). Gardez à l’esprit que chez le rat, la quantité maximale de sang qui peut être prélevée en une seule fois est de <10 % de son volume sanguin total (c’est-à-dire environ 1,6 à 1,9 ml chez un rat de 250 à 300 g) et de <15 % du volume sanguin total (environ 2,64 ml) en 1 mois29. Dans ce protocole, un maximum de 500 μL de sang prélevé en une seule occasion jusqu’à cinq fois chez un seul animal est utilisé30,31.
9. Procédure de recouvrement du LCR
NOTE. La technique peut être facilement réalisée par un seul opérateur, et la procédure nécessite environ 2 à 4 minutes. Les matériaux utilisés pour la collecte du LCR sont des aiguilles papillon sous vide à usage unique et peu coûteuses et des tubes d’extraction. Dans ce protocole, un dispositif de perfusion à ailes de papillon relié à une seringue stérile est utilisé afin de créer le vide (Figure 2A).
- Préparez l’aiguille papillon 23G en coupant son manchon de protection en plastique de manière à ce que l’extrémité de l’aiguille nue soit exposée de 7 mm pour éviter qu’elle ne pénètre à plus de 7 mm de profondeur dans la citerne magna lors du retrait (Figure 2B).
- Connectez l’aiguille papillon munie d’un tube en polymère à une seringue de 1 ml.
- Placez le rat dans une chambre d’induction et anesthésiez-le avec de l’isoflurane (1,4 % dans l’air ; 1,2 mL/min). Basculez le flux d’isoflurane vers le cadre stéréotaxique et maintenez l’anesthésie administrée à travers un masque facial. Retirez la fourrure sur l’arrière-plan, la tête et le cou du rat avec un rasoir.
- Fixez la tête du rat avec des barres auriculaires. Abaissez la tête de l’animal d’environ 45° verticalement, en descendant le long de la barre nasale du cadre stéréotaxique (figure 2C). Inspectez l’arrière de la tête de l’animal et trouvez une surface légèrement déprimée ayant l’aspect d’un losange, entre la protubérance occipitale et l’épine de l’atlas.
- Frottez cette surface avec de l’éthanol à 70% afin de la rendre plus visible et désinfectez-la.
- Insérez l’aiguille papillon verticalement au centre de la surface déprimée en forme de losange dans la citerne magna pour la collecte du LCR jusqu’à ce que le mouvement soit bloqué en coupant à la taille de la protection du manchon en plastique de l’aiguille (Figure 2D). Tirez doucement le piston de la seringue de 1 mL vers l’arrière afin de laisser le LCR s’écouler lentement à travers l’aiguille.
- Recueillir environ 100 μL de LCR dans un tube en polymère (figure 2D). Évitez d’entrer dans le sang ou toute autre contamination visible. Pincez le tube en polymère très près de l’aiguille papillon et coupez le tube à ce stade.
- Prélever l’échantillon clair (non contaminé) dans la seringue. Jetez l’échantillon contaminé si une contamination visible pénètre dans le tube collecteur.
- Expulser l’échantillon dans le microtube stérile de 0,2 ml et le conserver sur de la glace jusqu’à 1 h.
- Désinfectez le site de retrait du LCR sur la tête de l’animal. Retirez le rat du cadre stéréotaxique et remettez-le dans sa cage.
- Mettez de côté 2 μL de l’échantillon pour le contrôle de la qualité. Conservez le reste de l’échantillon à -80 °C pour une analyse plus approfondie.
REMARQUE : Chez le rat, si plusieurs prélèvements de LCR sont effectués à plusieurs reprises, le volume recommandé à retirer à chaque prélèvement est de 100 μL32. Dans ce protocole, un maximum de 100 μL de LCR en une seule occasion avec un retrait maximal de 5 fois en 15 jours chez un seul animal a été effectué.
10. Analyse spectrophotométrique de la qualité de l’échantillon
REMARQUE : Après un prélèvement approprié des échantillons de LCR et de plasma, les échantillons sont prêts pour les analyses spectrophotométriques et ne nécessitent aucune manipulation spécifique. Mesurer l’absorbance de l’hémoglobine par spectrophotométrie UV à 414 nm pour évaluer le risque d’hémolyse dans les échantillons. Utiliser une valeur limite d’absorbance de 0,25 dans les échantillons de rats. Le choix de cette limite peut dépendre de l’analyse ultérieure de la qPCR et de ses exigences spécifiques pour la quantification des ARNsnc.
- Allumez le spectrophotomètre UV. Sélectionnez la méthode de mesure de l’absorbance à une seule longueur d’onde de 414 nm pour le PLASMA ou le LCR. Cliquez sur Suivant.
- Rincez la cuvette de 1 mm à l’eau purifiée. Mettez 5 μL d’éthanol à 70 % sur le point de mesure de la cuvette. Séchez avec un essuie-tout et frottez avec du papier de soie non pelucheux. Vérifiez s’il est parfaitement transparent.
- Mettez 1,5 μL d’eau purifiée dans la cuvette de 1 mm et fermez-la. Insérez la cuvette dans la chambre de mesure du spectrophotomètre et mesurez l’absorbance de l’échantillon blanc en cliquant sur le bouton Vide . Vérifiez que la valeur d’absorbance à 414 nm est de 0,000.
- Séchez la cuvette avec une serviette en papier et nettoyez-la avec du papier de soie non pelucheux. Vérifiez s’il est parfaitement transparent.
- Mettez 1,5 μL de l’échantillon dans la cuvette de 1 mm et fermez-la. Insérez la cuvette dans la chambre de mesure du spectrophotomètre. Mesurez l’échantillon en cliquant sur le bouton Échantillon . Vérifier l’absorbance de l’échantillon à 414 nm et l’annoter.
- Procéder à la quantification de l’absorbance de l’hémoglobine dans tous les échantillons disponibles. Mesurez l’échantillon à blanc avant tout échantillon de plasma ou de LCR, en cliquant alternativement sur les boutons Blanc et Échantillon .
- Conserver les échantillons avec A414 nm < 0,25 à -80 °C et jeter les échantillons si A414 nm > 0,25.
- Rincez séquentiellement la cuvette de 1 mm avec de l’eau purifiée et de l’éthanol à 70 %. Séchez la cuvette.
- Fermez la cuvette vide dans la chambre de mesure pour éviter qu’elle ne s’époussète. Éteignez le spectrophotomètre.
Résultats
Le résultat de différentes procédures de LCR et de prélèvement sanguin effectuées chez 9 rats témoins et 18 rats épileptiques chroniques, tous implantés avec des électrodes à 1 mois après l’ES, est rapporté en termes de taux de réussite. Après l’implantation, tous les rats ont fait l’objet d’une vidéo-EEG pendant 1 mois, au cours de laquelle le LCR et le sang ont été prélevés 5 fois tous les 3 jours pendant les deux dernières semaines de l’expérience (c’est-à-dire aux jours 52, 55, 58, 61 et 64 après l’ES ; dpSE). Des données provenant de prélèvements multiples chez différents animaux ont été utilisées pour comparer le taux de réussite de la collecte du LCR chez les rats dotés d’un implant à double tête (canulé pour le retrait du LCR) avec le taux de réussite du prélèvement du LCR (effectué par ponction de la citerne magna) chez les animaux attachés ou implantés à des électrodes de télémétrie (tableau 1). Chez différents animaux, l’impact de la collecte de sang sous vide ou de la traite de la queue sur la qualité des échantillons de plasma a été évalué (tableau 2). À cette fin, l’analyse par spectrophotométrie UV à 414 nm a été utilisée pour la détection de l’hémoglobine libre. Pour les analyses statistiques, un logiciel commercial a été utilisé, et l’ANOVA de Kruskal-Wallis ou l’ANOVA à un facteur avec des tests de comparaison multiples de Tukey post-hoc ont été utilisés (p<0,05 considéré comme statistiquement significatif). Les données sont exprimées sous la forme d’une moyenne ± SEM.
Taux de réussite de l’échantillonnage multiple du LCR chez des rats canulés et ponctionnés
Le LCR a été échantillonné 5 fois en 2 semaines dans 3 groupes de rats : (i) rats canulés et dotés d’électrodes attachées (groupe d’animaux CT) ; dans ces cas, le retrait du LCR a été effectué à l’aide d’une canule de guidage factice et d’un joint de tube en PTFE à une seringue de 1 mL lorsqu’ils n’étaient pas anesthésiés et se déplaçaient librement sous vidéo-EEG ; (ii) rats ponctionnés (étape 9) et implantés à électrode attachée (groupe PT) ; (iii) rats ponctionnés et implantés à l’électrode de télémétrie (groupe PTe). Au total, 9 animaux par groupe (6 rats épileptiques et 3 rats témoins) ont été utilisés. Le nombre de collectes réussies plus de 5 fois a été évalué. Le taux de réussite était similaire chez les rats ponctionnés : 86,7 % ± 5,8 % chez les animaux attachés et 88,9 % ± 4,8 % chez les animaux implantés à l’électrode de télémétrie. Au lieu de cela, chez les rats canulés, le taux a été réduit même s’il n’a pas été significativement différent (71,1 % ± 8,9 %, tableau 1). De tels résultats indiquent que la canule sur la tête des animaux peut interférer avec les prélèvements répétés du LCR et compromettre les études longitudinales. La technique de ponction est plus adaptée aux prélèvements multiples de LCR chez les animaux implantés à l’aide d’électrodes.
Impact de la traite sous vide et de la traite de la queue sur la méthode de collecte du plasma
Le sang a été prélevé 5 fois sur 9 rats (6 épileptiques et 3 rats témoins) aux jours 52, 55, 58, 61 et 64 après l’ES et la qualité du plasma a été évaluée pour l’hémolyse visuellement et par spectrophotométrie UV à 414 nm. Pour obtenir le premier échantillon chez chaque rat, le prélèvement sous vide à l’aide d’une aiguille papillon de 21 G attachée à une seringue de 1 ml a été utilisé. Dans le deuxième échantillon, le retrait de goutte et le système d’aiguille papillon 21G ont été utilisés lors de la traite simultanée de la queue. Pour obtenir le 3e-5e échantillon, la procédure de retrait des gouttes sans traite de la queue (décrite à l’étape 9) a été utilisée.
Lors de l’utilisation d’un vide, le plasma était de couleur rose lors de l’inspection visuelle, et la valeur moyenne d’absorbance des échantillons de 9 rats était de 0,647 ± 0,067 (tableau 2, figure 3). Des résultats similaires ont été obtenus si l’on utilisait la traite de la queue pendant la procédure : plasma de couleur rose avec une absorbance moyenne de 0,620 ± 0,043 (tableau 2, figure 3). En revanche, avec le retrait de goutte activé par gravité et le système d’aiguille papillon 21G, les valeurs moyennes d’absorbance plasmatique ont été significativement réduites (0,226 ± 0,017 à 58 dpSE ; 0,223 ± -0,09 à 61 dpSE ; 0,226 ± 0,018 à 64 dpSE ; Tableau 2, figure 3) en ce qui concerne la méthode de traite sous vide ou par queue. De plus, les échantillons de plasma en gouttes étaient pour la plupart transparents. Des valeurs d’absorbance plus élevées (52 et 55 dpSE) étaient corrélées à la couleur rose des échantillons (données non présentées). Ces résultats peuvent suggérer que cette dernière méthode est la meilleure pour obtenir des échantillons de très haute qualité pour les analyses.

Figure 1 : Étapes clés du processus d’échantillonnage du plasma. (A) Matériel nécessaire au prélèvement sanguin et au rat dans le cadre stéréotaxique, prêt à être collecté ; (B, C) Grossissements de la queue avec une aiguille papillon 21G insérée dans la veine caudale latérale et la goutte de sang tombant le long des parois du tube de prélèvement avec un anticoagulant. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Étapes clés du processus d’échantillonnage du liquide céphalorachidien (LCR). (A) Matériel nécessaire pour le retrait du LCR et rat dans le cadre stéréotaxique, peu de temps avant le prélèvement ; (B) La préparation de l’aiguille papillon 23G en coupant son manchon de protection en plastique de manière à ce que l’extrémité de l’aiguille nue soit exposée sur 7 mm pour assurer une pénétration correcte dans la citerne magna ; (C) La tête du rat est inclinée de 45° vers le bas pendant le retrait. (D) Grossissement sur le site rhomboïde avec une aiguille papillon insérée dans la citerne magna. Remarquez le LCR qui monte dans le tube, indiqué par l’extrémité du marqueur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
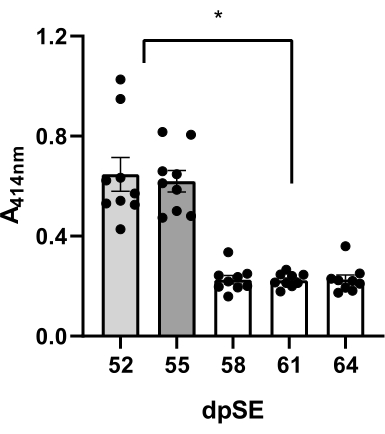
Figure 3 : Évaluation de la qualité des échantillons de plasma. Degré d’hémolyse mesuré à 414 nm pour l’hémoglobine libre par spectroscopie UV dans des échantillons de plasma de 9 animaux à 5 points temporels (52, 55, 58, 61 et 64 jours après l’état de mal épileptique, dpSE) en utilisant différentes méthodes : jour 52 - la technique du vide ; Jour 55 - la traite de la queue ; Jours 58-64 Les techniques de chute ont été utilisées. La diminution de l’hémoglobine libre dans le plasma obtenue par la technique de goutte par rapport aux méthodes de traite sous vide et à queue était significative (*p <0,05 selon l’ANOVA à un facteur et le test de comparaison multiple post-hoc de Tukey). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Taux de réussite des retraits du LCA. Comparaison des taux de réussite des sevrages répétés du LCR dans trois groupes expérimentaux d’animaux, exprimés en pourcentage de sevrages réussis sur 5 jours. La valeur 1 a été attribuée au prélèvement réussi de > 100 μL de LCR clair ; la valeur zéro a été attribuée aux prélèvements < 100 μL et/ou dont le LCR n’est pas clair. Abréviations : S.O. - l’absence de prélèvement en raison de la perte de canule pendant la procédure d’échantillonnage (animaux TDM seulement) ; TDM - canulée, attachée ; PT - perforé attaché ; PTe - électrodes de télémétrie perforées implantées. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Évaluation de l’hémolyse dans les échantillons de plasma. Résultats des mesures d’hémolyse à 5 moments en utilisant trois méthodes différentes de prélèvement sanguin : jour 52 - la technique du vide ; Jour 55 - la traite de la queue ; Jours 58-64 Les techniques de chute. Les valeurs >0,3 de l’absorbance sont corrélées avec la couleur rose des échantillons. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le présent travail illustre une technique facile à maîtriser de LCR et de prélèvement sanguin chez le rat, qui peut être utile non seulement pour des études sur des modèles d’épilepsie, mais aussi pour d’autres affections ou maladies neurologiques telles que la maladie d’Alzheimer, la maladie de Parkinson ou la sclérose en plaques. Dans la recherche sur l’épilepsie, les deux procédures d’échantillonnage couplées à l’EEG vidéo sont idéales lorsqu’une corrélation entre les niveaux de différentes molécules solubles et l’activité épileptique est recherchée. C’est précisément pour cette raison qu’un enregistrement vidéo-EEG en continu a été utilisé : i) afin de diagnostiquer correctement l’épilepsie ou ii) de surveiller les différentes phases de l’évolution de la maladie, et/ou iii) de corréler le prélèvement avec la survenue de crises spontanées. De telles techniques d’échantillonnage peuvent être effectuées sur des rats anesthésiés, ce qui réduit le stress nécessaire.
Étapes critiques, dépannage, limitations de la méthode
Le protocole comporte des étapes techniques critiques. Tout d’abord, il peut être difficile de trouver le bon endroit pour la collecte du LCR lors de la première tentative. Si l’opérateur manque la citerne magna lors de la première tentative, tout essai ultérieur sera contaminé par le sang, car l’animal saignera de la blessure à l’aiguille. De ce point de vue, le succès de la collecte dépend fortement de l’habileté de l’opérateur. Deuxièmement, certaines étapes du prélèvement sanguin nécessitent une attention particulière. En particulier, il existe un risque élevé d’hémolyse si l’opérateur frotte trop vigoureusement la queue avec de l’éthanol, si la température de l’eau utilisée pour la vasodilatation de la veine caudale est supérieure à 42 °C ou si le sang dans le tube de prélèvement est mélangé avec un anticoagulant trop énergiquement. Une autre particularité de la collecte de sang chez les animaux épileptiques chroniques est l’influence de leur bradycardie sur la vitesse à laquelle le sang tombe de la veine caudale33. Si cela est trop lent, le sang peut coaguler sur les parois du tube de prélèvement. Pour éviter ce problème, une option consiste à diviser l’échantillon en deux tubes de prélèvement, ce qui réduit le volume de sang/tube. Enfin, il y a un écueil qui est intrinsèque aux études sur l’épilepsie. Le stress provoqué par la manipulation des animaux avant l’échantillonnage peut induire des convulsions, qui à leur tour peuvent interférer avec les niveaux de molécules faisant l’objet de l’étude34. Dans la mesure du possible, placez la chambre d’induction de l’anesthésie dans la cage domestique et permettez à l’animal d’y entrer spontanément. En tant que modification du protocole proposé, un contenteur peut être utilisé pour effectuer un prélèvement sanguin sans anesthésie à l’isoflurane. Cependant, cela peut être fait en télémétrie, mais pas chez les animaux attachés, car les rats attachés peuvent perdre leurs implants crâniens au cours de cette procédure.
Ayant un opérateur bien formé et posant un maximum d’efforts pour éviter le stress, la seule limite du protocole actuel est le volume maximal qui peut être retiré sans compromettre la santé de l’animal. Selon les normes actuelles, il est recommandé de prélever un maximum de 100 μL de LCR pendant 4 fois sur 15 jours chez un seul animal32. De même, il est suggéré de prélever moins de 10 % du volume sanguin total sur un seul prélèvement et moins de 15 % du volume total du sang corporel en 28 jours30,31.
Comparaison de la méthode avec d’autres techniques
Les approches proposées pour l’échantillonnage du LCR et du plasma à résolution temporelle présentent plusieurs avantages par rapport aux méthodes alternatives existantes. Tout d’abord, une ponction de citerne magna utilisée pour échantillonner le LCR chez des rats épileptiques présente un risque plus faible de perte de l’implant crânien par rapport à un système canulé s’il est couplé à un EEG attaché. Contrairement aux procédures de ponction, la canule attachée à l’électrode par du ciment dentaire (volumineux et lourd pour la tête des animaux), bien que sollicitée par des attaches/décollements répétés aux prélèvements de LCR, est beaucoup plus susceptible d’être perdue sur plusieurs jours d’échantillonnage. En effet, les résultats du taux de réussite montrent que certains animaux canulés (N/A) n’arrivent pas aux points de temps d’échantillonnage avancés, donc leurs échantillons respectifs sont perdus (Tableau 1). De plus, la méthode de ponction semble être supérieure à l’approche canulée en termes de meilleure stérilité et de réduction de la réaction méningée avec une augmentation limitée de la teneur en cellules et en albumine dans le LCR, comme cela a déjà été documenté par d’autres 22,35,36. Le degré de contamination par les leucocytes du LCR et l’albumine peut être important pour la validité des méthodes utilisées pour la quantification des biomarqueurs de l’épilepsie35. Deuxièmement, la méthode de prélèvement de plasma sanguin en chute libre utilisée pour les mesures répétées est supérieure à toute autre méthode de prélèvement car elle n’est pas terminale (non-récupération), contrairement à la décapitation, à la ponction cardiaque, au vaisseau sanguin abdominal/thoracique ou au retrait rétro-orbitaire et permet de multiples prélèvements sanguins. Il est plus simple que de nombreuses techniques de prélèvement par aspiration du sang dans la veine de la queue, car il ne nécessite pas de tubulure28,37 et produit des échantillons de plasma sans hémolyse de haute qualité pour d’autres analyses d’ARNsnc axées sur l’identification de biomarqueurs putatifs de l’épileptogenèse38. L’absence d’hémoglobine libre dans les échantillons, lors de l’utilisation de la technique de prélèvement goutte ou de l’évitement de la traite de la queue, a été confirmée par les résultats de faible absorbance des échantillons de plasma (tableau 2) conformément aux procédures précédemment publiées adaptées à l’évaluation de la teneur plasmatique en ARNsnc39,40.
Applications et orientations futures
Les méthodes décrites ci-dessus peuvent être appliquées pour mesurer les molécules solubles d’intérêt dans n’importe quel modèle de maladies neurologiques. Un exemple spécifique est l’échantillonnage de liquides biologiques pour l’identification de biomarqueurs potentiels / putatifs de l’épilepsie. Il existe un besoin médical urgent non satisfait de découvrir ces biomarqueurs pour les personnes atteintes d’épilepsie, en particulier les biomarqueurs pronostiques et de susceptibilité/risque, car ils n’existent pas encore.
En conclusion, le présent protocole est réalisable chez les rats, y compris les rats épileptiques, et est facile à mettre en œuvre pour les personnes entraînées. De plus, il permet de multiples échantillonnages de haute qualité dans le cadre d’études longitudinales conformément au principe des 3R (c.-à-d. remplacement, réduction et raffinement)41.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par une subvention du programme de travail Horizon 2020 de l’Union européenne (appel H2020-FETOPEN-2018-2020) dans le cadre de la convention de subvention 964712 (PRIME ; à M. Simonato).
matériels
| Name | Company | Catalog Number | Comments |
| Blood collection set BD Vacutainer Safety-Lok | BD Italy SpA, Milan, Italy | 367246 | Material |
| Blood Collection tubes (Microtainer K2E) | BD Italy SpA, Milan, Italy | 365975 | Material |
| Butterfly Winged Infusion Set 23G x 3/4'' 0.6 x 19 mm | Nipro, Osaka, Japan | PSY-23-ET-ICU | Material |
| Centrifuge refrigerated ALC PK 130R | DJB Labcare Ltd, Buckinghamshire, England | 112000033 | Material |
| Cotton suture 3-0 | Ethicon, Johnson & Johnson surgical technologies, Raritan, New Jersey, USA | 7343H | Material |
| Diazepam 5 mg/2ml, Solupam | Dechra Veterinary Products, Torino, Italy | 105183014 (AIC) | Solution |
| Digital video 8-channel media recorder system of telemetry EEG set up | Data Sciences International (DSI), St Paul, MN, USA | PNM-VIDEO-008 | Equipment |
| Digital video surveillance system of tethered EEG set up | EZVIZ Network, Hangzhou, Cina | EZVIZ (V5.3.2) | Equipment |
| Disinfectant based on stabilized peroxides and quaternary ammonium activity | Laboratoire Garcin-Bactinyl, France | LB 920111 | Solution |
| Dummy guide cannula 8 mm | Agn Tho's, Lindigö, Sweden | CXD-8 | Material |
| Electrode 3-channel two-twisted | Invivo1, Plastic One, Roanoke, Virginia, USA | MS333/3-B/SPC | Material |
| Electrode holder for stereotxic surgery | Agn Tho's, Lindigö, Sweden | 1776-P1 | Equipment |
| Eppendorf BioSpectrometer basic | Eppendorf AG, Hamburg, Germany | 6137 | Equipment |
Eppendorf PCR Tubes 0.2 mL | Eppendorf Srl, Milan, Italy | 30124332 | Material |
| Eppendorf μCuvette G1.0 | Eppendorf AG, Hamburg, Germany | 6138 | Equipment |
| Feeding needle flexible 17G for rat | Agn Tho's, Lindigö Sweden | 7206 | Material |
| Grass Technology apparatus | Grass Technologies, Natus Neurology Incorporated, Pleasanton, California, USA | M665G08 | Equipment (AS40 amplifier, head box, interconnecting cables, telefactor model RPSA S40) |
| Isoflurane 100%, IsoFlo | Zoetis, Rome, Italy | 103287025 (AIC) | Solution |
| Ketamine (Imalgene) | Merial, Toulouse, France | 221300288 (AIC) | Solution |
| Lithium chloride | Sigma-Aldrich, Milan, Italy | L9650 | Material |
| Microinjection cannula 31G 9 mm | Agn Tho's, Lindigö Sweden | CXMI-9 | Material |
| MP150 modular data acquisition and analysis system | Biopac, Goleta, California, USA | MP150WSW | Equipment |
| Ophthalmic vet ointment, Hylo night | Ursapharm, Milan, Italy | 941791927 (AIC) | Material |
| Pilocarpine hydrochloride | Sigma-Aldrich, Milan, Italy | P6503 | Material |
| PTFE Tube with joint | Agn Tho's, Lindigö, Sweden | JT-10 | Material |
| Saline | 0.9% NaCl, pH adjusted to 7.0 | Solution | |
| Scopolamine hydrobromide trihydrate | Sigma-Aldrich, Milan, Italy | S2250 | Material |
| Scopolamine methyl nitrate | Sigma-Aldrich, Milan, Italy | S1876 | Material |
| Silver sulfadiazine 1% cream | Sofar, Trezzano Rosa, Milan, Italy | 025561010 (AIC) | Material |
| Simplex rapid dental methacrylic cement | Kemdent, Associated Dental Products Ltd, Swindon, United Kingdom | ACR811 | Material |
| Stereotaxic apparatus | David Kopf Instruments, Los Angeles, CA, USA | Model 963 | Equipment |
| Sucrose solution | 10% sucrose in distilled water | Home-made | Solution |
| Syringe 1 mL | Biosigma, Cona, Venezia, Italy | 20,71,26,03,00,350 | Material |
| Telemeters | Data Sciences International (DSI), St Paul, MN, USA | CTA-F40 | Material |
| Telemetry EEG traces analyzer | Data Sciences International (DSI), St Paul, MN, USA | NeuroScore v3-0 | Equipment |
| Telemetry system | Data Sciences International (DSI), St Paul, MN, USA | Hardware plus software Ponemah core 6.51 | Equipment |
| Xylazine hydrochloride | Sigma-Aldrich, Milan, Italy | X1251 | Material |
Références
- Hanin, A., et al. Cerebrospinal fluid and blood biomarkers of status epilepticus. Epilepsia. 61 (1), 6-18 (2020).
- Pitkänen, A., et al. Advances in the development of biomarkers for epilepsy. The Lancet Neurology. 15 (8), 843-856 (2016).
- Dlugos, D., et al. Childhood Absence Epilepsy Study Team (2013). Pretreatment EEG in childhood absence epilepsy: associations with attention and treatment outcome. Neurology. 81 (2), 150-156 (2013).
- Lorenzo, N. Y., et al. Intractable frontal lobe epilepsy: pathological and MRI features. Epilepsy research. 20 (2), 171-178 (1995).
- van Dellen, E., et al. Epilepsy surgery outcome and functional network alterations in longitudinal MEG: a minimum spanning tree analysis. NeuroImage. 86, 354-363 (2014).
- Shah, A. K., Mittal, S. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy of Neurology. 17 (Suppl 1), S89-S94 (2014).
- Whiting, P., et al. A systematic review of the effectiveness and cost-effectiveness of neuroimaging assessments used to visualise the seizure focus in people with refractory epilepsy being considered for surgery. Health technology assessment. 10 (4), 1-iv (2006).
- Lenkov, D. N., Volnova, A. B., Pope, A. R., Tsytsarev, V. Advantages and limitations of brain imaging methods in the research of absence epilepsy in humans and animal models. Journal of neuroscience methods. 212 (2), 195-202 (2013).
- Leach, J. P., Stephen, L. J., Salveta, C., Brodie, M. J. Which electroencephalography (EEG) for epilepsy? The relative usefulness of different EEG protocols in patients with possible epilepsy. Journal of neurology, neurosurgery, and psychiatry. 77 (9), 1040-1042 (2006).
- Huppertz, H. J., et al. Localization of interictal delta and epileptiform EEG activity associated with focal epileptogenic brain lesions. NeuroImage. 13 (1), 15-28 (2001).
- Linder, C., et al. Comparison between dried blood spot and plasma sampling for therapeutic drug monitoring of antiepileptic drugs in children with epilepsy: A step towards home sampling. Clinical biochemistry. 50 (7-8), 418-424 (2017).
- Wegner, I., Wilhelm, A. J., Lambrechts, D. A., Sander, J. W., Lindhout, D. Effect of oral contraceptives on lamotrigine levels depends on comedication. Acta neurologica Scandinavica. 129 (6), 393-398 (2014).
- Palmio, J., et al. CSF and plasma adipokines after tonic-clonic seizures. Seizure. 39, 10-12 (2016).
- Hogg, M. C., et al. Elevation in plasma tRNA fragments precede seizures in human epilepsy. Journal of Clinical Investigation. 129 (7), 2946-2951 (2019).
- Ellul, M., Solomon, T. Acute encephalitis - diagnosis and management. Clinical medicine. 18 (2), 155-159 (2018).
- Diamond, M. L., et al. IL-1β associations with posttraumatic epilepsy development: a genetics and biomarker cohort study. Epilepsia. 55 (7), 1109-1119 (2014).
- Auvin, S., et al. Prospective clinical trials to investigate clinical and molecular biomarkers. Epilepsia. 58 (Suppl 3), 20-26 (2017).
- Weber, Y. G., Nies, A. T., Schwab, M., Lerche, H. Genetic biomarkers in epilepsy. Neurotherapeutics. 11 (2), 324-333 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), e880(2008).
- Gardiner, T. W., Toth, L. A. Stereotactic Surgery and Long-Term Maintenance of Cranial Implants in Research Animals. Contemporary Topics in Laboratory Animal Science. 38 (1), 56-63 (1999).
- Westergren, I., Johansson, B. B. Changes in physiological parameters of rat cerebrospinal fluid during chronic sampling: evaluation of two sampling methods. Brain Research Bulletin. 27 (2), 283-286 (1991).
- Soukupová, M., et al. Impairment of GABA release in the hippocampus at the time of the first spontaneous seizure in the pilocarpine model of temporal lobe epilepsy. Experimental Neurology. 257, 39-49 (2014).
- Soukupová, M., et al. Microdialysis of Excitatory Amino Acids During EEG Recordings in Freely Moving Rats. Journal of Visualized Experiments. (141), e58455(2018).
- Guarino, A., et al. Low-dose 7,8-Dihydroxyflavone Administration After Status Epilepticus Prevents Epilepsy Development. Neurotherapeutics. 19 (6), 1951-1965 (2022).
- Curia, G., Longo, D., Biagini, G., Jones, R. S. G., Avoli, M. The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods. 172 (2), 143-157 (2008).
- Racine, R. J. Modification of seizure activity by electrical stimulation: II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32 (3), 281-294 (1972).
- Zou, W., et al. Repeated Blood Collection from Tail Vein of Non-Anesthetized Rats with a Vacuum Blood Collection System. Journal of Visualized Experiments. (130), e55852(2017).
- Blood sampling: Rat. , https://nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-rat (2022).
- Powles-Glover, N., Kirk, S., Wilkinson, C., Robinson, S., Stewart, J. Assessment of toxicological effects of blood microsampling in the vehicle dosed adult rat. Regulatory Toxicology and Pharmacology. 68 (3), 325-331 (2014).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animal. 32 (4), 369-376 (1998).
- Wang, D., Zhao, Y., Yang, Y., Xie, H. Safety assessment of multiple repeated percutaneous punctures for the collection of cerebrospinal fluid in rats. Brazilian Journal of Medical and Biological Research. 54 (6), e10032(2021).
- Möller, C., et al. Impact of repeated kindled seizures on heart rate rhythms, heart rate variability, and locomotor activity in rats. Epilepsy & Behavior. 92, 36-44 (2019).
- Espinosa-Garcia, C., Zeleke, H., Rojas, A. Impact of Stress on Epilepsy: Focus on Neuroinflammation-A Mini Review. International Journal of Molecular Sciences. 22 (8), 4061(2021).
- Cassar, S. C., et al. Comparing levels of biochemical markers in CSF from cannulated and non-cannulated rats. Journal of Neuroscience Methods. 192 (2), 249-253 (2010).
- Huang, Y. L., Säljö, A., Suneson, A., Hansson, H. A. Comparison among different approaches for sampling cerebrospinal fluid in rats. Brain Research Bulletin. 41 (5), 273-279 (1996).
- Hattori, N., Takumi, A., Saito, K., Saito, Y. Effects of serial cervical or tail blood sampling on toxicity and toxicokinetic evaluation in rats. Journal of Toxicological Sciences. 45 (10), 599-609 (2020).
- Roncon, P., et al. MicroRNA profiles in hippocampal granule cells and plasma of rats with pilocarpine-induced epilepsy--comparison with human epileptic samples. Scientific Reports. 5, 14143(2015).
- van Vliet, E. A., et al. Standardization procedure for plasma biomarker analysis in rat models of epileptogenesis: Focus on circulating microRNAs. Epilepsia. 58 (12), 2013-2024 (2017).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), e24145(2011).
- Grimm, H., et al. Advancing the 3Rs: innovation, implementation, ethics and society. Frontiers in Veterinary Science. 10, 1185706(2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon