Method Article
마이코박테리아의 native and recombinant extracellular vesicles 농축
요약
이 프로토콜은 Mycobacterium smegmatis(Msm)의 액센 배양에서 천연 마이코박테리아 세포외 소포체(mEV)의 농축과 mCherry(적색 형광 리포터) 함유 재조합 MsmEV를 설계하고 농축할 수 있는 방법을 자세히 설명합니다. 마지막으로, 결핵균(Mycobacterium tuberculosis)의 EsxA 단백질을 함유한 MsmEV의 농축을 통해 새로운 접근법을 검증합니다.
초록
마이코박테리아를 포함한 대부분의 박테리아는 세포외 소포체(EV)를 생성합니다. 박테리아 EV(bEV)에는 대사 산물, 지질, 단백질 및 핵산을 포함한 세포 구성 요소의 하위 집합이 포함되어 있기 때문에 여러 그룹에서 서브유닛 백신 후보로서의 보호 효능에 대해 bEV의 네이티브 또는 재조합 버전을 평가했습니다. 네이티브 EV와 달리 재조합 EV는 하나 이상의 관심 면역원을 포함하도록 분자 공학적으로 설계되었습니다. 지난 10년 동안 여러 그룹에서 재조합 bEV를 생성하기 위한 다양한 접근 방식을 탐구했습니다. 그러나 여기서는 마이코박테리아에서 재조합 마이코박테리아 EV(mEV)의 설계, 구성 및 농축을 보고합니다. 이를 위해 우리는 무독성 토양 마이코박테리움인 Mycobacterium smegmatis (Msm)를 모델 시스템으로 사용합니다. 먼저 Msm의 네이티브 EV의 생성과 강화에 대해 설명합니다. 그런 다음 적색 형광 리포터 단백질인 mCherry 또는 Mycobacterium tuberculosis의 저명한 면역원인 EsxA(Esat-6)를 포함하는 재조합 mEV의 설계 및 구성에 대해 설명합니다. mCherry와 EsxA N-말단을 작은 Msm 단백질 Cfp-29의 C-말단과 별도로 융합하여 이를 달성합니다. Cfp-29는 MsmEV에 풍부하게 존재하는 몇 안 되는 단백질 중 하나입니다. Msm에서 재조합 mEV를 생성하고 농축하는 프로토콜은 Msm의 네이티브 EV의 생성 및 농축과 동일하게 유지됩니다.
서문
전염병에 대한 광범위한 백신의 개발 및 투여에도 불구하고 오늘날까지도 모든 인간 사망의 ~30%는 여전히 전염병으로 인해 발생합니다1. 결핵(TB) 백신인 Bacillus Calmette Guerin(BCG)이 등장하기 전에는 결핵이 사망 원인 1위였습니다(~10,000명에서 15,000명/100,000명)2. BCG의 투여와 1차 및 2차 항결핵제에 대한 쉬운 접근으로 2022년까지 결핵 관련 사망은 2022년까지 ~100만명/년으로 급격히 감소했다(즉, ~15-20/100,000 인구1). 그러나 전 세계 결핵 풍토병 인구에서 결핵 관련 사망자는 인구 100,000명당 ~100-550명에 머물고있다 1. 전문가들은 이러한 왜곡된 수치를 초래하는 몇 가지 이유를 인정하지만, BCG에 의한 보호가 생후 첫 10년 동안도 지속되지 않는 것이 3,4,5,6,7의 주된 원인인 것으로 보인다. 결과적으로, UN의 '지속가능발전목표'와 WHO의 '결핵 퇴치 전략'이 새로워짐에 따라, 결핵으로부터 평생 보호해 줄 수 있는 BCG보다 훨씬 우수한 백신을 개발하기 위한 전 세계적인 공동의 노력이 이루어지고 있습니다.
이 목표를 달성하기 위해 여러 그룹에서 현재 변형/재조합 BCG 균주, BCG 이외의 비병원성 및 약독화 마이코박테리아 종, 서브유닛 후보 8,9,10,11,12,13,14,15,16,17,18을 평가하고 있습니다 . 일반적으로 서브유닛 백신은 병원체의 정제된(~1-6) 전장 또는 절단된 면역원성 단백질이 거의 없는 리포좀입니다. 그러나, 비-네이티브(non-native) 형태로의 가짜 접힘 및/또는 로드된 단백질 사이의 무작위적인 비기능적 상호작용으로 인해, 서브유닛은 종종 네이티브 및 게르만 에피토프(germane epitope)가 부족하여 면역계를 충분히 프라이밍하지 못한다14,19,20.
결과적으로, 박테리아의 세포외 소포체(EV)는 유망한 대안으로 속도를 내고 있습니다 21,22,23,24,25,26. 전형적으로, 박테리아 EV(bEV)는 핵산, 지질, 수백 개의 대사 산물 및 단백질의 일부를 포함하는 세포 구성 요소의 하위 집합을 포함합니다27,28. 몇 가지 정제된 단백질이 인위적으로 로드되는 리포솜과 달리, bEV는 특히 보조제 및 톨 유사 수용체(TLR) 작용제의 부스트/보조 없이 면역 체계를 프라이밍하는 더 나은 성향을 가진 수백 개의 자연적으로 로드되고 자연스럽게 접힌 단백질을 포함합니다27,28,29. 이러한 연구 분야에서 당사와 다른 연구자들은 BCG30에 대한 잠재적인 서브유닛 부스터로서 마이코박테리아 EV의 유용성을 탐구했습니다. bEV가 균일한 항원 부하가 부족하다는 우려에도 불구하고, 약독화된 Neisseria meningitidis의 EV는 혈청군 B 수막구균으로부터 인간을 성공적으로 보호했습니다31,32.
적어도 이론적으로는 BCG를 잘 부스트할 수 있는 최고의 EV는 병원성 박테리아가 농축된 EV입니다. 그러나 병원성 마이코박테리움에 의해 생성된 EV를 농축하는 것은 비용이 많이 들고 시간이 많이 걸리며 위험합니다. 또한 병원체에서 생성된 EV는 보호 기능보다 독성이 더 강할 수 있습니다. 잠재적인 위험을 감안하여, 여기에서는 독성이 강한 마이코박테리움인 축삭 배양 Msm에 의해 생성된 EV의 농축에 대해 잘 테스트된 프로토콜을 보고합니다.
그러나, 여러 병원체 단백질 ortholog를 암호화하고 있음에도 불구하고, 독성 마이코박테리아는 면역 체계를 보호하기 위해 충분히 준비시키는 데 필요한 몇 가지 백신 항원/병원성 단백질 에피토프가 부족하다33. 따라서 분자 공학을 통해 Msm의 재조합 EV를 구성하고 농축하여 Msm에서 발현되고 번역된 관심 병원성 단백질의 상당 부분이 EV에 도달해야 하는 연구도 수행했습니다. 우리는 Msm EV의 상위 10개 풍부한 단백질 중 하나 이상이 관심 단백질에 융합될 때 이러한 전좌에 도움이 될 것이라는 가설을 세웠습니다.
실험실에서 마이코박테리아 EV(mEV)의 농축을 표준화하기 시작했을 때, 2011년 Prados-Rosales et al.은 시험관 내 mEV의 시각화 및 농축을 처음으로 보고했습니다 30. 이후 2014년에 같은 그룹이 2011년 방법34의 수정된 버전을 발표했습니다. 2015년에 Lee et al.은 또한 mycobacteria35의 액센 배양에서 mEV 농축을 위한 독립적으로 표준화된 방법을 보고했습니다. 두 프로토콜 34,35를 결합하고 철저한 표준화 후 몇 가지 수정 사항을 통합하여, 마이코박테리아36의 액센 배양으로부터 mEV를 일상적으로 농축하는 데 도움이 되는 프로토콜을 설명합니다.
여기에서, 우리는 일반적으로 마이코박테리아 EV의 농축을 위해 발표된 프로토콜36의 확장인 Msm-특이적 EV의 농축에 대해 특히 자세히 설명합니다. 또한 mCherry 단백질(적색 형광 리포터)과 Mycobacterium tuberculosis의 우세한 면역원이자 잠재적인 하위 단위 백신물질인 EsxA(Esat-6)37,38,39를 포함하는 재조합 mEV(R-mEV)를 구성하는 방법에 대해서도 자세히 설명합니다. R-mEV를 강화하기 위한 프로토콜은 Msm의 기본 EV를 강화하기 위해 설명한 프로토콜과 동일합니다.
프로토콜
1. Mycobacterium smegmatis, Escherichia coli 및 그 유도체의 성장 조건
- 미디어
- 미들브룩 7H9 액체 육수
- 유리 비커에 필요한 양의 이중 증류수(ddw)를 전자레인지에서 ~45-50oC로 사전 데워 20% Tween-80 원액을 준비하고, 적절한 측정 실린더를 사용하여 필요한 부피의 Tween-80을 추가하고, 작은 자석 교반기에서 계속 저어 20% Tween-80을 균일한 용액으로 만듭니다. 0.22um 폐기 필터를 통해 20% 트윈-80을 여과하고 옅은 노란색 원액을 4°C에서 보관합니다.
참고: 정확한 최종 농도를 위해 측정 실린더에 있는 Tween-80의 모든 흔적을 비커로 옮겨야 합니다. 준비된 Tween-80 스톡을 고압멸균하지 마십시오. 필터(0.22μM 사용)를 살균하여 4 °C에서 보관합니다. - 7H9 육수 준비에 대한 제조업체의 지침을 따르십시오. 4.7g의 7H9 분말을 900mL의 ddw에 현탁시킵니다. 글리세롤 2mL를 넣고 내용물을 혼합한 후 121oC, 15psi에서 20분 동안 오토클레이브합니다.
알림: 고압멸균 전에 Middlebrook ADC 농축(ADC) 및 Tween-80을 추가하지 마십시오. - 오토클레이브 배지를 실온(RT, 즉, ~25 oC)으로 냉각한 후 표준 A2 유형 생물 안전 작업대에서 100mL의 ADC(최종 1x) 및 2.5mL(최종 0.05%)의 20% Tween-80을 무균 상태로 추가합니다. 0.22μm 일회용 필터 장치를 통해 혼합물을 여과하고 매우 밝은 황록색의 투명한 원액을 4 °C에서 보관합니다.
알림: 매체의 pH는 ~6.6에서 6.8이어야 합니다(<6.4 또는 >7.0인 경우 버리고 새로 만드십시오). 4 oC에서 보관하십시오 (3-4 주 동안 안정). 두 개의 독립적인 0.22μm 일회용 필터 장치를 통해 7H9 미디어(ADC 및 Tween-80 추가 후)를 두 번 필터링하는 것이 좋습니다.
- 유리 비커에 필요한 양의 이중 증류수(ddw)를 전자레인지에서 ~45-50oC로 사전 데워 20% Tween-80 원액을 준비하고, 적절한 측정 실린더를 사용하여 필요한 부피의 Tween-80을 추가하고, 작은 자석 교반기에서 계속 저어 20% Tween-80을 균일한 용액으로 만듭니다. 0.22um 폐기 필터를 통해 20% 트윈-80을 여과하고 옅은 노란색 원액을 4°C에서 보관합니다.
- Sauton의 (최소 매체) 액체 국물
- L-아스파라긴(0.4% w/v)과 구연산(0.2% w/v)을 950mL의 ddw에 녹입니다. 갓 준비한 1,000x 스톡(ddw)의 이염기성 인산칼륨(무색, 스톡 10g/20mL, 최종 1x 0.5g/L)을 각각 1mL씩 추가합니다. 황산 마그네슘 헵타하이드레이트 (무색, 스톡 10g / 20mL, 최종 1x 0.5g / L); 구연산제2철(매우 밝은 갈색, 육수 1.6g/40mL, 최종 1x 0.04g/L)을 넣고 자석 교반기에서 잘 저어줍니다.
참고: 기껏해야 1,000x 주식은 2주가 될 수 있습니다. 그보다 오래되면 신선한 주식을 준비하십시오. 어두운 곳(예: 캐비닛/선반 내부)의 RT에 보관하십시오. 구연산제2철이 짙은 갈색이면 버리고 신선하게 만드십시오. 1.1.2.1단계에서 언급한 순서대로 세 가지 소금을 추가하는 것이 가장 좋습니다. 각 소금 용액을 추가하기 전에 매번 용액을 휘젓습니다. - pH 측정기를 사용하여 pH를 측정하고 기록하십시오. 3.1에서 3.2 사이인지 확인합니다. pH가 3.7 이상이면 육수를 버리고 신선하게 준비하십시오. pH를 7.4로 조정하려면 필요한 만큼 10N 수산화나트륨 한 방울을 사용하십시오. 자석 교반기에서 용액/매체를 지속적으로 교반하면서 최종 pH를 모니터링합니다.
- 글리세롤 4.76mL, 20% Tween-80 0.25mL(최종 0.005%, 2.2.1.3 단계 참고 참조)를 추가한 다음 부피를 1L로 구성합니다. 그런 다음 두 개의 개별 0.22μm 처리 필터로 1L의 배지를 두 배로 필터 멸균합니다. 투명하고 무색의 배지를 4 °C에서 보관합니다(2주 동안 안정).
알림: pH가 7.4로 조정된 후에만 글리세롤을 첨가하십시오. 그렇지 않으면 미디어가 흐린 흰색으로 바뀝니다. 흐리면 버리고(가열하지 마십시오) 신선하게 준비하십시오. 모든 mEV 준비에는 새로 준비된 Sauton을 사용하십시오.
- L-아스파라긴(0.4% w/v)과 구연산(0.2% w/v)을 950mL의 ddw에 녹입니다. 갓 준비한 1,000x 스톡(ddw)의 이염기성 인산칼륨(무색, 스톡 10g/20mL, 최종 1x 0.5g/L)을 각각 1mL씩 추가합니다. 황산 마그네슘 헵타하이드레이트 (무색, 스톡 10g / 20mL, 최종 1x 0.5g / L); 구연산제2철(매우 밝은 갈색, 육수 1.6g/40mL, 최종 1x 0.04g/L)을 넣고 자석 교반기에서 잘 저어줍니다.
- 미들브룩 7 H11 한천 베이스
- 제조업체의 준비 지침을 따르십시오. 19g의 7H11 분말을 900mL의 ddw에 현탁시킵니다. 글리세롤 5mL를 첨가하고 자석 교반기에서 소용돌이쳐 균일한 현탁액(옅은 녹색, pH 6.6 - 6.8, >7.2인 경우 버리고 신선하게 준비)을 얻고 121oC, 15psi에서 20분 동안 오토클레이브합니다.
참고: 오토클레이브 전에 ADC와 0.05% Tween-80을 추가하지 마십시오. - 배지가 ~ 50oC로 냉각되면 A2 유형 생물 안전 캐비닛에서 무균으로 ADC 100mL(RT로 가져옴)와 2.5mL의 20%(최종 0.05%) Tween-80(RT로 가져옴)을 추가합니다. 즉시 페트리 접시에 무균 상태로 분배하십시오.
참고: 플레이트는 최소 4-6주 동안 4 °C에서 안정적입니다. 4 oC 보관을 위해 접시를 포장하기 전에 접시가 밤새 RT에 있는지 확인하십시오. 그렇지 않으면 37 °C에서 배양하는 동안 수분이 플레이트에 갇히게 됩니다.
- 제조업체의 준비 지침을 따르십시오. 19g의 7H11 분말을 900mL의 ddw에 현탁시킵니다. 글리세롤 5mL를 첨가하고 자석 교반기에서 소용돌이쳐 균일한 현탁액(옅은 녹색, pH 6.6 - 6.8, >7.2인 경우 버리고 신선하게 준비)을 얻고 121oC, 15psi에서 20분 동안 오토클레이브합니다.
- Miller Luria Bertani (LB) 육수와 한천베이스
- 제조업체의 준비 지침을 따르십시오. LB 육수를 준비하려면 ddw 1,000mL에 분말 25g을 현탁하고 자석 교반기의 유리 비커에서 5분 동안 부드럽게 저어줍니다. 균일한 현탁액이 주입되면 필요한 부피를 배지 병(예: 500mL 배지 병에 300mL)과 오토클레이브에 분주합니다. LB 한천을 준비하려면 1,000mL의 ddw 및 오토클레이브에 분말 40g을 현탁시킵니다(500mL 유리 배지 병에 담긴 300mL ddw에 분말 12g).
- 미들브룩 7H9 액체 육수
- 생육 조건
알림: 박테리아 배양 작업의 모든 단계는 생물 안전 캐비닛(A2 유형)에서 수행해야 합니다. 모든 배양액은 멸균 튜브, 플라스크 및 피펫 팁으로 처리해야 합니다.- 1일차
- 갓 고압 멸균, 냉각 및 예열된(~37 o C) 7H9 국물의 2 x 10mL(멸균 원추형 원심분리 튜브에서) 7H9 국물의 Msm(-80 o C 냉동고에서)의 글리세롤 스톡 각각 1mL를 첨가하고 세 번 휘젓고 뚜껑을 닫고 37 oC 및 200-220rpm(인큐베이터 셰이커)에서 밤새 튜브를 배양합니다.
참고: Mycobacterium tuberculosis (Mtb)를 성장시키려면 유사한 단계를 따르되 BSL3 설정에서 37oC및 120-150rpm(인큐베이터 셰이커)에서 50mL 튜브를 4-6일 동안 배양합니다. BSL3 및 위험 그룹 3 병원체에 대한 모든 국제 지침 및 생물 안전 관행을 준수하고 Mtb 및 그 배양물을 취급하고 폐기하십시오. Mtb 및 그 배양물을 취급하기 위해 B2 유형 생물 안전 캐비닛을 사용하십시오.
- 갓 고압 멸균, 냉각 및 예열된(~37 o C) 7H9 국물의 2 x 10mL(멸균 원추형 원심분리 튜브에서) 7H9 국물의 Msm(-80 o C 냉동고에서)의 글리세롤 스톡 각각 1mL를 첨가하고 세 번 휘젓고 뚜껑을 닫고 37 oC 및 200-220rpm(인큐베이터 셰이커)에서 밤새 튜브를 배양합니다.
- 2일차
- OD600 (A 600nm, 세포 밀도계)이 ~1.0에 도달하면 3,200 × g 및 RT(벤치탑 원심분리기)에서 10분 동안 Msm 배양을 원심분리합니다. 멸균 1mL 피펫 팁을 사용하여 상층액을 폐기합니다.
참고: 위의 단계는 일 수가 4-7이라는 점을 제외하고는 Mtb 문화권에 대해 동일하게 유지됩니다. 피펫 팁으로 박테리아 펠릿을 만지지 마십시오. - 세척: 각 Msm 펠릿에 예열된 Sauton(RT에서) 배지 1mL를 추가하고(1.1.2단계 1.1.2) 1mL 피펫 팁으로 부드럽게 재현탁하여 균일한 현탁액을 얻습니다. 멸균 피펫 팁을 사용하여 동일한 배지로 부피를 각각 10mL로 구성합니다. 현탁액을 3,200× g 에서 10분 동안 원심분리하고 상층액을 버립니다. 이 단계를 한 번 더 반복합니다.
참고: 위의 단계는 Mtb 문화권에 대해 동일하게 유지됩니다. - 2회 세척한 Msm 세포를 20mL(각각)의 예열된 Sauton's(플레이트 또는 셰이커 인큐베이터에서 예열)에 재현탁시키고 600nm에서 세포의 광학 밀도를 측정합니다. 최종 OD 600이 ~0.05가 되도록 ~330mL 의 멸균 Sauton이 들어 있는 멸균 1L 삼각 플라스크에 필요한 양의 Msm 배양물을 접종합니다.
참고: 일시 중단은 항상 작은 볼륨에서 시작해야 합니다. 최종 부피가 단일 단계로 펠릿에 직접 추가되는 경우 세포는 확산된 펠릿으로 유지됩니다(재현탁 불량의 지표). 이 문제를 해결하는 유일한 방법은 문화권을 스핀다운하고 권장 사항에 따라 다시 일시 중단을 다시 실행하는 것입니다. 위의 단계는 Mtb 문화권에서도 동일하게 유지됩니다.
- OD600 (A 600nm, 세포 밀도계)이 ~1.0에 도달하면 3,200 × g 및 RT(벤치탑 원심분리기)에서 10분 동안 Msm 배양을 원심분리합니다. 멸균 1mL 피펫 팁을 사용하여 상층액을 폐기합니다.
- 2/3일차
- 배양 OD600이 ~0.3에 도달할 때까지 200rpm 및 37oC의 인큐베이터 셰이커에서 330mL 배양액을 배양합니다. 그런 다음 세포를 한 번 세척한 다음(1.2.2.2단계와 유사하지만 동일한 부피로) 펠릿을 동일한 부피에 다시 현탁시킵니다. 재현탁 배양액 50mL를 각각 6개의 멸균 1L 멸균 삼각 플라스크에 분배하고, 각 플라스크에는 일반적으로 사용되는 1/10(0.05%) 트윈-80, 즉 0.005%의 280mL의 멸균 예열 Sauton이 들어 있습니다(1/10 이유를 이해하려면 2.2.1.3단계의 참고참조). 최종 OD600은 약 0.05여야 합니다.
알림: Mtb 배양의 경우 삼각 플라스크 대신 롤러 병(1/2/4L 용량)을 사용하십시오. 롤러 장치에 보관할 때 배양액이 병의 입구에 도달 하지 않도록 병당 배양량을 조정합니다. 롤러 병의 실제 부피는 롤러 병의 용량에 따라 다릅니다. - OD600이 2.0 - 2.5 (~15-18 h)에 도달할 때까지 200 rpm 및 37 oC에서 인큐베이터 Shaker에서 각각 330 mL 배양액을 배양합니다.
알림: Mtb 배양의 경우 최종 OD600 이 ~1.0-1.2(~5-8일 소요)인지 확인하십시오.
- 배양 OD600이 ~0.3에 도달할 때까지 200rpm 및 37oC의 인큐베이터 셰이커에서 330mL 배양액을 배양합니다. 그런 다음 세포를 한 번 세척한 다음(1.2.2.2단계와 유사하지만 동일한 부피로) 펠릿을 동일한 부피에 다시 현탁시킵니다. 재현탁 배양액 50mL를 각각 6개의 멸균 1L 멸균 삼각 플라스크에 분배하고, 각 플라스크에는 일반적으로 사용되는 1/10(0.05%) 트윈-80, 즉 0.005%의 280mL의 멸균 예열 Sauton이 들어 있습니다(1/10 이유를 이해하려면 2.2.1.3단계의 참고참조). 최종 OD600은 약 0.05여야 합니다.
- 1일차
2. 밀도 구배 원심분리를 통한 Msm mEV의 농축
- 4일차
- ~8,000 × g(플로어 모델 원심분리기)에서 4 x 400mL 멸균 원심분리기 병 6개에 ~2L의 중간 지수 단계 Msm 배양액을 4°C에서 20분 동안 원심분리합니다. 사용한 배지/배양 상층액을 사전 냉각된 2개의 오토클레이브 1L 삼각 플라스크에 수집하고 모든 분석 절차(예: SDS-PAGE 및 웨스턴 블로팅-여기에 자세히 설명되지 않음)를 위해 펠릿의 부분 표본을 저장합니다.
알림: 모든 후속 단계는 mEV의 무결성을 더 잘 유지하기 위해 저온(~ 4°C)에서 수행해야 합니다. mEV는 RT에서 매우 안정적이지만 장기적인 안정성을 위해서는 냉장이 필수입니다(반복적인 냉동 및 해동은 권장되지 않음). 축삭 배양 성장 중에 mEV는 Msm/Mtb 표면에서 분리되어 배양 상층액/사용 배지에 축적됩니다. - 먼저 0.45μm 폐기 필터 장치를 통해 Msm 배양 상층액을 여과한 다음 0.22μm 폐기 필터 장치를 통해 여과하여 모든 박테리아 흔적을 제거합니다.
알림: 0.22μm 필터를 통한 직접 여과는 종종 필터 장치를 질식시킵니다(2.1.1단계를 수행하는 동안 박테리아 펠릿이 방해받을 수 있음). Mtb 배양 상층액을 생성하려면 배양 여과액을 BSL-2 설정으로 이동하기 전에 Mtb 배양액을 3회 여과(즉, 0.45μm 일회용 필터 장치를 사용한 첫 번째 여과 단계, 0.22μm 일회용 필터 장치를 사용한 2회 연속 여과 단계)를 수행합니다.
- ~8,000 × g(플로어 모델 원심분리기)에서 4 x 400mL 멸균 원심분리기 병 6개에 ~2L의 중간 지수 단계 Msm 배양액을 4°C에서 20분 동안 원심분리합니다. 사용한 배지/배양 상층액을 사전 냉각된 2개의 오토클레이브 1L 삼각 플라스크에 수집하고 모든 분석 절차(예: SDS-PAGE 및 웨스턴 블로팅-여기에 자세히 설명되지 않음)를 위해 펠릿의 부분 표본을 저장합니다.
- 4/5일째
- 30kDa 멤브레인 농축기를 사용하여 배양 여과액을 4oC, 20분 및 3,200× g에서 원심분리하여 Msm 배양 여과액(~2L)을 ~ 38mL까지 농축합니다.
- 먼저 멸균된 차가운 ddw(~15mL)로 농축기를 사전 세척합니다(4 °C, 5분 및 3,200× g에서 세척).
- ~15mL의 사전 여과된 차가운 Sauton(물(2.2.1.1.)과 동일한 조건)으로 세척하여 모든 미량의 화학 물질(제조 중 사용)을 제거합니다.
- ~130L의 배양 여과액을 농축하려면 기술적으로 ~2개의 중심체(1회만 사용하는 경우)가 필요하므로 필요한 경우 중심체를 최소 3-4회 재사용하십시오. 15 mL - 0.5 - 1.0 mL를 농축하고(2.2.1 단계 따름) 농축액을 깨끗한 오토클레이브 냉장 38mL 초원심분리 튜브로 옮긴 다음, 나머지 농축되지 않은 배양 여과액을 사용된 중심체로 다시 옮겨 반복 농축합니다.
참고: 24, 30kDa 농축기를 사용하여 2L의 배양 여과액을 농축하는 데 최대 6시간이 소요됩니다. 배양 여과액을 농축하면 Tween-80도 농축되어 농축기를 차단할 수 있습니다. Sauton의 미디어에서 Tween-80 - 0.005% final(0.05% 대신)을 사용하면 이러한 막힘을 방지하는 데 도움이 됩니다. Tween-80의 감소된 농도는 성장 중 Msm의 균일한 현탁액에 영향을 미치지 않으며 Msm 세포의 응집을 일으키지 않습니다. 그러나 Mtb 셀은 0.005% 트윈-80에서 응집하므로 Mtb 전용 EV에는 0.05% 트윈-80을 사용합니다.
- 농축된 Msm 배양 여과액(~38mL)을 세척(ddw 사용) 및 사전 냉각된 40-50mL 폴리프로필렌 원심분리기 튜브에 옮기고 먼저 4,000×g에서 20분 동안 4°C에서 두 단계 모두 15,000×g에서 2단계 원심분리를 실시합니다(모든 파편을 제거하기 위해). 바닥형 원심분리기를 사용하십시오.
- 30kDa 멤브레인 농축기를 사용하여 배양 여과액을 4oC, 20분 및 3,200× g에서 원심분리하여 Msm 배양 여과액(~2L)을 ~ 38mL까지 농축합니다.
- 5/6일째
- 배양 상층액을 사전 냉각된 38.5mL 폴리프로필렌 초원심분리기 튜브로 옮기고 100,000× g 의 초원심분리기에서 4oC에서 4시간 동안 회전시킵니다.
알림: 스윙 버킷은 이 속도에서 가장 잘 작동합니다. 초원심분리기 튜브를 가장자리까지 채우고 동일한 무게의 저울 초원심분리기 튜브를 사용하십시오. 원심분리(응결로 인해 발생) 후 두 튜브 중 하나가 스윙 버킷에 붙어 있으면 집게를 사용하여 로터에서 부드럽게 제거합니다. 초원심분리 전에 초원심분리기 외부 표면에 존재하는 응축된 수분을 닦아내면 달라붙는 것을 방지할 수 있습니다. - 상층액을 50mL 예냉 튜브에 보관합니다(참고 참조). 초원심분리기 튜브를 보푸라기가 없는 새 흡수제에 뒤집어 상층액의 흔적을 제거합니다. 펠릿을 600μL의 HEPES 완충 용액(50mM HEPES 및 150mM NaCl, pH 7.4, 사용 전 필터 멸균)에 재현탁시킵니다.
알림: 상층액은 백업으로만 저장하십시오. 천연 mEV 펠릿은 젤리 모양의 직경 5-7mm, 칙칙한 회황색에서 반투명 반점으로 나타납니다. 펠릿이 보이지 않으면 저장된 상층액을 재사용하여 2.3.1단계를 반복합니다. 2.3.1단계를 반복한 후에도 펠릿이 나타나지 않으면 버리고 1.2단계부터 다시 시작하십시오. 펠릿이 재현탁되는 데 시간이 걸립니다. HEPES 완충액을 추가하고 쉬운 재현탁을 위해 4 °C에서 밤새 그대로 두는 것이 좋습니다. 균일한 재현탁액이 될 때까지 반복적인 피펫팅(더 나은 재현탁을 위해 P200 팁 사용)으로 부드럽게 재현탁하십시오.
- 배양 상층액을 사전 냉각된 38.5mL 폴리프로필렌 초원심분리기 튜브로 옮기고 100,000× g 의 초원심분리기에서 4oC에서 4시간 동안 회전시킵니다.
- 6일째
- 재현탁된 펠릿을 '요오딕사놀' 기반 밀도 구배 원심분리에 적용합니다.
- 13mL의 세척 및 세척(DDW 사용) 및 사전 냉각된 초투명 폴리프로필렌 초원심분리기 튜브의 바닥에 재현탁 펠릿을 층층화하고 ~4mL의 불활성 밀도 구배 '요오딕사놀' 용액(~60% w/v 용액으로 시판)과 부드럽게 혼합(1mL 피펫 사용)합니다. 재부유 펠릿을 튜브 바닥에 겹겹이 쌓은 후(최대 5mL까지), 각각 40%, 30%, 20%, 10%의 '요오딕산올' 하위 스톡을 1mL(w/v)로 오버레이합니다(60% 스톡에서 하위 스톡(HEPES 완충액 포함) 준비). 그런 다음 상단에 6% 서브 스톡(HEPES 완충액이 있는 60% 스톡에서 준비) 4mL를 추가하여 튜브를 채웁니다.
알림: 사용 직전에 그라디언트를 준비하십시오. 절대 보관하거나 사용하지 마십시오. - 조심스럽게(흔들지 않고) 유리 비커에서 튜브의 무게를 측정하고 스윙 버킷 로터로 부드럽게 옮깁니다.
알림: 더미 튜브(또한 계량됨)로 균형을 맞추기 위해 계량이 필요합니다. - 141,000 × g 에서 4 oC에서 16 시간 동안 초 원심 분리를합니다.
- 13mL의 세척 및 세척(DDW 사용) 및 사전 냉각된 초투명 폴리프로필렌 초원심분리기 튜브의 바닥에 재현탁 펠릿을 층층화하고 ~4mL의 불활성 밀도 구배 '요오딕사놀' 용액(~60% w/v 용액으로 시판)과 부드럽게 혼합(1mL 피펫 사용)합니다. 재부유 펠릿을 튜브 바닥에 겹겹이 쌓은 후(최대 5mL까지), 각각 40%, 30%, 20%, 10%의 '요오딕산올' 하위 스톡을 1mL(w/v)로 오버레이합니다(60% 스톡에서 하위 스톡(HEPES 완충액 포함) 준비). 그런 다음 상단에 6% 서브 스톡(HEPES 완충액이 있는 60% 스톡에서 준비) 4mL를 추가하여 튜브를 채웁니다.
- 재현탁된 펠릿을 '요오딕사놀' 기반 밀도 구배 원심분리에 적용합니다.
- 7일째
- 튜브를 조심스럽게 제거하고(2.3.1단계 참고 참조) 1mL 분획을 갓 오토클레이브한 마이크로 원심분리기 튜브에 수집합니다. 일반적으로 Msm mEV를 포함하는 4-6분수에 주의하십시오.
참고: 이 분획의 mEV는 일반적으로 흰색이 흐릿한 3개 또는 4개의 mEV 대역(하나는 주요 대역)으로 분류됩니다. mCherry를 포함하는 R-mEV는 5번째에서 7번째 분획으로 분별되며 짙은 보라색에서 자홍색으로 나타납니다. Mtb EV는 일반적으로 5번째에서 7번째 부분으로 나뉩니다. 그래디언트에서 mEV의 분리는 사용된 그래디언트 농도와 그래디언트가 얼마나 잘 적층되어 있는지에 따라 달라집니다. mEV가 부분적으로 파열되면 이전 분획에서 분별될 수 있습니다. 대안적으로, 단계 2.3.2 이후에 얻어진 펠릿이 잘 재현탁되지 않으면, 소포는 나중에 분획으로 분획되는 조밀한 미세 펠릿을 형성합니다. 사용자가 1mL 분획 중 mEV가 포함된 분획을 평가하고자 하는 경우에만 분획을 정밀하게 분취하는 것이 좋습니다. 사용자는 편의에 따라 더 작거나 더 큰 분획으로 분주하는 것을 좋아할 수 있습니다. 예를 들어 BCG에 대한 잠재적인 서브유닛 백신 부스터로 테스트하는 것과 같은 특정 응용 분야에 사용할 때 mEV 수집을 250μL 미만의 분획(mEV가 분획되는 부분)으로 제한하여 2.7.5에 표시된 대로 mEV 대역 및 공정만 구체적으로 수집할 수 있습니다. 이는 다운스트림 실험을 방해할 수 있는 요오드화물산올의 모든 흔적을 보다 효과적으로 제거하는 데 도움이 됩니다.
- 튜브를 조심스럽게 제거하고(2.3.1단계 참고 참조) 1mL 분획을 갓 오토클레이브한 마이크로 원심분리기 튜브에 수집합니다. 일반적으로 Msm mEV를 포함하는 4-6분수에 주의하십시오.
- 8일째
- mEV 함유 분획을 풀링하고, HEPES 완충액으로 38mL로 희석하고, 100,000×g에서 16시간 동안 4oC에서 초원심분리를 반복합니다. HEPES 완충액 또는 단백질 추정, 나노 추적 분석, 음성 염색, 투과 전자 현미경, 웨스턴 블로팅 및 면역 금 라벨링과 같은 다운스트림 실험(여기에 자세히 설명되지 않음)에 펠릿을 재현탁시킵니다(2.3.2단계에서와 같이 동일한 주의 사항).
알림: 더 나은 재현탁을 위해 초음파 수조 초음파 발생기를 사용하여 mEV 함유 튜브를 10분 동안 초음파 처리합니다. 더 오랜 시간 동안 초음파 처리하면 손상되지 않은 mEV의 파열 및 손실이 시작될 수 있습니다. 잘 현탁하면 초음파 처리가 필요하지 않습니다. 2.1에서 2.6까지의 모든 단계는 Mtb 생성 EV를 강화하는 동안 동일합니다.
- mEV 함유 분획을 풀링하고, HEPES 완충액으로 38mL로 희석하고, 100,000×g에서 16시간 동안 4oC에서 초원심분리를 반복합니다. HEPES 완충액 또는 단백질 추정, 나노 추적 분석, 음성 염색, 투과 전자 현미경, 웨스턴 블로팅 및 면역 금 라벨링과 같은 다운스트림 실험(여기에 자세히 설명되지 않음)에 펠릿을 재현탁시킵니다(2.3.2단계에서와 같이 동일한 주의 사항).
3. 재조합 mEV의 건설 및 농축.
참고: Msm EV의 가장 풍부한 10가지 단백질(질량 분석법으로 식별됨) 중 하나는 Cfp-2930입니다. 이의 작은 크기(29kDa), 단순한 2차 구조(40), 막(41)에 대한 국소화, 및 액센 배양물(예를 들어, 배양 여과 단백질로서, Msm 및 Mtb42,43 모두에 의해 분비됨)에서 사용된 배지로 분비되는 경향을 감안할 때, 적색 형광 리포터 및 관심 단백질(EsxAMtb)을 mEV로 전달하기 위해 이용되었다. 이를 위해
- Msm에서 cfp-29를 증폭하기 위해 적절한 정방향 및 역방향 프라이머(표 1, pMV261과 같은 셔틀 벡터로 직접 복제할 수 있음)를 사용합니다. ~50ng의 고분자량(~>20kb) Msm 게놈 DNA를 주형으로 사용하여 고충실도 교정 DNA 중합효소(예: Phusion 또는 Q5)로 cfp-29 유전자 단편을 PCR 증폭합니다. PCR에 대한 제조업체의 권장 사항을 따릅니다.
NOTE: 필요한 제한 부위를 프라이머로 설계하여 관심 있는 대체 셔틀 벡터로 쉽게 클로닝할 수 있습니다. PCR 조건 및 부피는 사용되는 교정 판독 DNA 중합효소의 유형 및 브랜드에 따라 달라집니다. 반응 혼합물의 부피는 DNA 템플릿의 양과 교정 DNA 중합효소의 양에 따라 달라집니다. PCR 조건, 증폭 성공 및 프라이머의 비특이적 어닐링 제거에 대한 제조업체의 권장 사항을 따르십시오. - PCR은 시판되는 PCR 정제 키트로 용출된 앰플리콘을 정제하고 표준 아가로스 겔 전기영동으로 앰플리콘 길이를 검증합니다. 정제된 앰플리콘을 분해합니다.
- 분광 광도계에서 정제된 앰플리콘의 양을 추정합니다. 분해를 위해 최소 2μg의 cfp-29 앰플리콘을 사용하십시오.
- 먼저 BstB1을 65oC에서 1시간 동안 분해하고(완충액 및 효소의 종류 및 양-제조업체의 권장 사항에 따름), 반응 온도를 RT로 낮춘 다음, HindIII로 37oC에서 1시간 동안 분해합니다(제조업체의 권장 사항에 따른 완충액 및 효소의 종류 및 양).
- PCR은 50μL의 오토클레이브 뉴클레아제가 없는 DDW에서 분해된 앰플리콘을 정제하고 용리합니다.
- 분광 광도계를 사용하여 분해된 앰플리콘의 농도와 수율을 추정합니다. 결찰이 설정될 때까지 -20 oC에서 보관하십시오. 참고: PCR 후 앰플리콘 길이(~798 + 50bp)를 확인하고 1% 아가로스 겔에 PCR 반응 혼합물 10μL를 전기영동하여 수율을 확인합니다. 이러한 효소 조합으로 이중 분해가 가능하지는 않지만, 호환 가능한 완충액은 반복적인 PCR 정제 및 분해된 앰플리콘의 후속 손실을 방지합니다. 분해된 앰플리콘의 농도는 PCR 정제에 사용되는 키트에 따라 다릅니다. 또한 선택한 대체 벡터의 길이(bp)에 따라 달라집니다.
- 정방향 및 역방향 프라이머(표 1), 교정 DNA 중합효소 및 ~50ng의 Mtb 게놈 DNA를 사용하여 PCR은 esxA 또는 esxA-3X FLAG-태그 특이적 앰플리콘을 증폭합니다. ~5ng의 적절한 플라스미드 DNA를 사용하여 mCherry를 PCR 증폭합니다. 플라스미드 및 염기서열 세부 정보는 보충 파일 1에 있습니다.
참고: cfp-44,45와 mCherry/esxA/esxA-4X FLAG 사이에 Glycine, Glycine, Glycine, Glycine, Serine29(G3S) 링커를 사용하십시오.mCherry가 시작되기 전에 G4S 링커는 mCherry가 가짜 비기능적 접힘(Cfp-29에 의해 구동되는 접힘 포함)을 겪지 않도록 도와줍니다. 보충 파일 1의 cfp-29, hsp60 promoter, mCherry 및 esxA 염기서열을 참조하십시오. mCherry의 템플릿으로 사용되는 플라스미드는 다양한 플라스미드 저장소/뱅크에서 사용할 수 있습니다. 변경된 정방향 및 역방향 프라이머 서열이 필요한 mCherry의 다양한 버전(약간 변경된 서열)을 사용할 수 있습니다. 프라이머(표 1)는 보충 파일 1에 언급된 mCherry를 증폭하는 데 도움이 됩니다. mCherry/esxA/esxA::3XFLAG의 N-종단과 Cfp-29의 C-터미널 끝의 융합이 잘 작동합니다. - mCherry/esxA/esxA::3XFLAG 앰플리콘의 DNA 1μg을 분해하고 분해된 DNA를 정제합니다.
- 각 앰플리콘을 HindIII 및 HpaI로 37 oC에서 1 시간 동안 이중 분해합니다 (또는 제조업체의 권장 사항에 따라).
- 시중에서 판매되는 PCR 정제 키트와 분해된 앰플리콘 정제에 대한 제조업체의 권장 사항을 사용하십시오. 분해된 앰플리콘을 50μL의 오토클레이브 뉴클레아제가 없는 ddw에서 용리합니다.
- 분광 광도계를 사용하여 분해된 앰플리콘의 농도와 수율을 추정합니다. 결찰이 설정될 때까지 -20 oC에서 보관하십시오.
- 2μg의 pMV261-KanR (보충 파일 1) 또는 선택한 효소와 함께 적절한 클로닝 벡터를 분해합니다.
- 먼저 BstB1을 65oC에서 1시간 동안 분해하고(완충액 및 효소의 종류 및 양-제조업체의 권장 사항에 따름), 반응 온도를 RT로 낮춘 다음, HindIII로 37oC에서 1시간 동안 분해합니다(제조업체의 권장 사항에 따른 완충액 및 효소의 종류 및 양).
- 겔을 정제하고 50μL의 오토클레이브 뉴클레아제가 없는 ddw에서 용리합니다.
- 분광광도계를 사용하여 분해된 벡터의 농도와 수율을 추정합니다. 결찰이 설정될 때까지 -20 oC에서 보관하십시오.
참고: pMV261에 대한 위의 프라이머를 사용하여 1단계 2단편 클로닝이 가능합니다. 에피솜으로 살아남는 모든 대체 셔틀 벡터가 작동합니다. 통합 플라스미드도 효과가 있지만 재조합 단백질 수율은 세포당 상대적으로 적습니다.
- 결합하고 E. coli의 호환 가능한 균주로 변환합니다.
- 접합의 경우 벡터의 125ng를 사용합니다. 적절하게 소화된 mCherry/esxA/esxA::3XFLAG 앰플리콘을 1:3 몰비로 사용합니다. 냉장 순환 수조에서 16°C에서 T4 DNA Ligase(제조업체의 권장 사항에 따른 양)를 사용하여 밤새 결찰을 수행합니다.
참고: 소화 효율을 평가하고 클로닝 성공의 효율성을 예측하기 위해 T4 DNA Ligase의 유무에 관계없이 벡터와 같은 적절한 제어를 사용하십시오. - 변형
- NEB5α 화학적으로 적합한 세포 분취액(형질전환당 ~100μL)을 얼음에서 15분 동안 해동합니다. 멸균 피펫 팁으로 부드럽게 두 번 혼합합니다. ligation mix(최대 20 μL)를 차가운 유능한 세포에 추가합니다.
- 피펫 세포 + 결찰된 DNA를 부드럽게 혼합합니다. 혼합물을 얼음 위에서 30분 더 배양합니다.
- 42°C(순환 수조에서)에서 60초 동안 열 충격을 가하고 즉시 얼음으로 다시 옮겨 추가 15분 동안 가열합니다.
- 1mL의 SOC 브로스(2% 트립톤, 0.5% 효모 추출물, 10mM NaCl, 2.5mM KCl, 10mMMgCl2, 10mM MgSO4 및 20mM 글루코스)를 첨가하여 형질전환된 세포를 회수하고 37°C에서 200rpm에서 1시간 동안 배양합니다.
- 회수된 박테리아를 1.5mL 미세 원심분리 튜브(3000 × g, RT 및 10분)에서 회전시키고, 상층액을 버리고, 펠릿을 200μL의 멸균되고 예열된 갓 준비된 LB 배지에 재현탁시킨 다음, 적절한 농도로 필요한 항생제가 들어 있는 갓 부은 LB Miller 한천 플레이트에 현탁액을 펴 바릅니다.
- 37 oC로 사전 설정된 플레이트 인큐베이터에서 페트리 접시를 배양합니다.
- 접합의 경우 벡터의 125ng를 사용합니다. 적절하게 소화된 mCherry/esxA/esxA::3XFLAG 앰플리콘을 1:3 몰비로 사용합니다. 냉장 순환 수조에서 16°C에서 T4 DNA Ligase(제조업체의 권장 사항에 따른 양)를 사용하여 밤새 결찰을 수행합니다.
- 잠재적 클론을 스크리닝하고(여기에 자세히 설명되지 않음), (콜로니 PCR-/제한 효소 기반으로)46 검증하고, 융합을 확인하기 위해 서열(Sanger 시퀀싱)합니다.
- 확인된 클론(E. coli 배경)의 플라스미드 DNA(~200ng/1-2μL, 시판되는 키트)를 추출하여 갓 만든 Msm의 전기 능력 세포로 형질전환시킵니다.
- Msm 전기 능력 전지의 제조
- Msm을 새로 키웁니다(1.2.1 및 1.2.2 단계에서와 같이). 1.3.3 및 1.3.4 단계에서와 같이 갓 자란 Msm을 세척합니다 (Sauton 대신 7H9 + ADC + Tween-80 (풍부한) 사용).
- 세척된 Msm 세포의 부분 표본을 150mL의 리치 배지가 들어 있는 멸균 500mL 삼각 플라스크에서 ~0.05의 최종 OD600 에 추가합니다.
- 배양 OD 600이 ~0.8 - 1.0 (~12-14 h)에 도달할 때까지200 rpm 및 37 oC의 인큐베이터 셰이커에서 배양합니다.
- 배양액을 사전 냉각된 400mL 원심분리기 병에 옮기고 얼음 위에서 60-90분 동안 배양합니다. 그런 다음 세포를 4oC에서 4,000× g으로 15분 동안 펠렛합니다.
- 세포를 얼음처럼 차가운 멸균(고압멸균) 10% 글리세롤로 두 번 세척합니다(각각 150mL, 4,000× g, 4oC, 15분)합니다.
알림: 세탁할 때마다 펠릿이 느슨해집니다. 전체 상층액을 버릴 때(각 세척 후) 주의하십시오. 그렇지 않으면 대부분의 세포가 폐기된 상층액에서 손실됩니다. - 0.005% Tween-80을 함유한 얼음처럼 차갑고 멸균된 10% 글리세롤 75mL로 세포를 한 번 더 세척합니다.
- 세포 펠릿을 0.005% 트윈-80과 함께 10% 글리세롤 7.5mL에 재현탁시키고 400μL 부분 표본으로 분취합니다.
알림: Msm 전기 능력은 최소 4개월 동안 유효하지만 새로 준비된 전기 능력 셀이 최상의 결과를 제공합니다. 오래된 유능한 세포를 사용할 때, 분홍색이 아닌 콜로니(흰색)가 몇 개 거짓 형질전환체로 나타난다. 유능한 세포가 오래될수록 더 많은 백색 군체가 있습니다.
- Msm의 변환
- Msm 유능한 세포 부분 표본을 얼음 위에서 해동합니다.
알림: RT에서 해동하고 이러한 셀을 변형시키면 효율성이 떨어집니다. - 1-2 μL의 플라스미드 DNA(~200 ng total)를 차가운 세포에 추가하고, 1 mL 멸균 피펫 팁으로 부드럽게 혼합한 다음, 사전 냉각된 멸균 2 mm 전기천공법 큐벳으로 옮깁니다.
- Msm competent cell + plasmid DNA mix가 있는 닫힌 큐벳을 elctroporator의 마우스에 옮기고 뚜껑을 부드럽게 닫은 다음 2.5kV(전압), 25μF(커패시턴스) 및 1000 Ω(저항)에서 펄스(지수 붕괴 유형)를 적용합니다.
- 즉시 1mL의 예열된 멸균 농축액(7H9 + ADC + Tween-80) 배지를 큐벳에 추가하고 1mL 멸균 피펫 팁으로 부드럽게 혼합한 다음 전체 내용물을 10mL 멸균 튜브에 옮깁니다.
- 37 oC 및 200 rpm으로 설정된 인큐베이터 쉐이커에서 내용물을 3시간 동안 배양합니다. 마이크로 원심분리 튜브(4,000 × g, RT 및 10분)에서 내용물을 회전시키고, 상층액을 버리고, 펠릿을 200μL의 멸균 예열된 풍부한 배지에 재현탁시키고, ADC, Tween-80 및 필요한 항생제를 적절한 농도로 포함하는 새로 부은 7H11 한천 플레이트에 현탁액을 펴 바릅니다.
참고: Msm의 경우 필요한 경우 각각 50μg/mL, 25μg/mL 및 50μg/mL의 최종 농도에서 Hygromycin, Kanamycin 및 Apramycin을 사용하십시오. Msm 자체는 이러한 항생제에 내성이 없습니다. 이러한 항생제는 형질전환체/재조합 Msm 콜로니의 선택/성장을 위해 적절한 내성 유전자를 가진 플라스미드를 사용할 때만 사용하십시오. - 37 °C로 미리 설정된 플레이트 인큐베이터에서 페트리 접시를 배양한다. 전형적으로, 형질전환체는 3-5일 사이에 나타난다.
참고: 관심의 단백질이 Msm에 독성이 있는 경우, 형질전환체는 나중에 출현하거나 출현하지 못할 수 있다. 이러한 경우 전체 길이의 잘린 버전을 복제합니다. - 양성 클론을 확인한 후 출현 Msm 콜로니의 글리세롤 스톡을 만듭니다(3.7단계와 동일).
- Msm 유능한 세포 부분 표본을 얼음 위에서 해동합니다.
- mCherry 또는 EsxA 단백질을 포함하는 R-mEV를 강화하려면 먼저 1.2.1 - 1.2.3 단계에 따라 mCherry 또는 exsA 또는 esxA::3X FLAG를 발현하는 R-Msm을 성장시킨 다음 2.1 - 2.6 단계를 수행합니다. R-mEV를 풍부하게 합니다. R-mEV는 밀도 그래디언트 스핀 후4-7번째 분획으로 용리됩니다(2.5단계). 첫 번째 초원심분리 단계(2.3.1) 이후의 R-mEV 펠릿. 2.3.1단계와 동일한 작업을 수행한 후 R-mEV가 초원심분리기 하단 중앙에서 5-7mm 직경의 자홍색에서 자홍색의 펠릿으로 보이는지 확인합니다.
- 농축된 R-mEV 내에서 관심 단백질을 검출하기 위해 웨스턴 분석47 (여기에 자세히 설명되지 않음)을 수행합니다.
결과
M. smegmatis(Msm)를 모델 마이코박테리움으로 사용하여 네이티브 및 재조합 mEV(R-mEV)의 농축을 입증합니다. 이 개략적으로 요약된 mEV 농축 프로토콜(그림 1)은 Msm의 R-mEV 및 Mtb의 네이티브 EV의 농축에도 작동합니다(1.2의 프로토콜 노트에서와 같이 약간의 수정 포함). 농축된 mEV를 시각화하려면 투과 전자 현미경(36)으로 음성으로 염색해야 합니다(그림 2A). 일반적으로 Msm 특이적 EV는 13mL 6-60% 밀도 구배의4th-6th 1mL 분획에서 분리됩니다(그림 2B). EV에 해당하는 약 80-100μg의 단백질은 Msm의 중간 로그 액상 배양 2L에서 일상적으로 얻어집니다. 직경은 일반적으로 20nm에서 250nm 사이입니다(그림 2C).
우리 실험실의 장기 목표 중 하나는 서로 다른 마이코박테리아의 mEV가 기존 백신인 BCG의 서브유닛 부스터로 작용할 수 있는지 평가하는 것입니다. 병원성 박테리아에 의해 생성된 mEV를 농축하는 것은 시간이 많이 걸리고 위험하며 비용이 많이 들기 때문에 독성 마이코박테리아의 토착 및 재조합 EV를 활용하는 것이 적절한 대안이 될 수 있습니다. 따라서 우리는 Msm의 mEV를 풍부하게 하기 위해 프로토콜을 표준화할 뿐만 아니라 R-mEV를 구성하고 풍부하게 하는 것을 목표로 합니다.
R-mEV를 구성하기 위해 먼저 Msm EV의 상위 10개 풍부한 단백질을 선택했습니다(표 1, Msm EV의 상세한 질량 분석 분석에서 식별)30. 우리는 관심 있는 외부 단백질이 이들 중 하나에 번역적으로 융합되면 mEV로 국소화될 수 있어야 한다는 가설을 세웠습니다. 그런 다음 Cfp-29는 그 중 가장 작고(~29kDa) 막 국소화되어 있으며 비교적 간단한 2차 구조 40,41,42,43을 가진 배양 여과 단백질이기 때문에10개 중 최종 후보에 올랐습니다. mCherry(형광 단백질) N-말단 말단을 Cfp-29의 C-말단 말단에 번역 융합하고 mEV로의 로딩/전달을 평가했습니다. Msm의 농축된 mEV의 일부가 분홍색으로 변했는데(그림 3), 이는 Cfp-29가 관심 있는 외부 단백질을 Msm EV로 운반할 수 있는 능력을 나타냅니다.
Cfp-29(그림 3)의 이러한 능력을 감안할 때, 우리는 Msm EV에 전달되는 주요 면역원성 단백질37,38,39인 EsxA(Esat-6)를 평가했습니다. 다시 말하지만, Cfp-29 전용 EsxA의 C-말단과 EsxA + 3X FLAG 태그(EsxA의 C-말단에 융합된 3X FLAG)에 대해 두 개의 독립적인 변환 융합을 생성했습니다. 예상했던 대로, 우리는 Msm EV(레인 5, 6, 10, 그림 4A,B)에서 Mtb의 EsxA를 관찰했습니다. 흥미롭게도 Cfp-29::EsxA::3XFLAG는 훨씬 더 안정적이었습니다(레인 3 및 4 플러스 8 및 9; 그림 4A) mEV에서 더 높은 수준으로 축적됩니다(레인 3 및 4 플러스 8 및 9; 그림 4B). 요약하면, 관심 있는 외부 단백질을 포함하는 R-mEV의 설계, 구성 및 농축을 보여줍니다(그림 3 및 그림 4).

그림 1: mycobacterial extracellular vesicle enrichment의 개략도. '일'(그림 상단의 빨간색 글꼴)은 Msm에서 mEV를 보강하는 데 필요한 일수를 나타냅니다(특히 프로토콜 단계 1 및 2의 경우). "단계"(검은색 글꼴, 그림 하단)는 프로토콜 섹션에 설명된 프로토콜 단계를 나타냅니다. Mtb에서 mEV를 농축하는 경우 모든 단계가 유사하지만 배양 단계(1단계)에서 원심분리의 첫 번째 단계(2단계)까지 최소 10일이 걸립니다. 후속 단계에는 동일한 기간(빨간색 글꼴로 표시)이 필요합니다. 밀도 구배 전에 mEV 펠릿 + 세포외 복합체는 네이티브 mEV와 R-mEV를 모두 농축할 때 무색으로 보입니다. 그러나 mCherry를 포함하는 mEV를 농축할 때 분홍빛에서 파란색으로 나타납니다( 그림 3 참조). 밀도 구배 후 mEV는 밀도 구배 튜브에서 흰색(네이티브 및 R-mEV) 또는 분홍색(mCherry를 포함하는 경우)으로 나타납니다. 그림에서 mEV의 색상은 선명도를 나타내기 위한 것일 뿐이며 정확한 색상을 나타내지 않습니다. 자세한 내용은 그림 3 을 참조하십시오. 약어: Msm = M. smegmatis; Mtb = M. 결핵; 0.45 및 0.22 μm = 폐기 필터 장치의 기공 크기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 마이코박테리아 EV는 원형이고, 밀도 구배로 농축되며, 크기가 다양 합니다. (A) Msm EV를 네거티브 염색으로 시각화하고 투과 전자 현미경으로 관찰한 대표 이미지. 스케일 바 = 200nm. (B) 6-60% 밀도 구배를 수행할 때 초원심분리기 튜브에서 mEV가 어떻게 나타나는지에 대한 대표적인 이미지. 6-60% 그래디언트가 정확하게 적층되지 않으면 mEV의 주대역(상단 개방 화살표) 및 마이너(하단 개방 화살표) 대역의 위치가 크게 변경되어 1mL 분획 수가 변경될 수 있습니다. (C) Msm의 농축 mEV의 나노트래킹 분석에 대한 대표적인 이미지. 나노트래킹 분석은 다양한 크기의 mEV의 비율과 농도 및 제제 내 총 mEV 수를 보여줍니다. 평균적으로 여기에 자세히 설명된 프로토콜을 사용하면 ~1-3 ×10 10 EV는 2L의 Msm 및 Mtb에서 농축됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: mCherry를 발현하는 mEV의 농축을 나타내는 다양한 단계. (A) Cfp-29::mCherry를 발현하는 Msm 축삭 배양을 보여주는 대표 이미지. (B) Cfp-29::mCherry를 발현하는 Msm axenic 배양 원심분리 후 박테리아 펠릿의 대표 이미지. (C) 중심 농축기를 통해 Cfp-29::mCherry를 발현하는 Msm 축삭 배양의 폐배지를 농축한 후 얻은 배양 여과액 농축액의 대표 이미지. (D) Cfp-29::mCherry를 발현하는 Msm 축산 배양에서 얻은 배양 여과액 농축액의 초원심분리 후 mEVs + 세포외 복합체 펠릿의 대표 이미지. 그러나 mEV가 mCherry를 제외한 모든 외부 단백질에 대해 네이티브 또는 재조합(Cfp-29에 융합 시)인 경우 펠릿은 무색으로 유지됩니다. (E) mEV를 포함하는 mCherry의 대표 이미지. 모든 mEV가 분홍색인 것은 아니며, 이는 모든 mEV에 Cfp-29가 포함되어 있지 않음을 나타냅니다. 양호: Cfp-29::mCherry EV에 대해 농축 후 일반적으로 얻어지는 다양한 mEV 대역을 나타내는 대표 이미지입니다. mCherry 함유 EV는 밀도가 높기 때문에 나중에 분수로 분리됩니다. 불량: 분리 불량을 나타내는 대표적인 이미지입니다(흰색 mEV는 첫 번째/두 번째 분획에서 분리되고 mCherry 함유 mEV는 10번째 분획에서 분리됩니다(mEV 펠릿의 재현탁 불량, 즉 프로토콜 단계 2.3.2 때문일 수 있음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
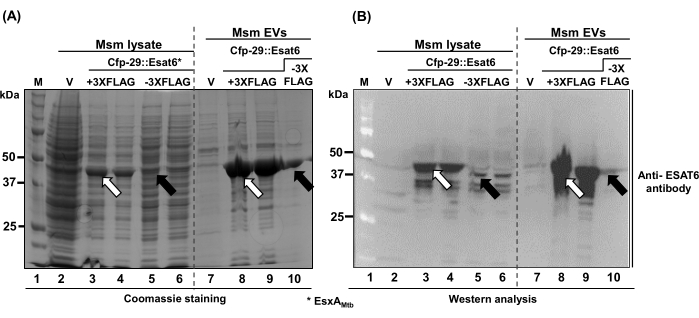
그림 4: Msm 총 세포 용해물 및 Msm 생성 EV의 Mtb 인코딩 면역원인 EsxA(ESAT-6)를 포함하는 재조합 mEV. (A) Coomassie 겔 및 (B) cfp-29::esxA::3XFLAG(+ 3XFLAG, 레인 3 및 4(총 용해물) 및 레인 8 및 9(mEV)) 또는 cfp-29를 발현하는 Msm 총 세포 용해물 및 mEV 모두에서 융합된 ExsA의 축적을 보여주는 웨스턴 분석(ESAT6 특이적 다클론 항체로 검출) 이미지: esxA(- 3XFLAG, 레인 5 및 6(총 용해물) 및 레인 10(mEV)). 열기 화살표와 채워진 화살표는 각각 누적된 Cfp-29::ExsA::3XFLAG 및 Cfp-29::ExsA를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 뇌관: | ||||||||||
| Sl # | 유전자 | 입문서 | 시퀀스(5' - 3') | 근원 | 복제하려면 | |||||
| 1 | 재질 보기 CFP-29 | 전달 | CAGTTCGAA(BstBI)ATGAACAACCTCTATCGC | Msm 게놈 DNA | pMV261 시리즈 | |||||
| 후진 | GAAAAGCTT (HindIII)GGGGGTCAGCGCGACAG | Msm 게놈 DNA | pMV261 시리즈 | |||||||
| 2 | 엠체리 | 전달 | GAAAAGCTT(HindIII) ggcggcggtggctcg (G4S링커)ATGGTGAGCAAGGGCGAGGAGG | 실험실 컬렉션 | pMV261 시리즈 | |||||
| 후진 | TGTGTTAAC(HpaI)CTACTTGTACAGCTCGTCC | 실험실 컬렉션 | pMV261 시리즈 | |||||||
| 3 | 에스엑스에이 | 전달 | GAAAAGCTT(HindIII)ggcggcggtggctcg(G4S 링커) ATGACAGAGCAGCAGTGGAATTTCGCGGGTATCGAG | Mtb 게놈 DNA | pMV261 시리즈 | |||||
| 후진 | TGTGTTAAC(HpaI)TCATGCGAACA TCCCAGTGACGTTGCCTTCGGTCG | Mtb 게놈 DNA | pMV261 시리즈 | |||||||
| 4 | exsA-3X 플래그 | 전달 | GAAAAGCTT(HindIII)ggcggcggtggctcg(G4S 링커) ATGACAGAGCAGCAGTGGAATTTCGCGGGTATCGAG | Mtb 게놈 DNA | pMV261 시리즈 | |||||
| 후진 | TGTGTTAAC(HpaI)TCA cttgtcgtcgtcgtccttgtagtcgatgtcgtg gtccttgtagtcaccgtcgtggtccttgtagtc (3XFLAG) TGCGAACATCCCAGTGACGTTG CCTTCGGTCGAAGCCATTGCCTGACC | Mtb 게놈 DNA | pMV261 시리즈 | |||||||
표 1: 프라이머 서열. cfp-29, mCherry, esxA 및 esxA::3X FLAG를 증폭하고 셔틀 벡터 pMV261로 클로닝하기 위한 순방향 및 역방향 프라이머가 나열되어 있습니다.
보충 파일 1: A: pMV261 , 원형 지도, 주요 특징 및 전체 뉴클레오티드 서열. 노란색 하이라이트-hsp60 프로모터 뉴클레오티드 서열; mCherry, esxA 및 esxA::3X FLAG 앰플리콘이 복제된 녹색 및 청록색 강조 표시 제한 사이트입니다. B, C 및 D: 각각 cfp-29, mCherry 및 esxA 의 뉴클레오티드 서열. cfp-29, mCherry 및 esxA의 녹색 하이라이트 중지 코돈. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
BCG보다 우수하고 BCG를 대체할 수 있는 새로운 결핵 백신을 개발하는 것은 여전히 만만치 않은 과제로 남아 있기 때문에, 대안으로 여러 그룹에서 BCG의 효능을 높이고 보호 기간을 연장할 수 있는 다양한 소단위 결핵 백신의 발견을 추구하고 있습니다48,49. 박테리아 EV(bEV)가 잠재적인 소단위체(subunit) 및 천연 보조제(natural adjuvants)50,51)로서 증가함에 따라, 다운스트림 테스트/분석을 위해 충분한 양의 mEV를 지속적으로 농축하는 것이 중요한 단계가 되었습니다. 이러한 연구 질문을 고려하여 이 프로토콜은 액센 배양과 재조합 버전의 mEV를 농축하는 것을 목표로 합니다.
Msm EV의 상세한 질량 분광 단백질체 분석 중에 Prados-Rosales 등은 가장 풍부한 단백질 10개를 식별했습니다30. 우리는 또한 충분한 분자 공학을 통해 이들 중 하나가 관심 있는 외부 단백질을 mEV로 운반하기에 충분해야 한다는 가설을 세웠습니다. 흥미롭게도 Cfp-29는 다양한 기능 39,40,41,42로 인해 최상의 옵션으로 두드러졌습니다. 우리의 데이터는 실제로 mCherry와 EsxA를 운반하고 (EsxA가 더 안정적이려면 C 말단에 작은 태그가 필요했지만) mEV에 축적하기에 충분하다는 것을 보여줍니다. 최근 2021년에 Tang et al.은 Cfp-29가 염료 탈색 과산화효소(DyP)형 과산화효소40을 운반할 수 있는 능력을 가진 캡슐화임을 입증했습니다. 어쩌면 Cfp-29는 다른 외부 단백질도 운반할 수 있을 것이다.
EsxA는 저명한 Mtb 면역원 37,38,39이고 동물 모델37,38,39에서 서브유닛 백신으로 보호할 수 있으며 크기가 작기 때문에 탐색했습니다. 그리고 그것의 ortholog(MSMEG_0066)는 흥미롭게도 Msm EV에는 없습니다. 여기서는 이에 대해 논의하지 않지만, 항원 85B(Rv 1886c)를 포함하여 몇 가지 다른 Mtb 단백질(Mtb에 고유하게 존재하며 Msm에 의해 암호화되지 않음)에 대한 R-mEV를 성공적으로 생성했습니다. 동시에, 흥미롭게도, 우리는 또한 전장 Rv2660c 및 Rv0288을 포함한 몇 가지 다른 단백질에 대한 R-mEV를 생성하지 못했는데, 이는 단백질이 Msm에 독성이 있기 때문일 수 있습니다. 올바른 뉴클레오티드 서열을 클로닝하고 반복적인 형질전환을 수행했음에도 불구하고 Msm의 형질전환체가 나타나지 않았기 때문에 그렇게 결론을 내렸습니다. EsxA는 mEV에서 더 나은 축적을 위해 C 말단 끝에 3XFLAG 태그가 필요했기 때문에 평가한 다른 모든 Mtb 인코딩 단백질에 3XFLAG 태그를 추가했습니다. 태그에도 불구하고 Msm은 살아남지 못했으며, 이는 일부 Mtb 단백질이 태그 융합에도 불구하고 독성이 남아 있음을 나타냅니다. 이러한 경우 예측된 항원결정기 영역만 복제하거나 여러 항원결정기를 함께 꿰매는 것이 효과가 있을 것으로 추측합니다(현재 우리 실험실에서 평가 중). 우리는 Cfp-29와 mCherry/EsxA 사이에 작은 5개의 아미노산(4개의 글리신과 1개의 세린) 링커를 사용하여 관심 단백질44,45의 접힘에 대한 부정적인 영향을 최소화했습니다. 이 링커가 없다면, 관심 단백질 접힘은 Cfp-29 접힘에 의해 크게 영향을 받을 것으로 예측됩니다.
이 농축 프로토콜은 Mtb 생성 EV의 농축으로 쉽게 확장할 수 있습니다. 우리는 또한 환경 마이코박테리아로부터 mEV를 농축하는 것도 이 프로토콜로 실현 가능할 것이라고 추측합니다. 프로토콜이 간단하고 간단함에도 불구하고 Msm 생성 EV 및 R-mEV를 강화하는 데 여전히 7-8일이 필요합니다. 대조적으로, Mtb 생성 EV의 농축에는 15-20일이 필요합니다. EV를 더 작은 부피로 집중하는 것은 시간과 비용이 많이 들기 때문에 현재 '시간' 문제를 해결하기 위해 접선 흐름 여과 및 기타 접근 방식을 모색하고 있습니다.
마지막으로, 'ADC' 보충제에는 mEV의 다운스트림 사용을 방해할 수 있는 소의 혈청 알부민이 다량 포함되어 있기 때문에 mEV를 농축하기 위해 7H9가 아닌 Sauton을 사용합니다. 이 프로토콜은 mEV 조성을 평가하는 데 사용해야 하는 다른 특정 매체(예: 저철분 매체)로 쉽게 확장할 수 있습니다. 또는 특정 응용 분야의 경우 마지막 단계(즉, 프로토콜 단계 2.7.5)에서 HEPES 완충액 대신 다양한 생체 내 기반 분석을 위해 생쥐 또는 기니피그에 동일한 식염수를 주입할 때 멸균 식염수를 사용할 수 있습니다.
공개
모든 저자는 이 연구 작업이 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계/이해관계가 없는 상태에서 수행되었음을 선언합니다.
감사의 말
저자는 M. smegmatis mc2155 주식을 친절하게 공유해 주신 Sarah M. Fortune 교수에게 진심으로 감사드립니다. 또한 그림 1의 몇 가지 기본 요소를 제공한 Servier Medical Art(smart.servier.com)를 인정합니다. 그들은 mEV 농축을 위해 인큐베이터 쉐이커, 원심분리기 및 초원심분리기를 장기간 사용하는 동안 환자 조정에 대한 나머지 실험실 구성원의 지원에 진심으로 감사드립니다. 또한 실험실 조교인 Surjeet Yadav 씨가 필요한 유리 제품과 소모품을 항상 사용할 수 있고 편리하게 사용할 수 있도록 해준 것에 대해 감사를 표합니다. 마지막으로, 그들은 프로젝트의 원활한 실행에 대한 지속적인 지원과 도움에 대해 THSTI의 관리, 구매 및 재무 팀에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| A2 type Biosafety Cabinet | Thermo Fisher Scientific, USA | 1300 series | |
| Bench top Centrifuge | Eppendorf, USA | 5810 R | |
| BstB1, HindIII, HpaI | NEB, USA | NEB | |
| Cell densitometer | GE Healthcare, USA | Ultraspec 10 | |
| Citric Acid | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Dibasic Potassium Phosphate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Double Distilled Water | Merck, USA | ~18.2 MW/cm @ 25 oC | |
| Electroporation cuvettes | Bio-Rad, USA | 2 mm | |
| Electroporator | Bio-Rad, USA | Electroporator | |
| EsxA-specific Ab | Abcam, UK | Rabbit polyclonal | |
| Ferric Ammonium Citrate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Floor model centrifuge | Thermo Fisher Scientific, USA | Sorvall RC6 plus | |
| Glassware | Borosil, INDIA | 1 L Erlenmeyer flasks | |
| Glycerol | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| HEPES and Sodium Chloride | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Incubator shakers | Thermo Fisher Scientific, USA | MaxQ 6000 & 8000 | |
| L-Asparagine | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Luria Bertani Broth and Agar, Miller | Hi Media, INDIA | Hi Media | |
| Magnesium Sulfate Heptahydrate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Magnetic stirrer | Tarsons, INDIA | Tarsons | |
| mCherry-specific Ab | Abcam, UK | Rabbit monoclonal | |
| Microwave | LG, INDIA | MC3286BLT | |
| Middlebrook 7H9 Broth | BD, USA | Difco Middlebrook 7H9 Broth | |
| Middlebrook ADC enrichment | BD, USA | BBL Middlebrook ADC enrichment | |
| Nanodrop | Thermo Fisher Scientific, USA | Spectronic 200 UV-Vis | |
| NEB5a | NEB, USA | a derivative of DH5a | |
| Optiprep (Iodixanol) | Merck, USA | Available as 60% stock solution (in water) | |
| PCR purification kit | Hi Media, INDIA | Hi Media | |
| pH Meter | Mettler Toledo, USA | Mettler Toledo | |
| Plasmid DNA mini kit | Hi Media, INDIA | Hi Media | |
| Plate incubator | Thermo Fisher Scientific, USA | New Series | |
| Plasmid pMV261 | Addgene, USA * *The plasmid is no more available in this plasmid bank | Shuttle vector | |
| Proof-reading DNA Polymerase | Thermo Fisher Scientific, USA | Phusion DNA Plus Polymerase | |
| Q5 Proof-reading DNA Polymerase | NEB, USA | NEB | |
| Refrigerated circulating water bath | Thermo Fisher Scientific, USA | R20 | |
| Middlebrock 7H11 Agar base | BD, USA | BBL Seven H11 Agar base | |
| SOC broth | Hi Media, INDIA | Hi Media | |
| Sodium Hydroxide | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| T4 DNA Ligase | NEB, USA | NEB | |
| Tween-80 | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Ultracentrifuge | Beckman Coulter, USA | Optima L100K | |
| Ultracentrifuge tubes - 14 mL | Beckman Coulter, USA | Polyallomer type – ultra clear type in SW40Ti rotor | |
| Ultracentrifuge tubes - 38 mL | Beckman Coulter, USA | Polypropylene type– cloudy type for SW28 rotor | |
| Ultrasonics cleaning waterbath sonicator | Thermo Fisher Scientific, USA | Sonicator - bench top model | |
| 0.22 µm Disposable filters | Thermo Fisher Scientific, USA | Nunc-Nalgene | |
| 30-kDa Centricon concentrators | Merck, USA | Amicon Ultra centrifugal filters - Millipore | |
| 3X FLAG antibody | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| 400 mL Centrifuge bottles | Thermo Fisher Scientific, USA | Nunc-Nalgene | |
| 50 mL Centrifuge tubes | Corning, USA | Sterile, pre-packed | |
| Bacteria | |||
| Strain | |||
| Escherichia coli | NEB, USA | NEB 5-alpha (a derivative of DH5α). | |
| Msm expressing cfp29::mCherry | This study | MC2 155 | |
| Msm expressing cfp29::esxA | This study | MC2 155 | |
| Msm expressing cfp29::esxA::3X FLAG | This study | MC2 155 | |
| Mycobacterium smegmatis (Msm) | Prof. Sarah M. Fortune, Harvard Univ, USA | MC2 155 |
참고문헌
- . Global Tuberculosis Report 2022. , (2022).
- Luca, S., Mihaescu, T. History of BCG vaccine. Mædica. 8 (1), 53-58 (2013).
- Palmer, C. E., Long, M. W. Effects of infection with atypical mycobacteria on BCG vaccination and tuberculosis. The American Review of Respiratory Disease. 94 (4), 553-568 (1966).
- Brandt, L., et al. Failure of the Mycobacterium bovis BCG vaccine: some species of environmental mycobacteria block multiplication of BCG and induction of protective immunity to tuberculosis. Infection and Immunity. 70 (2), 672-678 (2002).
- Andersen, P., Doherty, T. M. The success and failure of BCG - implications for a novel tuberculosis vaccine. Nature Reviews. Microbiology. 3 (8), 656-662 (2005).
- Kumar, P. A perspective on the success and failure of BCG. Frontiers in Immunology. 12, 778028 (2021).
- Fine, P. E. Variation in protection by BCG: implications of and for heterologous immunity. Lancet. 346 (8986), 1339-1345 (1995).
- Triccas, J. A. Recombinant BCG as a vaccine vehicle to protect against tuberculosis. Bioengineered Bugs. 1 (2), 110-115 (2010).
- Dietrich, G., Viret, J. -. F., Hess, J. Mycobacterium bovis BCG-based vaccines against tuberculosis: novel developments. Vaccine. 21 (7-8), 667-670 (2003).
- Singh, V. K., Srivastava, R., Srivastava, B. S. Manipulation of BCG vaccine: a double-edged sword. European Journal of Clinical Microbiology & Infectious Diseases. 35 (4), 535-543 (2016).
- Bastos, R. G., Borsuk, S., Seixas, F. K., Dellagostin, O. A. Recombinant Mycobacterium bovis BCG. Vaccine. 27 (47), 6495-6503 (2009).
- Kaufmann, S. H. E., Gengenbacher, M. Recombinant live vaccine candidates against tuberculosis. Current Opinion in Biotechnology. 23 (6), 900-907 (2012).
- Yuan, X., et al. A live attenuated BCG vaccine overexpressing multistage antigens Ag85B and HspX provides superior protection against Mycobacterium tuberculosis infection. Applied Microbiology and Biotechnology. 99 (24), 10587-10595 (2015).
- Vartak, A., Sucheck, S. J. Recent advances in subunit vaccine carriers. Vaccines. 4 (2), 12 (2016).
- Lindenstrøm, T., et al. Tuberculosis subunit vaccination provides long-term protective immunity characterized by multifunctional CD4 memory T cells1. The Journal of Immunology. 182 (12), 8047-8055 (2009).
- Liu, Y., et al. A subunit vaccine based on rH-NS induces protection against Mycobacterium tuberculosis infection by inducing the Th1 immune response and activating macrophages. Acta Biochimica et Biophysica Sinica. 48 (10), 909-922 (2016).
- Ning, H., et al. Subunit vaccine ESAT-6:c-di-AMP delivered by intranasal route elicits immune responses and protects against Mycobacterium tuberculosis infection. Frontiers in Cellular and Infection Microbiology. 11, 647220 (2021).
- Woodworth, J. S., et al. A Mycobacterium tuberculosis-specific subunit vaccine that provides synergistic immunity upon co-administration with Bacillus Calmette-Guérin. Nature Communications. 12 (1), 6658 (2021).
- Moyle, P. M., Toth, I. Modern subunit vaccines: development, components, and research opportunities. ChemMedChem. 8 (3), 360-376 (2013).
- Baxter, D. Active and passive immunity, vaccine types, excipients and licensing. Occupational Medicine. 57 (8), 552-556 (2007).
- Lee, W. -. H., et al. Vaccination with Klebsiella pneumoniae-derived extracellular vesicles protects against bacteria-induced lethality via both humoral and cellular immunity. Experimental & Molecular Medicine. 47 (9), e183-e183 (2015).
- Micoli, F., et al. Comparative immunogenicity and efficacy of equivalent outer membrane vesicle and glycoconjugate vaccines against nontyphoidal Salmonella. Proceedings of the National Academy of Sciences. 115 (41), 10428-10433 (2018).
- Obiero, C. W., et al. A phase 2a randomized study to evaluate the safety and immunogenicity of the 1790GAHB generalized modules for membrane antigen vaccine against Shigella sonnei administered intramuscularly to adults from a shigellosis-endemic country. Frontiers in Immunology. 8, 1884 (2017).
- Sedaghat, M., et al. Evaluation of antibody responses to outer membrane vesicles (OMVs) and killed whole cell of Vibrio cholerae O1 El Tor in immunized mice. Iranian Journal of Microbiology. 11 (3), 212-219 (2019).
- Adriani, R., Mousavi Gargari, S. L., Nazarian, S., Sarvary, S., Noroozi, N. Immunogenicity of Vibrio cholerae outer membrane vesicles secreted at various environmental conditions. Vaccine. 36 (2), 322-330 (2018).
- Roier, S., et al. Intranasal immunization with nontypeable Haemophilus influenzae outer membrane vesicles induces cross-protective immunity in mice. PLOS ONE. 7 (8), e42664 (2012).
- Furuyama, N., Sircili, M. P. Outer membrane vesicles (OMVs) produced by gram-negative bacteria: structure, functions, biogenesis, and vaccine application. BioMed Research International. 2021, e1490732 (2021).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nature Reviews Immunology. 23 (4), 236-250 (2022).
- Cai, W., et al. Bacterial outer membrane vesicles, a potential vaccine candidate in interactions with host cells based. Diagnostic Pathology. 13 (1), 95 (2018).
- Prados-Rosales, R., et al. Mycobacteria release active membrane vesicles that modulate immune responses in a TLR2-dependent manner in mice. The Journal of Clinical Investigation. 121 (4), 1471-1483 (2011).
- Bai, X., Findlow, J., Borrow, R. Recombinant protein meningococcal serogroup B vaccine combined with outer membrane vesicles. Expert Opinion on Biological Therapy. 11 (7), 969-985 (2011).
- Nagaputra, J. C., et al. Neisseria meningitidis native outer membrane vesicles containing different lipopolysaccharide glycoforms as adjuvants for meningococcal and nonmeningococcal antigens. Clinical and Vaccine Immunology: CVI. 21 (2), 234-242 (2014).
- Echeverria-Valencia, G., Flores-Villalva, S., Espitia, C. I. Virulence factors and pathogenicity of Mycobacterium. Mycobacterium - Research and Development. IntechOpen. , (2017).
- Prados-Rosales, R., Brown, L., Casadevall, A., Montalvo-Quirós, S., Luque-Garcia, J. L. Isolation and identification of membrane vesicle-associated proteins in Gram-positive bacteria and mycobacteria. MethodsX. 1, 124-129 (2014).
- Lee, J., et al. Proteomic analysis of extracellular vesicles derived from Mycobacterium tuberculosis. Proteomics. 15 (19), 3331-3337 (2015).
- Das, S., et al. Development of DNA aptamers to visualize release of mycobacterial membrane-derived extracellular vesicles in infected macrophages. Pharmaceuticals. 15 (1), 45 (2022).
- Brandt, L., Elhay, M., Rosenkrands, I., Lindblad, E. B., Andersen, P. ESAT-6 subunit vaccination against Mycobacterium tuberculosis. Infection and Immunity. 68 (2), 791-795 (2000).
- Kim, W. S., Kim, H., Kwon, K. W., Cho, S. -. N., Shin, S. J. Immunogenicity and vaccine potential of InsB, an ESAT-6-like antigen identified in the highly virulent Mycobacterium tuberculosis Beijing K strain. Frontiers in Microbiology. 10, 220 (2019).
- Valizadeh, A., et al. Evaluating the performance of PPE44, HSPX, ESAT-6 and CFP-10 factors in tuberculosis subunit vaccines. Current Microbiology. 79 (9), 260 (2022).
- Tang, Y., et al. Cryo-EM structure of Mycobacterium smegmatis DyP-loaded encapsulin. Proceedings of the National Academy of Sciences. 118 (16), (2021).
- Rosenkrands, I., et al. Identification and characterization of a 29-kilodalton protein from Mycobacterium tuberculosis culture filtrate recognized by mouse memory effector cells. Infection and Immunity. 66 (6), 2728-2735 (1998).
- Gu, S., et al. Comprehensive proteomic profiling of the membrane constituents of a Mycobacterium tuberculosis strain. Molecular & cellular proteomics: MCP. 2 (12), 1284-1296 (2003).
- Xiong, Y., Chalmers, M. J., Gao, F. P., Cross, T. A., Marshall, A. G. Identification of Mycobacterium tuberculosis H37Rv integral membrane proteins by one-dimensional gel electrophoresis and liquid chromatography electrospray ionization tandem mass spectrometry. Journal of Proteome Research. 4 (3), 855-861 (2005).
- Chen, X., Zaro, J. L., Shen, W. -. C. Fusion protein linkers: property, design and functionality. Advanced Drug Delivery Reviews. 65 (10), 1357-1369 (2013).
- Klein, J. S., Jiang, S., Galimidi, R. P., Keeffe, J. R., Bjorkman, P. J. Design and characterization of structured protein linkers with differing flexibilities. Protein Engineering, Design and Selection. 27 (10), 325-330 (2014).
- Green, M. R., Sambrook, J. . Molecular cloning, a laboratory manual, 4th Edition. , (2012).
- Atmakuri, K., Ding, Z., Christie, P. J. VirE2, a Type IV secretion substrate, interacts with the VirD4 transfer protein at cell poles of Agrobacterium tumefaciens. MolecularMicrobiology. 49 (6), 1699-1713 (2003).
- Woodworth, J. S., et al. A Mycobacterium tuberculosis-specific subunit vaccine that provides synergistic immunity upon co-administration with Bacillus Calmette-Guérin. Nature Communications. 12 (1), 6658 (2021).
- Khademi, F., Derakhshan, M., Yousefi-Avarvand, A., Tafaghodi, M., Soleimanpour, S. Multi-stage subunit vaccines against Mycobacterium tuberculosis: an alternative to the BCG vaccine or a BCG-prime boost. Expert Review of Vaccines. 17 (1), 31-44 (2018).
- Prior, J. T., et al. Bacterial-derived outer membrane vesicles are potent adjuvants that drive humoral and cellular immune responses. Pharmaceutics. 13 (2), 131 (2021).
- Tan, K., Li, R., Huang, X., Liu, Q. Outer membrane vesicles: current status and future direction of these novel vaccine adjuvants. Frontiers in Microbiology. 9, 783 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유