Method Article
Arricchimento di vescicole extracellulari native e ricombinanti di micobatteri
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio l'arricchimento di vescicole extracellulari micobatteriche native (mEV) da colture axeniche di Mycobacterium smegmatis (Msm) e come possono essere progettate e arricchite le MsmEV ricombinanti contenenti mCherry (un reporter fluorescente rosso). Infine, verifica il nuovo approccio con l'arricchimento di MsmEVs contenenti la proteina EsxA di Mycobacterium tuberculosis.
Abstract
La maggior parte dei batteri, compresi i micobatteri, genera vescicole extracellulari (EV). Poiché le vescicole extracellulari batteriche (bEV) contengono un sottoinsieme di componenti cellulari, tra cui metaboliti, lipidi, proteine e acidi nucleici, diversi gruppi hanno valutato le versioni native o ricombinanti delle bEV per la loro potenza protettiva come candidati vaccini a subunità. A differenza delle vescicole extracellulari native, le vescicole extracellulari ricombinanti sono molecolarmente ingegnerizzate per contenere uno o più immunogeni di interesse. Nell'ultimo decennio, diversi gruppi hanno esplorato diversi approcci per la generazione di bEV ricombinanti. Tuttavia, qui, riportiamo la progettazione, la costruzione e l'arricchimento di vescicole extracellulari micobatteriche ricombinanti (mEV) nei micobatteri. A tal fine, utilizziamo Mycobacterium smegmatis (Msm), un micobatterio avirulento del suolo come sistema modello. Per prima cosa descriviamo la generazione e l'arricchimento di vescicole extracellulari native di Msm. Quindi, descriviamo la progettazione e la costruzione di mEV ricombinanti che contengono mCherry, una proteina reporter fluorescente rossa, o EsxA (Esat-6), un importante immunogeno di Mycobacterium tuberculosis. Raggiungiamo questo risultato fondendo separatamente mCherry ed EsxA N-termini con il C-terminale di una piccola proteina Msm Cfp-29. Cfp-29 è una delle poche proteine abbondantemente presenti delle MsmEV. Il protocollo per generare e arricchire mEV ricombinanti da Msm rimane identico alla generazione e all'arricchimento di EV native di Msm.
Introduzione
Nonostante lo sviluppo e la somministrazione di un'ampia gamma di vaccini contro le malattie infettive, ancora oggi, ~30% di tutti i decessi umani si verifica ancora a causadi malattie trasmissibili. Prima dell'avvento del vaccino contro la tubercolosi (TB) - Bacillus Calmette Guerin (BCG) - la tubercolosi era il killer numero uno (~10.000-15.000/100.000 abitanti)2. Con la somministrazione di BCG e il facile accesso ai farmaci antitubercolari di prima e seconda linea, entro il 2022, i decessi correlati alla tubercolosi sono drasticamente scesi a ~ 1 milione / anno entro il 2022 (cioè, ~ 15-20/100.000 popolazione1). Tuttavia, nelle popolazioni endemiche di tubercolosi del mondo, i decessi correlati alla tubercolosi continuano a attestarsi a ~100-550/100.000 abitanti1. Sebbene gli esperti riconoscano diverse ragioni che portano a questi numeri distorti, la protezione mediata da BCG che non dura nemmeno per la prima decade di vita sembra essere la ragione principale 3,4,5,6,7. Di conseguenza, dati i rinnovati "Obiettivi di Sviluppo Sostenibile" delle Nazioni Unite e la "Strategia End TB" dell'OMS, c'è uno sforzo globale concertato per sviluppare un vaccino alternativo molto superiore al BCG che forse fornisca una protezione permanente dalla tubercolosi.
A tal fine, diversi gruppi stanno attualmente valutando ceppi di BCG modificati/ricombinanti, specie micobatteriche non patogene e attenuate diverse dal BCG e candidati subunità 8,9,10,11,12,13,14,15,16,17,18 . Tipicamente, i vaccini a subunità sono liposomi caricati selettivamente con poche proteine immunogeniche purificate (~1-6) a lunghezza intera o troncate del patogeno. Tuttavia, a causa del loro ripiegamento spurio in conformazioni non native e/o interazioni casuali non funzionali tra le proteine caricate, le subunità spesso mancano di epitopi nativi e germanici e, quindi, non riescono a innescare sufficientemente il sistema immunitario14,19,20.
Di conseguenza, le vescicole extracellulari (EV) dei batteri hanno preso piede come alternativa promettente 21,22,23,24,25,26. Tipicamente, le vescicole extracellulari batteriche (bEV) contengono un sottoinsieme dei loro componenti cellulari, tra cui alcune porzioni di acidi nucleici, lipidi e centinaia di metaboliti e proteine27,28. A differenza dei liposomi in cui poche proteine purificate sono caricate artificialmente, le bEV contengono centinaia di proteine caricate naturalmente e ripiegate in modo nativo con una migliore propensione a innescare il sistema immunitario, specialmente senza la spinta / aiuto di adiuvanti e agonisti del recettore Toll-like (TLR)27,28,29. È in questa linea di ricerca che noi e altri abbiamo esplorato l'utilità delle vescicole extracellulari micobatteriche come potenziali booster di subunità per BCG30. Nonostante le preoccupazioni che le vescicole extracellulari manchino di carichi antigenici uniformi, le vescicole extracellulari di Neisseria meningitidis attenuata hanno protetto con successo gli esseri umani contro il meningococco di sierogruppoB 31,32.
Almeno in teoria, le migliori vescicole extracellulari che potrebbero aumentare bene il BCG sono le vescicole extracellulari arricchite da batteri patogeni. Tuttavia, l'arricchimento delle vescicole extracellulari generate da micobatteri patogeni è costoso, dispendioso in termini di tempo e rischioso. Inoltre, le vescicole extracellulari generate da agenti patogeni possono essere più virulente che protettive. Dati i potenziali rischi, riportiamo qui un protocollo ben collaudato per l'arricchimento di vescicole extracellulari generate da Msm coltivato assinicamente, un micobatterio avirulento.
Tuttavia, nonostante codifichino diversi ortologhi di proteine patogene, i micobatteri avirulenti mancano di diversi antigeni vaccinali/epitopi proteici patogeni necessari per preparare sufficientemente il sistema immunitario verso la protezione33. Pertanto, abbiamo anche esplorato la costruzione e l'arricchimento di vescicole extracellulari ricombinanti di Msm attraverso l'ingegneria molecolare, in modo tale che una porzione significativa di qualsiasi proteina patogena di interesse espressa e tradotta in Msm, debba raggiungere le sue vescicole extracellulari. Abbiamo ipotizzato che una o più delle prime 10 proteine abbondanti delle vescicole extracellulari Msm, una volta fuse con la proteina di interesse, aiutino in tale traslocazione.
Mentre stavamo iniziando a standardizzare l'arricchimento delle vescicole extracellulari micobatteriche (mEV) nel nostro laboratorio, nel 2011, Prados-Rosales et al. hanno riportato per la prima volta la visualizzazione e l'arricchimento delle mEV in vitro30. Successivamente, nel 2014, lo stesso gruppo ha pubblicato una versione modificata del metodo34 del 2011. Nel 2015, Lee et al. hanno anche riportato un metodo standardizzato in modo indipendente per l'arricchimento di mEV sempre da colture axeniche di micobatteri35. Combinando entrambi i protocolli34,35 e incorporando alcune delle nostre modifiche dopo un'accurata standardizzazione, descriviamo qui un protocollo che aiuta ad arricchire regolarmente le mEV da colture axeniche di micobatteri36.
Qui, descriviamo in dettaglio l'arricchimento delle vescicole extracellulari specifiche per Msm, che è un'estensione di un protocollopubblicato 36 per l'arricchimento delle vescicole extracellulari micobatteriche in generale. Descriviamo anche in dettaglio come costruire mEV ricombinanti (R-mEVs) che contengono la proteina mCherry (come reporter fluorescente rosso) ed EsxA (Esat-6)37,38,39, un immunogeno predominante e una potenziale subunità vaccinogeno di Mycobacterium tuberculosis. Il protocollo per l'arricchimento delle R-mEV rimane identico a quello che abbiamo descritto per l'arricchimento delle EV native da Msm.
Protocollo
1. Condizioni di crescita di Mycobacterium smegmatis, Escherichia coli e loro derivati
- Media
- Brodo liquido Middlebrook 7H9
- Preparare la soluzione madre Tween-80 al 20% preriscaldando il volume richiesto di acqua bidistillata (ddw) in un bicchiere di vetro a ~45-50 oC in un microonde, aggiungere il volume richiesto di Tween-80 utilizzando un cilindro graduato appropriato e agitare continuamente su un piccolo agitatore magnetico per portare il Tween-80 al 20% in soluzione uniforme. Filtrare il Tween-80 al 20% attraverso un filtro di smaltimento da 0,22 um e conservare la soluzione madre giallo pallido a 4 oC.
NOTA: Tutte le tracce di Tween-80 nel cilindro graduato devono essere trasferite nel becher per un'accurata concentrazione finale. Non sterilizzare in autoclave il materiale Tween-80 preparato. Filtrare (utilizzare 0,22 μM), sterilizzare e conservare a 4 oC. - Seguire le istruzioni del produttore per la preparazione del brodo 7H9. Sospendere 4,7 g di polvere 7H9 in 900 mL di ddw. Aggiungere 2 mL di glicerolo, mescolare il contenuto e sterilizzare in autoclave a 121 °C, 15 psi per 20 minuti.
NOTA: Non aggiungere l'arricchimento ADC Middlebrook (ADC) e Tween-80 prima della sterilizzazione in autoclave. - Dopo che il terreno sterilizzato in autoclave si è raffreddato a temperatura ambiente (RT, cioè ~25 oC), in una cabina di biosicurezza standard di tipo A2, aggiungere in modo asettico 10 ml di 100 mL di ADC (1 finale) e 2,5 ml (0,05 mL finali) di Tween-80 al 20%. Filtrare la miscela attraverso un'unità filtrante monouso da 0,22 μm e conservare la soluzione madre trasparente di colore verde giallastro molto chiaro a 4 oC.
NOTA: Il pH del terreno deve essere compreso tra ~6,6 e 6,8 (se <6,4 o >7,0, scartare e rinfrescare). Conservare a 4 oC (stabile per 3-4 settimane). Si consiglia vivamente di filtrare il materiale filtrante 7H9 (dopo l'aggiunta di ADC e Tween-80) due volte attraverso due unità filtranti monouso indipendenti da 0,22 μm.
- Preparare la soluzione madre Tween-80 al 20% preriscaldando il volume richiesto di acqua bidistillata (ddw) in un bicchiere di vetro a ~45-50 oC in un microonde, aggiungere il volume richiesto di Tween-80 utilizzando un cilindro graduato appropriato e agitare continuamente su un piccolo agitatore magnetico per portare il Tween-80 al 20% in soluzione uniforme. Filtrare il Tween-80 al 20% attraverso un filtro di smaltimento da 0,22 um e conservare la soluzione madre giallo pallido a 4 oC.
- Brodo liquido (media minima) di Sauton
- Sciogliere L-asparagina (0,4% p/v) e acido citrico (0,2% p/v) in 950 mL di ddw. Aggiungere 1 mL ciascuno di 1.000 stock (in ddw) di fosfato di potassio bibasico appena preparato (incolore; brodo 10 g/20 mL; finale 1x 0,5 g/L); solfato di magnesio eptaidrato (incolore; brodo 10 g/20 mL; finale 1x 0,5 g/L); e citrato di ammonio ferrico (marrone molto chiaro; brodo 1,6 g/40 mL; finale 1x 0,04 g/L) e mescolare bene su un agitatore magnetico.
NOTA: Nella migliore delle ipotesi, le azioni 1.000x possono avere 2 settimane; se più vecchio, preparare brodi freschi; conservarli a RT al buio (ad es. all'interno di un armadio/scaffale). Se il citrato di ammonio ferrico è marrone scuro, scartalo e rendilo fresco. È meglio aggiungere i tre sali nell'ordine indicato al punto 1.1.2.1. Agitare la soluzione ogni volta prima di aggiungere ogni soluzione salina. - Misurare e annotare il pH utilizzando un pHmetro; Assicurati che sia compreso tra 3,1 e 3,2. Se il pH è superiore a 3,7, scartare i brodi e prepararli freschi. Per regolare il pH a 7,4, utilizzare tutte le gocce di idrossido di sodio 10 N necessarie. Monitorare il pH finale agitando continuamente la soluzione/il terreno su un agitatore magnetico.
- Aggiungere 4,76 mL di glicerolo, 0,25 mL di 20% Tween-80 (0,005% finale, vedere anche la nota per il passaggio 2.2.1.3) e solo allora portare il volume a 1 L. Quindi, sterilizzare con il filtro il doppio di 1 litro di terreno con due filtri separati per lo smaltimento da 0,22 μm. Conservare il terreno limpido e incolore a 4 oC (stabile per 2 settimane).
NOTA: Solo dopo che il pH è stato regolato a 7,4, aggiungere glicerolo. In caso contrario, il supporto diventerà bianco torbido. Se è torbido, scartatelo (non provate a riscaldarlo) e preparatelo fresco. Per tutte le preparazioni di mEVs, usa Sauton's appena preparato.
- Sciogliere L-asparagina (0,4% p/v) e acido citrico (0,2% p/v) in 950 mL di ddw. Aggiungere 1 mL ciascuno di 1.000 stock (in ddw) di fosfato di potassio bibasico appena preparato (incolore; brodo 10 g/20 mL; finale 1x 0,5 g/L); solfato di magnesio eptaidrato (incolore; brodo 10 g/20 mL; finale 1x 0,5 g/L); e citrato di ammonio ferrico (marrone molto chiaro; brodo 1,6 g/40 mL; finale 1x 0,04 g/L) e mescolare bene su un agitatore magnetico.
- Base in agar Middlebrook 7H11
- Seguire le istruzioni del produttore per la preparazione. Sospendere 19 g di polvere 7H11 in 900 mL di ddw. Aggiungere 5 mL di glicerolo, agitare su un agitatore magnetico per ottenere una sospensione uniforme (verde pallido; pH da 6,6 a 6,8; se >7,2, scartare e preparare fresco) e autoclavare a 121 oC, 15 psi e per 20 min.
NOTA: Non aggiungere ADC e 0.05% Tween-80 prima della sterilizzazione in autoclave. - Quando il mezzo si raffredda a ~50 °C, in modo asettico in una cabina di biosicurezza di tipo A2, aggiungere 100 mL di ADC (portato a RT) e 2,5 mL di Tween-80 al 20% (0,05% finale (portato a RT). Erogare immediatamente in modo asettico in piastre di Petri.
NOTA: Le piastre sono stabili a 4 °C per almeno 4-6 settimane. Assicurarsi che le piastre siano a RT durante la notte prima di avvolgerle per la conservazione a 4 °C. In caso contrario, l'umidità rimarrà intrappolata nelle piastre durante l'incubazione a 37 °C.
- Seguire le istruzioni del produttore per la preparazione. Sospendere 19 g di polvere 7H11 in 900 mL di ddw. Aggiungere 5 mL di glicerolo, agitare su un agitatore magnetico per ottenere una sospensione uniforme (verde pallido; pH da 6,6 a 6,8; se >7,2, scartare e preparare fresco) e autoclavare a 121 oC, 15 psi e per 20 min.
- Brodo Miller Luria Bertani (LB) e base di Agar
- Seguire le istruzioni del produttore per la preparazione. Per preparare LB Broth, sospendere 25 g di polvere in 1.000 ml di ddw e mescolare delicatamente per 5 minuti in un bicchiere di vetro su un agitatore magnetico. In caso di sospensione uniforme, aliquotare i volumi richiesti in flaconi di terreno (ad esempio, 300 ml in un flacone di terreno da 500 ml) e in autoclave. Per preparare LB Agar, sospendere 40 g di polvere in 1.000 mL di ddw e in autoclave (12 g di polvere in 300 mL ddw in un flacone di vetro da 500 mL).
- Brodo liquido Middlebrook 7H9
- Condizioni di crescita
NOTA: Tutte le fasi del lavoro di coltura batterica devono essere eseguite in una cabina di biosicurezza (tipo A2). Tutte le colture devono essere processate con provette, flaconi e puntali di pipette sterili.- Giorno 1
- Aggiungere 1 mL ciascuno di scorta di glicerolo di Msm (da -80 o C congelatore) a 2 x 10 mL (in provette centrifugate coniche sterili da 50 mL) di brodo 7H9 appena sterilizzato, raffreddato e preriscaldato (~37 o C), agitare tre volte, chiudere i coperchi e incubare le provette per una notte a 37 oC e 200-220 giri/min (agitatore dell'incubatrice).
NOTA: Per coltivare Mycobacterium tuberculosis (Mtb), seguire passaggi simili ma incubare le provette da 50 mL per 4-6 giorni a 37 oC e 120-150 rpm (agitatore dell'incubatrice) in impostazioni BSL3. Seguire TUTTE le linee guida internazionali e le pratiche di biosicurezza dei patogeni BSL3 e del gruppo di rischio 3 durante la manipolazione e lo scarto di Mtb e delle sue colture. Utilizzare una cabina di biosicurezza di tipo B2 per la manipolazione di Mtb e delle sue colture.
- Aggiungere 1 mL ciascuno di scorta di glicerolo di Msm (da -80 o C congelatore) a 2 x 10 mL (in provette centrifugate coniche sterili da 50 mL) di brodo 7H9 appena sterilizzato, raffreddato e preriscaldato (~37 o C), agitare tre volte, chiudere i coperchi e incubare le provette per una notte a 37 oC e 200-220 giri/min (agitatore dell'incubatrice).
- Giorno 2
- Quando OD 600 (A 600nm; densitometro cellulare) raggiunge ~1,0, centrifugare le colture Msm per 10 minuti a 3.200 × g e RT (centrifuga da banco). Scartare i surnatanti utilizzando puntali sterili per pipette da 1 mL.
NOTA: Il passaggio precedente rimane lo stesso per le culture Mtb, tranne per il fatto che il numero di giorni è 4-7. Assicurarsi di non toccare il pellet batterico con il puntale della pipetta. - Lavaggio: A ciascun pellet di Msm, aggiungere 1 mL di terreno Sauton preriscaldato (a RT) (passaggio 1.1.2) e risospendere delicatamente con puntali per pipette da 1 mL per ottenere una sospensione uniforme. Utilizzando puntali per pipette sterili, portare i volumi a 10 mL (in ciascuno) con lo stesso terreno. Centrifugare le sospensioni per 10 minuti a 3.200 × g e RT ed eliminare i surnatanti. Ripeti questo passaggio ancora una volta.
NOTA: Il passaggio precedente rimane lo stesso per le culture Mtb. - Risospendere le cellule Msm lavate due volte in 20 mL (ciascuna) di Sauton preriscaldato (preriscaldato in un incubatore a piastre o agitatore) e misurare la densità ottica delle cellule a 600 nm. Inoculare il volume richiesto di colture di Msm in matracci sterili di Erlenmeyer da 1 L contenenti ~330 mL di Sauton sterili in modo che l'ODfinale di 600 sia ~0,05.
NOTA: Le risospensioni devono sempre iniziare in un piccolo volume. Se il volume finale viene aggiunto direttamente al pellet in un unico passaggio, le celle rimarranno come pellet diffusi (un indicatore di scarsa risospensione). L'unico modo per risolvere il problema consiste nel ridurre le impostazioni cultura e ripetere la risospensione come consigliato. Il passaggio di cui sopra rimane lo stesso per le culture Mtb.
- Quando OD 600 (A 600nm; densitometro cellulare) raggiunge ~1,0, centrifugare le colture Msm per 10 minuti a 3.200 × g e RT (centrifuga da banco). Scartare i surnatanti utilizzando puntali sterili per pipette da 1 mL.
- Giorno 2/3
- Incubare la coltura da 330 mL nell'agitatore dell'incubatore a 200 giri/min e 37 °C fino a quando il diametro esterno della coltura600 raggiunge ~0,3. Quindi, lavare le celle una volta (simile al passaggio 1.2.2.2 ma con lo stesso volume) e quindi risospendere il pellet nello stesso volume. Distribuire 50 mL delle colture risospese ciascuna in sei palloni sterili di Erlenmeyer da 1 L, ciascuno contenente 280 mL di Sauton sterile preriscaldato con 1/10 di Tween-80 normalmente utilizzato (0,05%), cioè 0,005% (vedere anche la nota del passaggio 2.2.1.3. per capire perché 1/10di th). Il diametro esterno finaledi 600 deve essere di circa 0,05.
NOTA: Per le colture Mtb, al posto dei flaconi Erlenmeyer, utilizzare bottiglie a rullo (di capacità 1/2/4 L). Regolare il volume di coltura per flacone in modo tale che, una volta conservato sull'apparecchio a rulli, il prodotto non raggiunga l'imboccatura del flacone. Il volume effettivo della bottiglia a rulli dipenderà dalla capacità della bottiglia a rulli. - Incubare ciascuna delle colture da 330 mL nell'agitatore dell'incubatore a 200 giri/min e 37 °C fino a quando OD600 raggiunge 2,0-2,5 (~15-18 h).
NOTA: Per le colture Mtb, assicurarsi che l'OD600 finale sia ~1.0-1.2 (richiede ~5-8 giorni).
- Incubare la coltura da 330 mL nell'agitatore dell'incubatore a 200 giri/min e 37 °C fino a quando il diametro esterno della coltura600 raggiunge ~0,3. Quindi, lavare le celle una volta (simile al passaggio 1.2.2.2 ma con lo stesso volume) e quindi risospendere il pellet nello stesso volume. Distribuire 50 mL delle colture risospese ciascuna in sei palloni sterili di Erlenmeyer da 1 L, ciascuno contenente 280 mL di Sauton sterile preriscaldato con 1/10 di Tween-80 normalmente utilizzato (0,05%), cioè 0,005% (vedere anche la nota del passaggio 2.2.1.3. per capire perché 1/10di th). Il diametro esterno finaledi 600 deve essere di circa 0,05.
- Giorno 1
2. Arricchimento di mEV Msm mediante centrifugazione a gradiente di densità
- Giorno 4
- Centrifugare i ~2 L di colture Msm in stadio esponenziale medio in 6 flaconi da centrifuga sterile da 400 ml a 4 °C per 20 minuti a ~8.000 × g (centrifuga da pavimento). Raccogliere il surnatante di coltura esaurito in due matracci Erlenmeyer da 1 L pre-raffreddati e sterilizzati in autoclave e conservare un'aliquota del pellet per eventuali procedure analitiche (come SDS-PAGE e western blotting, non dettagliate qui).
NOTA: Tutti i passaggi successivi devono essere eseguiti a freddo (~ 4 °C) per mantenere al meglio l'integrità delle mEV. Gli mEV sono abbastanza stabili a RT, ma la refrigerazione è un must per la stabilità a lungo termine (si sconsiglia il congelamento e lo scongelamento ripetuti). Durante la crescita della coltura axenica, le mEV si dissociano dalla superficie di Msm/Mtb e si accumulano nel surnatante della coltura/terreno esausto. - Filtrare il surnatante di coltura Msm prima attraverso l'unità filtrante di smaltimento da 0,45 μm e poi attraverso l'unità filtrante di smaltimento da 0,22 μm per rimuovere tutte le tracce di batteri.
NOTA: La filtrazione diretta attraverso i filtri da 0.22 μm spesso soffoca le unità filtranti (poiché il pellet batterico potrebbe essere disturbato durante l'esecuzione del passaggio 2.1.1.). Per generare surnatanti di coltura Mtb, eseguire tre filtrazioni di colture Mtb (ad esempio, prima fase di filtrazione con un'unità filtrante monouso da 0,45 μm; due fasi di filtrazione consecutive con unità filtranti monouso da 0,22 μm) prima di spostare i filtrati di coltura in impostazioni BSL-2.
- Centrifugare i ~2 L di colture Msm in stadio esponenziale medio in 6 flaconi da centrifuga sterile da 400 ml a 4 °C per 20 minuti a ~8.000 × g (centrifuga da pavimento). Raccogliere il surnatante di coltura esaurito in due matracci Erlenmeyer da 1 L pre-raffreddati e sterilizzati in autoclave e conservare un'aliquota del pellet per eventuali procedure analitiche (come SDS-PAGE e western blotting, non dettagliate qui).
- Giorno 4/5
- Utilizzare i concentratori a membrana da 30 kDa per concentrare il filtrato di coltura Msm (~2 L) fino a ~ 38 mL centrifugando il filtrato di coltura a 4 °C, 20 min e a 3.200 × g.
- Prelavare prima i concentratori con liquido sterile freddo (~15 mL) (lavare a 4 °C, 5 min e a 3.200 × g).
- Lavare con ~15 mL di Sauton's freddo prefiltrato (stesse condizioni dell'acqua (2.2.1.1.)) per rimuovere ogni traccia di sostanze chimiche (utilizzate durante la produzione).
- Poiché sono tecnicamente necessari ~130 centricon (se un solo utilizzo) per concentrare ~2 L di filtrato di coltura, riutilizzare i centricon almeno 3-4 volte, se necessario. Procedere come descritto di seguito: concentrare da 15 mL a 0,5-1,0 mL (seguire il passaggio 2.2.1), trasferire il concentrato in una provetta per ultracentrifuga pulita, sterilizzata in autoclave e fredda da 38 mL, quindi trasferire nuovamente il filtrato di coltura non concentrato rimanente nei centricon utilizzati per ripetere la concentrazione.
NOTA: L'uso di concentratori da 24, 30 kDa per concentrare 2 L di filtrato di coltura richiederà fino a 6 ore. Dopo aver concentrato il filtrato di coltura, anche il Tween-80 si concentra e può bloccare il concentratore. L'uso di Tween-80 allo 0,005% finale (anziché allo 0,05%) nei terreni di Sauton aiuta a prevenire questo blocco. La ridotta concentrazione di Tween-80 non influisce sulla sospensione uniforme di Msm durante la crescita e non causa l'aggregazione delle cellule Msm. Tuttavia, poiché le cellule Mtb si aggregano allo 0,005% Tween-80, utilizzare lo 0,05% Tween-80 per i veicoli elettrici specifici per Mtb.
- Trasferire il filtrato di coltura concentrato di Msm (~38 mL) in una provetta da centrifuga in polipropilene da 40-50 mL pulita, lavata (con ddw) e pre-raffreddata e sottoporla a una centrifugazione in due fasi, prima a 4.000 × g e poi a 15.000 × g, entrambe le fasi a 4 oC per 20 minuti (per rimuovere tutti i detriti). Utilizzare una centrifuga da pavimento per lo stesso.
- Utilizzare i concentratori a membrana da 30 kDa per concentrare il filtrato di coltura Msm (~2 L) fino a ~ 38 mL centrifugando il filtrato di coltura a 4 °C, 20 min e a 3.200 × g.
- Giorno 5/6
- Trasferire il surnatante di coltura in una provetta per ultracentrifuga in polipropilene preraffreddato da 38,5 mL e centrifugarlo in un'ultracentrifuga a 100.000 × g per 4 ore a 4 °C.
NOTA: Una benna oscillante funziona meglio a questa velocità. Assicurarsi di riempire la provetta per ultracentrifuga fino all'orlo e di disporre di una provetta per ultracentrifuga bilanciata di peso equivalente. Se uno dei tubi è attaccato al secchio oscillante dopo la centrifugazione (che si verifica a causa della condensa), utilizzando una pinza, rimuoverlo delicatamente dal rotore. Rimuovendo l'umidità condensata presente sulla superficie esterna dell'ultracentrifuga prima dell'ultracentrifugazione si evita che si attacchi. - Conservare il surnatante in una provetta preraffreddata da 50 mL (vedi nota). Capovolgere la provetta dell'ultracentrifuga su una carta assorbente fresca e priva di lanugine per rimuovere le tracce del surnatante. Risospendere il pellet in 600 μL di soluzione tampone HEPES (50 mM HEPES e 150 mM NaCl, pH 7,4; filtrare prima dell'uso).
NOTA: Salvare il surnatante solo come backup. Il pellet nativo mEV si presenta come una macchia gelatinosa, di 5-7 mm di diametro, da giallo grigiastro opaco a traslucido. Se non è visibile alcun pellet, ripetere il passaggio 2.3.1 riutilizzando il surnatante salvato. Se dopo aver ripetuto il passaggio 2.3.1 non viene visualizzato alcun pellet, scartare e ricominciare dal passaggio 1.2. Il pellet impiega tempo per riessere sospeso. Si consiglia di aggiungere il tampone HEPES e lasciarlo per una notte a 4 °C per una facile risospensione. Risospendere delicatamente ma con pipettaggio ripetuto (utilizzare i puntali P200 per una migliore risospensione) fino a una risospensione uniforme.
- Trasferire il surnatante di coltura in una provetta per ultracentrifuga in polipropilene preraffreddato da 38,5 mL e centrifugarlo in un'ultracentrifuga a 100.000 × g per 4 ore a 4 °C.
- Giorno 6
- Sottoporre il pellet risospeso a centrifugazione a gradiente di densità a base di "iodixanolo".
- Stratificare il pellet risospeso sul fondo della provetta per ultracentrifuga in polipropilene ultratrasparente da 13 mL pulita, lavata (con ddw) e pre-raffreddata e miscelare delicatamente (utilizzare una pipetta da 1 mL) con ~4 mL di soluzione di "iodixanolo" a gradiente di densità inerte (disponibile in commercio come soluzione ~60% p/v). Dopo aver stratificato il pellet risospeso sul fondo della provetta (fino a un massimo di 5 mL), quindi rivestire con 1 mL (p/v) ciascuno di 40%, 30%, 20% e 10% di sottoscorte di "iodixanolo" nel rispettivo ordine (preparare le sottoscorte (con tampone HEPES) dal 60% di scorte). Quindi, aggiungere 4 ml di sottostock al 6% (preparato dal 60% di stock con tampone HEPES) nella parte superiore per riempire la provetta.
NOTA: Preparare la sfumatura appena prima dell'uso; Non conservare e utilizzare mai. - Con cautela (senza agitare), pesare il tubo in un bicchiere di vetro e trasferirlo delicatamente nel rotore del secchio oscillante.
NOTA: La pesatura è necessaria per bilanciare con un tubo fittizio (anch'esso pesato). - Sottoporlo ad ultracentrifugazione a 141.000 × g per 16 ore a 4 oC.
- Stratificare il pellet risospeso sul fondo della provetta per ultracentrifuga in polipropilene ultratrasparente da 13 mL pulita, lavata (con ddw) e pre-raffreddata e miscelare delicatamente (utilizzare una pipetta da 1 mL) con ~4 mL di soluzione di "iodixanolo" a gradiente di densità inerte (disponibile in commercio come soluzione ~60% p/v). Dopo aver stratificato il pellet risospeso sul fondo della provetta (fino a un massimo di 5 mL), quindi rivestire con 1 mL (p/v) ciascuno di 40%, 30%, 20% e 10% di sottoscorte di "iodixanolo" nel rispettivo ordine (preparare le sottoscorte (con tampone HEPES) dal 60% di scorte). Quindi, aggiungere 4 ml di sottostock al 6% (preparato dal 60% di stock con tampone HEPES) nella parte superiore per riempire la provetta.
- Sottoporre il pellet risospeso a centrifugazione a gradiente di densità a base di "iodixanolo".
- Giorno 7
- Rimuovere con cautela la provetta (vedere la nota del passaggio 2.3.1) e raccogliere le frazioni da 1 mL in provette per microcentrifuga appena sterilizzate in autoclave; prestare attenzione alle frazionidalla 4a alla6a , che in genere contengono le mEV Msm.
NOTA: Le mEV di queste frazioni normalmente si frazionano in tre o quattro bande di mEV (una è la banda principale) che sono di colore bianco opaco. Gli R-mEV contenenti mCherry si frazionano tra la 5ae la 7a frazione e appaiono dal viola scuro al magenta. Le Mtb EV in genere si frazionano tra la 5ae la 7a frazione. La separazione delle mEV nel gradiente dipende dalla concentrazione del gradiente utilizzata e dal livello di stratificazione del gradiente. Se le mEV si rompono parzialmente, possono frezzarsi in frazioni precedenti. In alternativa, se il pellet ottenuto dopo il passaggio 2.3.2 non viene risospeso bene, le vescicole formano micropellet densi che si frazionano come frazioni successive. Si consiglia di raccogliere con precisione le frazioni solo quando l'utente desidera valutare quale delle frazioni da 1 mL contiene le mEV. Gli utenti possono voler aliquotare in frazioni più piccole o più grandi in base alla loro convenienza. Quando li utilizziamo per determinate applicazioni, ad esempio testandoli come potenziale richiamo del vaccino a subunità di BCG, limitiamo la nostra raccolta delle mEV a meno di 250 μL delle frazioni (dove le mEV si frazionano) in modo da poter raccogliere in modo specifico solo le bande e il processo delle mEV come indicato al punto 2.7.5. Questo aiuta a rimuovere in modo più efficace tutte le tracce di iodixanolo che possono interferire nel modo dei nostri esperimenti a valle.
- Rimuovere con cautela la provetta (vedere la nota del passaggio 2.3.1) e raccogliere le frazioni da 1 mL in provette per microcentrifuga appena sterilizzate in autoclave; prestare attenzione alle frazionidalla 4a alla6a , che in genere contengono le mEV Msm.
- Giorno 8
- Raggruppare le frazioni contenenti mEVs, diluire con tampone HEPES a 38 mL e ripetere l'ultracentrifugazione a 4 oC per 16 ore a 100.000 × g. Risospendere il pellet (come al punto 2.3.2 con le stesse precauzioni) nel tampone HEPES o in qualsiasi tampone richiesto dagli esperimenti a valle (non dettagliati qui) come la stima delle proteine, le analisi di nano-tracciamento, la colorazione negativa, la microscopia elettronica a trasmissione, il western blotting e la marcatura immuno-oro.
NOTA: Per una migliore risospensione, sonicare il tubo contenente mEV per 10 minuti utilizzando un sonicatore a bagno d'acqua ad ultrasuoni. La sonicazione per un tempo più lungo può avviare la rottura e la perdita di mEV intatte. Se ben sospesi, la sonicazione non è necessaria. Tutti i passaggi da 2.1 a 2.6 sono identici arricchendo i veicoli elettrici generati da Mtb.
- Raggruppare le frazioni contenenti mEVs, diluire con tampone HEPES a 38 mL e ripetere l'ultracentrifugazione a 4 oC per 16 ore a 100.000 × g. Risospendere il pellet (come al punto 2.3.2 con le stesse precauzioni) nel tampone HEPES o in qualsiasi tampone richiesto dagli esperimenti a valle (non dettagliati qui) come la stima delle proteine, le analisi di nano-tracciamento, la colorazione negativa, la microscopia elettronica a trasmissione, il western blotting e la marcatura immuno-oro.
3. Costruzione e arricchimento di mEV ricombinanti.
NOTA: Una delle 10 proteine più abbondanti (identificate mediante spettrometria di massa) delle vescicole extracellulari Msm è Cfp-2930. Date le sue piccole dimensioni (29 kDa), la struttura secondaria semplice 40, la localizzazione alla membrana41 e la propensione ad essere secreta in terreni esausti in colture axeniche (ad esempio, come proteina filtrata di coltura; secreta sia da Msm che da Mtb42,43), qui, è stata sfruttata per veicolare un reporter fluorescente rosso e una proteina di interesse (EsxAMtb) in mEV. Per raggiungere questo obiettivo,
- Impiegare primer diretti e inversi appropriati (Tabella 1; compatibili per essere clonati direttamente in un vettore navetta come pMV261) per amplificare cfp-29 da Msm. Utilizzando ~50 ng di DNA genomico Msm ad alto peso molecolare (~>20 kb) come stampo, amplificare con PCR il frammento del gene cfp-29 con una DNA polimerasi ad alta fedeltà (come Phusion o Q5). Seguire le raccomandazioni del produttore per la PCR.
NOTA: Progettare i siti di restrizione necessari in primer per una facile clonazione in qualsiasi vettore shuttle alternativo di interesse. Le condizioni e il volume della PCR variano a seconda del tipo e della marca della DNA polimerasi utilizzata per la correzione di bozze. Il volume della miscela di reazione varierà a seconda della quantità di DNA stampo e della quantità di DNA polimerasi per la correzione di bozze. Seguire le raccomandazioni del produttore per le condizioni della PCR, il successo dell'amplificazione e l'eliminazione della ricottura non specifica dei primer. - La PCR purifica l'amplicone eluito con qualsiasi kit di purificazione PCR disponibile in commercio e verifica la lunghezza dell'amplicone mediante elettroforesi standard su gel di agarosio. Digerire l'amplicone purificato.
- Stimare la quantità di amplicone purificato su uno spettrofotometro. Utilizzare almeno 2 μg di amplicone cfp-29 per la digestione.
- Digerire prima con BstB1 a 65 o C per 1 ora (tipo e quantità di tampone ed enzima, secondo le raccomandazioni del produttore), portare la temperatura di reazione a RT, quindi digerire con HindIII per 1 ora a 37 oC (tipo e quantità di tampone ed enzima, secondo le raccomandazioni del produttore).
- La PCR purifica ed eluisce l'amplicone digerito in 50 μL di ddw autoclavato privo di nucleasi.
- Stimare la concentrazione e la resa dell'amplicone digerito utilizzando uno spettrofotometro. Conservare a -20 oC fino all'impostazione della legatura. NOTA: Dopo la PCR, verificare la lunghezza dell'amplicone (~798 + 50 bp) e la resa elettroforando 10 μL della miscela di reazione PCR su un gel di agarosio all'1%. Sebbene la doppia digestione non sia possibile con questa combinazione di enzimi, un tampone compatibile impedirà la purificazione ripetuta della PCR e la successiva perdita dell'amplicone digerito. La concentrazione dell'amplicone digerito varia a seconda del kit utilizzato per la purificazione PCR. Varia anche con la lunghezza (in bp) di qualsiasi vettore alternativo di scelta.
- Impiega i primer diretti e inversi (Tabella 1), una DNA polimerasi per la correzione di bozze e ~50 ng di DNA genomico Mtb, la PCR amplifica l'amplicone specifico del tag FLAG esxA o esxA-3X. Utilizzare ~5 ng di DNA plasmidico appropriato per amplificare mCherry con PCR. I dettagli del plasmide e della sequenza si trovano nel file supplementare 1.
NOTA: Utilizzare un linker Glycine, Glycine, Glycine, Glycine, Serine 44,45(G4S) tra cfp-29 e mCherry/esxA/esxA-3X FLAG; prima dell'inizio di mCherry, il linker G4S aiuta mCherry a non subire pieghe spurie non funzionali (comprese quelle guidate da Cfp-29). Fare riferimento alle sequenze cfp-29, hsp60 promoter, mCherry ed esxA nel file supplementare 1. I plasmidi che fungono da modelli per mCherry sono disponibili in diversi repository/banche di plasmidi. Sono disponibili diverse versioni (sequenze leggermente alterate) di mCherry che richiedono sequenze di primer avanti e indietro modificate. I primer (Tabella 1) aiutano ad amplificare l'mCherry menzionato nel file supplementare 1. La fusione dell'N-terminale di mCherry/esxA/esxA::3XFLAG all'estremità C-terminale di Cfp-29 funziona bene. - Digerire 1 μg di DNA degli ampliconi mCherry/esxA/esxA::3XFLAG e purificare il DNA digerito.
- Digerire due volte ogni amplicone con HindIII e HpaI per 1 ora a 37 o C ( osecondo le raccomandazioni del produttore).
- Utilizzare un kit di purificazione PCR disponibile in commercio e le raccomandazioni del produttore per purificare l'amplicone digerito. Eluire l'amplicone digerito in 50 μL di ddw autoclavato privo di nucleasi.
- Stimare la concentrazione e la resa dell'amplicone digerito utilizzando uno spettrofotometro. Conservare a -20 oC fino all'impostazione della legatura.
- Digerire 2 μg di pMV261-KanR (file supplementare 1) o un vettore di clonaggio adatto con l'enzima o gli enzimi di scelta.
- Digerire prima con BstB1 a 65 o C per 1 ora (tipo e quantità di tampone ed enzima, secondo le raccomandazioni del produttore), portare la temperatura di reazione a RT, quindi digerire con HindIII per 1 ora a 37 oC (tipo e quantità di tampone ed enzima, secondo le raccomandazioni del produttore).
- Gel purificare ed eluire in 50 μL di ddw autoclavato privo di nucleasi.
- Stimare la concentrazione e la resa del vettore digerito utilizzando uno spettrofotometro. Conservare a -20 oC fino all'impostazione della legatura.
NOTA: La clonazione di due frammenti in un solo passaggio è possibile con i primer di cui sopra per pMV261. Qualsiasi vettore navetta alternativo che sopravvive come episoma funzionerà. Anche i plasmidi integrativi funzioneranno, ma la resa proteica ricombinante sarà relativamente inferiore per base cellulare.
- Liga e si trasforma in un ceppo compatibile di E. coli.
- Per la legatura, utilizzare 125 ng del vettore. Utilizzare ampliconi mCherry/esxA/esxA::3XFLAG opportunamente digeriti con un rapporto molare di 1:3. Eseguire la legatura durante la notte utilizzando T4 DNA Ligasi (quantità secondo le raccomandazioni del produttore) a 16 °C in un bagno d'acqua circolante refrigerato.
NOTA: Utilizzare controlli appropriati come il vettore solo con e senza T4 DNA ligasi per valutare l'efficienza della digestione e prevedere l'efficienza del successo della clonazione. - Trasformazione
- Scongelare le aliquote di cellule NEB5α chimicamente competenti (~100 μL per trasformazione) su ghiaccio per 15 min. Mescolare delicatamente due volte con un puntale sterile per pipetta. Aggiungere la miscela di legatura (fino a 20 μL) alle celle fredde competenti.
- Mescolare delicatamente le cellule della pipetta + il DNA legato. Incubare la miscela su ghiaccio per altri 30 minuti.
- Fornire uno shock termico a 42 °C (a bagnomaria circolante) per 60 s e trasferire immediatamente nel ghiaccio per altri 15 min.
- Recuperare le cellule trasformate aggiungendo 1 mL di brodo SOC (2% di triptone, 0,5% di estratto di lievito, 10 mM di NaCl, 2,5 mM di KCl, 10 mM di MgCl2, 10 mM di MgSO4 e 20 mM di glucosio) e incubare a 37 °C per 1 ora a 200 giri/min.
- Centrifugare i batteri recuperati in una provetta per microcentrifuga da 1,5 mL (3000 × g, RT e 10 min), scartare il surnatante, risospendere il pellet in 200 μL di terreno LB sterile, preriscaldato e appena preparato e distribuire la sospensione su piastre di agar LB Miller appena versate contenenti gli antibiotici necessari a concentrazioni appropriate.
- Incubare le piastre di Petri in un'incubatrice a piastre preimpostata a 37 °C.
- Per la legatura, utilizzare 125 ng del vettore. Utilizzare ampliconi mCherry/esxA/esxA::3XFLAG opportunamente digeriti con un rapporto molare di 1:3. Eseguire la legatura durante la notte utilizzando T4 DNA Ligasi (quantità secondo le raccomandazioni del produttore) a 16 °C in un bagno d'acqua circolante refrigerato.
- Eseguire lo screening (non dettagliato qui) per potenziali cloni, verificare (mediante PCR/enzimi di restrizione delle colonie)46 e sequenziarli (sequenziamento con metodo Sanger) per confermare la fusione.
- Estrarre il DNA plasmidico (~200 ng/1-2 μL; qualsiasi kit disponibile in commercio) del clone confermato (E. coli background) e trasformarlo in cellule elettrocompetenti di Msm appena realizzate.
- Preparazione di celle elettrocompetenti Msm
- Coltiva appena Msm (come nei passaggi 1.2.1 e 1.2.2). Lavare l'Msm appena cresciuto come nei passaggi 1.3.3 e 1.3.4 (tranne che per l'uso di 7H9 + ADC + Tween-80 (ricco) al posto di Sauton).
- Aggiungere un'aliquota delle cellule Msm lavate a un OD finale 600 di ~0,05 in un matraccio sterile da500 mL contenente 150 mL di terreno ricco.
- Incubare nell'agitatore dell'incubatore a 200 giri/min e 37 oC fino a quando il diametro esterno della coltura600 raggiunge ~0,8-1,0 (~12-14 h).
- Trasferire la coltura in un flacone da centrifuga prerefrigerato da 400 ml e incubare su ghiaccio per 60-90 minuti. Quindi, pellettare le cellule a 4 oC per 15 minuti a 4.000 × g.
- Lavare le cellule due volte (ogni lavaggio con 150 ml, a 4.000 × g, 4 oC e 15 min) con glicerolo ghiacciato, sterile (autoclavato) al 10%.
NOTA: Ad ogni lavaggio, il pellet si allenta. Prestare attenzione quando si getta l'intero surnatante (dopo ogni lavaggio). In caso contrario, la maggior parte delle cellule andrà persa nel surnatante scartato. - Lavare ancora una volta le cellule con 75 ml di glicerolo sterile al 10% contenente lo 0,005% di Tween-80.
- Risospendere il pellet cellulare in 7,5 mL di glicerolo al 10% con Tween-80 allo 0,005% e aliquote in aliquote da 400 μL.
NOTA: Sebbene le celle elettrocompetenti Msm siano competenti per almeno 4 mesi, le celle elettrocompetenti appena preparate danno i migliori risultati. Quando si utilizzano vecchie cellule competenti, alcune colonie non rosa (bianche) appaiono come falsi trasformanti. Più vecchie sono le cellule competenti, più sono le colonie bianche.
- Trasformazione di Msm
- Scongelare le cellule competenti Msm aliquote su ghiaccio.
NOTA: Lo scongelamento a RT e la trasformazione di tali celle produce una minore efficienza. - Aggiungere 1-2 μL di DNA plasmidico (~200 ng in totale) alle cellule fredde competenti, mescolare delicatamente con un puntale per pipetta sterile da 1 mL e trasferire in una cuvetta sterile per elettroporazione da 2 mm pre-raffreddata.
- Trasferire la cuvetta chiusa con la miscela di cellule competenti Msm + DNA plasmidico nel topo dell'elettropomoratore, chiudere delicatamente il coperchio e applicare un impulso (tipo di decadimento esponenziale) a 2,5 kV (tensione), 25 μF (capacità) e 1000 Ω (resistenza).
- Aggiungere immediatamente 1 mL di terreno ricco sterile preriscaldato (7H9 + ADC + Tween-80) alla cuvetta, mescolare delicatamente con un puntale per pipetta sterile da 1 mL e trasferire l'intero contenuto in una provetta sterile da 10 mL.
- Incubare il contenuto per 3 ore in un agitatore incubatore impostato a 37 °C e 200 giri/min. Centrifugare il contenuto in una provetta per microcentrifuga (4.000 × g, RT e 10 min), scartare il surnatante, risospendere il pellet in 200 μL di terreno ricco sterile preriscaldato e distribuire la sospensione su piastre di agar 7H11 appena versate contenenti ADC, Tween-80 e gli antibiotici richiesti a concentrazioni appropriate.
NOTA: Per l'Msm, quando necessario, utilizzare igromicina, kanamicina e apramicina alle concentrazioni finali di 50 μg/mL, 25 μg/mL e 50 μg/mL, rispettivamente. L'Msm di per sé NON è resistente a questi antibiotici. Utilizzare questi antibiotici solo quando si utilizzano plasmidi con i geni resistenti appropriati per la selezione/crescita di colonie di Msm ricombinanti/trasformanti. - Incubare le piastre di Petri in un'incubatrice a piastre preimpostata a 37 °C. In genere, i trasformanti compaiono tra i 3 e i 5 giorni.
NOTA: Se una proteina di interesse è tossica per Msm, i trasformanti possono emergere più tardi o non emergere. In questi casi, clonare le versioni troncate dell'intera lunghezza. - Effettuare le scorte di glicerolo delle colonie di Msm emergenti dopo aver verificato la presenza di cloni positivi (come al punto 3.7)
- Scongelare le cellule competenti Msm aliquote su ghiaccio.
- Per arricchire le R-mEV contenenti proteine mCherry o EsxA, far crescere prima R-Msm che esprime mCherry o exsA o esxA::3X FLAG seguendo i passaggi da 1.2.1 a 1.2.3 e quindi seguire i passaggi da 2.1 a 2.6. per arricchire gli R-mEV. Le R-mEV eluiscono nella4ª-7ª frazione dopo lo spin del gradiente di densità (passo 2.5). Il pellet di R-mEVs dopo la prima fase di ultracentrifugazione (2.3.1). Dopo aver eseguito l'identica operazione 2.3.1, verificare che gli R-mEV siano visibili come un pellet di 5-7 mm di diametro da viola scuro a magenta in basso al centro dell'ultracentrifuga.
- Eseguire analisi occidentali47 (non dettagliate qui) per rilevare proteine di interesse all'interno delle R-mEV arricchite.
Risultati
Utilizziamo M. smegmatis (Msm) come micobatterio modello per dimostrare l'arricchimento di mEV sia native che ricombinanti (R-mEV). Questo protocollo di arricchimento di mEV schematicamente riassunto (Figura 1) funziona anche per l'arricchimento di R-mEV di Msm e EV nativi di Mtb (con piccole modifiche come nelle note di protocollo di 1.2). La visualizzazione delle mEV arricchite richiede la loro colorazione negativa al microscopio elettronicoa trasmissione 36 (Figura 2A). Tipicamente, le vescicole extracellulari specifiche per Msm si separano nelle frazioni 4-6del gradiente di densità 6-60% da 13 mL (Figura 2B). Circa 80-100 μg di proteine equivalenti di vescicole extracellulari sono ottenuti di routine da 2 L di colture axeniche medio-logaritmiche di Msm. I loro diametri variano tipicamente tra 20 nm e 250 nm (Figura 2C).
Un obiettivo a lungo termine del nostro laboratorio è quello di valutare se le mEV di diversi micobatteri potrebbero potenzialmente fungere da booster a subunità per il vaccino esistente, BCG. Poiché l'arricchimento delle mEV generate da batteri patogeni è dispendioso in termini di tempo, rischioso e costoso, lo sfruttamento delle vescicole extracellulari native e ricombinanti di micobatteri avirulenti può funzionare come alternativa adeguata. Quindi, miriamo non solo a standardizzare il protocollo per arricchire le mEV di Msm, ma anche a costruire e arricchire le sue R-mEV.
Per costruire le R-mEV, abbiamo prima selezionato le prime 10 proteine abbondanti di MSM EVs (Tabella 1; le abbiamo identificate da dettagliate analisi di spettrometria di massa delle MSM EVs)30. Abbiamo ipotizzato che se una proteina estranea di interesse viene fusa traduzionalmente in una qualsiasi di esse, dovrebbe essere in grado di localizzarsi in mEV. Quindi, abbiamo selezionato Cfp-29 tra le 10 perché è la più piccola tra loro (~29 kDa), è localizzata su membrana ed è una proteina filtrata di coltura con una struttura secondaria relativamente semplice40,41,42,43. Abbiamo fuso traduzionalmente l'estremità N-terminale di mCherry (proteina fluorescente) con l'estremità C-terminale di Cfp-29 e abbiamo valutato il suo carico/rilascio in mEV. Una porzione delle mEV arricchite di Msm è diventata rosa (Figura 3), indicando la capacità di Cfp-29 di trasportare una proteina estranea di interesse nelle EV di Msm.
Data questa capacità di Cfp-29 (Figura 3), abbiamo quindi valutato EsxA (Esat-6), una delle principali proteine immunogeniche37,38,39 che veicola nelle vescicole extracellulari di Msm. Ancora una volta, abbiamo generato due fusioni traslazionali indipendenti al C-terminale di Cfp-29-only EsxA e EsxA + 3X FLAG tag (3X FLAG fuso al C-terminale di EsxA. Come previsto, abbiamo osservato l'EsxA di Mtb nei veicoli elettrici Msm (corsie 5, 6 e 10, Figura 4A,B), anche se in quantità ridotte. È interessante notare che Cfp-29::EsxA::3XFLAG era molto più stabile (corsie 3 e 4 più 8 e 9; Figura 4A) e accumulati a livelli più elevati nelle mEV (corsie 3 e 4 più 8 e 9; Figura 4B). In sintesi, dimostriamo la progettazione, la costruzione e l'arricchimento di R-mEV che contengono una proteina estranea di interesse (Figura 3 e Figura 4).

Figura 1: Rappresentazione schematica dell'arricchimento di vescicole extracellulari micobatteriche. 'Giorni' (in carattere rosso, in alto nella figura) si riferisce ai giorni necessari per arricchire gli mEV da Msm (in particolare per i passaggi 1 e 2 del protocollo). "Passaggi" (in carattere nero, nella parte inferiore della figura) si riferiscono ai passaggi del protocollo come descritto nella sezione relativa al protocollo. Per l'arricchimento di mEV da Mtb, sebbene tutti i passaggi siano simili, sono necessari almeno 10 giorni per le diverse fasi di coltura (fase 1) fino alla prima fase di centrifugazione (fase 2). I passaggi successivi richiedono una durata identica (come indicato in carattere rosso). Prima del gradiente di densità, i complessi mEV pellet + extracellulare appaiono incolori quando arricchiscono sia le mEV native che le R-mEV. Tuttavia, apparirebbe da rosato a blu (vedere la Figura 3) quando si arricchiscono mEV contenenti mCherry. Dopo il gradiente di densità, le mEV apparirebbero bianche (native e R-mEV) o rosa (se contengono mCherry) nel tubo del gradiente di densità. I colori delle mEV nella figura servono solo per indicare la chiarezza e non rappresentano i colori esatti. Vedere la Figura 3 per maggiore chiarezza. Abbreviazioni: Msm = M. smegmatis; Mtb = M. tuberculosis; 0,45 e 0,22 μm = dimensione dei pori delle unità filtranti di smaltimento. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Le vescicole extracellulari micobatteriche sono circolari, si concentrano con gradienti di densità e variano in dimensioni . (A) Un'immagine rappresentativa delle vescicole extracellulari Msm dopo la loro visualizzazione con colorazione negativa e visualizzazione al microscopio elettronico a trasmissione. Barra della scala = 200 nm. (B) Un'immagine rappresentativa di come le mEV appaiono nella provetta dell'ultracentrifuga dopo aver eseguito un gradiente di densità del 6-60%. Se il gradiente del 6-60% non è accuratamente stratificato, il posizionamento delle bande maggiore (freccia aperta in alto) e minore (freccia aperta in basso) delle mEV può alterarsi in modo significativo, alterando così il numero di frazione di 1 mL. (C) Un'immagine rappresentativa dell'analisi di nanotracking di mEV arricchite di Msm. Le analisi di nanotracking rivelano le proporzioni e le concentrazioni di mEV di diverse dimensioni e il numero totale di mEV all'interno del preparato. In media, con il protocollo qui dettagliato, ~1-3 × 1010 EV sono arricchiti da 2 L di Msm e Mtb. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Diversi passaggi indicativi dell'arricchimento di mEV che esprimono mCherry. (A) Immagine rappresentativa che mostra la coltura axenica Msm che esprime Cfp-29::mCherry. (B) Immagine rappresentativa del pellet batterico post-centrifugazione di coltura axenica Msm esprimente Cfp-29::mCherry. (C) Immagine rappresentativa del concentrato di filtrato di coltura ottenuto dopo la concentrazione dei terreni esausti della coltura axenica Msm che esprime Cfp-29::mCherry attraverso concentratori centrici. (D) Immagine rappresentativa di mEVs + complessi extracellulari in pellet post ultracentrifugazione di concentrato di filtrato di coltura ottenuto da coltura axenica Msm esprimente Cfp-29::mCherry. Il pellet rimarrebbe, tuttavia, incolore se le mEV dovessero essere native o ricombinanti (dopo fusione in Cfp-29) per qualsiasi proteina estranea tranne mCherry. (E) Immagini rappresentative di mCherry contenenti mEV. Si noti che non tutte le mEV sono rosa, il che indica che non tutte le mEV contengono Cfp-29. Buono: un'immagine rappresentativa che indica diverse bande di mEV tipicamente ottenute dopo l'arricchimento per Cfp-29::mCherry EV. Poiché le vescicole extracellulari contenenti mCherry sono più dense, si separano in frazioni successive. Scarso: un'immagine rappresentativa che indica una scarsa separazione (le mEV bianche si separano nella prima/seconda frazione e le mEV contenenti mCherry si separano nelladecima frazione (probabilmente a causa della scarsa risospensione del pellet di mEV, cioè il passaggio 2.3.2 del protocollo). Fare clic qui per visualizzare una versione più grande di questa figura.
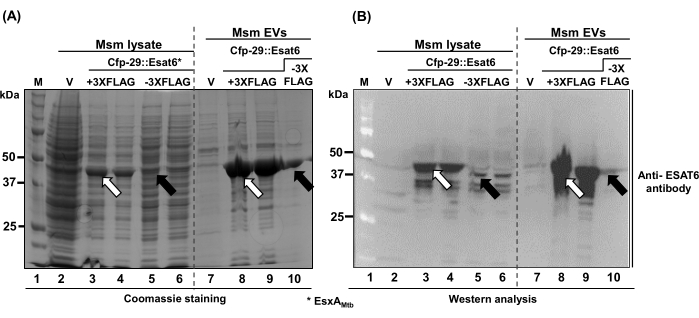
Figura 4: Immagini ricombinanti di mEV contenenti EsxA (ESAT-6), un immunogeno codificato da Mtb nel lisato di cellule totali Msm e nelle vescicole extracellulari generate da Msm. (A) Gel di Coomassie e (B) immagini di analisi western (rilevate con anticorpi policlonali specifici per ESAT6) che mostrano l'accumulo di ExsA fuso sia nel lisato cellulare totale Msm che nelle mEV che esprimono cfp-29::esxA::3XFLAG (+ 3XFLAG, corsie 3 e 4 (lisato totale) e corsie 8 e 9 (mEV)) o cfp-29:: esxA (- 3XFLAG, corsie 5 e 6 (lisato totale) e corsia 10 (mEV)). Le frecce aperte e piene indicano rispettivamente Cfp-29::ExsA::3XFLAG e Cfp-29::ExsA accumulati. Fare clic qui per visualizzare una versione più grande di questa figura.
| Primer: | ||||||||||
| Sl # | Gene | Abbecedario | Sequenza (da 5' a 3') | Fonte | Per clonare in | |||||
| 1 | CFP-29 | Inoltrare | CAGTTCGAA(BstBI)ATGAACAACCTCTATCGC | DNA genomico Msm | pMV261 | |||||
| Inverso | GAAAAGCTT(HindIII)GGGGGTCAGCGCGACAG | DNA genomico Msm | pMV261 | |||||||
| 2 | mCherry | Inoltrare | GAAAAGCTT (HindIII) ggcggcggtggctcg (G4S linker)ATGGTGAGCAAGGGCGAGGAGG | Collezione Lab | pMV261 | |||||
| Inverso | TGTGTTAAC(HpaI)CTACTTGTACAGCTCGTCC | Collezione Lab | pMV261 | |||||||
| 3 | esxA | Inoltrare | GAAAAGCTT(HindIII)ggcggcggtggctcg (linker G4S) ATGACAGAGCAGCAGTGGAATTTCGCGGGTATCGAG | DNA genomico Mtb | pMV261 | |||||
| Inverso | TGTGTTAAC(HpaI)TCATGCGAACA TCCCAGTGACGTTGCCTTCGGTCG | DNA genomico Mtb | pMV261 | |||||||
| 4 | exsA-3X BANDIERA | Inoltrare | GAAAAGCTT(HindIII)ggcggcggtggctcg (linker G4S) ATGACAGAGCAGCAGTGGAATTTCGCGGGTATCGAG | DNA genomico Mtb | pMV261 | |||||
| Inverso | TGTGTTAAC(HpaI)TCA cttgtcgtcgtcgtccttgtagtcgatgtcgtg gtccttgtagtcaccgtcgtggtccttgtagtc (3XFLAG) TGCGAACATCCCAGTGACGTTG CCTTCGGTCGAAGCCATTGCCTGACC | DNA genomico Mtb | pMV261 | |||||||
Tabella 1: Sequenze di primer. Sono elencati i primer forward e reverse per l'amplificazione di cfp-29, mCherry, esxA e esxA::3X FLAG e la clonazione nel vettore shuttle pMV261.
File supplementare 1: A: pMV261, la sua mappa circolare, le caratteristiche principali e la sequenza nucleotidica completa. Sequenza nucleotidica gialla del promotore highlight-hsp60 ; Siti di restrizione delle evidenziazioni verdi e ciano in cui sono stati clonati gli ampliconi FLAG mCherry, esxA ed esxA::3X. B, C e D: sequenze nucleotidiche di cfp-29, mCherry ed esxA, rispettivamente. Codone verde highlight-stop di cfp-29, mCherry ed esxA. Fare clic qui per scaricare il file.
Discussione
Poiché lo sviluppo di un nuovo vaccino contro la tubercolosi che sia superiore e in grado di sostituire il BCG rimane una sfida formidabile, in alternativa, diversi gruppi stanno perseguendo la scoperta di diversi vaccini contro la tubercolosi a subunità che possano aumentare la potenza del BCG e prolungarne la durata protettiva48,49. Data la crescente attenzione alle vescicole extracellulari batteriche (bEV) come potenziali subunità e come adiuvanti naturali50,51, l'arricchimento costante di quantità sufficienti di mEV per i loro test/analisi a valle è diventato un passo importante. È in considerazione di queste domande di ricerca che questo protocollo mira ad arricchire le mEV da colture axeniche e dalle loro versioni ricombinanti.
Durante le analisi dettagliate del proteoma con spettrometria di massa delle vescicole extracellulari Msm, Prados-Rosales et al. hanno identificato le 10 proteine più abbondanti30. Abbiamo inoltre ipotizzato che, dopo una sufficiente ingegneria molecolare, una di esse dovrebbe essere sufficiente per trasportare una proteina estranea di interesse nelle mEV. È interessante notare che Cfp-29 si è distinto come la migliore opzione possibile grazie alle sue varie caratteristiche 39,40,41,42. I nostri dati mostrano infatti che è sufficiente per trasportare mCherry ed EsxA (anche se EsxA ha richiesto un piccolo tag al suo C-terminale per essere più stabile) e accumularli nelle mEV. Recentemente, nel 2021, Tang et al. hanno dimostrato che Cfp-29 è un'incapsulina con la capacità di trasportare perossidasi di tipo colorante (DyP)40. Forse, Cfp-29 può trasportare anche altre proteine estranee.
Abbiamo esplorato EsxA perché è un importante immunogeno Mtb 37,38,39, può essere protettivo come vaccino a subunità nel modello animale37,38,39, è di piccole dimensioni; e il suo ortologo (MSMEG_0066) è curiosamente assente nelle EV Msm. Anche se non ne discutiamo qui, abbiamo generato con successo R-mEVs per alcune altre proteine Mtb (presenti in modo univoco in Mtb e non codificate da Msm), incluso l'antigene 85B (Rv 1886c). Allo stesso tempo, è interessante notare che non siamo riusciti a generare R-mEV per alcuni altri, tra cui Rv2660c e Rv0288, probabilmente perché le proteine sono tossiche per Msm. Concludiamo così perché, nonostante la clonazione delle sequenze nucleotidiche corrette e l'esecuzione di ripetute trasformazioni, non sono emersi trasformanti di Msm. Poiché EsxA richiedeva un tag 3XFLAG all'estremità C-terminale per un migliore accumulo nelle mEV, abbiamo aggiunto un tag 3XFLAG a tutte le altre proteine codificate da Mtb che abbiamo valutato. Nonostante il tag, Msm non è sopravvissuto, indicando che alcune proteine Mtb rimangono tossiche nonostante la fusione del tag. Ipotizziamo che in questi casi, clonare solo le regioni dell'epitopo previste o cucire insieme diversi epitopi possa dare i suoi frutti (attualmente in fase di valutazione nel nostro laboratorio). Abbiamo usato un piccolo linker di cinque aminoacidi (quattro glicina e una serina) tra Cfp-29 e mCherry/EsxA per ridurre al minimo l'influenza negativa sul ripiegamento della proteina di interesse44,45. Prevediamo che senza questo linker, il ripiegamento della proteina di interesse sarebbe fortemente influenzato dal ripiegamento di Cfp-29.
Questo protocollo di arricchimento è facilmente estendibile all'arricchimento di veicoli elettrici generati da Mtb. Ipotizziamo inoltre che l'arricchimento di mEV da micobatteri ambientali dovrebbe essere fattibile anche con questo protocollo. Nonostante il protocollo sia semplice e diretto, richiede comunque 7-8 giorni per arricchire le EV e le R-mEV generate da Msm. Al contrario, richiede 15-20 giorni per l'arricchimento dei veicoli elettrici generati da Mtb. Concentrare i veicoli elettrici in un volume più piccolo richiede tempo e denaro e attualmente stiamo esplorando la filtrazione a flusso tangenziale e altri approcci per risolvere il problema del "tempo".
Infine, utilizziamo Sauton e non 7H9 per arricchire le mEV perché l'integratore "ADC" contiene elevate quantità di albumina sierica bovina che possono interferire con qualsiasi uso a valle delle mEV. Questo protocollo può essere facilmente esteso a qualsiasi altro mezzo specifico (ad esempio, terreni a basso contenuto di ferro) che deve essere utilizzato per valutare la composizione delle mEV. In alternativa, per alcune applicazioni, nell'ultima fase (cioè la fase 2.7.5 del protocollo), invece del tampone HEPES, si potrebbe utilizzare soluzione fisiologica sterile quando si inietta la stessa nei topi o nei porcellini d'India per varie analisi in vivo.
Divulgazioni
Tutti gli autori dichiarano che questo lavoro di ricerca è stato condotto in assenza di relazioni/interessi commerciali o finanziari che possano essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori ringraziano sinceramente la Prof.ssa Sarah M. Fortune per aver gentilmente condiviso le scorte di M. smegmatis mc2155. Riconoscono inoltre a Servier Medical Art (smart.servier.com) di aver fornito alcuni elementi di base per la Figura 1. Riconoscono sinceramente il supporto del resto dei membri del laboratorio per le regolazioni dei loro pazienti durante il lungo uso degli agitatori dell'incubatore, delle centrifughe e delle ultracentrifughe per l'arricchimento mEV. Riconoscono anche il signor Surjeet Yadav, l'assistente di laboratorio, per essersi sempre assicurato che la vetreria e i materiali di consumo necessari fossero sempre disponibili e a portata di mano. Infine, ringraziano i team amministrativi, di acquisto e finanziari di THSTI per il loro costante supporto e aiuto nell'esecuzione senza soluzione di continuità del progetto.
Materiali
| Name | Company | Catalog Number | Comments |
| A2 type Biosafety Cabinet | Thermo Fisher Scientific, USA | 1300 series | |
| Bench top Centrifuge | Eppendorf, USA | 5810 R | |
| BstB1, HindIII, HpaI | NEB, USA | NEB | |
| Cell densitometer | GE Healthcare, USA | Ultraspec 10 | |
| Citric Acid | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Dibasic Potassium Phosphate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Double Distilled Water | Merck, USA | ~18.2 MW/cm @ 25 oC | |
| Electroporation cuvettes | Bio-Rad, USA | 2 mm | |
| Electroporator | Bio-Rad, USA | Electroporator | |
| EsxA-specific Ab | Abcam, UK | Rabbit polyclonal | |
| Ferric Ammonium Citrate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Floor model centrifuge | Thermo Fisher Scientific, USA | Sorvall RC6 plus | |
| Glassware | Borosil, INDIA | 1 L Erlenmeyer flasks | |
| Glycerol | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| HEPES and Sodium Chloride | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Incubator shakers | Thermo Fisher Scientific, USA | MaxQ 6000 & 8000 | |
| L-Asparagine | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Luria Bertani Broth and Agar, Miller | Hi Media, INDIA | Hi Media | |
| Magnesium Sulfate Heptahydrate | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Magnetic stirrer | Tarsons, INDIA | Tarsons | |
| mCherry-specific Ab | Abcam, UK | Rabbit monoclonal | |
| Microwave | LG, INDIA | MC3286BLT | |
| Middlebrook 7H9 Broth | BD, USA | Difco Middlebrook 7H9 Broth | |
| Middlebrook ADC enrichment | BD, USA | BBL Middlebrook ADC enrichment | |
| Nanodrop | Thermo Fisher Scientific, USA | Spectronic 200 UV-Vis | |
| NEB5a | NEB, USA | a derivative of DH5a | |
| Optiprep (Iodixanol) | Merck, USA | Available as 60% stock solution (in water) | |
| PCR purification kit | Hi Media, INDIA | Hi Media | |
| pH Meter | Mettler Toledo, USA | Mettler Toledo | |
| Plasmid DNA mini kit | Hi Media, INDIA | Hi Media | |
| Plate incubator | Thermo Fisher Scientific, USA | New Series | |
| Plasmid pMV261 | Addgene, USA * *The plasmid is no more available in this plasmid bank | Shuttle vector | |
| Proof-reading DNA Polymerase | Thermo Fisher Scientific, USA | Phusion DNA Plus Polymerase | |
| Q5 Proof-reading DNA Polymerase | NEB, USA | NEB | |
| Refrigerated circulating water bath | Thermo Fisher Scientific, USA | R20 | |
| Middlebrock 7H11 Agar base | BD, USA | BBL Seven H11 Agar base | |
| SOC broth | Hi Media, INDIA | Hi Media | |
| Sodium Hydroxide | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| T4 DNA Ligase | NEB, USA | NEB | |
| Tween-80 | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| Ultracentrifuge | Beckman Coulter, USA | Optima L100K | |
| Ultracentrifuge tubes - 14 mL | Beckman Coulter, USA | Polyallomer type – ultra clear type in SW40Ti rotor | |
| Ultracentrifuge tubes - 38 mL | Beckman Coulter, USA | Polypropylene type– cloudy type for SW28 rotor | |
| Ultrasonics cleaning waterbath sonicator | Thermo Fisher Scientific, USA | Sonicator - bench top model | |
| 0.22 µm Disposable filters | Thermo Fisher Scientific, USA | Nunc-Nalgene | |
| 30-kDa Centricon concentrators | Merck, USA | Amicon Ultra centrifugal filters - Millipore | |
| 3X FLAG antibody | Sigma-Aldrich, Merck, USA | Sigma Aldrich | |
| 400 mL Centrifuge bottles | Thermo Fisher Scientific, USA | Nunc-Nalgene | |
| 50 mL Centrifuge tubes | Corning, USA | Sterile, pre-packed | |
| Bacteria | |||
| Strain | |||
| Escherichia coli | NEB, USA | NEB 5-alpha (a derivative of DH5α). | |
| Msm expressing cfp29::mCherry | This study | MC2 155 | |
| Msm expressing cfp29::esxA | This study | MC2 155 | |
| Msm expressing cfp29::esxA::3X FLAG | This study | MC2 155 | |
| Mycobacterium smegmatis (Msm) | Prof. Sarah M. Fortune, Harvard Univ, USA | MC2 155 |
Riferimenti
- . Global Tuberculosis Report 2022. , (2022).
- Luca, S., Mihaescu, T. History of BCG vaccine. Mædica. 8 (1), 53-58 (2013).
- Palmer, C. E., Long, M. W. Effects of infection with atypical mycobacteria on BCG vaccination and tuberculosis. The American Review of Respiratory Disease. 94 (4), 553-568 (1966).
- Brandt, L., et al. Failure of the Mycobacterium bovis BCG vaccine: some species of environmental mycobacteria block multiplication of BCG and induction of protective immunity to tuberculosis. Infection and Immunity. 70 (2), 672-678 (2002).
- Andersen, P., Doherty, T. M. The success and failure of BCG - implications for a novel tuberculosis vaccine. Nature Reviews. Microbiology. 3 (8), 656-662 (2005).
- Kumar, P. A perspective on the success and failure of BCG. Frontiers in Immunology. 12, 778028 (2021).
- Fine, P. E. Variation in protection by BCG: implications of and for heterologous immunity. Lancet. 346 (8986), 1339-1345 (1995).
- Triccas, J. A. Recombinant BCG as a vaccine vehicle to protect against tuberculosis. Bioengineered Bugs. 1 (2), 110-115 (2010).
- Dietrich, G., Viret, J. -. F., Hess, J. Mycobacterium bovis BCG-based vaccines against tuberculosis: novel developments. Vaccine. 21 (7-8), 667-670 (2003).
- Singh, V. K., Srivastava, R., Srivastava, B. S. Manipulation of BCG vaccine: a double-edged sword. European Journal of Clinical Microbiology & Infectious Diseases. 35 (4), 535-543 (2016).
- Bastos, R. G., Borsuk, S., Seixas, F. K., Dellagostin, O. A. Recombinant Mycobacterium bovis BCG. Vaccine. 27 (47), 6495-6503 (2009).
- Kaufmann, S. H. E., Gengenbacher, M. Recombinant live vaccine candidates against tuberculosis. Current Opinion in Biotechnology. 23 (6), 900-907 (2012).
- Yuan, X., et al. A live attenuated BCG vaccine overexpressing multistage antigens Ag85B and HspX provides superior protection against Mycobacterium tuberculosis infection. Applied Microbiology and Biotechnology. 99 (24), 10587-10595 (2015).
- Vartak, A., Sucheck, S. J. Recent advances in subunit vaccine carriers. Vaccines. 4 (2), 12 (2016).
- Lindenstrøm, T., et al. Tuberculosis subunit vaccination provides long-term protective immunity characterized by multifunctional CD4 memory T cells1. The Journal of Immunology. 182 (12), 8047-8055 (2009).
- Liu, Y., et al. A subunit vaccine based on rH-NS induces protection against Mycobacterium tuberculosis infection by inducing the Th1 immune response and activating macrophages. Acta Biochimica et Biophysica Sinica. 48 (10), 909-922 (2016).
- Ning, H., et al. Subunit vaccine ESAT-6:c-di-AMP delivered by intranasal route elicits immune responses and protects against Mycobacterium tuberculosis infection. Frontiers in Cellular and Infection Microbiology. 11, 647220 (2021).
- Woodworth, J. S., et al. A Mycobacterium tuberculosis-specific subunit vaccine that provides synergistic immunity upon co-administration with Bacillus Calmette-Guérin. Nature Communications. 12 (1), 6658 (2021).
- Moyle, P. M., Toth, I. Modern subunit vaccines: development, components, and research opportunities. ChemMedChem. 8 (3), 360-376 (2013).
- Baxter, D. Active and passive immunity, vaccine types, excipients and licensing. Occupational Medicine. 57 (8), 552-556 (2007).
- Lee, W. -. H., et al. Vaccination with Klebsiella pneumoniae-derived extracellular vesicles protects against bacteria-induced lethality via both humoral and cellular immunity. Experimental & Molecular Medicine. 47 (9), e183-e183 (2015).
- Micoli, F., et al. Comparative immunogenicity and efficacy of equivalent outer membrane vesicle and glycoconjugate vaccines against nontyphoidal Salmonella. Proceedings of the National Academy of Sciences. 115 (41), 10428-10433 (2018).
- Obiero, C. W., et al. A phase 2a randomized study to evaluate the safety and immunogenicity of the 1790GAHB generalized modules for membrane antigen vaccine against Shigella sonnei administered intramuscularly to adults from a shigellosis-endemic country. Frontiers in Immunology. 8, 1884 (2017).
- Sedaghat, M., et al. Evaluation of antibody responses to outer membrane vesicles (OMVs) and killed whole cell of Vibrio cholerae O1 El Tor in immunized mice. Iranian Journal of Microbiology. 11 (3), 212-219 (2019).
- Adriani, R., Mousavi Gargari, S. L., Nazarian, S., Sarvary, S., Noroozi, N. Immunogenicity of Vibrio cholerae outer membrane vesicles secreted at various environmental conditions. Vaccine. 36 (2), 322-330 (2018).
- Roier, S., et al. Intranasal immunization with nontypeable Haemophilus influenzae outer membrane vesicles induces cross-protective immunity in mice. PLOS ONE. 7 (8), e42664 (2012).
- Furuyama, N., Sircili, M. P. Outer membrane vesicles (OMVs) produced by gram-negative bacteria: structure, functions, biogenesis, and vaccine application. BioMed Research International. 2021, e1490732 (2021).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nature Reviews Immunology. 23 (4), 236-250 (2022).
- Cai, W., et al. Bacterial outer membrane vesicles, a potential vaccine candidate in interactions with host cells based. Diagnostic Pathology. 13 (1), 95 (2018).
- Prados-Rosales, R., et al. Mycobacteria release active membrane vesicles that modulate immune responses in a TLR2-dependent manner in mice. The Journal of Clinical Investigation. 121 (4), 1471-1483 (2011).
- Bai, X., Findlow, J., Borrow, R. Recombinant protein meningococcal serogroup B vaccine combined with outer membrane vesicles. Expert Opinion on Biological Therapy. 11 (7), 969-985 (2011).
- Nagaputra, J. C., et al. Neisseria meningitidis native outer membrane vesicles containing different lipopolysaccharide glycoforms as adjuvants for meningococcal and nonmeningococcal antigens. Clinical and Vaccine Immunology: CVI. 21 (2), 234-242 (2014).
- Echeverria-Valencia, G., Flores-Villalva, S., Espitia, C. I. Virulence factors and pathogenicity of Mycobacterium. Mycobacterium - Research and Development. IntechOpen. , (2017).
- Prados-Rosales, R., Brown, L., Casadevall, A., Montalvo-Quirós, S., Luque-Garcia, J. L. Isolation and identification of membrane vesicle-associated proteins in Gram-positive bacteria and mycobacteria. MethodsX. 1, 124-129 (2014).
- Lee, J., et al. Proteomic analysis of extracellular vesicles derived from Mycobacterium tuberculosis. Proteomics. 15 (19), 3331-3337 (2015).
- Das, S., et al. Development of DNA aptamers to visualize release of mycobacterial membrane-derived extracellular vesicles in infected macrophages. Pharmaceuticals. 15 (1), 45 (2022).
- Brandt, L., Elhay, M., Rosenkrands, I., Lindblad, E. B., Andersen, P. ESAT-6 subunit vaccination against Mycobacterium tuberculosis. Infection and Immunity. 68 (2), 791-795 (2000).
- Kim, W. S., Kim, H., Kwon, K. W., Cho, S. -. N., Shin, S. J. Immunogenicity and vaccine potential of InsB, an ESAT-6-like antigen identified in the highly virulent Mycobacterium tuberculosis Beijing K strain. Frontiers in Microbiology. 10, 220 (2019).
- Valizadeh, A., et al. Evaluating the performance of PPE44, HSPX, ESAT-6 and CFP-10 factors in tuberculosis subunit vaccines. Current Microbiology. 79 (9), 260 (2022).
- Tang, Y., et al. Cryo-EM structure of Mycobacterium smegmatis DyP-loaded encapsulin. Proceedings of the National Academy of Sciences. 118 (16), (2021).
- Rosenkrands, I., et al. Identification and characterization of a 29-kilodalton protein from Mycobacterium tuberculosis culture filtrate recognized by mouse memory effector cells. Infection and Immunity. 66 (6), 2728-2735 (1998).
- Gu, S., et al. Comprehensive proteomic profiling of the membrane constituents of a Mycobacterium tuberculosis strain. Molecular & cellular proteomics: MCP. 2 (12), 1284-1296 (2003).
- Xiong, Y., Chalmers, M. J., Gao, F. P., Cross, T. A., Marshall, A. G. Identification of Mycobacterium tuberculosis H37Rv integral membrane proteins by one-dimensional gel electrophoresis and liquid chromatography electrospray ionization tandem mass spectrometry. Journal of Proteome Research. 4 (3), 855-861 (2005).
- Chen, X., Zaro, J. L., Shen, W. -. C. Fusion protein linkers: property, design and functionality. Advanced Drug Delivery Reviews. 65 (10), 1357-1369 (2013).
- Klein, J. S., Jiang, S., Galimidi, R. P., Keeffe, J. R., Bjorkman, P. J. Design and characterization of structured protein linkers with differing flexibilities. Protein Engineering, Design and Selection. 27 (10), 325-330 (2014).
- Green, M. R., Sambrook, J. . Molecular cloning, a laboratory manual, 4th Edition. , (2012).
- Atmakuri, K., Ding, Z., Christie, P. J. VirE2, a Type IV secretion substrate, interacts with the VirD4 transfer protein at cell poles of Agrobacterium tumefaciens. MolecularMicrobiology. 49 (6), 1699-1713 (2003).
- Woodworth, J. S., et al. A Mycobacterium tuberculosis-specific subunit vaccine that provides synergistic immunity upon co-administration with Bacillus Calmette-Guérin. Nature Communications. 12 (1), 6658 (2021).
- Khademi, F., Derakhshan, M., Yousefi-Avarvand, A., Tafaghodi, M., Soleimanpour, S. Multi-stage subunit vaccines against Mycobacterium tuberculosis: an alternative to the BCG vaccine or a BCG-prime boost. Expert Review of Vaccines. 17 (1), 31-44 (2018).
- Prior, J. T., et al. Bacterial-derived outer membrane vesicles are potent adjuvants that drive humoral and cellular immune responses. Pharmaceutics. 13 (2), 131 (2021).
- Tan, K., Li, R., Huang, X., Liu, Q. Outer membrane vesicles: current status and future direction of these novel vaccine adjuvants. Frontiers in Microbiology. 9, 783 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon