Method Article
reference reagent를 사용하여 단클론 항체 안전성 예측을 위한 cytokine 방출 분석의 견고성 확인
요약
사이토카인 방출 분석 참조 시약을 사용하면 면역 치료용 단클론 항체의 재현성 및 표준화된 체외 안전성 프로파일을 얻을 수 있습니다. 여기에서는 사이토카인 방출 분석을 참조 시약 패널과 함께 사용하여 일부 치료용 단클론 항체의 안전성을 예측하는 방법을 설명합니다.
초록
특정 면역 세포를 직접 자극하거나 면역 체계의 내인성 조절자를 차단 또는 활성화하여 면역 반응을 간접적으로 강화하도록 설계된 새로운 면역 자극 항체 약물은 사이토카인 방출 증후군(CRS)과 같은 심각한 면역 관련 부작용을 유발할 가능성이 있습니다. 따라서 first-in-human 투여 전에 in vivo 및 in vitro 실험을 조합하여 이러한 약물의 안전성 프로파일을 평가하는 것이 중요합니다. 제안된 항체 치료제를 인간 면역 세포(예: 말초 혈액 단핵 세포(PBMC), 전혈 등)과 공동 배양하고 생성된 염증성 사이토카인의 양을 측정하는 사이토카인 방출 분석(CRA)은 위험 식별에 매우 중요합니다. 그러나 서로 다른 대조 항체를 사용하는 다른 실험실은 CRA의 조화를 위협할 수 있으며, 임상적으로 관련된 대조군(예: TGN1412)을 소싱하기 어려울 수 있으며, 이로 인해 정확도나 신뢰성이 떨어지는 결과 또는 실험실 간 비교가 어려운 데이터가 나올 수 있습니다. CRA에 양성 및 음성 대조군을 포함하면 결과의 정확성과 신뢰성을 보장할 수 있습니다. NIBSC(National Institute for Biological Standards and Control)는 다양한 실험실 및 분석 방법의 결과를 조화시키기 위해 다양한 CRA 플랫폼에서 사용하기 위한 동결건조 항체 제어 패널을 제작했습니다. 세 가지 다른 양성 대조군 항체 세트에는 anti-CD52, anti-CD3 및 anti-CD28 superagonist(SA)가 포함되며, 이는 환자에서 용량 의존적 CRS를 유도하는 것으로 알려져 있습니다. 각 항체에는 isotype-matched 음성 대조군 항체가 제공됩니다. 이 참조 시약 패널은 이전에 실험실 간 재현성이 우수한 것으로 나타났으며 다양한 CRA 플랫폼에서 안전성 데이터의 신뢰성과 견고성을 높이는 데 적합한 대조군입니다.
서문
유도 사이토카인 방출은 일부 면역조절 단클론 항체(mAb)의 예상되고 원하는 효과일 수 있습니다. 그러나 전염증성 사이토카인의 예상치 못한 방출은 발열, 피로, 심지어 다발성 장기 부전을 특징으로 하는 환자에게 사이토카인 방출 증후군(CRS)을 유발할 수 있다1. 따라서 사이토카인 방출 분석법(CRA)에서 사이토카인 방출을 측정하여 새로운 면역자극 mAb가 CRS를 유발할 수 있는 가능성에 대해 시험관 내에서 테스트하는 것이 중요합니다.
TGN1412는 CD28 초작용제(CD28SA)로 작용하여 B세포 만성 림프구성 백혈병의 잠재적 치료제로 개발된 단클론항체로, 공동자극수용체인 CD28을 가교결합시켜 T-림프구를 활성화할 수 있다2. 2006년, 임상시험에서 TGN1412 투여된 6명의 건강한 지원자가 약물1을 투여받은 지 몇 시간 이내에 CRS를 포함한 심각한 부작용을 경험했습니다. 이로 인해 임상시험이 중단되고 TGN1412 추가 개발에서 철회되었습니다. CRS를 부작용으로 유발하는 것으로 알려진 다른 항체로는 anti-CD52 mAb, Campath-1H3 및 anti-CD3 mAb, Muromonab (OKT3)4 등이 있습니다. 환자에서 용량 의존적 CRS를 유도할 수 있는 능력을 감안할 때 TGN1412, OKT3 및 Campath-1H는 CRA에서 강력하고 신뢰할 수 있는 결과를 생성하는 데 적합한 양성 대조 항체입니다. 그러나 이러한 대조 항체는 이전에는 높은 비용이나 제한된 가용성으로 인해 쉽게 얻을 수 없었습니다.
그러나 최근 NIBSC(National Institute for Biological Standards and Control)에서 동형과 일치하는 음성 대조군과 함께 이 세 가지 항체 5,6,7의 재제조된 동결건조 참조 패널을 사용할 수 있게 되었습니다. 이 참조 시약 패널은 이전에 우수한 실험실 간 재현성8을 갖는 것으로 나타났으며, 따라서 다양한 CRA 플랫폼에서 안전성 데이터의 신뢰성과 견고성을 높이기 위한 적절한 대조군입니다. 따라서 이러한 시약과 함께 이 프로토콜을 사용하는 이유는 CRA 조화를 개선하기 위한 것이며, 이러한 시약의 장점은 국제 협력 연구에서 검증되었습니다8.
여기에서는 고체상(SP) PBMC CRA 및 수성상(AQ) 전혈(WB) CRA에서 이 참조 시약 패널을 사용하여 항체 유도 CRS를 예측하는 가장 좋은 방법을 설명합니다. 이 두 CRA 형식은 모두 항체 제시 방식(고체상의 경우 간접 대 수성상의 경우 직접)과 서로 다른 그룹의 반응 세포를 표적으로 한다는 사실로 인해 상호 보완적입니다. 동일한 프로토콜이 희석된 전혈(dWB) 또는 내피: PBMC 공동 배양과 함께 사용하도록 조정될 수 있습니다.
프로토콜
다음 프로토콜은 NIBSC 연구 윤리 위원회의 지침을 따릅니다. 관련 규정 및 지침에 따라 건강한 기증자 또는 환자의 서면 동의서를 받으십시오. 멸균 기술을 사용하여 층류 세포 배양 후드에서 프로토콜의 모든 준비 단계를 수행합니다. 모든 시약 및 장비에 대한 자세한 내용은 재료 표를 참조하십시오.
1. 고체상(SP) 분석을 위한 mAb로 코팅된 플레이트 준비
- 기준 시약 앰플의 내용물을 1mL의 멸균 증류수로 재구성합니다. 항체 용액을 혼합하고 멸균 캡이 있는 튜브로 옮기기 전에 재수화를 위해 5-10분을 기다립니다.
- 물 1mL에서 재구성 후 다음 재조합 항체의 저장 농도는 200μg/mL가 됩니다: 항-CD3(15/162), 항-CD52(15/178), 항-CD52에 대한 IgG1K 동형(15/198), 항-CD3에 대한 IgG2a 동형(15/218), 항-CD28SA에 대한 IgG4 동형(15/232).
- 물 1mL에서 재구성 후 anti-CD28SA(15/144)의 스톡 농도는 100μg/mL가 됩니다. 최대 7일의 단기 보관을 위해 재구성된 재료를 멸균 캡이 있는 튜브에 넣어 4°C로 옮깁니다.
- 재구성된 항체를 희석하고 항체를 멸균 PBS에서 10μg/mL로 테스트하고 멸균 non-TC 처리된 U-bottom 폴리프로필렌 96웰 마이크로타이터 플레이트의 웰을 100μL의 희석된 항체 용액(1μg/웰)으로 코팅하고 4°C에서 밤새 배양합니다.
참고: 단백질 흡착을 위해 폴리프로필렌 플레이트를 사용하는 것이 중요한데, 이는 표준 시약의 검증에 사용되었기 때문입니다9.
2. PBMC의 준비
- 최소 30mL의 말초 전혈(WB)을 헤파린화/헤파린 함유 튜브에 수집하고 헤파린나트륨과 적절한 혼합을 보장하기 위해 여러 번 뒤집습니다.
- 나중에 수성 상 전혈 분석 준비에 사용할 별도의 튜브에 WB 15mL를 옮깁니다(3.1단계).
- 나머지 혈액 15mL를 PBS 또는 무혈청 RPMI-1640 배지로 1:1 부피 비율로 희석하고 50mL 튜브에서 15mL의 밀도 구배 배지(예: 림프구판, Ficoll-Hypaque) 위에 희석된 혈액을 부드럽게 층을 이룹니다.
- 500 x g 의 튜브를 실온에서 20분 동안 브레이크 없이 회전식 로터로 원심분리하고 가속을 줄여 혈액을 다른 구성 요소로 분리합니다.
- 원심분리 후, 밀도 구배는 플라즈마의 최상층으로 분리된 후 PBMC를 포함하는 얇은 담황색 코팅층과 적혈구(RBC)와 호중구 및 호산구를 포함한 다형성 핵 과립구를 포함하는 바닥층으로 분리됩니다. 상부 혈장층을 통해 PBMC에 직접 피펫을 삽입하여 PBMC를 조심스럽게 채취합니다. 또는 세포를 채취하기 전에 상부층을 제거합니다.
- 10mL의 PBS 또는 무혈청 RPMI-1640 배지에 버피 코트를 부드럽게 재현탁합니다. 튜브를 500 x g 에서 10분 동안 다시 원심분리하여 세포를 펠릿화합니다. 상층액을 제거하고 버리십시오.
- 세척 단계 2.6을 반복합니다. 10% FCS(완전한 RPMI-1640, cRPMI)를 함유한 2mL의 RPMI에 펠렛을 재현탁합니다.
- 혈구계를 사용하여 세포 계수10.
- pPMC를 cRPMI에서 1 x 106 cells/mL의 농도로 조정합니다.
3. 수성상(AQ) 전혈(WB) 사이토카인 방출 분석의 준비
- 190μL의 WB를 96웰 U-바닥 폴리스티렌 플레이트의 웰에 추가합니다. 아직 100μg/mL가 아닌 경우 모든 처리 항체와 참조 시약을 PBS에서 100μg/mL로 사전 희석합니다.
- 190μL의 WB에 10μL의 희석된 항체를 첨가하여 95% WB에서 5μg/mL 항체의 최종 항체 농도를 제공합니다.
- 37°C의 가습 인큐베이터에서 48시간 동안 플레이트를 배양합니다.
4. 고체상(SP) PBMC 사이토카인 방출 분석의 준비
- 멀티채널 피펫을 사용하여 코팅된 플레이트에서 항체 용액을 제거하고 폐기하고(1단계에서 설명), 시약 reservoir에 PBS를 채우고 플레이트를 200μL PBS로 3x 세척하여 결합되지 않은 mAb를 제거합니다.
- 2.8단계의 세포 현탁액 200μL를 각 웰에 추가합니다. 플레이트를 37 ° C, 5 % CO2의 가습 인큐베이터에서 48 시간 동안 배양합니다.
5. 상등액 또는 혈장의 수집
- 대조군 및 테스트 mAb로 48시간 동안 배양한 후 400 x g 에서 5분 동안 원심분리 플레이트를 만들고 세포 펠릿을 방해하지 않도록 주의하면서 세포 컨디셔닝 배지 또는 혈장을 수집합니다. 수집된 상등액 또는 플라즈마를 -20°C에서 동결합니다.
알림: 혈장을 채취할 때 적혈구 펠릿을 방해하지 않도록 하십시오.
6. 상층액 또는 혈장에서 사이토카인(cytokine)의 정량화 수행
- 수집된 상층액 또는 혈장을 사용하여 선호하는 멀티플렉스 옵션을 사용하여 IFN-γ, IL-2, TNF-α 및 IL-6 농도의 사이토카인 분석을 수행합니다. 세포분석 비드 분석을 사용한 멀티플렉스 사이토카인 분석의 예시 방법은 이전에 발표된 바있습니다 11.
참고: 대표 결과 생성에 사용된 multiplex kit에 대해서는 Table of Materials 를 참조하십시오.
결과
SP 분석의 결과는 48시간에 모든 양성 대조군 항체에서 pg/mL 범위의 IL-2, IFN-γ, IL-6 및 TNF-α12 의 방출을 입증해야 하며 일치하는 동형 대조군보다 통계적으로 유의하게 커야 합니다. 당사의 대표적인 결과는 양성 대조군 항체인 αCD28, αCD3 및 αCD28SA가 PBMC SP 분석에서 실행할 때 일치하는 동형α과 비교하여 상당히 높은 수준의 IFN-γ, IL-6 및 TNF-를 유도한다는 것을 보여줍니다(그림 1). 이 분석은 또한 일치하는 isotype(859.0)에 비해 αCD28SA를 사용한 자극으로 인한 IL-2 방출의 높은 폴드 변화가 특징입니다. αCD3 및 αCD52는 여전히 IL-2 발현을 유도하지만 αCD28SA보다 폴드 변화가 적습니다(αCD3 및 αCD52의 경우 각각 6.2 및 3.3, 그림 2).
WB AQ 분석(그림 3)에서 검출 가능한 사이토카인의 수준은 PBMC SP 분석보다 눈에 띄게 낮지만 IL-2, IFN-γ 및 IL-6의 평균 접힘 변화가 100 이상인 αCD52 항체(그림 2 및 그림 3)에 의한 자극에 대한 민감도가 더 높은 것이 특징입니다.
향후 인간 최초 투여가 관련 동형대조군에 비해 사이토카인 방출을 예상치 못한 현저히 증가시키지 않을 것으로 예상되는 테스트 항체. 그러나 새로운 치료용 mAb의 개발을 중단하기보다는 CRA의 긍정적인 결과를 위험/편익 관리의 일부로 고려해야 합니다13. 새로운 CRA 플랫폼을 개발할 때 플랫폼의 재현성을 보장하기 위해 다른 공여체 세트를 사용하여 분석을 반복해야 합니다. 또한 공여자 간의 반응의 다양성을 고려하는 것이 중요하며14, 따라서 충분한 능력을 갖춘 실험이 권장된다15. 반응의 폭을 이해하고 공여자 반응에서 관찰될 수 있는 변동성을 완전히 나타내기 위해서는 복제 실험에서 치료제를 분석하는 것 외에도 여러 개별 공여자와 함께 분석을 수행하는 것이 이상적입니다.
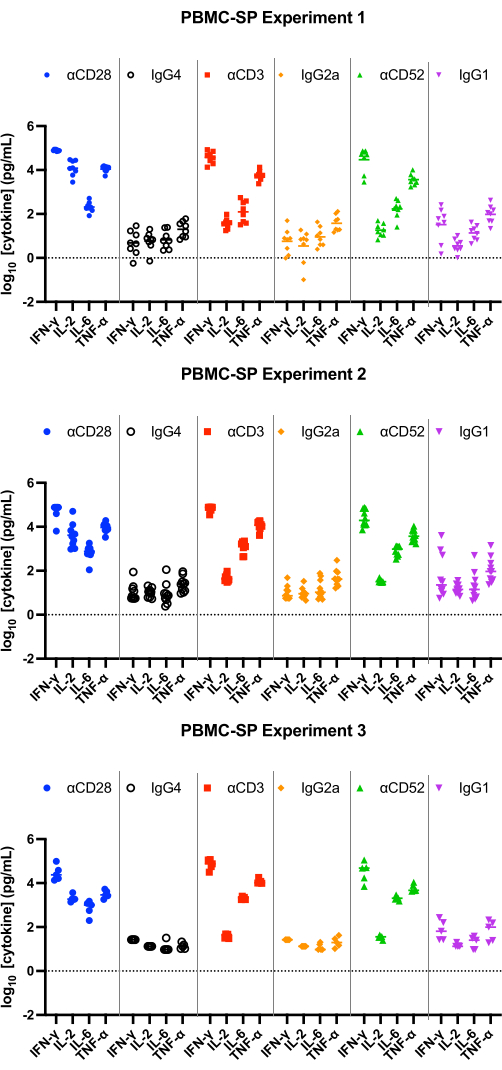
그림 1: PBMC-SP 실험에서 사이토카인 방출. 기준 시약 항체를 사용할 때 48시간 후 PBMC-SP 사이토카인 방출 분석법(실험당 5-8명의 공여체를 포함하는 3개의 독립적인 실험; n=8, n=10, n=5[위에서 아래로])에서 얻은 IFN-γ, IL-2, IL-6 및 TNF-α 방출의 대표적인 결과. 약어: PBMC = 말초 혈액 단핵 세포; SP = 고체상; IFN-γ = 인터페론 감마; IL-2 = 인터루킨 2; IL-6 = 인터루킨 6; TNF-α = 종양 괴사 인자 알파. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: PBMC-SP 및 WB-AQ 실험에서 사이토카인 폴드 변화 증가. 48시간 후 PBMC-SP 및 WB-AQ 사이토카인 방출 분석에서 얻은 일치하는 동형α형 대조군과 관련된 CRS 유도 항체 참조 시약의 IFN-γ, IL-2, IL-6 및 TNF- 방출의 폴드 변화. 약어: PBMC = 말초 혈액 단핵 세포; SP = 고체상; WB = 전혈; AQ = 수성(상); IFN-γ = 인터페론 감마; IL-2 = 인터루킨 2; IL-6 = 인터루킨 6; TNF-α = 종양 괴사 인자 알파; CRS = 사이토카인 방출 증후군. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
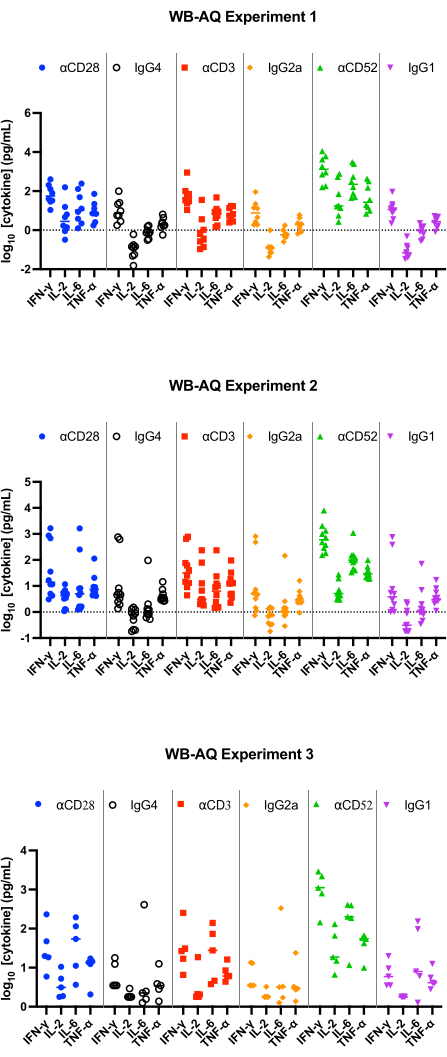
그림 3: WB-AQ 실험에서 사이토카인 방출. 참조 시약 항체를 사용할 때 48시간 후 WB-AQ 사이토카인 방출 분석(실험당 각각 5-8명의 공여자를 포함하는 3개의 독립적인 실험; n=8, n=10, n=5[위에서 아래로])에서 얻은 IFN-γ, IL-2, IL-6 및 TNF-α 방출의 대표적인 결과. 약어: WB = 전혈; AQ = 수성(상); IFN-γ = 인터페론 감마; IL-2 = 인터루킨 2; IL-6 = 인터루킨 6; TNF-α = 종양 괴사 인자 알파. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에는 양성 및 음성 대조군에 대한 참조 시약 패널을 사용하여 항체 코팅 플레이트 또는 용액 내 항체에서 항체 매개 자극 후 PBMC 및 WB에서 사이토카인 방출을 측정하는 방법이 설명되어 있습니다. 이러한 각 분석에는 고유한 강점과 약점이 있습니다. PBMC 및 WB 분석은 CRA에 사용되는 두 가지 실험 매트릭스에서 림프구, 단핵구 및 과립구와 같은 다양한 면역 세포의 비율이 다르기 때문에 상호 보완적입니다. WB 분석법이 PBMC 단일배양과 대조적으로 생체 내 상태를 더 잘 나타낼 수 있지만, 전자의 플랫폼은 TGN1412 및 OKT315의 T-세포 매개 CRS 위험을 덜 예측한다는 것을 관찰하는 것은 흥미롭습니다. 적혈구에 대한 글리코포린 A가 IL-2 매개 T세포 확장을 억제한 결과16. 그럼에도 불구하고, 항-CD52로 인한 CRS 위험의 예측은 호중구(PBMC 분리에 사용된 2단계에서 설명한 기존 밀도 구배 방법 중 손실)의 존재로 인해 WB CRA에서 그대로 유지됩니다.
CRA의 형식(SP 또는 AQ 프레젠테이션)은 CRS의 특정 메커니즘을 감지하는 데 중요합니다. 예를 들어, TGN1412의 전임상 시험관 내 안전성 테스트에서 사용된 인간 림프구17,18에 대한 mAb의 수성상 제시는 국소 세포 수용체 클러스터링 및 참여19의 부족과 수성상에서 항체에 의해 매개되는 결과적인 T 세포 활성화로 인한 CRS 위험을 식별하지 못했습니다. 실제로, TGN1412 매개 CRS는 여기에 제시된 바와 같이 Fc-gamma receptor(FcγR) 교차결합을 인위적으로 복제하는 SP 형식에서만 정확하게 검출할 수 있으며, 고밀도의 PBMC 배양 전배양에서 접촉 의존적 프라이밍과 CD32+ 면역 세포(예: B-세포20 및 단핵구21)와의 Fc 상호 작용에 의해서만 정확하게 검출될 수 있습니다.
이러한 플랫폼 외에도 더 복잡한 공동 배양 시스템으로 CRA를 수행하는 다른 방법이 있습니다. 이러한 방법에 설명된 CRA에 대한 대체 CRA의 예는 PBMC를 자가 혈액 성장 내피 세포(BOEC)와 함께 배양하는 것입니다22. 이 분석은 2015년에 교란 조직 불일치를 제거함으로써 당시의 기존 혼합 공여자 HUVEC:PBMC 분석을 개선한 것으로 설명되었습니다. WB 분석보다 항-CD28SA CRS에 대한 민감도가 더 우수하며, 생체 내에 존재하는 내피 세포와 백혈구의 조합을 모방하여 PBMC 단일배양 분석의 한계를 극복하지만, 특수 세포 배양 기술이 필요한 더 긴 절차 단계가 필요합니다22.
또한, 이 프로토콜은 특히 IFN-γ, IL-2, IL-6 및 TNF-α 방출에 초점을 맞추고 있지만, MHRA의 동료들은 이전에 이 설정에서 IL-12 및 기타 방출을 살펴본 적이 있습니다23. IL-12 생산은 이러한 양성 대조군 CRS 항체에 의해 증가하지만, 특별히 민감하지는 않으므로 이 방식에서 CRS의 훌륭한 예측 인자는 아닐 수 있습니다. IL-15와 같은 일부 사이토카인은 본 프로토콜에서 평가된 4개의 사이토카인이 CRS의 잠재적 위험에 대한 좋은 지표를 제공함에도 불구하고 테스트되지 않았습니다. 물론, 검사된 양상과 항체에 따라 다른 사이토카인을 평가할 수 있습니다.
이러한 관찰을 종합해 볼 때, reference reagent의 사용이 새로운 항체의 CRS 위험을 식별하는 데 도움이 될 수 있지만, CRS 가능성을 식별하지 못할 수 있는 차선의 CRA 플랫폼을 피하기 위해 주의를 기울여야 한다는 점에 주목하는 것이 중요하다는 점을 강조합니다. 결정적으로, 치료제의 예측된 작용 메커니즘은 Fc 영역을 통하든 항원 발현 세포에 대한 가설된 작용을 통해서든 분석의 생물학과 일치해야 합니다. 따라서 이 기사에서 논의된 테스트 치료 및 참조 시약의 작용 메커니즘의 차이로 인해 테스트 항체에 대한 관련 CRA가 참조 시약의 생물학과 호환되지 않을 수 있는 방식으로 잠재적인 제한이 있을 수 있지만, 이 분석은 위험 식별을 위한 강력하고 신뢰할 수 있는 플랫폼을 제공합니다. 그러나 다양한 작용 기전 및 면역 세포 하위 집합을 포함하는 여러 CRA 형식의 결과는 안전성 평가 데이터에 대한 최적의 신뢰도를 위해 필요할 수 있습니다.
공개
EM은 이전에 MHRA(Medicines and Healthcare Products Regulatory Agency)에 고용되었습니다. 나머지 저자는 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립생물학표준통제연구소(National Institute for Biological Standards and Control)의 자금 지원을 받았습니다. 원고를 검토해 주시고 도움이 되는 의견과 제안을 해 주신 Sandra Diebold에게 감사드립니다. 영상을 촬영해주신 Ka Seng Ieong님께도 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
참고문헌
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042 (2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440 (2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유