Method Article
Verwendung von Referenzreagenzien zur Bestätigung der Robustheit von Zytokin-Freisetzungsassays für die Vorhersage der Sicherheit monoklonaler Antikörper
In diesem Artikel
Zusammenfassung
Die Verwendung von Referenzreagenzien für Zytokinfreisetzungsassays ermöglicht reproduzierbarere und standardisierte In-vitro-Sicherheitsprofile von immuntherapeutischen monoklonalen Antikörpern. Im Folgenden wird beschrieben, wie Zytokin-Freisetzungsassays zusammen mit einem Referenzreagenzienpanel verwendet werden können, um die Sicherheit einiger therapeutischer monoklonaler Antikörper vorherzusagen.
Zusammenfassung
Neue immunstimulierende Antikörper, die entweder spezifische Immunzellen direkt stimulieren oder die Immunantwort indirekt verstärken sollen, indem sie einen endogenen Regulator des Immunsystems blockieren oder aktivieren, haben das Potenzial, schwerwiegende immunbedingte unerwünschte Ereignisse wie das Zytokinfreisetzungssyndrom (CRS) zu verursachen. Daher ist es von entscheidender Bedeutung, das Sicherheitsprofil solcher Arzneimittel mit einer Kombination aus In-vivo - und In-vitro-Experimenten zu bewerten, bevor die erste Dosis am Menschen verabreicht wird. Zytokin-Freisetzungsassays (CRAs), bei denen das vorgeschlagene Antikörpertherapeutikum mit menschlichen Immunzellen (wie mononukleären Zellen des peripheren Blutes (PBMCs), Vollblut oder anderem) cokultiviert wird und die Menge des produzierten entzündlichen Zytokins gemessen wird, sind entscheidend für die Identifizierung von Gefahren. Verschiedene Labore, die unterschiedliche Kontrollantikörper verwenden, können jedoch die Harmonisierung von Ratingagenturen gefährden, und klinisch relevante Kontrollen (wie z. B. TGN1412) können schwierig zu beschaffen sein, was zu weniger genauen oder zuverlässigen Ergebnissen oder Daten führen kann, die zwischen Laboratorien schwer zu vergleichen sind. Die Einbeziehung von Positiv- und Negativkontrollen in eine Ratingagentur kann die Genauigkeit und Zuverlässigkeit der Ergebnisse gewährleisten. Das National Institute for Biological Standards and Control (NIBSC) hat ein Panel von lyophilisierten Antikörperkontrollen erstellt, die für den Einsatz in verschiedenen CRA-Plattformen vorgesehen sind, um die Ergebnisse über verschiedene Labore und Assay-Methoden hinweg zu harmonisieren. Ein Satz von drei verschiedenen Positivkontrollantikörpern umfasst Anti-CD52-, Anti-CD3- und Anti-CD28-Superagonisten (SA), von denen bekannt ist, dass sie bei Patienten dosisabhängiges CRS induzieren. Jeder Antikörper ist mit einem isotypangepassten Negativkontroll-Antikörper ausgestattet. Dieses Panel von Referenzreagenzien hat sich bereits als gut reproduzierbar zwischen den Laboren erwiesen und ist eine geeignete Kontrolle, um die Zuverlässigkeit und Robustheit von Sicherheitsdaten von einer Vielzahl von CRA-Plattformen zu erhöhen.
Einleitung
Die induzierte Zytokinfreisetzung kann ein antizipierter und gewünschter Effekt einiger immunmodulatorischer monoklonaler Antikörper (mAbs) sein. Die unerwartete Freisetzung von proinflammatorischen Zytokinen kann jedoch bei Patienten, die durch Fieber, Müdigkeit und sogar Multiorganversagen gekennzeichnet sind, zum Zytokinfreisetzungssyndrom (CRS) führen1. Daher ist es von entscheidender Bedeutung, dass neue immunstimulierende mAbs in vitro auf ihr Potenzial zur Auslösung von CRS getestet werden, indem die Freisetzung von Zytokinen in einem Zytokin-Freisetzungsassay (CRA) gemessen wird.
TGN1412 handelt sich um einen monoklonalen Antikörper, der als potenzieller Behandlung für chronische lymphatische B-Zell-Leukämie entwickelt wurde, indem er als CD28-Superagonist (CD28SA) fungiert und in der Lage ist, T-Lymphozyten durch Vernetzung des co-stimulatorischen Rezeptors CD282 zu aktivieren. Im Jahr 2006 traten bei sechs gesunden Freiwilligen, denen in einer klinischen Studie TGN1412 verabreicht wurde, innerhalb weniger Stunden nach Erhalt des Medikaments schwere Nebenwirkungen, einschließlich CRS, auf1. Dies führte dazu, dass die Studie gestoppt und TGN1412 aus der Weiterentwicklung zurückgezogen wurde. Andere Antikörper, von denen bekannt ist, dass sie CRS als Nebenwirkung verursachen, sind das Anti-CD52-mAb, Campath-1H3, und das Anti-CD3-mAb, Muromonab (OKT3)4. Aufgrund ihrer Fähigkeit, dosisabhängiges CRS bei Patienten zu induzieren, sind TGN1412, OKT3 und Campath-1H geeignete Positivkontrollantikörper für die Generierung robuster und zuverlässiger Ergebnisse aus einer CRA. Allerdings waren diese Kontrollantikörper bisher aufgrund der hohen Kosten oder der eingeschränkten Verfügbarkeit nicht leicht zu beschaffen.
Das National Institute for Biological Standards and Control (NIBSC) hat jedoch kürzlich ein wiederaufbereitetes lyophilisiertes Referenzpanel dieser drei Antikörper 5,6,7 zusammen mit isotypangepassten Negativkontrollen zur Verfügung gestellt. Es wurde bereits gezeigt, dass dieses Panel von Referenzreagenzien eine gute Reproduzierbarkeit zwischen Laboratorienaufweist 8 und daher eine geeignete Kontrolle ist, um die Zuverlässigkeit und Robustheit von Sicherheitsdaten aus einer Vielzahl von CRA-Plattformen zu erhöhen. Der Grund für die Verwendung dieses Protokolls zusammen mit diesen Reagenzien besteht daher darin, die Harmonisierung der Ratingagenturen zu verbessern, wobei der Vorteil besteht, dass diese Reagenzien in einer internationalen Kooperationsstudie validiert wurden8.
Im Folgenden beschreiben wir, wie dieses Panel von Referenzreagenzien am besten in einer Festphasen- (SP), PBMC-CRA und einer wässrigen (AQ) Vollblut-CRA (WB) verwendet werden kann, um Antikörper-induziertes CRS vorherzusagen. Beide CRA-Formate ergänzen sich aufgrund der Art der Antikörperpräsentation (indirekt für die feste Phase versus direkt für die wässrige Phase) und aufgrund der Tatsache, dass sie auf unterschiedliche Gruppen von Responderzellen abzielen. Das gleiche Protokoll kann für die Verwendung mit verdünntem Vollblut (dWB) oder mit endothelialen: PBMC-Cokulturen angepasst werden.
Protokoll
Das folgende Protokoll folgt den Richtlinien der NIBSC-Forschungsethikkommission. Holen Sie in Übereinstimmung mit den geltenden Vorschriften und Richtlinien die schriftliche Einverständniserklärung des gesunden Spenders oder der Patienten ein. Verwenden Sie sterile Techniken, um alle Vorbereitungsschritte des Protokolls in einer Laminar-Flow-Zellkulturhaube durchzuführen. In der Materialtabelle finden Sie Details zu allen Reagenzien und Geräten.
1. Vorbereitung von beschichteten Platten mit mAb für den Festphasen-Assay (SP)
- Der Inhalt der Ampullen des Referenzreagenzes wird mit 1 ml sterilem destilliertem Wasser rekonstituiert. Lassen Sie 5-10 Minuten für die Rehydrierung warten, bevor Sie die Antikörperlösung mischen und in ein steriles Röhrchen mit Deckel umfüllen.
- Nach der Rekonstitution in 1 ml Wasser beträgt die Stammkonzentration der folgenden rekombinanten Antikörper 200 μg/ml: anti-CD3 (15/162), anti-CD52 (15/178), IgG1K-Isotypkontrolle (15/198) für anti-CD52, IgG2a-Isotypkontrolle (15/218) für anti-CD3, IgG4-Isotypkontrolle (15/232) für anti-CD28SA.
- Nach der Rekonstitution in 1 mL Wasser beträgt die Stammkonzentration von Anti-CD28SA (15/144) 100 μg/ml. Für eine kurzfristige Lagerung von bis zu 7 Tagen überführen Sie das rekonstituierte Material in einem sterilen Röhrchen mit Deckel auf 4 °C.
- Verdünnen Sie die rekonstituierten Antikörper und Testantikörper auf 10 μg/ml in sterilem PBS und beschichten Sie die Vertiefungen einer sterilen, nicht TC-behandelten 96-Well-Mikrotiterplatte aus Polypropylen mit U-Boden mit 100 μl verdünnter Antikörperlösung (1 μg/Well) und inkubieren Sie sie über Nacht bei 4 °C.
HINWEIS: Es ist wichtig, Polypropylenplatten für die Proteinadsorption zu verwenden, da diese bei der Validierung der Standardreagenzien9 verwendet wurden.
2. Vorbereitung von PBMCs
- Sammeln Sie mindestens 30 ml peripheres Vollblut (WB) in heparinisierte/heparinhaltige Röhrchen und invertieren Sie es mehrmals, um eine korrekte Mischung mit dem Natriumheparin zu gewährleisten.
- 15 ml WB in ein separates Röhrchen übertragen, um es später bei der Vorbereitung eines Vollbluttests in der wässrigen Phase (Schritt 3.1) zu verwenden
- Verdünnen Sie die restlichen 15 ml Blut in einem Volumenverhältnis von 1:1 mit PBS oder serumfreiem RPMI-1640-Medium und schichten Sie das verdünnte Blut vorsichtig über 15 ml Dichtegradientenmedium (z. B. Lymphoprep, Ficoll-Hypaque) in einem 50-ml-Röhrchen.
- Das Röhrchen bei 500 x g für 20 min bei Raumtemperatur in einem Ausschwingrotor ohne Bremse und mit reduzierter Beschleunigung zentrifugieren, um das Blut in seine verschiedenen Bestandteile zu trennen.
- Nach der Zentrifugation trennt sich der Dichtegradient als obere Plasmaschicht, gefolgt von einer dünnen Schicht aus Buffy-Mantel, die PBMCs enthält, und einer unteren Schicht, die rote Blutkörperchen (RBCs) und polymorphkernige Granulozyten einschließlich Neutrophilen und Eosinophilen enthält. Entnehmen Sie die PBMCs vorsichtig, indem Sie eine Pipette direkt durch die obere Plasmaschicht in die PBMCs einführen. Alternativ können Sie die obere Schicht vor der Entnahme der Zellen entfernen.
- Resuspendieren Sie den Buffy Coat vorsichtig in 10 ml PBS oder serumfreiem RPMI-1640-Medium. Zentrifugieren Sie das Röhrchen erneut bei 500 x g für 10 min, um die Zellen zu pelletieren. Entfernen Sie den Überstand und entsorgen Sie ihn.
- Wiederholen Sie den Waschschritt 2.6. und resuspendieren Sie das Pellet in 2 mL RPMI mit 10 % FCS (vollständiges RPMI-1640, cRPMI)
- Zählen Sie die Zellen mit einem Hämozytometer10.
- Stellen Sie die PBMCs auf eine Konzentration von 1 x 106 Zellen/ml in cRPMI ein.
3. Herstellung eines Zytokin-Freisetzungsassays für Vollblut (AQ) in der wässrigen Phase (AQ)
- Geben Sie 190 μl WB in die Vertiefungen einer 96-Well-Polystyrolplatte mit U-Boden. Falls nicht bereits bei 100 μg/ml, verdünnen Sie alle Behandlungsantikörper und Referenzreagenzien auf 100 μg/ml in PBS.
- Fügen Sie 10 μl verdünnte Antikörper zu 190 μl WB hinzu, um eine endgültige Antikörperkonzentration von 5 μg/ml Antikörper in 95 % WB zu erhalten.
- Inkubationsplatte für 48 h in einem befeuchteten Inkubator bei 37 °C.
4. Vorbereitung des Festphasen-PBMC-Zytokin-Release-Assays (SP)
- Entfernen und verwerfen Sie mit einer Mehrkanalpipette die Antikörperlösung von den beschichteten Platten (beschrieben in Schritt 1), füllen Sie ein Reagenzreservoir mit PBS und waschen Sie die Platte 3x mit 200 μl PBS, um ungebundene mAbs zu entfernen.
- Geben Sie 200 μl der Zellsuspension aus Schritt 2.8 in jede Vertiefung. Inkubieren Sie die Platte 48 h lang in einem befeuchteten Brutschrank bei 37 °C, 5 % CO2.
5. Entnahme von Überstand oder Plasma
- Nach einer 48-stündigen Inkubation mit Kontroll- und Test-mAbs zentrifugieren Sie die Platten bei 400 x g für 5 min und sammeln das zellkonditionierte Medium oder Plasma, wobei darauf zu achten ist, dass das Zellpellet nicht gestört wird. Der gesammelte Überstand oder das Plasma wird bei -20 °C eingefroren.
HINWEIS: Achten Sie darauf, das Pellet der roten Blutkörperchen beim Sammeln des Plasmas nicht zu stören.
6. Durchführung der Quantifizierung von Zytokinen im Überstand oder im Plasma
- Führen Sie unter Verwendung des gesammelten Überstands oder Plasmas eine Zytokinanalyse der IFN-γ-, IL-2-, TNF-α- und IL-6-Konzentrationen mit der bevorzugten Multiplex-Option durch. Ein Beispiel für die Multiplex-Zytokin-Analyse mit einem zytometrischen Bead-Assay wurde bereits veröffentlicht11.
HINWEIS: Bitte beachten Sie die Materialtabelle für das Multiplex-Kit, das bei der Erstellung der repräsentativen Ergebnisse verwendet wurde.
Ergebnisse
Die Ergebnisse des SP-Assays sollten eine Freisetzung von IL-2, IFN-γ, IL-6 und TNF-α12 im pg/ml-Bereich von allen positiven Kontrollantikörpern nach 48 h zeigen und statistisch signifikant höher sein als bei Kontrollen mit übereinstimmenden Isotypen. Unsere repräsentativen Ergebnisse zeigen, dass die Positivkontroll-Antikörper αCD28, αCD3 und αCD28SA im Vergleich zu angepassten Isotyp-Kontrollen signifikant hohe Spiegel an IFN-γ , IL-6 und TNF-α induzieren, wenn sie im PBMC SP-Assay durchgeführt werden (Abbildung 1). Dieser Assay zeichnet sich auch durch eine hohe Faltungsänderung der IL-2-Freisetzung durch Stimulation mit αCD28SA im Vergleich zu seinem angepassten Isotyp (859,0) aus. Während αCD3 und αCD52 zwar immer noch die IL-2-Expression induzieren, führen sie zu geringeren Faltungsänderungen als αCD28SA (6,2 bzw. 3,3 für αCD3 bzw. αCD52, Abbildung 2).
Im WB AQ-Assay (Abbildung 3) ist der Gehalt an nachweisbaren Zytokinen deutlich geringer als im PBMC SP-Assay, zeichnet sich jedoch durch eine höhere Empfindlichkeit gegenüber der Stimulation durch αCD52-Antikörper aus (Abbildung 2 und Abbildung 3) mit mittleren Faltungsänderungen von IL-2, IFN-γ und IL-6 über 100.
Ein Testantikörper, bei dem bei einer zukünftigen Erstdosierung beim Menschen davon ausgegangen werden kann, dass er im Vergleich zu relevanten Isotypkontrollen keine unvorhergesehenen signifikanten Erhöhungen der Zytokinfreisetzung verursacht. Anstatt die Entwicklung eines neuen therapeutischen mAb zu stoppen, sollte ein positives Ergebnis einer CRA jedoch als Teil des Nutzen-Risiko-Managements betrachtet werden13. Bei der Entwicklung einer neuen CRA-Plattform sollte der Assay mit einer anderen Gruppe von Spendern wiederholt werden, um die Reproduzierbarkeit der Plattform zu gewährleisten. Es sollte auch darauf geachtet werden, die Variabilität der Reaktion zwischen den Spendernzu berücksichtigen 14, und daher wird ein gut durchgeführtes Experiment empfohlen15. Um die Breite des Ansprechens zu verstehen und eine vollständige Darstellung der Variabilität zu erhalten, die bei den Spenderreaktionen beobachtet werden könnte, sollte der Assay idealerweise mit mehreren einzelnen Spendern durchgeführt werden, zusätzlich zum Assay des Therapeutikums in Replikatexperimenten.
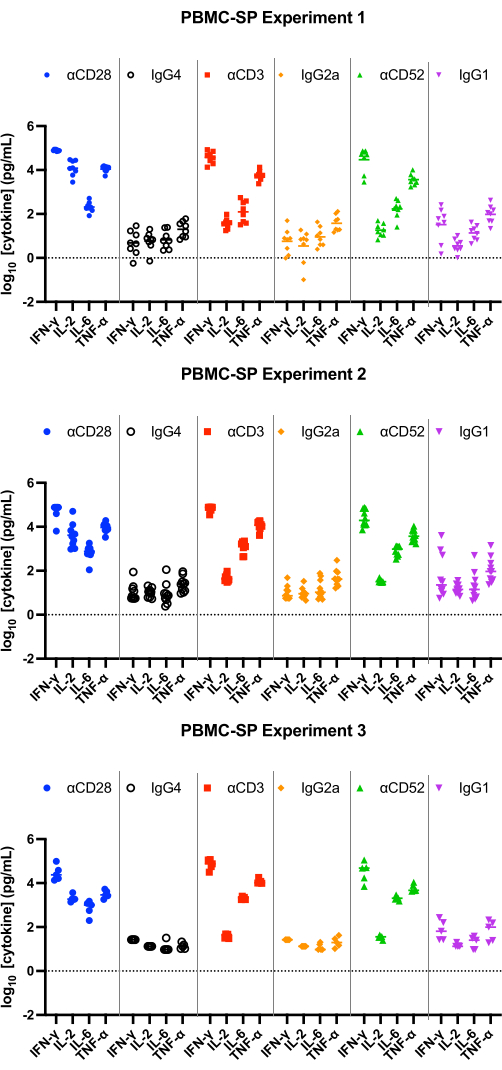
Abbildung 1: Zytokinfreisetzung aus dem PBMC-SP-Experiment. Repräsentative Ergebnisse der Freisetzung von IFN-γ, IL-2, IL-6 und TNF-α aus PBMC-SP-Zytokinfreisetzungsassays (3 unabhängige Experimente mit jeweils 5-8 Spendern pro Experiment; n=8, n=10, n=5 [von oben nach unten]) nach 48 h bei Verwendung von Referenzreagenzantikörpern. Abkürzungen: PBMC = mononukleäre Zellen des peripheren Blutes; SP = feste Phase; IFN-γ = Interferon-Gamma; IL-2 = Interleukin 2; IL-6 = Interleukin 6; TNF-α = Tumornekrosefaktor alpha. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Zunahme der Zytokinfaltungsänderung aus PBMC-SP- und WB-AQ-Experimenten. Verfaltung der Freisetzung von IFN-γ, IL-2, IL-6 und TNF-α von CRS-induzierenden Antikörper-Referenzreagenzien im Vergleich zu ihren übereinstimmenden Isotypkontrollen, erhalten aus PBMC-SP- und WB-AQ-Zytokinfreisetzungsassays nach 48 h. Abkürzungen: PBMC = mononukleäre Zellen des peripheren Blutes; SP = feste Phase; WB = Vollblut; AQ = wässrig (Phase); IFN-γ = Interferon-Gamma; IL-2 = Interleukin 2; IL-6 = Interleukin 6; TNF-α = Tumornekrosefaktor alpha; CRS = Zytokinfreisetzungssyndrom. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
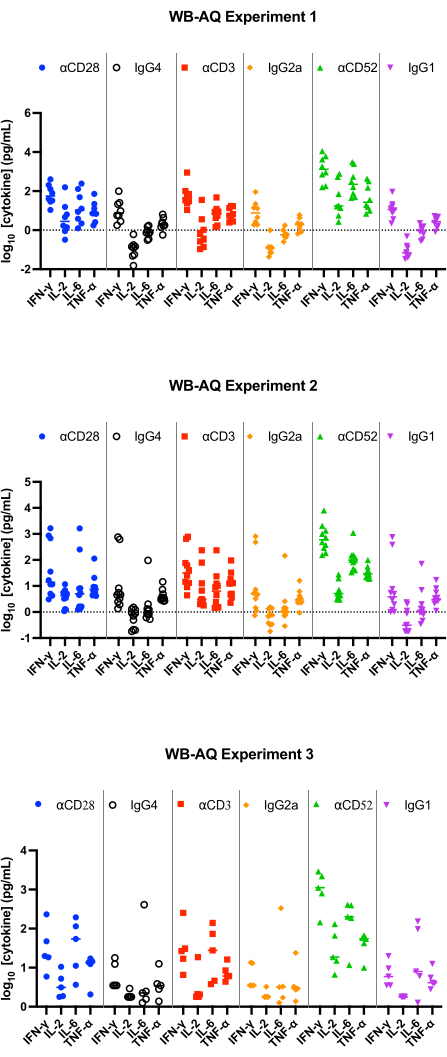
Abbildung 3: Zytokinfreisetzung aus dem WB-AQ-Experiment. Repräsentative Ergebnisse der Freisetzung von IFN-γ, IL-2, IL-6 und TNF-α aus WB-AQ-Zytokinfreisetzungsassays (3 unabhängige Experimente mit jeweils 5-8 Spendern pro Experiment; n=8, n=10, n=5 [von oben nach unten]) nach 48 h bei Verwendung von Referenzreagenzantikörpern. Abkürzungen: WB = Vollblut; AQ = wässrig (Phase); IFN-γ = Interferon-Gamma; IL-2 = Interleukin 2; IL-6 = Interleukin 6; TNF-α = Tumornekrosefaktor alpha. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier werden Verfahren zur Messung der Zytokinfreisetzung aus PBMCs und WB nach Antikörper-vermittelter Stimulation von einer Antikörper-beschichteten Platte oder mit Antikörpern in Lösung beschrieben, wobei ein Panel von Referenzreagenzien für Positiv- und Negativkontrollen verwendet wird. Jeder dieser Assays hat seine eigenen Stärken und Schwächen. PBMC- und WB-Assays ergänzen sich, da der Anteil verschiedener Immunzellen wie Lymphozyten, Monozyten und Granulozyten in den beiden experimentellen Matrices, die für CRAs verwendet werden, unterschiedlich ist. Es ist interessant zu beobachten, dass, obwohl ein WB-Assay die In-vivo-Bedingung im Gegensatz zu PBMC-Monokulturen besser darstellen könnte, die erstgenannte Plattform weniger prädiktiv für das T-Zell-vermittelte CRS-Risiko von TGN1412 und OKT3ist 15; ein Ergebnis von Glykophorin A auf Erythrozyten, das die IL-2-vermittelte T-Zell-Expansion hemmt16. Nichtsdestotrotz bleibt die Vorhersage des CRS-Risikos durch Anti-CD52 in WB CRA intakt, was auf das Vorhandensein von Neutrophilen zurückzuführen ist (verloren bei herkömmlichen Dichtegradientenmethoden, die in Schritt 2 beschrieben und für die PBMC-Isolierung verwendet wurden).
Das Format der CRA (SP- oder AQ-Darstellung) ist entscheidend für den Nachweis eines spezifischen CRS-Mechanismus. Zum Beispiel konnte die wässrige Phasenpräsentation des mAb in humanen Lymphozyten17,18, die während präklinischer In-vitro-Sicherheitstests von TGN1412 verwendet wurde, das CRS-Risiko wahrscheinlich aufgrund des Mangels an lokalisierter Zellrezeptor-Clusterbildung und -Bindung19 und der daraus resultierenden T-Zell-Aktivierung, die durch Antikörper in der wässrigen Phase vermittelt wurde, nicht identifizieren. Tatsächlich konnte TGN1412-vermitteltes CRS nur im SP-Format genau nachgewiesen werden, das die Vernetzung von Fc-gamma-Rezeptoren (FcγR) künstlich repliziert, wie hier vorgestellt, oder durch kontaktabhängiges Priming in PBMC-Präkulturen bei hoher Dichte und Fc-Interaktion mit CD32+-Immunzellen (wie B-Zellen20 und Monozyten21).
Zusätzlich zu diesen Plattformen gibt es andere Möglichkeiten, CRA mit komplexeren Co-Kultursystemen durchzuführen. Ein Beispiel für eine alternative CRA zu den in diesen Methoden beschriebenen ist die Co-Kultur von PBMCs mit autologen Blutauswuchs-Endothelzellen (BOECs)22. Dieser Assay wurde 2015 als Verbesserung des damals konventionellen HUVEC:PBMC-Assays mit gemischten Spendern beschrieben, indem die verwirrende Gewebefehlanpassung beseitigt wurde. Er zeigt eine bessere Sensitivität gegenüber Anti-CD28SA-CRS als der WB-Assay und überwindet auch die Einschränkungen des PBMC-Monokultur-Assays, indem er die in vivo vorhandene Kombination von Endothelzellen und Leukozyten nachahmt, jedoch auf Kosten langwierigerer Verfahrensschritte, die spezielle Zellkulturtechniken erfordern22.
Während sich dieses Protokoll speziell auf die Freisetzung von IFN-γ, IL-2, IL-6 und TNF-α konzentriert, haben Kollegen an der MHRA zuvor IL-12 und andere in diesem Bereich untersucht23. Die IL-12-Produktion wird durch diese Positivkontroll-CRS-Antikörper erhöht, obwohl sie nicht besonders empfindlich sind und daher in dieser Modalität vielleicht kein guter Prädiktor für CRS sind. Einige Zytokine, wie z. B. IL-15 und andere, wurden nie getestet, obwohl die 4 Zytokine, die in unserem Protokoll bewertet wurden, einen guten Hinweis auf das potenzielle Risiko von CRS liefern. Natürlich können je nach Modalität und getesteten Antikörpern auch andere Zytokine beurteilt werden.
Zusammengenommen unterstreichen diese Beobachtungen, wie wichtig es ist, darauf hinzuweisen, dass die Verwendung von Referenzreagenzien zwar dazu beitragen kann, das CRS-Risiko neuer Antikörper zu identifizieren, dass jedoch darauf geachtet werden sollte, eine suboptimale CRA-Plattform zu vermeiden, die das CRS-Potenzial möglicherweise nicht identifiziert. Entscheidend ist, dass der vorhergesagte Wirkmechanismus eines Therapeutikums, sei es über seine Fc-Region oder seine hypothetische Wirkung auf Antigen-exprimierende Zellen, mit der Biologie des Assays übereinstimmen muss. Obwohl Unterschiede im Wirkmechanismus der in diesem Artikel erörterten Testtherapeutika und Referenzreagenzien eine potenzielle Einschränkung darstellen können, so dass eine relevante CRA für den Testantikörper mit der Biologie der Referenzreagenzien inkompatibel sein könnte, bietet der Assay eine robuste, zuverlässige Plattform für die Gefahrenidentifizierung. Ergebnisse aus verschiedenen CRA-Formaten, die verschiedene Wirkmechanismen und Immunzelluntergruppen abdecken, können jedoch für ein optimales Vertrauen in die Daten zur Sicherheitsbewertung erforderlich sein.
Offenlegungen
EM war zuvor bei der Medicines and Healthcare Products Regulatory Agency (MHRA) beschäftigt. Die übrigen Autoren haben keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde vom National Institute for Biological Standards and Control finanziert. Wir danken Sandra Diebold für die Durchsicht des Manuskripts und für hilfreiche Kommentare und Anregungen. Wir danken auch Ka Seng Ieong für das Filmen des Videos.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Referenzen
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042 (2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440 (2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten