Method Article
Uso de reactivos de referencia para confirmar la solidez de los ensayos de liberación de citocinas para la predicción de la seguridad de los anticuerpos monoclonales
En este artículo
Resumen
El uso de reactivos de referencia para el ensayo de liberación de citocinas permite obtener perfiles de seguridad in vitro más reproducibles y estandarizados de los anticuerpos monoclonales inmunoterapéuticos. En este artículo describimos cómo se pueden utilizar los ensayos de liberación de citocinas junto con un panel de reactivos de referencia para predecir la seguridad de algunos anticuerpos monoclonales terapéuticos.
Resumen
Los nuevos fármacos de anticuerpos inmunoestimuladores diseñados para estimular directamente células inmunitarias específicas o mejorar indirectamente la respuesta inmunitaria mediante el bloqueo o la activación de un regulador endógeno del sistema inmunitario tienen el potencial de causar efectos adversos graves relacionados con el sistema inmunitario, como el síndrome de liberación de citocinas (SRC). Por lo tanto, es crucial evaluar el perfil de seguridad de estos fármacos con una combinación de experimentos in vivo e in vitro antes de la primera administración de dosis en humanos. Los ensayos de liberación de citocinas (CRA), en los que el tratamiento de anticuerpos propuesto se cocultiva con células inmunitarias humanas (como las células mononucleares de sangre periférica (PBMC), sangre total u otros) y se mide la cantidad de citocinas inflamatorias producidas, son fundamentales para la identificación de peligros. Sin embargo, los diferentes laboratorios que utilizan diferentes anticuerpos de control pueden amenazar la armonización de las CRA, y los controles clínicamente relevantes (como los TGN1412) pueden ser difíciles de obtener, lo que puede dar lugar a resultados menos precisos o fiables o a datos que son difíciles de comparar entre laboratorios. La inclusión de controles positivos y negativos en una CRA puede garantizar la exactitud y fiabilidad de los resultados. El Instituto Nacional de Normas y Control Biológico (NIBSC, por sus siglas en inglés) ha producido un panel de controles de anticuerpos liofilizados destinados a su uso en varias plataformas de CRA para armonizar los resultados en varios laboratorios y métodos de ensayo. Un conjunto de tres anticuerpos de control positivo diferentes incluyen el superagonista (SA) anti-CD52, anti-CD3 y anti-CD28, que se sabe que induce un CRS dependiente de la dosis en los pacientes. A cada anticuerpo se le proporciona un anticuerpo de control negativo emparejado con el isotipo. Se ha demostrado previamente que este panel de reactivos tiene una buena reproducibilidad entre laboratorios y son controles adecuados para aumentar la confianza y la solidez de los datos de seguridad de una variedad de plataformas de CRA.
Introducción
La liberación inducida de citocinas puede ser un efecto anticipado y deseado de algunos anticuerpos monoclonales inmunomoduladores (mAbs). Sin embargo, la liberación imprevista de citocinas proinflamatorias puede dar lugar al síndrome de liberación de citocinas (SRC) en pacientes caracterizados por fiebre, fatiga e incluso insuficiencia orgánica múltiple1. Por lo tanto, es crucial que los nuevos mAbs inmunoestimuladores se prueben in vitro para determinar su potencial para causar CRS midiendo la liberación de citocinas en un ensayo de liberación de citocinas (CRA).
TGN1412 es un anticuerpo monoclonal que se desarrolló como un tratamiento potencial para la leucemia linfocítica crónica de células B al actuar como un superagonista CD28 (CD28SA), capaz de activar los linfocitos T mediante la reticulación del receptor coestimulador CD282. En 2006, seis voluntarios sanos a los que se les administró TGN1412 en un ensayo clínico experimentaron efectos secundarios graves, incluido el CRS, a las pocas horas de recibirel medicamento. Esto llevó a que se detuviera el ensayo y TGN1412 se retirara del desarrollo posterior. Otros anticuerpos que se sabe que causan CRS como efecto secundario incluyen el mAb anti-CD52, Campath-1H3, y el mAb anti-CD3, Muromonab (OKT3)4. Dada su capacidad para inducir CRS dependiente de la dosis en pacientes, TGN1412, OKT3 y Campath-1H son anticuerpos de control positivo adecuados para la generación de resultados sólidos y fiables a partir de una CRA. Sin embargo, estos anticuerpos de control no eran fácilmente obtenibles anteriormente debido a los altos costos o la disponibilidad restringida.
Sin embargo, el Instituto Nacional de Normas y Control Biológicos (NIBSC, por sus siglas en inglés) puso a disposición recientemente un panel de referencia liofilizado remanufacturado de estos tres anticuerpos 5,6,7 junto con controles negativos emparejados con isotipos. Este panel de reactivos de referencia ha demostrado previamente tener una buena reproducibilidad entre laboratorios8 y, por lo tanto, es un control adecuado para aumentar la confianza y la solidez de los datos de seguridad de una variedad de plataformas de CRA. Por lo tanto, la razón detrás del uso de este protocolo junto con estos reactivos es mejorar la armonización de CRA, con la ventaja de que estos reactivos han sido validados en un estudio colaborativo internacional8.
Aquí describimos la mejor manera de utilizar este panel de reactivos de referencia en una CRA de PBMC en fase sólida (SP) y una CRA de sangre total (WB) en fase acuosa (AQ) para predecir la CRS inducida por anticuerpos. Ambos formatos de CRA son complementarios debido al modo de presentación de los anticuerpos (indirecto para la fase sólida frente a directo para la fase acuosa) y debido al hecho de que se dirigen a diferentes grupos de células respondedoras. El mismo protocolo puede adaptarse para su uso con sangre total diluida (dWB) o con cocultivos endoteliales: PBMC.
Protocolo
El siguiente protocolo sigue las directrices del comité de ética de investigación del NIBSC. De acuerdo con las regulaciones y pautas aplicables, obtener el consentimiento informado por escrito del donante o pacientes sanos. Utilizar técnicas estériles para realizar todos los pasos de preparación del protocolo en una campana de cultivo celular de flujo laminar. Consulte la Tabla de materiales para obtener detalles sobre todos los reactivos y equipos.
1. Preparación de placas recubiertas con mAb para ensayos de fase sólida (SP)
- Reconstituya el contenido de las ampollas de reactivo de referencia con 1 mL de agua destilada estéril. Espere de 5 a 10 minutos para la rehidratación antes de mezclar la solución de anticuerpos y transferirla a un tubo estéril con tapa.
- Después de la reconstitución en 1 mL de agua, la concentración de los siguientes anticuerpos recombinantes será de 200 μg/mL: anti-CD3 (15/162), anti-CD52 (15/178), control del isotipo IgG1K (15/198) para anti-CD52, control del isotipo IgG2a (15/218) para anti CD3, control del isotipo IgG4 (15/232) para anti-CD28SA.
- Después de la reconstitución en 1 mL de agua, la concentración de stock de anti-CD28SA (15/144) será de 100 μg/mL. Para un almacenamiento a corto plazo de hasta 7 días, transfiera el material reconstituido en un tubo estéril con tapa a 4 °C.
- Diluir los anticuerpos reconstituidos y probar los anticuerpos a 10 μg/mL en PBS estéril y recubrir los pocillos de una placa de microtitulación estéril de polipropileno con fondo en U tratada sin TC con 100 μL de solución de anticuerpos diluida (1 μg/pocillo) e incubar durante la noche a 4 °C.
NOTA: Es importante el uso de placas de polipropileno para la adsorción de proteínas, ya que estas fueron utilizadas en la validación de los reactivos estándar9.
2. Preparación de PBMC
- Recoja un mínimo de 30 mL de sangre total periférica (WB) en tubos heparinizados/que contengan heparina e inviértalo varias veces para asegurar una mezcla adecuada con la heparina de sodio.
- Transfiera 15 mL de WB en un tubo separado para utilizarlo posteriormente en la preparación del ensayo de sangre total en fase acuosa (paso 3.1)
- Diluya los 15 mL restantes de sangre en una proporción de volumen de 1:1 con PBS o medios RPMI-1640 sin suero y coloque suavemente la sangre diluida sobre la parte superior de 15 mL de medio de gradiente de densidad (p. ej., linfopr, Ficoll-Hypaque) en un tubo de 50 mL.
- Centrifugar el tubo a 500 x g durante 20 min a temperatura ambiente en un rotor basculante sin freno y con una aceleración reducida para separar la sangre en sus diferentes componentes.
- Después de la centrifugación, el gradiente de densidad se separará como una capa superior de plasma, seguida de una capa delgada de capa leucocitaria que contiene PBMC y una capa inferior que contiene glóbulos rojos (RBC) y granulocitos polimorfonucleares, incluidos neutrófilos y eosinófilos. Recolectar cuidadosamente las PBMC insertando una pipeta directamente a través de la capa superior de plasma hasta las PBMC. Alternativamente, retire la capa superior antes de la recolección de células.
- Vuelva a suspender suavemente la capa leucitaria en 10 ml de PBS o medio RPMI-1640 sin suero. Vuelva a centrifugar el tubo a 500 x g durante 10 min para granular las células. Retire el sobrenadante y deséchelo.
- Repita el paso de lavado 2.6. y resuspender pellet en 2 mL de RPMI con 10% de FCS (RPMI-1640 completo, cRPMI)
- Recuento de células con un hemocitómetro10.
- Ajuste las PBMC a una concentración de 1 x 106 células/mL en cRPMI.
3. Preparación del ensayo de liberación de citocinas de sangre total (WB) en fase acuosa (AQ)
- Agregue 190 μL de WB a los pocillos de una placa de poliestireno con fondo en U de 96 pocillos. Si aún no lo ha hecho a 100 μg/mL, diluya previamente todos los anticuerpos del tratamiento y los reactivos de referencia a 100 μg/mL en PBS.
- Añadir 10 μL de anticuerpos diluidos a 190 μL de WB para obtener una concentración final de anticuerpos de 5 μg/mL de anticuerpo en un 95% de WB.
- Placa de incubación durante 48 h en una incubadora humidificada a 37 °C.
4. Preparación del ensayo de liberación de citocinas PBMC en fase sólida (SP)
- Con una pipeta multicanal, retire y deseche la solución de anticuerpos de las placas recubiertas (descrito en el paso 1), llene un depósito de reactivo con PBS y lave la placa 3 veces con 200 μL de PBS para eliminar los mAbs no unidos.
- Añada 200 μL de la suspensión celular del paso 2.8 a cada pocillo. Incubar la placa durante 48 h en una incubadora humidificada a 37 °C, 5% de CO2.
5. Recolección de sobrenadante o plasma
- Después de la incubación durante 48 h con mAbs de control y prueba, centrifugar las placas a 400 x g durante 5 min y recoger el medio o plasma acondicionado a la célula, teniendo cuidado de no alterar la pellet celular. Congele el sobrenadante o plasma recogido a -20 °C.
NOTA: Asegúrese de no alterar la gránula de glóbulos rojos al recolectar el plasma.
6. Realización de la cuantificación de citocinas en el sobrenadante o plasma
- Utilizando el sobrenadante o plasma recolectado, realice un análisis de citocinas de las concentraciones de IFN-γ, IL-2, TNF-α e IL-6 utilizando la opción multiplex preferida. Anteriormente se ha publicado un ejemplo de método de análisis de citocinas multiplex utilizando un ensayo de perlas citométricas11.
NOTA: Consulte la Tabla de Materiales para el kit multiplex que se utilizó en la generación de los resultados representativos.
Resultados
Los resultados del ensayo SP deben demostrar una liberación de IL-2, IFN-γ, IL-6 yTNF-α 12 en el rango de pg/mL de todos los anticuerpos de control positivos a las 48 h y deben ser estadísticamente significativamente mayores que los controles de isotipo emparejados. Nuestros resultados representativos demuestran que los anticuerpos de control positivo, αCD28, αCD3 y αCD28SA inducen niveles significativamente altos de IFN-γ, IL-6 y TNF-α en comparación con los controles de isotipo emparejados, cuando se ejecutan en el ensayo PBMC SP (Figura 1). Este ensayo también se caracteriza por un alto cambio de pliegue de la liberación de IL-2 de la estimulación con αCD28SA en comparación con su isotipo emparejado (859.0). Mientras que αCD3 y αCD52, aunque siguen induciendo la expresión de IL-2, dan lugar a cambios de pliegue más bajos que αCD28SA (6,2 y 3,3 para αCD3 y αCD52, respectivamente, Figura 2).
En el ensayo WB AQ (Figura 3), el nivel de citocinas detectables es notablemente menor que en el ensayo PBMC SP, pero se caracteriza por una mayor sensibilidad a la estimulación por el anticuerpo αCD52 (Figura 2 y Figura 3) con cambios medios en el pliegue de IL-2, IFN-γ e IL-6 por encima de 100.
Un anticuerpo de prueba para el que se podría anticipar que la futura dosificación por primera vez en humanos no causará aumentos significativos imprevistos en la liberación de citocinas en comparación con los controles de isotipos relevantes. Aunque, en lugar de detener el desarrollo de un nuevo AcM terapéutico, un resultado positivo en una CRA debe considerarse como parte de la gestión de riesgos/beneficios13. Al desarrollar una nueva plataforma de CRA, el ensayo debe repetirse utilizando un conjunto diferente de donantes para garantizar la reproducibilidad de la plataforma. También se debe dar importancia a la variabilidad de la respuesta entre donantes14, por lo que se recomienda un experimento con buen poder estadístico15. Con el fin de comprender la amplitud de las respuestas y obtener una representación completa de la variabilidad que podría observarse en las respuestas de los donantes, lo ideal es que el ensayo se realice con varios donantes individuales, además de ensayar la terapéutica en experimentos replicados.
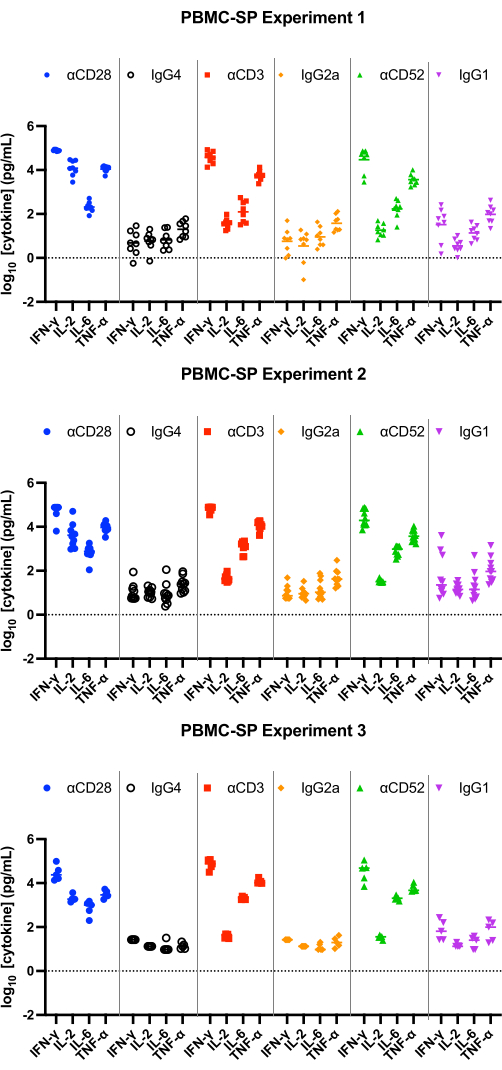
Figura 1: Liberación de citocinas del experimento PBMC-SP. Resultados representativos de la liberación de IFN-γ, IL-2, IL-6 y TNF-α obtenidos de ensayos de liberación de citocinas PBMC-SP (3 experimentos independientes que contienen cada uno de 5 a 8 donantes por experimento; n = 8, n = 10, n = 5 [de arriba a abajo]) después de 48 h cuando se utilizan anticuerpos reactivos de referencia. Abreviaturas: PBMC = células mononucleares de sangre periférica; SP = fase sólida; IFN-γ = interferón gamma; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = factor de necrosis tumoral alfa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Aumento del cambio en el pliegue de las citocinas de los experimentos PBMC-SP y WB-AQ. Cambio de pliegue de la liberación de IFN-γ, IL-2, IL-6 y TNF-α de los reactivos de referencia de anticuerpos inductores de CRS en relación con sus controles de isotipo emparejados, obtenidos a partir de ensayos de liberación de citocinas PBMC-SP y WB-AQ después de 48 h. Abreviaturas: PBMC = células mononucleares de sangre periférica; SP = fase sólida; WB = sangre entera; AQ = acuoso (fase); IFN-γ = interferón gamma; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = factor de necrosis tumoral alfa; CRS = síndrome de liberación de citocinas. Haga clic aquí para ver una versión más grande de esta figura.
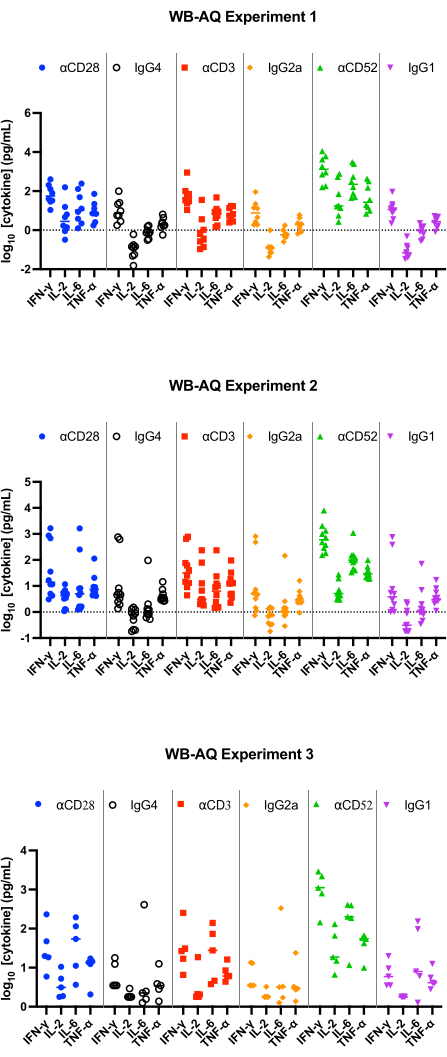
Figura 3: Liberación de citocinas del experimento WB-AQ. Resultados representativos de la liberación de IFN-γ, IL-2, IL-6 y TNF-α obtenidos de los ensayos de liberación de citocinas WB-AQ (3 experimentos independientes con 5-8 donantes por experimento; n = 8, n = 10, n = 5 [de arriba a abajo]) después de 48 h cuando se utilizaron anticuerpos reactivos de referencia. Abreviaturas: WB = sangre entera; AQ = acuoso (fase); IFN-γ = interferón gamma; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = factor de necrosis tumoral alfa. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí se describen métodos para medir la liberación de citocinas de PBMC y WB después de la estimulación mediada por anticuerpos desde una placa recubierta de anticuerpos o con anticuerpo en solución, utilizando un panel de reactivos de referencia para controles positivos y negativos. Cada uno de estos ensayos tiene sus propias fortalezas y debilidades asociadas. Los ensayos PBMC y WB son complementarios, ya que la proporción de diversas células inmunitarias, como linfocitos, monocitos y granulocitos, es diferente en las dos matrices experimentales utilizadas para las CRA. Es interesante observar que, aunque un ensayo de WB podría representar mejor la condición in vivo en comparación con el monocultivo de PBMC, la plataforma anterior es menos predictiva del riesgo de SRC mediado por células T a partir de TGN1412 y OKT315; un resultado de la glicoforina A en los glóbulos rojos que inhibe la expansión de las células T mediada por IL-216. Sin embargo, la predicción del riesgo de CRS por anti-CD52 permanece intacta en WB CRA, debido a la presencia de neutrófilos (perdidos durante los métodos convencionales de gradiente de densidad descritos en el paso 2, utilizados para el aislamiento de PBMC).
El formato de la CRA (presentación SP o AQ) es crítico para la detección de mecanismos específicos de CRS. Por ejemplo, la presentación en fase acuosa del AcM a los linfocitos humanos17,18, empleada durante las pruebas preclínicas de seguridad in vitro de TGN1412 no logró identificar el riesgo de SRC probablemente debido a la falta de agrupamiento y compromiso de los receptores celulares localizados19 y la consiguiente activación de las células T mediada por anticuerpos en la fase acuosa. De hecho, el CRS mediado por TGN1412 solo pudo detectarse con precisión en formato SP que replica artificialmente la reticulación del receptor Fc-gamma (FcγR), como se presenta aquí, o mediante cebado dependiente del contacto en el precultivo de PBMC a alta densidad e interacción Fc con células inmunitarias CD32+ (como las células B20 y los monocitos21).
Además de estas plataformas, existen otras formas de realizar CRA con sistemas de co-cultivo más complejos. Un ejemplo de CRA alternativa a las descritas en estos métodos es el cocultivo de PBMCs con células endoteliales autólogas de excrecimiento sanguíneo (BOECs)22. Este ensayo se describió en 2015 como una mejora del ensayo HUVEC:PBMC convencional de donantes mixtos de entonces, ya que eliminó la discordancia tisular. Demuestra una mejor sensibilidad al CRS anti-CD28SA que el ensayo WB, y también supera la limitación del ensayo de monocultivo PBMC al imitar la combinación de células endoteliales y leucocitos presentes in vivo, pero a costa de pasos de procedimiento más largos que requieren técnicas de cultivo celular especializadas22.
Además, mientras que este protocolo se centra específicamente en la liberación de IFN-γ, IL-2, IL-6 y TNF-α, los colegas de la MHRA han analizado previamente la IL-12 y otros en este entorno23. La producción de IL-12 se ve incrementada por estos anticuerpos CRS de control positivo, aunque no es particularmente sensible y, por lo tanto, quizás no sea un gran predictor de CRS en esta modalidad. Algunas citocinas, como la IL-15, entre otras, nunca se probaron, aunque las 4 citocinas evaluadas en nuestro protocolo proporcionan una buena indicación del riesgo potencial de CRS. Por supuesto, dependiendo de la modalidad y los anticuerpos probados, se podrían evaluar otras citocinas.
Combinadas, estas observaciones ponen de manifiesto la importancia de señalar que, aunque el uso de reactivos de referencia puede ayudar a identificar el riesgo de CRS de nuevos anticuerpos, se debe tener cuidado para evitar una plataforma de CRA subóptima que podría no identificar el potencial de CRS. De manera crucial, el mecanismo de acción predicho de un tratamiento, ya sea a través de su región Fc o su acción hipotética sobre las células que expresan antígenos, debe coincidir con la biología del ensayo. Por lo tanto, si bien las diferencias en el mecanismo de acción de los reactivos terapéuticos de ensayo y de referencia analizadas en este artículo pueden plantear una limitación potencial de tal manera que un CRA relevante para el anticuerpo de ensayo podría ser incompatible con la biología de los reactivos de referencia, el ensayo proporciona una plataforma sólida y fiable para la identificación de peligros. Sin embargo, los resultados de varios formatos de CRA que cubren varios mecanismos de acción y subconjuntos de células inmunitarias pueden ser necesarios para una confianza óptima en los datos de evaluación de la seguridad.
Divulgaciones
EM fue empleado anteriormente por la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA). El resto de los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo fue financiado por el Instituto Nacional de Estándares y Control Biológicos. Agradecemos a Sandra Diebold por revisar el manuscrito y por sus útiles comentarios y sugerencias. También estamos agradecidos a Ka Seng Ieong por filmar el video.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Referencias
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042 (2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440 (2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados